肿瘤免疫检查点抑制剂及其联合疗法的研究进展
2020-04-20周姚邑赵新新陈沅沅陈焱飞王雪绒赵轩朗管政高建莉
周姚邑 赵新新 陈沅沅 陈焱飞 王雪绒 赵轩朗 管政 高建莉
摘 要 目的:了解免疫检查点抑制剂及其联合疗法的研究进展,为免疫检查点抑制剂在癌症治疗中的应用提供参考。方法:以“免疫疗法”“免疫检查点抑制剂”“联用”“Immunotherapy”“Immune checkpoint inhibitor”“Combined application”等关键词,在中国知网、万方数据库、维普网、PubMed、Web of Science等数据库中组合查询2014年1月-2020年1月发表的相关文献,对免疫检查点抑制剂及其联用情况进行归纳总结。结果与结论:共检索到相关文献3 658篇,其中有效文献66篇。目前常用的免疫检查点抑制剂有CTLA-4抗体(如伊匹单抗)、PD-1/PD-L1抗体(如帕博利珠单抗、纳武利尤单抗、阿特珠单抗、阿维单抗)、TIM-3抗体[如MBG453、TSR-022、LY3321367(暂处于临床试验阶段)]、LAG-3抗体(如Relatlimab)、其他抗体(如双特异性抗体Y-traps)。其联合疗法主要有PD-1抑制剂与其他抑制剂联用,如与CTLA-4抑制剂联用(如纳武利尤单抗和伊匹单抗联用),可延長肺癌患者的无进展生存期,具有很好的互补性;与LAG-3抑制剂联用(如BMS-986016和纳武利尤单抗联用)治疗晚期黑色素瘤,能有效克服PD-1单用疗法的耐药性;与TIM-3抑制剂联用治疗非小细胞肺癌,可抑制机体对PD-1抑制剂产生耐药性。还有CTLA-4抑制剂与LAG-3抑制剂联用,可通过共抑制信号通路诱导机体产生免疫耐受;与IDO抑制剂联用,能有效减小黑色素瘤小鼠的肿瘤体积、延长其生存期。免疫检查点抑制剂可促进机体的抗肿瘤免疫,其中双特异性抗体可进行双通路的双靶点阻断,进而有效发挥协同作用对抗单一抗体的耐药性;也可分别结合同一通路中T细胞表面分子和癌细胞表面抗原,引导T细胞直接杀伤肿瘤细胞。免疫检查点抑制剂在克服耐药性、增强免疫细胞对肿瘤细胞的特异性识别方面具有良好的效果。
关键词 免疫疗法;免疫检查点;免疫检查点抑制剂;联合疗法;双功能融合蛋白;双特异性抗体
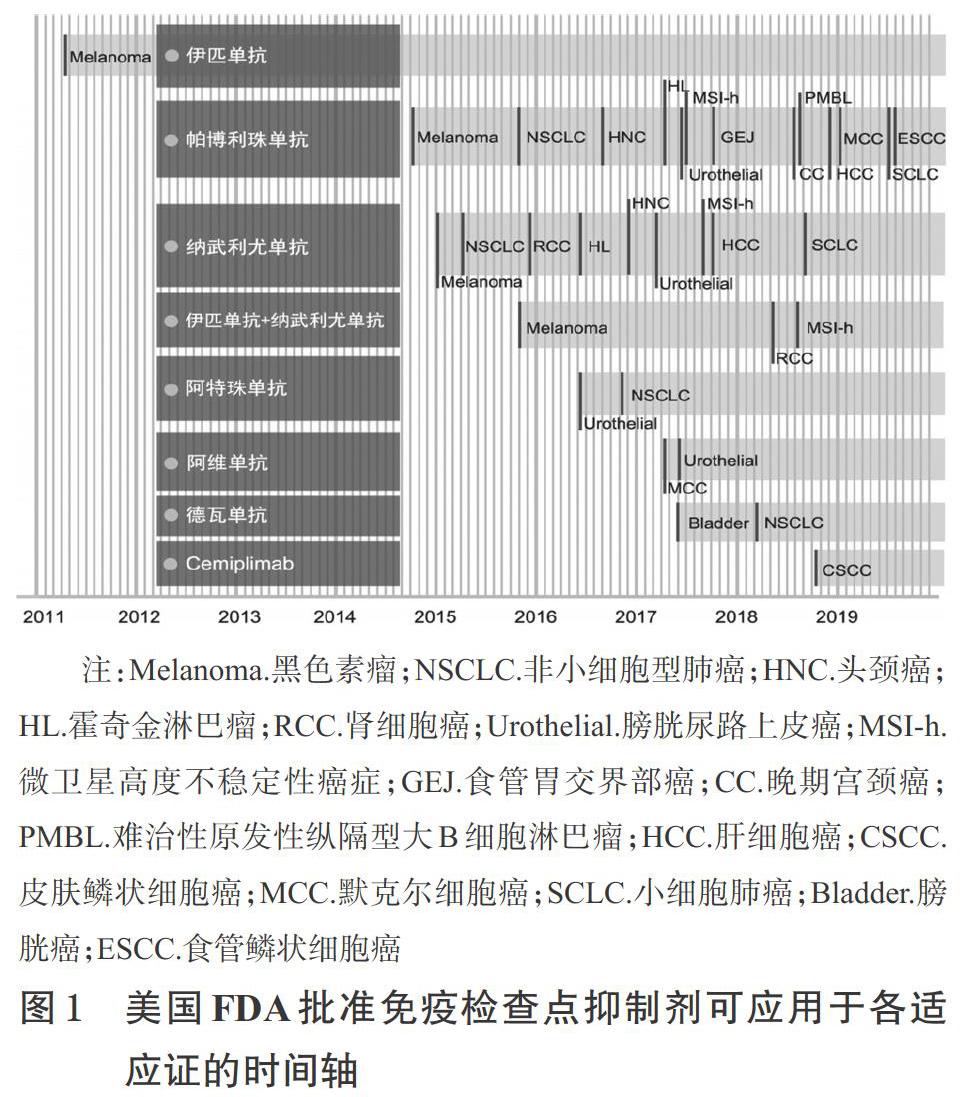
肿瘤免疫疗法是一类通过激活患者自身的免疫系统来治疗癌症的方法,是继手术、放疗、化疗之后抗肿瘤治疗的第四大领域。肿瘤免疫疗法发展迅速,第一代为缺乏靶向性的淋巴因子激活的杀伤细胞(LAK细胞)、细胞因子激活的杀伤细胞(CIK细胞)治疗;第二代为通过同时输入树突状细胞(DC细胞)赋予CIK细胞一定靶向性的DC-CIK治疗;第三代为利用基因编辑给T细胞加入能识别肿瘤细胞并激活T细胞杀死肿瘤细胞的嵌合抗体(CAR);随着免疫治疗精准性的提高,第四代免疫检查点抑制剂和肿瘤疫苗技术应运而生,美国食品药品监督管理局(FDA)批准免疫检查点抑制剂可应用于各适应证的时间轴[1]详见图1。2011年,美国FDA批准首个免疫检查点抑制剂用于治疗晚期黑色素瘤;2018年,美国德克萨斯大学免疫学家詹姆斯·艾利森和日本京都大学教授本庶佑因免疫检查点抑制剂的相关研究而获得诺贝尔医学奖。至此,免疫检查点抑制剂的相关研究也到达了一个新的高度。
基于此,笔者以“免疫疗法”“免疫检查点抑制剂”“联用”“Immunotherapy”“Immune checkpoint inhibitor”“Combined application”等为关键词,在中国知网、万方数据库、维普网、PubMed、Web of Science等数据库中组合查询2014年1月-2020年1月期间发表的相关文献。结果,共检索到相关文献3 658篇,其中有效文献66篇。现对免疫检查点抑制剂及其联用的情况进行归纳总结,以期为其在癌症治疗中的应用及后续深入研究提供参考。
1 免疫检查点及其抑制剂
免疫检查点包括刺激性检查点和抑制性检查点。与促进机体免疫反应的刺激性检查点不同,抑制性检查点是防止人体过激免疫反应的保护性位点,可降低自身免疫反应,故常被肿瘤细胞利用而发生免疫逃逸。免疫检查点抑制剂则可通过阻断抑制性检查点与相关配体间的相互作用,调节机体免疫细胞活性以实现抗肿瘤效果,故也可称为免疫检查点的抗体[2-4]。目前,较为热门的免疫检查点抑制剂有CTLA-4抗体、PD-1抗体、PD-L1抗体、TIM-3抗体、LAG-3抗体等。
1.1 CTLA-4及其抑制剂
CTLA-4,亦被称为CD152,是T细胞的受体之一。T细胞被活化的必要条件之一是抗原呈递细胞上的B7复合体与T细胞上的CD28受体结合;CTLA-4相较CD28对B7复合物具有更高的亲和力,能竞争性阻止CD28与B7结合,从而抑制T细胞活化[5-6]。基于此,针对CTLA-4的抑制剂在临床上的应用已经使部分癌症患者产生了持久的肿瘤消退反应,目前已被广泛应用于临床[7]。
伊匹单抗(Ipilimumab)是一种可拮抗CTLA-4的完全人源化的免疫球蛋白G1(IgG1)单克隆抗体[8],也是第一个被FDA批准的免疫检查点抑制剂。Ito A等[9]对反复治疗失败、不能进行手术切除的进展期(Ⅲ期或Ⅳ期)黑色素瘤患者做了伊匹单抗和gp肽100疫苗给药的对照试验,结果显示,伊匹单抗可有效提高患者的总体生存率。尽管此研究中,患者的中位生存期仅提高了几个月,但治疗开始后伊匹单抗组的标志性生存率均较高,如在第一阶段Ⅲ研究中,18%的患者在2年后存活,而接受gp100疫苗对照治疗的患者仅有5%存活。由此可知,伊匹单抗治疗在临床试验中具有良好的应用效果。
据笔者调查,至今为止CTLA-4抗体仅有伊匹单抗被FDA批准用于治疗黑色素瘤;另一种IgG2同型CTLA-4抗体Tremelimumab在黑色素瘤、间皮瘤试验中表现不佳,目前尚未获批[10-11]。
1.2 PD-1/PD-L1及其抑制剂
PD-1是一种Ⅰ型跨膜蛋白,表达于T细胞、B细胞和NK细胞、调节性T细胞表面,其配体PD-L1属于B7家族,在内皮细胞、表皮细胞等多种细胞表面均有表达[12]。PD-1的抑制功能由蛋白酪氨酸磷酸酶SHP-2介导,PD-1与其配体PD-L1结合后会使T细胞抗原受体(T cell receptor,TCR)下游的信号分子去磷酸化,从而抑制T细胞生长分化[13]。
目前FDA批准的PD-1抑制剂有帕博利珠单抗(Pembrolizumab)、纳武利尤单抗(Nivolumab);PD-L1抑制剂有阿特珠单抗(Atezolizumab)、阿维单抗(Avelumab)、德瓦鲁单抗(Durvalumab)以及Cemiplimab。其中,帕博利珠单抗在临床试验中已表现出良好的疗效及安全性,如在非小细胞肺癌的临床试验中,1 200余例无法手术的晚期肺癌患者分为2组,分别接受帕博利珠单抗单药治疗和以铂为基础的化疗[14]。结果表明,不论患者PD-L1表达水平如何,与传统化疗比较,帕博利珠单抗单用疗法均能显著延长患者的总生存期,并且不良事件较少。此外,FDA还先后批准了PD-1/PD-L1抗体用于治疗黑色素瘤、非小细胞肺癌、复发性或转移性头颈部鳞状细胞癌等疾病。
随着自主研发能力的提升,我国在PD-1及PD-L1抑制剂的研制中也有了明显的成果,如PD-1抗体特瑞普利单抗(Toripalimab)、信迪利单抗(Sintilimab)及卡瑞利珠单抗(Camrelizumab)已于近年先后獲得国家药品监督管理局(NMPA)批准上市,分别用于治疗黑色素瘤和霍奇金淋巴瘤。
综上所述,相较于CTLA-4抗体,PD-1/PD-L1抗体适应证较多,在临床上得到了更为广泛的应用。
1.3 TIM-3及其抑制剂
与PD-1、CTLA-4相似,TIM-3作为抑制性免疫检查点,一旦与肿瘤细胞上相应配体结合就会使T细胞死亡,下调机体免疫反应。TIM-3分布广泛,在T细胞、调节性T细胞、先天免疫细胞(DC细胞、NK细胞、单核细胞)表面均有表达。TIM-3的配体有半乳糖凝集素9、高迁移率族蛋白1及癌胚抗原相关细胞黏附分子1[15-17]。
目前,进入临床试验的TIM-3抑制剂有MBG453、TSR-022、LY3321367、Sym023、BGB-A425、INCAGN- 02390等[18]。以INCAGN02390为例,相关研究表明,其与TIM-3高度亲和,不仅能阻止TIM-3接近CC′-FG结合槽,并能阻断TIM-3与磷脂酰丝氨酸的结合,还能引起受体快速内化,避免与其他配体相互作用[19]。
1.4 LAG-3及其抑制剂
LAG-3是一种表达于活化T细胞、NK细胞、B细胞和浆细胞样树突状细胞上的免疫检查点分子[20-21]。Wang J等[22]研究表明,FGL1是LAG-3的配体,在癌症模型小鼠中,阻断FGL1或LAG-3均可增强T细胞活性并减缓肿瘤生长。相关研究显示,在多种癌症中,肿瘤浸润淋巴细胞常表达LAG-3从而抑制免疫应答、促进癌细胞扩散;而阻断LAG-3则可以解除上述抑制作用,恢复细胞毒性T细胞(Cytotoxic T cell,Tc)活性,减少调节性T细胞数量,提高免疫应答的敏感度[23-24]。
基于LAG-3在基础研究中取得的进展,其抑制剂在临床中的应用也得到了广泛关注。由于早期研究中LAG-3抗体的作用机制不明,研究者大多未关注到其主要配体FGL1的存在,故早期研发的抗体多靶向第二类主要组织相容性复合体[22],而可能不会阻断LAG-3和FGL1的结合(即不能完全封闭LAG-3通路),推测这也可能是截至目前LAG-3抑制剂单用临床数据不佳的主要原因之一。相关研究表明,目前针对LAG-3的研究以联用为主,如以百时美施贵宝公司研发的Relatlimab,截至2020年1月,共有14项临床试验正在进行,其中13项联合纳武利尤单抗,1项联合伊匹单抗[25]。
1.5 其他免疫检查点及其抑制剂
其他免疫检查点还包括IDO、VISTA、TIGIT、B7/H3、BTLA等[26]。IDO是人体色氨酸代谢的限速酶,能够控制代谢肿瘤微环境中的色氨酸含量;色氨酸代谢完则会抑制T细胞的免疫调节作用;在肿瘤细胞(如黑色素瘤、胰腺癌、胃癌等多种细胞)中通常都会过表达IDO,诱发人体免疫系统对其产生免疫耐受,从而发生免疫逃逸[27-29]。目前进入临床试验阶段的IDO抑制剂有BMS- 986205、Epacadostat、Indoximod、KHK2455等[30]。
VISTA主要表达于髓系和粒系细胞,在小鼠和人体T细胞中仅有少量的表达,相关研究发现,VISTA在浸润到胰腺癌的巨噬细胞表面过表达,提示其可能为治疗靶点[31]。同时,另有研究表明,VISTA抑制剂单克隆抗体13F3与癌症疫苗联用时可抑制肿瘤生长[32]。针对晚期癌症,VISTA抑制剂JNJ-61610588的Ⅰ期临床试验结果显示,其具有良好的安全性[33]。
此外,新兴的免疫检查点抑制剂还有双特异性抗体,其又被称为双功能抗体或双价抗体[34]。双特异性抗体可进行双通路的双靶点阻断,进而有效发挥协同作用对抗单一抗体耐药性;也可分别结合同一通路中T细胞表面分子和癌细胞表面抗原,引导T细胞直接杀伤肿瘤细胞[35-36]。如Y-traps有2种亚型(anti-CTLA4-TGFβRⅡ和anti-PDL1-TGFβRⅡ),其中anti-CTLA4-TGFβRⅡ可同时拮抗CTLA-4与乙型转化生长因子β(TGF-β);anti-PDL1-TGFβRⅡ则可同时阻断PD-L1与TGF-β[37]。TGF-β是一种多功能蛋白,具有控制多种细胞的生长、分化、细胞凋亡及免疫调节等功能;在晚期肿瘤中,TGF-β能通过抑制T细胞分化和活化,诱导上皮-间质转化,诱导纤维化和血管生成,从而促进肿瘤发育[38-40]。虽然相关研究表明,同时给予PD-L1抗体和阻断TGF-β可通过促进活化的T细胞浸润肿瘤而触发有效应答[41],但由于TGF-β受体分布广泛,TGF-β拮抗药靶向性不佳,因而无法有效阻断调节性T细胞的自分泌信号[37]。此外,TGF-β拮抗药较大的心脏毒性也使其不能取得预期效果[41-42]。
2 免疫检查点抑制剂的联用及临床效果
相较前几代免疫疗法,第四代免疫检查点抑制剂的精准性、适应性得到了广泛认可;但在免疫检查点抑制剂的临床应用中,仍有很多癌症患者会对该疗法产生抗性或复发[43]。解决这个问题的策略之一是使用联合疗法靶向不同的免疫检查点蛋白,此策略不仅可解决肿瘤细胞表面缺少特异性抗原、肿瘤组织中浸润的T细胞数量减少、T细胞耗竭、抗体本身被巨噬细胞吞噬等原因造成的耐药性问题,还能充分发挥免疫检查点抑制剂在杀灭肿瘤细胞的互补作用[43-44],进而突破应答率不足的瓶颈。目前的主要联用策略如下:
2.1 与PD-1抑制剂的联用
相关研究表明,与单独表达PD-1的T细胞相比,共同表达PD-1和LAG-3、TIM-3等其他抑制分子的T细胞活性更低[45-46],故联合阻断比单独阻断任一检查点更能有效抑制肿瘤生长。
2.1.1 PD-1抑制剂与CTLA-4抑制剂联用 相关研究表明,CTLA-4主要在淋巴结中的免疫循环早期阶段抑制T细胞,而PD-1主要抑制后期外周組织或肿瘤部位的Tc细胞和NK细胞的激活,并诱导调节性T细胞分化,二者抗体的联用具有很好的互补性[47-48]。
有临床前试验表明,联合阻断PD-1和CTLA-4比单独阻断任一通路的抗肿瘤效果更明显[49]。同样,临床研究也证实了PD-1和CTLA-4抑制剂联用的优越性,其通过对比纳武利尤单抗和伊匹单抗联合治疗晚期肾细胞癌与舒尼替尼单药治疗的效果[50]。结果显示,联用组在客观应答率、完全缓解率、肿瘤病灶消失的患者比例方面都具有优势。另有研究显示,PD-1抑制剂与CTLA-4抑制剂联用相较化疗能更有效地延长肺癌患者的无进展生存期[51]。该研究将2 877例患者分为纳武利尤单抗+伊匹单抗组、纳武利尤单抗组、化疗组。结果表明,纳武利尤单抗+伊匹单抗组、化疗组患者的1年无进展生存率分别为42.6%、13.2%,无进展生存期分别为7.2、5.5个月,客观缓解率分别为45.3%、26.9%。
2.1.2 PD-1抑制剂与LAG-3抑制剂联用 LAG-3与PD-1协同作用,不但能抑制Tc细胞的增殖,还能增强调节性T细胞活性,从而进一步抑制免疫应答,故阻断LAG-3对解除PD-1抗体耐受至关重要。比如在肾细胞癌中,研究人员发现PD-1和LAG-3检查点受体能对T细胞产生抑制作用;同时抑制PD-1和LAG-3可以刺激干扰素-γ的释放,进而促进机体免疫反应[52]。另有研究表明,在抗原刺激较弱的条件下,阻断LAG-3或双重阻断LAG-3和PD-1可显著激活并增强抗肿瘤免疫应答[53]。此外,2018年美国临床肿瘤学会公布的 LAG-3抑制剂BMS- 986016和纳武利尤单抗联合治疗晚期黑色素瘤的临床数据显示,两者联用能有效克服PD-1单药治疗的耐药性[54]。另一项LAG-3抗体REGN3767与PD-1抗体Cemiplimab联用治疗多种晚期癌症的研究也正在Ⅰ期临床试验阶段[55],但研究数据尚未公布。
2.1.3 PD-1抑制剂与TIM-3抑制剂联用 一项针对非小细胞肺癌的研究结果显示,PD-1抑制剂改善不同时期的肿瘤细胞微环境后,TIM-3在对PD-1抗体产生耐药性的动物中出现高表达;而当TIM-3抑制剂与PD-1抑制剂联用时可抑制机体对PD-1抑制剂产生的耐药性[56]。此外,在乙型肝炎(HBV)相关的一项肝癌研究中显示,阻断TIM-3和/或PD-1可以逆转HBV相关性肝癌肿瘤浸润淋巴细胞功能障碍[57]。
2.2 与CTLA-4抑制剂的联用
CTLA-4抑制剂除了与PD-1抑制剂联用效果良好外,尚有多种其他联用具有良好的临床应用效果。
2.2.1 CTLA-4抑制剂与LAG-3抑制剂联用 CTLA-4和LAG-3均能抑制TCR信号通路,抑制细胞周期进程,触发调节性T细胞的免疫抑制功能,并可通过共抑制信号通路诱导机体产生免疫耐受[58]。如研究发现,乳腺癌细胞在进行PD-1/PD-L1阻断后,上调了辅助性T细胞中CTLA-4和LAG-3免疫检查点的表达,提示共阻断CTLA-4和LAG-3可能为PD-1/PD-L1抑制剂耐受的患者提供新的治疗方案选择[59]。另外有研究发现,伊匹单抗治疗会引起转移性黑色素瘤患者中LAG-3表达水平上调[60];而在急性移植物抗宿主病(GVHD)患者中,使用四价CTLA-4免疫球蛋白融合蛋白和LAG-3免疫球蛋白融合蛋白可以协同抑制T细胞反应,预防急性GVHD,降低死亡率[61]。
2.2.2 CTLA-4抑制剂与IDO抑制剂联用 Holmgaard RB等[62]发现使用CTLA-4抑制剂之后,肿瘤细胞能够通过IDO来逃避免疫系统监视;当CTLA-4抑制剂与IDO抑制剂联用时,则能有效减小黑色素瘤模型小鼠的肿瘤体积,延长其生存期。
2.3 其他联用
2017年欧洲肿瘤学学会年会披露的数据显示,PD-1抑制剂帕博利珠单抗与IDO抑制剂Epacadostat的联用在晚期黑色素瘤的Ⅰ/Ⅱ期临床试验中表现出良好的效果,客观缓解率为56%[63]。遗憾的是,与PD-1抑制剂单用疗法比较,该联合疗法错过了其在整体人群中改善无进展存活的第一个主要终点,于2018年4月终止试验[64]。但最近一项新的Ⅰ/Ⅱ期临床试验[65]已经开始,该临床试验将研究三重靶向LAG-3、PD-1和CTLA-4的有效性,这有望引导癌症治疗多重靶向策略的发展。
此外,近日发现的免疫疗法靶点Siglec-15是Siglec基因家族成员之一,具有特征性唾液酸结合免疫球蛋白型凝集素结构。相关研究发现,对 PD-1/PD-L1 抗体不响应的肿瘤中,Siglec-15是其主要免疫抑制因子[66],即该靶点在功能上很可能与PD-1互补。因此,PD-1/PD-L1抗体与Siglec-15抗体联用也可能成为今后的研究方向之一。
3 結语
近年来,随着肿瘤免疫研究的迅猛发展,免疫检查点抑制剂CTLA-4抗体及PD-1/PD-L1抗体等抑制剂在多种癌症中均得到了成功应用,如黑色素瘤、非小细胞肺癌、晚期宫颈癌、肝细胞癌、皮肤鳞状细胞癌、膀胱癌等。免疫疗法已然成为晚期癌症患者的主要治疗选择之一。其中,具有精准性、多通路靶向的免疫检查点抑制剂联合疗法则在克服耐药性、增强免疫细胞对肿瘤细胞的特异性识别与杀伤方面独具优势。如PD-1抑制剂纳武利尤单抗与CTLA-4抑制剂伊匹单抗联用,可延长肺癌患者的无进展生存期,具有很好的互补性;纳武利尤单抗与LAG-3抑制剂BMS-986016联用治疗晚期黑色素瘤,能有效克服PD-1单药疗法的耐药性;PD-1抑制剂与TIM-3抑制剂联用治疗非小细胞肺癌,则可抑制机体对PD-1抑制剂产生的耐药性。CTLA-4抑制剂与LAG-3抑制剂联用,可通过共抑制信号通路诱导机体产生免疫耐受;与IDO抑制剂联用,能有效减小黑色素瘤小鼠的肿瘤体积,延长其生存期等。此外,兼具了较好的靶向性、可通过双通路或双靶点阻断进而有效发挥协同作用的双功能抗体的出现,更给予了肿瘤治疗新的启示,或将成为人类攻克癌症的关键治疗策略之一。
参考文献
[ 1 ] RIHOVA B,STASTNY M. History of immuno-therapy- from coleytoxins to check-points of the immune reaction[J]. Klin Onkol,2015.DOI:10.14735/amko20154S8.
[ 2 ] POSTOW MA,CALLAHAN MKWOLCHOK JD. Immune checkpoint blockade in cancer therapy[J]. J Clin Oncol,2015,33(17):1974-U1161.
[ 3 ] TOPALIAN SL,DRAKE CGPARDOLL DM. Immune checkpoint blockade:a common denominator approach to cancer therapy[J]. Cancer Cell,2015,27(4):450-461.
[ 4 ] LI X,SHAO C,SHI Y,et al. Lessons learned from the blockade of immune checkpoints in cancer immunotherapy[J]. J Hematol Oncol,2018,11(1):31-56.
[ 5 ] WALKER LSK,SANSOM DM. Confusing signals:recent progress in CTLA-4 biology[J]. Trends Immunol,2015,36(2):63-70.
[ 6 ] CHAN DV,GIBSON HM,AUFIERO BM,et al. Differential CTLA-4 expression in human CD4+ versus CD8+ T cells is associated with increased NFAT1 and inhibition of CD4+ proliferation[J]. Genes Immun,2014,15(1):25-32.
[ 7 ] HARGADON KM,JOHNSON CE,WILLIAMS CJ. Immune checkpoint blockade therapy for cancer:an overview of FDA-approved immune checkpoint inhibitors[J]. Int Immunopharmacol,2018,62(1):29-39.
[ 8 ] HODI FS,ODAY SJ,MCDERMOTT DF,et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. New Engl J Med,2010,363(8):711-723.
[ 9 ] ITO A,KONDO S,TADA K,et al. Clinical development of immune checkpoint inhibitors[J]. Bio Med Res Int,2015.DOI:10.1155/2015/605478.
[10] RIBAS A,KEFFORD R,MARSHALL MA,et al. Phase Ⅲ randomized clinical trial comparing tremelimumab with standard-of-care chemotherapy in patients with advanced melanoma[J]. J Clin Oncol,2013,31(5):616- 622.
[11] MAIO M,SCHERPEREEL A,CALABRO L,et al. Tre- melimumab as second-line or third-line treatment in relapsed malignant mesothelioma (DETERMINE):a multicentre,international,randomised,double-blind,placebo-controlled phase 2b trial[J]. Lancet Oncol,2017,18(9):1261-1273.
[12] SAHNI S,VALECHA G,SAHNI A. Role of anti-PD-1 antibodies in advanced melanoma:the era of immunotherapy[J]. Cureus,2018.DOI:10.7759/cureus.3700.
[13] ARASANZ H,GATO-CANAS M,ZUAZO M,et al. PD1 signal transduction pathways in T cells[J]. Oncotarget,2017,8(31):51936-51945.
[14] MOKTS K,WU YL,KUDABA I,et al. Pembrolizumab versus chemotherapy for previously untreated,PD-L1-expressing,locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042):a randomised,open-label,controlled,phase 3 trial[J]. Lancet,2019,393(10183):1819-1830.
[15] SABATOS-PEYTON CA,NEVIN J,BROCK A,et al. Blockade of Tim-3 binding to phosphatidylserine and CEACAM1 is a shared feature of anti-Tim-3 antibodies that have functional efficacy[J]. Oncoimmunology,2018.DOI:10.1080/2162402X.2017.1385690.
[16] XU L,HUANG Y,TAN L,et al. Increased Tim-3 expression in peripheral NK cells predicts a poorer prognosis and Tim-3 blockade improves NK cell-mediated cytotoxicity in human lung adenocarcinoma[J]. Int Immunopharmacol,2015,29(2):635-641.
[17] ANDERSON AC,JOLLER N,KUCHROO VK. Lag-3,Tim-3,and TIGIT:co-inhibitory receptors with specialized functions in immune regulation[J]. Immunity,2016,44(5):989-1004.
[18] Samsung Medical Center,Symphogen AS,Changhai Hospital,et al. TIM-3 inhibitor clinical studies[EB/OL].[2019-12-23].https://clinicaltrials.gov/ct2/results?cond=TIM-3&term=&cntry=&state=&city=&dist=.
[19] WAIGHT J,IYER P,BREOUS-NYSTROM E,et al. INCAGN02390,a novel antagonist antibody that targets the co-inhibitory receptor TIM-3[J]. Cancer Research,2018.DOI:10.1158/1538-7445.AM2018-3825.
[20] YU X,HUANG X,CHEN X,et al. Characterization of a novel anti-human lymphocyte activation gene 3 (LAG-3) antibody for cancer immunotherapy[J]. MAbs,2019,11(6):1139-1148.
[21] TAKAYA S,SAITO H,IKEGUCHI M. Upregulation of immune checkpoint molecules,PD-1 and LAG-3,on CD4+ and CD8+ T cells after gastric cancer surgery[J]. Yonago Acta Med,2015,58(1):39-58.
[22] WANG J,SANMAMED MF,DATAR I,et al. Fibrinogen-like protein 1 is a major immune inhibitory ligand of LAG-3[J]. Cell,2019,176(1/2):334-347.
[23] SEGA EI,LEVESON-GOWER DB,FLOREK M,et al. Role of lymphocyte activation gene-3 (Lag-3) in conventional and regulatory T cell function in allogeneic transplantation[J]. PLoS One,2014. DOI:10.1371/journal.pone.0086551.
[24] MARUHASHI T,OKAZAKI IM,SUGIURA D,et al. LAG-3 inhibits the activation of CD4+ T cells that recognize stable pMHCⅡ through its conformation-dependent recognition of pMHCⅡ[J]. Nat Immunol,2018,19(12):1415-1426.
[25] Bristol-myers Squibb,Nation Cancer Institute,Vanderbilt- ingram Cancer Center,et al. Relatlimab clinical studies[EB/OL].[2020-01-18]. https://clinicaltrials.gov/ct2/results?cond=Relatlimab&term=&cntry=&state=&city=& dist=.
[26] MARIN-ACEVEDO JA,DHOLARIA B,SOYANO AE,et al. Next generation of immune checkpoint therapy in cancer:new developments and challenges [J]. J Hematol Oncol,2018.DOI:10.1186/s13045-018-0582-8.
[27] CHEVOLET I,SPEEKAERT R,SCHREUER M,et al. Characterization of the in vivo immune network of IDO,tryptophan metabolism,PD-L1,and CTLA-4 in circulating immune cells in melanoma[J]. Oncoimmunology,2015. DOI:10.4161/2162402X.2014.982382.
[28] MOON YW,HAJJAR J,HWU P,et al. Targeting the indoleamine 2,3-dioxygenase pathway in cancer[J]. J Immunother Cancer,2015,3(1):51-60.
[29] NISHI M,YOSHIKAWA K,HIGASHIJIMA J,et al. The impact of indoleamine 2,3-dioxygenase (IDO) expression on stage Ⅲ gastric cancer[J]. Anticancer Res,2018,38(6):3387-3392.
[30] SAVANE IM,Main Line Health,Herlev Hospital,et al. IDO inhibitor clinical studies[EB/OL].[2019-12-23].https://clinicaltrials.gov/ct2/results?cond=IDO&term=& cntry=&state=&city=&dist=.
[31] LIU J,XIE X,XUAN C,et al. High-density infiltration of V-domain immunoglobulin suppressor of T-cell activation up-regulated immune cells in human pancreatic cancer[J]. Pancreas,2018,47(6):725-731.
[32] LE MERCIER I,CHEN W,LINES JL,et al. VISTA regulates the development of protective antitumor immunity[J]. Cancer Res,2014,74(7):1933-1944.
[33] Janssen Research & Development. A study of safety,pharmacokinetics,pharmacodynamics of JNJ61610588 in participants with advanced cancer[EB/OL].[2020-01-18].https://clinicaltrials.gov/ct2/show/NCT02671955.
[34] KONTERMANN RE,BRINKMANN U. Bispecific antibodies[J]. Drug Discov Today,2015,20(7):838-847.
[35] KOBOLD S,PANTELYUSHIN S,RATAI F,et al. Rationale for combining bispecific T cell activating antibodies with checkpoint blockade for cancer therapy[J]. Front Oncol,2018.DOI:10.3389/fonc.2018.00285.
[36] LI J,ZHOU C,DONG B,et al. Single domain antibody- based bispecific antibody induces potent specific anti-tumor activity[J]. Cancer Biol Ther,2016,17(12):1231- 1239.
[37] RAVI R,NOONAN KA,PHAM V,et al. Bifunctional immune checkpoint-targeted antibody-ligand traps that simultaneously disable TGF beta enhance the efficacy of cancer immunotherapy[J]. Nat Commun,2018,9(741):1-14.
[38] ZHAO Y,HU J,LI R,et al. Enhanced NK cell adoptive antitumor effects against breast cancer in vitro via blockade of the transforming growth factor-beta signaling pathway[J]. Onco Targets Ther,2015.DOI:10.2147/OTT.S82616.
[39] ROS XR,VERMEULEN L. Turning cold tumors hot by blocking TGF-β[J]. Trends Cancer,2018,4(5):335-337.
[40] MORIKAWA M,DERYNCK R,MIYAZONO K. TGF-beta and the TGF-beta family:context-dependent roles in cell and tissue physiology[J]. Cold Spring Harb Perspect Biol,2016.DOI:10.1101/cshperspect.a021873.
[41] GANESH K,MASSAGU? J. TGF-β inhibition and immunotherapy:checkmate[J]. Immunity,2018,48(4):626- 628.
[42] COURAU T,NEHAR-BELAID D,FLOREZ L,et al. TGF-beta and VEGF cooperatively control the immunotolerant tumor environment and the efficacy of cancer immunotherapies[J]. JCI Insight,2016.DOI:10.1172/jci.insight. 85974.
[43] ARLAUCKAS SP,GARRIS CS,KOHLER RH,et al. In vivo imaging reveals a tumor-associated macrophage-mediated resistance pathway in anti-PD-1 therapy[J]. Sci Transl Med,2017.DOI:10.1126/scitranslmed.aal3604.
[44] LIU D,JENKINS RW,SULLIVAN RJ. Mechanisms of resistance to immune checkpoint blockade[J]. Am J Clin Dermatol,2019,20(1):41-54.
[45] HE Y,YU H,ROZEBOOM L,et al. LAG-3 protein expression in non-small cell lung cancer and its relationship with PD-1/PD-L1 and tumor-infiltrating lymphocytes[J]. J Thorac Oncol,2017,12(5):814-823.
[46] YUN SJ,LEE B,KOMORI K,et al. Regulation of TIM-3 expression in a human T cell line by tumor-conditioned media and cyclic AMP-dependent signaling[J]. Mol Immunol,2019. DOI:10.1016/j.molimm.2018.12.006.
[47] ROTTE A. Combination of CTLA-4 and PD-1 blockers for treatment of cancer[J]. J Exp Clin Cancer Res,2019,38(1):255-267.
[48] JIA L,ZHANG Q,ZHANG R. PD-1/PD-L1 pathway blockade works as an effective and practical therapy for cancer immunotherapy[J]. Cancer Biol Med,2018,15(2):116-123.
[49] DURAISWAMY J,FREEMAN GJ,COUKOS G. Dualblockade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-cell rejection function in tumors-response[J]. Cancer Res,2014,74(2):633-634.
[50] MOTZER RJ,TANNIR NM,MCDERMOTT DF,et al.Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma[J]. N Engl J Med,2018,378(14):1277-1290.
[51] HELLMANN MD,CIULEANU TE,PLUZANSKI A, et al. Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden[J]. N Engl J Med,2018,378(22):2093-2104.
[52] ZELBA H,BEDKE J,HENNENLOTTER J,et al. PD-1 and LAG-3 dominate checkpoint receptor-mediated T-cell inhibition in renal cell carcinoma[J]. Cancer Immunol Res,2019,7(11):1891-1899.
[53] LICHTENEGGER FS,ROTHE M,SCHNORFEIL FM,et al. Targeting LAG-3 and PD-1 to enhance T cell activation by antigen-presenting cells[J]. Front Immunol,2018.DOI:10.3389/fimmu.2018.00385.
[54] Bristol-myers Squibb. Aninvestigational immuno-therapy study to assess the safety,tolerability and effectiveness of anti-LAG-3 with and without Anti-PD-1 in the treatment of solid tumors[EB/OL].[2020-01-18]. https://clinicaltrials.gov/ct2/show/NCT01968109?cond=NCT01968109& draw=2&rank=1.
[55] Regeneron Pharmaceutical. Study of REGN3767 (Anti- LAG-3) with or without REGN2810 (Anti-PD1) in advanced cancers[EB/OL].[2020-01-18]. https://clinicaltrials.gov/ct2/show/NCT03005782?cond=NCT03005782& draw=2&rank=1.
[56] LIZOTTE PH,IVANOVA EV,AWAD MM,et al. Multiparametric profiling of non-small-cell lung cancers reveals distinct immunophenotypes[J]. JCI Insight,2016.DOI:10.1172/jci.insight.89014.
[57] LIU F,ZENG G,ZHOU S,et al. Blocking Tim-3 or/and PD-1 reverses dysfunction of tumor-infiltrating lymphocytes in HBV-related hepatocellular carcinoma[J]. Bull Cancer,2018,105(5):493-501.
[58] BAUMEISTER SH,FREEMAN GJ,DRANOFF G,et al. Coinhibitory pathways in immunotherapy for cancer[J]. Annu Rev Immunol,2016.DOI:10.1146/annurev-immunol-032414-112049.
[59] SALEH R,TOOR SM,KHALAF S,et al. Breast cancer cells and PD-1/PD-L1 blockade upregulate the expression of PD-1,CTLA-4,TIM-3 and LAG-3 immune checkpoints in CD4+ T cells[J]. Vaccines,2019,7(4):149-161.
[60] BJOERN J,LYNGAA R,ANDERSEN R,et al. Influence of ipilimumab on expanded tumour derived T cells from patients with metastatic melanoma[J]. Oncotarget,2017,8(16):27062-27074.
[61] CHO H,CHUNG YH. Construction,and in vitro and in vivo analyses of tetravalent immunoadhesins[J]. J Microbiol Biotechnol,2012,22(8):1066-1076.
[62] HOLMGAARD RB,ZAMARIN D,MUNN DH,et al. Indoleamine 2,3-dioxygenase is a critical resistance mechanism in antitumor T cell immunotherapy targeting CTLA-4[J]. J Exp Med,2013,210(7):1389-1402.
[63] HAMID O,GAJEWSKI TF,Frankel AE,et al. Epacado- stat plus pembrolizumab in patients with advanced melanoma:phase 1 and 2 efficacy and safety results from ECHO-202/KEYNOTE-037[J]. Ann Oncol,2017.DOI:10. 1093/annonc/mdx377.001.
[64] FIGUEIREDO M. Keytruda-epacadostatcombo fails primary goal in phase 3 trial for melanoma,companies announce[EB/OL].[2020-01-18].https://immuno-oncologynews.com/2018/04/11/keytruda-epacadostat-fails-primary- goal-phase-3-trial-melanoma/.
[65] Bristol-myers Squibb. An investigational study of Immunotherapy combinations in participants with solid cancers that are advanced or have spread[EB/OL].[2020-01-18].https://clinicaltrials.gov/ct2/show/NCT03459222.
[66] WANG J,SUN J,LIU LN,et al. Siglec-15 as an immune suppressor and potential target for normalization cancer immunotherapy[J]. Nat Med,2019,25(4):656-666.
(收稿日期:2019-11-14 修回日期:2020-01-19)
(編辑:唐晓莲)
