血液恶性肿瘤患者中MTHFR基因多态性与大剂量甲氨蝶呤血液毒性相关性的Meta分析
2020-04-20刘爽宋再伟易湛苗赵荣生
刘爽 宋再伟 易湛苗 赵荣生

摘 要 目的:系統评价血液恶性肿瘤患者中亚甲基四氢叶酸还原酶(MTHFR) C677T及A1298C多态性与大剂量甲氨蝶呤(HDMTX)血液系统不良事件的相关性。方法:系统检索Medline、Embase、Clinical Trials.gov、中国学术期刊网络出版总库、万方数据库、中国生物医学文献数据库,收集采用HDMTX治疗血液恶性肿瘤涉及MTHFR C677T及A1298C基因多态性的队列研究,时限均为自建库起至2018年3月。对符合纳入标准的文献进行资料提取,并采用纽卡斯尔-渥太华量表进行质量评价后,应用Rev Man 5.3软件对不同遗传模型下HDMTX血液系统不良事件进行Meta分析。结果:共纳入25项队列研究,其中23项研究关注MTHFR C677T位点(1 858例患者)、16项研究关注MTHFR A1298C位点(1 088例患者)。Meta分析结果表明,MTHFR C677T突变型显著增加了血液毒性[TT/CT vs. CC:OR=1.57,95%CI(1.12,2.20),P=0.009;TT vs. CT/CC:OR=2.19,95%CI(1.49,3.23),P<0.001;T vs. C:OR=1.34,95%CI(1.03,1.74),P=0.03]、严重血液毒性[TT/CT vs. CC:OR=2.33,95%CI(1.43,3.81),P<0.001]的发生风险,具体包括增加了白细胞减少[TT/CT vs. CC:OR=1.37,95%CI(1.02,1.82),P=0.03]、严重白细胞减少[TT/CT vs. CC:OR=1.63,95%CI(1.03,2.56),P=0.04]、严重粒细胞减少[TT/CT vs. CC:OR=2.26,95%CI(1.50,3.39),P<0.001]的发生风险;MTHFR A1298C突变型显著降低了严重血液毒性[CC/AC vs. AA:OR=0.17,95%CI(0.04,0.76),P=0.02]的发生风险,具体包括降低了白细胞减少[CC/AC vs. AA:OR=0.68,95%CI(0.48,0.97),P=0.03; CC vs. AC/AA:OR=0.28,95%CI(0.14,0.59),P<0.001]、严重白细胞减少[CC/AC vs. AA:OR=0.43,95%CI(0.19,0.97),P=0.04]的发生风险。结论:在血液恶性肿瘤患者中,MTHFR C677T突变型可能增加HDMTX血液毒性发生风险,包括白细胞减少以及粒细胞减少;而MTHFR A1298C突变型则可能降低HDMTX血液毒性发生风险,包括白细胞减少。
关键词 亚甲基四氢叶酸还原酶;基因多态性;大剂量甲氨蝶呤;血液恶性肿瘤;安全性;Meta分析
ABSTRACT OBJECTIVE: To systematically evaluate the correlation of methylenetetrahydrofolate reductase (MTHFR) C677T and A1298C gene polymorphisms with blood system adverse events induced by high-dose of methotrexate (HDMTX). METHODS: Retrieved from Medline, Embase, Clinical Trials.gov, CNKI, Wanfang database, CBM, cohort studies about MTHFR gene polymorphism in hematological neoplasm treated by HDMTX were collected from inceptions to March 2018. After data extraction of included literatures, quality evaluation with Newcastle Ottawa scale, Meta-analysis was performed for adverse events of blood system induced by HDMTX in different genetic models with Rev Man 5.3 software. RESULTS: Totally 25 cohort studies were included, 23 studies of which were related to MTHFR C677T site (including 1 858 patients) and 16 studies related to MTHFR A1298C site (including 1 088 patients). Results of Meta-analysis showed that MTHFR C677T mutation type significantly increased the risk of hematotoxicity [TT/CT vs. CC: OR=1.57, 95%CI(1.12,2.20), P=0.009;TT vs. CT/CC: OR=2.19, 95%CI(1.49,3.23), P<0.001;T vs. C: OR=1.34, 95%CI(1.03,1.74), P=0.03] and severe hematotoxicity [TT/CT vs. CC: OR=2.33, 95%CI(1.43,3.81), P<0.001], including leukopenia [TT/CT vs. CC: OR=1.37, 95%CI(1.02,1.82), P=0.03], severe leukopenia [TT/CT vs. CC: OR=1.63, 95%CI(1.03,2.56), P=0.04], severe granulopenia [TT/CT vs. CC: OR=2.26, 95%CI(1.50,3.39), P<0.001]. The mutation genotypes of MTHFR A1298C significantly decreased the risk of severe hematotoxicity [CC/AC vs. AA: OR=0.17, 95%CI(0.04,0.76), P=0.02], including leukopenia [CC/AC vs. AA: OR=0.68, 95%CI(0.48,0.97), P=0.03; CC vs. AC/AA: OR=0.28, 95%CI(0.14,0.59), P<0.001] and severe leukopenia [CC/AC vs. AA: OR=0.43, 95%CI(0.19,0.97), P=0.04]. CONCLUSIONS: Among patients with hematological neoplasms, MTHFR C677T mutation may significantly increase the risk of hematotoxicity by HDMTX including the risk of leukopenia and granulopenia; while MTHFR A1298C may reduce the risk of hematotoxicity by HDMTX, including the risk of leukopenia.
KEYWORDS Methylenetetrahydrofolate reductase; Gene polymorphisms; High-dose methotrexate; Hematological neoplasms; Safety; Meta-analysis
甲氨蝶呤(Methotrexate,MTX)是临床上重要的叶酸拮抗药,属于周期特异性细胞毒药物,对增殖旺盛的细胞,尤其是处于S期的细胞具有较强的杀伤作用,可使细胞的DNA和RNA合成中断,进而发挥阻断肿瘤细胞增殖的作用[1]。MTX在非靶向性抑制肿瘤细胞增殖的同时,也会使正常细胞的代谢受阻,从而引起不同程度的不良事件,包括血液毒性、肝毒性、肾毒性、口腔黏膜炎、消化道毒性、皮肤毒性及神经毒性等[2]。目前临床常用大剂量MTX(High-dose methotrexate,HDMTX,>500 mg/m2)[3]治疗急性淋巴细胞白血病(ALL)、非霍奇金淋巴瘤(NHL)等血液系统肿瘤。HDMTX在提高血药浓度、改善预后的同时,也增加了不良事件的发生风险。其中,骨髓抑制是HDMTX最严重的不良事件之一,主要表现为白细胞下降,也可见血小板减少,严重时可出现全血细胞下降、皮肤或内脏出血,临床常根据患者化疗后的白细胞、粒细胞、血小板及血红蛋白等监测值对骨髓抑制进行严重程度分级[4-5]。
亚甲基四氢叶酸还原酶(Methylenetetrahydrofolate reductase,MTHFR)是叶酸代谢的关键酶之一,对DNA的合成、活化、修复等起调控作用,其中,C677T、A1298C是其常见的基因多态性位点[6]。目前多项研究结果表明,C677T、A1298C两个位点的不同基因型对HDMTX血液系统不良事件发生风险的影响不尽相同,如樊春艳[7]研究表明,MTHFR C677T野生型患者发生骨髓抑制的风险显著降低;Chiusolo P等[8]研究表明,MTHFR C677T多态性与血液毒性的发生风险无显著相关性,MTHFR A1298C突变型降低了血液毒性的发生风险;而Kantar M等[9]研究则表明,MTHFR A1298C突变型增加了贫血及血小板减少的发生风险。因此,本研究纳入并整合相关临床证据,系统评价血液恶性肿瘤患者的MTHFR C677T、A1298C多态性对其HDMTX血液系统不良事件发生风险的影响,从而为临床决策提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 队列研究。
1.1.2 研究对象 接受HDMTX治疗的血液恶性肿瘤患者,包括ALL、NHL等患者。年龄、性别及种族均不限。
1.1.3 干预措施 MTHFR C677T与A1298C基因型患者分别按照野生型与突变型分组。
1.1.4 结局指标 ①血液毒性/骨髓抑制率;②严重血液毒性/骨髓抑制率;③白细胞减少率;④严重白细胞减少率;⑤粒细胞减少率;⑥严重粒细胞减少率;⑦血小板减少率;⑧严重血小板减少率;⑨贫血发生率;⑩严重贫血发生率;11淋巴细胞减少率;12严重淋巴细胞减少率。不良反应分级标准参照世界卫生组织(WHO)抗癌药物毒副作用分级(严重程度:0级为正常或轻微,3~4级为重度)[1]、美国国家癌症研究所常见不良反应评价标准(CTCAE,严重程度:1级为正常或轻微,3~4级为重度)[1]或其他通用标准。
1.1.5 排除标准 结局指标为非血液毒性或血药浓度/排泄延迟的研究;不符合哈迪-温伯格平衡定律(HWE)[10]的研究;无法定量合并的研究;非中英文研究;重复文献(样本重复的文献则仅纳入最新发表的文献);联系原文作者后仍无法获取全文的文献;数据有误或缺失的文献。
1.2 检索策略
英文以“Methotrexate”及其同义词和“Acute lymphoblastic leukemia”“B cell lymphoma”“Polymorphim”“Methylenetetrahydrofolate reductase”“MTHFR”等为关键词,中文以“甲氨蝶呤”及其同义词和“急性淋巴细胞白血病”“B细胞淋巴瘤”“亚甲基四氢叶酸还原酶”“基因多態性”等为关键词,检索英文数据库包括Medline、Embase,中文数据库包括中国学术期刊网络出版总库、万方数据库、中国生物医学文献数据库,并补充检索Clinical Trials.gov,时限均为自建库起至2018年3月。此外,利用Google等搜索引擎手工补充检索综述和纳入文献的参考文献。
1.3 文献筛选和数据提取
两位研究者独立筛选文献,按照题目、摘要、全文的逐级顺序确定符合纳排标准的研究,交叉核对后如有分歧,通过与第三人讨论解决。两位研究者阅读全文后独立提取纳入研究的基本信息,主要包括第一作者、发表年份、血液肿瘤类型、患者数、性别和年龄构成、结局指标及不良反应分级标准。若纳入研究中数据缺失,则尝试通过邮件等方式联系原文作者。提取过程如遇分歧,则通过讨论或咨询第三人裁决。
1.4 质量评价
两位研究者采用Cochrane协作网推荐的纽卡斯尔-渥太华量表(NOS)[11]独立评价,量表包括研究人群选择(4个条目)、组间可比性(1个条目)、结果测量(3个条目)3个部分,满分为9分,其中7~9分为高质量研究,5~6分为中等质量研究,1~4分为低质量研究。综合评价后如有分歧,则通过讨论或咨询第三人裁决。
1.5 统计分析方法
应用Microsoft Excel 2016软件建立数据库,对纳入研究的基因型分布频率进行χ2检验,P>0.05表明样本符合HWE,说明具有群体代表性。采用Rev Man 5.3软件进行定量分析(Meta分析)。Meta分析时,采用比值比(OR)作为计数资料的分析统计量,效应量以95%置信区间(CI)表示,分别计算显性遗传模型(MM/Mm vs. mm)、隐性遗传模型(MM vs. Mm/mm)、等位基因遗传模型(M vs. m)下的OR值及95%CI(“M”在MTHFR C677T中表示T,在MTHFR A1298C中表示C)。用Z检验分析OR值是否具有统计学意义(P<0.05表示具有统计学意义),所有分析均采用固定效应模型合并OR值。采用q检验分析各研究间的异质性(检验水平α=0.1),并根据I 2评价研究间的异质性大小,Phet>0.1(Phet为异质性的P值)或I 2≤50%表明异质性尚可;Phet≤0.1且I 2>50%表明异质性显著,应进一步分析异质性来源[12]。各研究结果存在统计学异质性时,首先排除数据提取错误,其次当文献数量足够时,按照不同种族、年龄(儿童或成人)等进行亚组分析,进而判断是否可以解释异质性来源。采用敏感性分析判断Meta分析结果的稳定性及可靠性,逐篇剔除纳入Meta分析的研究,去除低质量研究后与原合并结果进行比较,若未使原结果发生逆转,则合并结果可能较为可靠;若最终未明确异质性来源,则换用随机效应模型,或只行定性分析。如果研究数量大于10,则采用漏斗图评估纳入研究是否存在发表偏倚[13]。
2 结果
2.1 文献筛选流程及结果
共检索到1 901项相关原始研究,经除重和阅读题目、摘要及全文后,最终纳入25项队列研究[7-8,14-36],其中与MTHFR C677T有关的队列研究有23项[7-8,14-29,31-33,35-36],共1 858例患者;与MTHFR A1298C有关的队列研究有16项[7-8,16-18,20-22,27-28,30-31,33-36],共1 088例患者;同时涉及MTHFR C677T和MTHFR A1298C的研究有14项[7-8,16-18,20-22,27-28,31,33,35-36]。25项研究中,中文研究有9项[7,23-27,29,35-36],英文研究有16项[8,14-22,28,30-34]。文献筛选的具体流程图详见图1。
2.2 纳入研究的基本特征及质量评价
纳入人群均为ALL或NHL等血液系统恶性肿瘤患者,其中17项研究[7,14,16-18,20-23,26,28-29,31-32,34-36]限定患儿,5项研究[15,19,27,30,33]限定成人,3项研究[8,24-25]同时纳入了患儿与成人。大部分研究中不良事件的定义采用了WHO标准或CTCAE。报告MTHFR C677T多态性的23项研究的NOS平均分为7.52分,报告MTHFR A1298C多态性的16项研究的NOS平均分为7.75分,可见纳入研究均为高质量研究。其中,8项研究[14,16-19,21,30,34]满足NOS的所有条目,均充分考虑了纳入人群的选择性与队列间的可比性,但多数研究未报道随访情况。纳入研究的基本特征及质量评价结果详见表1。
2.3 MTHFR C677T多态性对HDMTX血液毒性的影响
共有11项研究[7-8,16,23-25,28-29,31-33]报告了MTHFR C677T与骨髓抑制的相关性,Meta分析结果详见表2。结果显示,在3种遗传模型下,突变型均显著增加了骨髓抑制的发生风险[TT/CT vs. CC:OR=1.57,95%CI(1.12,2.20),P=0.009(见图2); TT vs. CT/CC:OR=2.19,95%CI(1.49,3.23),P<0.001; T vs. C:OR=1.34,95%CI(1.03,1.74),P=0.03](受文章篇幅限制,部分森林图略,下同)。
上述Meta分析纳入的研究间均无显著异质性(Phet>0.10)。基于年龄与种族分层的亚组分析表明,一方面,在显性遗传模型中,突变型显著增加了成人骨髓抑制的发生风险(Psub=0.03,Psub为亚组间的P值),而在隐性遗传模型及等位基因模型中,不同年龄亚组间的差异无统计学意义(Psub>0.05);另一方面,各种族间的差异无统计学意义(Psub>0.05)。
共有4项研究[15,27,29,32]报告了MTHFR C677T与严重骨髓抑制的相关性。在显性遗传模型下,突变型增加了严重骨髓抑制的发生风险,且差异有统计学意义[TT/CT vs. CC:OR=2.33,95%CI(1.43,3.81),P<0.001]。在隐性遗传模型下,伴随显著异质性(Phet<0.10,I 2=75%)。对异质性来源进行分析,首先排除了数据提取错误,亚组分析提示亚洲人群与高加索人群之间存在显著差异(Psub=0.03),故异质性可能源于种族差异。
2.3.1 MTHFR C677T与白细胞減少的相关性 共有7项研究[17-18,20-22,25-26]报告了MTHFR C677T与白细胞减少的相关性。在显性遗传模型下,突变型显著增加了白细胞减少的发生风险[TT/CT vs. CC:OR=1.37,95%CI(1.02,1.82),P=0.03(见图3)]。而在隐性及等位基因遗传模型下,未观察到显著相关性。但在等位基因遗传模型下,伴随显著异质性(Phet<0.10,I 2=61%)。对异质性来源进行分析,首先排除了数据提取错误,亚组分析提示亚洲人群与高加索人群之间存在显著差异(Psub=0.03),故异质性可能源于种族差异。
共有3项研究[14-15,20]报告了MTHFR C677T与严重白细胞减少的相关性。在显性遗传模型下,突变型显著增加了严重白细胞减少的发生风险[TT/CT vs. CC:OR=1.63,95%CI(1.03,2.56),P=0.04],但伴随显著异质性(Phet<0.10,I 2=56%),基于年龄及种族的亚组分析均未观察到显著相关性。
2.3.2 MTHFR C677T与粒细胞减少的相关性 共有5项研究[16,25,28,35-36]报告了MTHFR C677T与粒细胞减少的相关性。在3种遗传模型下,MTHFR C677T与粒细胞减少发生风险无显著相关性,但均伴随显著异质性(Phet<0.10,I 2>50%)。对异质性来源进行分析,排除数据提取错误,针对年龄与种族分层的亚组分析提示患儿、成人及混合人群之间,亚洲人与非洲人之间的差异均有统计学意义(Psub<0.05),故异质性可能源于纳入患者的年龄及种族差异。
共有2项研究[14-15]报告了MTHFR C677T与严重粒细胞减少的相关性。在显性遗传模型下,突变型显著增加了严重粒细胞减少的发生风险[TT/CT vs. CC:OR=2.26,95%CI(1.50,3.39),P<0.001]。
2.3.3 MTHFR C677T与血小板减少、贫血及淋巴细胞减少的相关性 分别有11项研究[17-22,25-26,28,35-36]、10项研究[17-21,25-26,28,35-36]、2项研究[19,25]报告了MTHFR C677T与血小板减少、贫血及淋巴细胞减少的相关性。在3种遗传模型下,均无显著相关性,且纳入的各研究间均无显著异质性(Phet>0.10,I 2≤30%)。
分别有3项研究[15,20,28]、2项研究[15,20]、1项研究[15]报告了MTHFR C677T与严重血小板减少、严重贫血及严重淋巴细胞减少的相关性。在3种遗传模型下,均无显著相关性。
2.4 MTHFR A1298C多态性对HDMTX血液毒性的影响
共有6项研究[7-8,16,27,31,33]报告了MTHFR A1298C与骨髓抑制的相关性,Meta分析结果详见表3。在3种遗传模型下,均无显著相关性,且纳入的各研究间无显著异质性(Phet>0.10)。基于1项研究[27]的结果表明,在显性遗传模型下,突变型显著降低了严重骨髓抑制的发生风险[CC/AC vs. AA:OR=0.17,95%CI(0.04,0.76),P=0.02]。
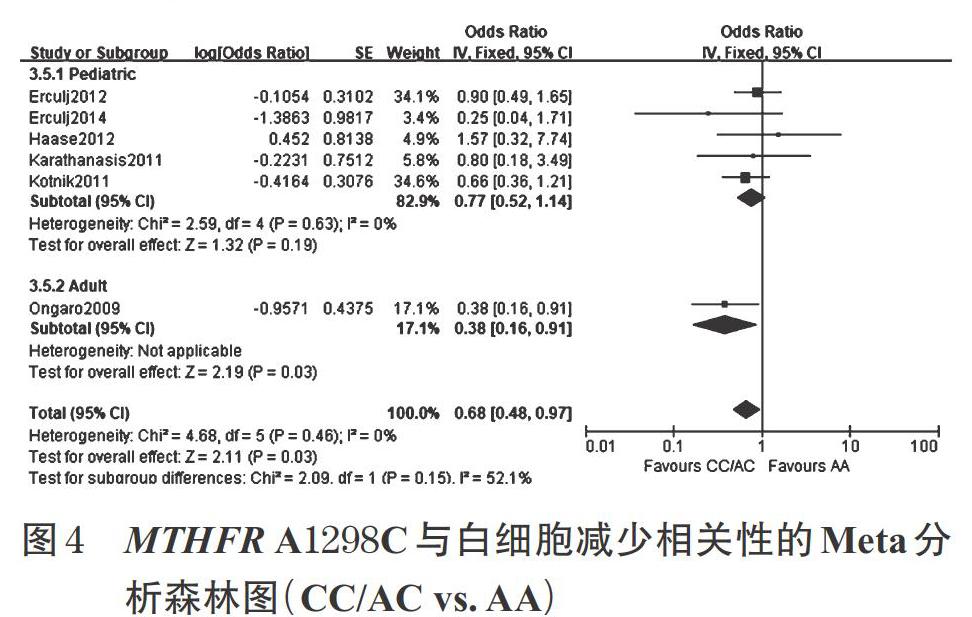
2.4.1 MTHFR A1298C与白细胞减少的相关性 共有6项研究[17-18,20-22,30]报告了MTHFR A1298C与白细胞减少的相关性。在显性遗传模型及隐性遗传模型下,突变型降低了白细胞减少的发生风险,差异有统计学意义[CC/AC vs. AA:OR=0.68,95%CI(0.48,0.97),P=0.03(见图4)]; CC vs. AC/AA:OR=0.28,95%CI(0.14,0.59),P<0.001],且纳入的各研究间无显著异质性(Phet>0.10)。
共有2项研究[20,30]报告了MTHFR A1298C与严重白细胞减少的相关性。在显性遗传模型下,突变型降低了严重白细胞减少的发生风险,差异有统计学意义[CC/AC vs. AA:OR=0.43,95%CI(0.19,0.97),P=0.04],且2项研究间无显著异质性(Phet>0.10)。
2.4.2 MTHFR A1298C与粒细胞减少的相关性 共有4项研究[16,28,35-36]报告了MTHFR A1298C与粒细胞减少的相关性。在3种遗传模型下,MTHFR A1298C与粒细胞减少的发生风险无显著相关性,但显性遗传模型纳入的各研究间伴随显著异质性(Phet<0.10,I 2=53%)。对异质性来源进行分析,排除数据提取错误,针对年龄与种族分层的亚组分析提示患儿及成人之间、亚洲人与非洲人之间的差异均有统计学意义(Psub<0.05),故异质性可能源于各研究间纳入患者的年龄及种族差异。1项研究[30]表明,MTHFR A1298C与严重粒细胞减少的发生风险无显著相关性。
2.4.3 MTHFR A1298C与血小板减少、贫血的相关性 分别有8项研究[17-18,20-22,28,35-36]、2项研究[20,28]、7项研究[17-18,20-21,28,35-36]、1项研究[20]报告了MTHFR A1298C与血小板减少、严重血小板减少、贫血及严重贫血的相关性。在3种遗传模型下,MTHFR A1298C与上述不良事件的发生风险均无显著相关性,仅在隐性遗传模型下的血小板减少、严重血小板减少伴有显著异质性(Phet<0.10,I 2=52%、57%)。基于年龄及种族的亚组分析均未观察到显著差异(Psub>0.05)。
2.5 敏感性分析与发表偏倚
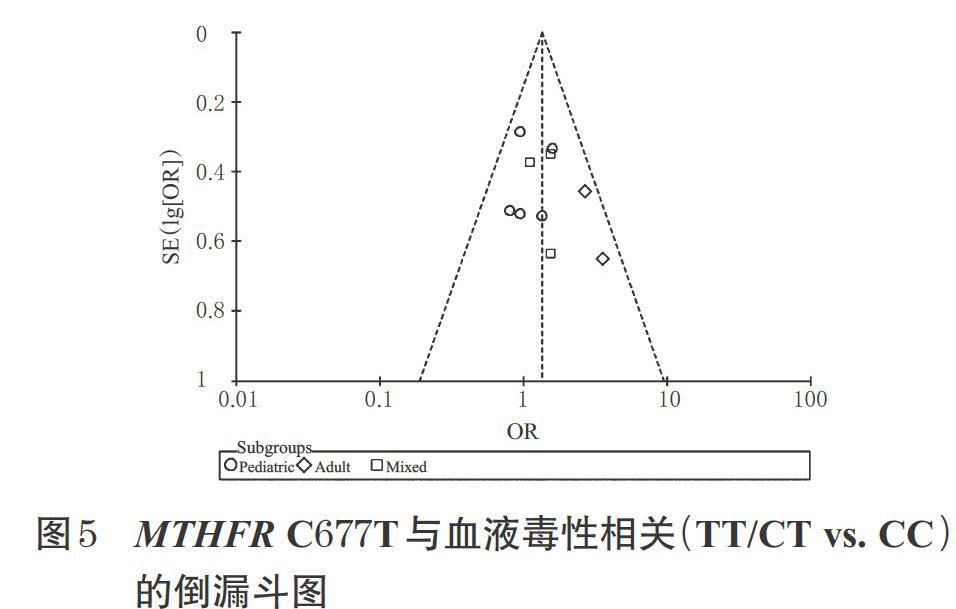
对表2中MTHFR C677T与HDMTX血液系统不良事件相关性的31项Meta结果进行敏感性分析,21项Meta结果在逐篇剔除纳入研究后合并效应量均未发生显著改变;对表3中MTHFR A1298C与HDMTX血液系统不良事件相关性的21项Meta结果进行敏感性分析,15项Meta结果在逐篇剔除纳入研究后合并效应量均未发生显著改变,这表明上述Meta结果整体均较稳定。上述各结局指标漏斗图基本对称,呈近似倒漏斗状,未观察到明显的发表偏倚,详见图5(仅列出TT/CT vs. CC的倒漏斗圖,余图略)。
3 讨论
MTX对增殖速度快的细胞抑制强度大,主要抑制已经定向分化的骨髓幼稚细胞,对未定向分化的骨髓多能造血干细胞的损伤较轻,故骨髓抑制是MTX常见的不良事件[37]。MTX通过抑制MTHFR发挥抗叶酸代谢的作用。MTHFR是叶酸代谢途径中的关键酶,催化5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸,其正常的活性能够保证叶酸代谢、DNA合成和甲基化的正常进行,而MTHFR基因发生突变将会影响酶的催化活性,干扰DNA的合成及损伤修复,从而导致MTX给药后不良事件的发生风险增加[38]。
本系统评价整合现有的原始研究,在严格评价纳入研究质量的基础上对结局指标进行定量合并,综合23项关于MTHFR C677T和16项关于MTHFR A1298C的研究的Meta分析结果,发现MTHFR C677T突变型与更高风险的(严重)血液毒性/骨髓抑制相关,具体包括(严重)白细胞减少、严重粒细胞减少及严重贫血,不良反应严重程度可能是导致血液系统不良事件发生风险差异的影响因素;MTHFR A1298C突变型则与更低风险的严重血液毒性/骨髓抑制相关,包括(严重)白细胞减少。亚组分析结果表明,年龄因素可能会影响MTHFR C677T与血液毒性(包括粒细胞减少)的相关性,种族因素可能会影响MTHFR C677T与严重血液毒性(包括白细胞减少及粒细胞减少)的相关性;年龄及种族因素可能均会影响MTHFR A1298C与粒细胞减少的相关性。敏感性分析结果表明,大部分研究结果稳健性较好,信度尚可。
对比既往已发表的系统评价[39-40],大多在单一遗传模型下进行定量分析,或纳入研究未限制MTX的给药剂量及患者病种类型,或未依据血液系统不良事件的严重程度进行亚组分析以及未充分评估原始研究质量。本研究考虑到HDMTX用于不同病种(如骨肉瘤)在给药剂量与输注时间等用药方案方面存在差异,故仅关注HDMTX在血液恶性肿瘤患者中的应用,并结合3种遗传模型合并效应量,因此更全面集中地评价了MTHFR C677T及A1298C两个位点的多态性对HDMTX血液系统不良事件发生风险的影响;其次,纳入的原始研究总体质量较高,均满足HWE,因此具有较好的群体代表性。但本研究尚存在一定局限性,如部分合并结果受纳入原始研究数目限制(小于10项),发表偏倚不能完全除外;此外,部分研究未提及不良事件分级标准,且不同研究间HDMTX具体输注方案存在差异,故临床异质性无法完全除外。因此,本文所得结论仍需更高质量、更大样本量的原始研究进一步验证。
參考文献
[ 1 ] RADTKE S,ZOLK O,RENNER B,et al. Germline genetic variations in methotrexate candidate genes are associated with pharmacokinetics,toxicity,and outcome in childhood acute lymphoblastic leukemia[J]. Blood,2013,121(26):5145-5153.
[ 2 ] SCHMIEGELOW K. Advances in individual prediction of methotrexate toxicity:a review[J]. Brit J Haematol,2009,146(5):489-503.
[ 3 ] HOWARD SC,MCCORMICK J,PUI CH,et al. Preventing and managing toxicities of high-dose methotrexate[J]. Oncologist,2016,21(12):1471-1482.
[ 4 ] 汪洋,叶琦,张华年,等.应用群体药动学-药效学结合模型评估大剂量甲氨蝶呤化疗后的骨髓抑制[J].中国新药杂志,2017,26(19):70-78.
[ 5 ] 裔照国,刘洪月,丁哲,等.甲氨蝶呤临床常见不良反应及其应对方法[J].中国药物与临床,2014,14(11):1529- 1530.
[ 6 ] MATTIA ED,TOFFOLI G. C677T and A1298C MTHFR polymorphisms,a challenge for antifolate and fluoropyrimidine-based therapy personalisation[J]. Eur J Cancer,2009,45(8):1333-1351.
[ 7 ] 樊春艳. MTHFR、ABCB1基因多态性与急性淋巴细胞白血病患儿甲氨蝶呤化疗毒副反应的关系[D].乌鲁木齐:新疆医科大学,2017.
[ 8 ] CHIUSOLO P,GIAMMARCO S,BELLESI S,et al. The role of MTHFR and RFC1 polymorphisms on toxicity and outcome of adult patients with hematological malignancies treated with high-dose methotrexate followed by leucovorin rescue[J]. Cancer Chemother Pharmacol,2012,69(3):691-696.
[ 9 ] KANTAR M,KOSOVA B,CETINGUL N,et al. Methylenetetrahydrofolate reductase C677T and A1298C gene polymorphisms and therapy-related toxicity in children treated for acute lymphoblastic leukemia and non-hodgkin lymphoma[J]. Leuk Lymphoma,2009,50(6):912-917.
[10] 翁鸿,江梅,仇成凤,等.遗传关联性研究Meta分析中的Hardy-Weinberg平衡[J].中国循证心血管医学杂志,2016,8(11):1281-1283.
[11] STANG A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidem,2010,25(9):603-605.
[12] SEDGWICK P. Meta-analyses:what is heterogeneity? [J]. BMJ,2015.DOI:10.1136/bmj.h1435.
[13] SEDGWICK P,MARSTON L. How to read a funnel plot in a Meta-analysis[J]. BMJ,2015.DOI:10.1136/bmj.h4718.
[14] AR?OZ HV,DALOI K,FONCUBERTA ME,et al. Pharmacogenetic studies in children with acute lymphoblastic leukemia in Argentina[J]. Leuk Lymphoma,2015,56(5):1370-1378.
[15] CHOI YJ,PARK H,LEE JS,et al. Methotrexate elimination and toxicity:MTHFR 677C>T polymorphism in patients with primary CNS lymphoma treated with high- dose methotrexate[J]. Hematol Oncol,2016,35(4):504- 509.
[16] EISSA DS,AHMED TM. C677T and A1298C polymorphisms of the methylenetetrahydrofolate reductase gene:effect on methotrexate-related toxicity in adult acute lymphoblastic leukaemia[J]. Blood Coagul Fibrinol,2013,24(2):181-188.
[17] ER?ULJ N,KOTNIK BF,DEBELJAK M,et al. Influence of folate pathway polymorphisms on high-dose methotrexate-related toxicity and survival in childhood acute lymphoblastic leukemia[J]. Leuk Lymphoma,2012,53(6):1096-1104.
[18] ER?ULJ N,DEBELJAK M,JAZBEC J,et al. The influence of folate pathway polymorphisms on high-dose methotrexaterelated toxicity and survival in children with non-Hodgkin malignant lymphoma[J]. Radiol Oncol,2014,48(3):289-292.
[19] GEMMATI D,ONGARO A,TOGNAZZO S,et al. Methylenetetrahydrofolate reductase C677T and A1298C gene variants in adult non-Hodgkins lymphoma patients:association with toxicity and survival[J]. Haematologica,2007,92(4):478-485.
[20] HAASE R,ELSNER K,MERKEL N,et al. High dose methotrexate treatment in childhood ALL:pilot study on the impact of the MTHFR 677C>T and 1298A>C polymorphisms on MTX-related toxicity[J]. Klinische Padiatrie,2012,224(3):156-159.
[21] KARATHANASIS NV,STIAKAKI E,GOULIELMOS GN,et al. The role of the methylenetetrahydrofolate reductase 677 and 1298 polymorphisms in Cretan children with acute lymphoblastic leukemia[J]. Genetic Testing and Molecular Biomarkers,2011,15(1/2):5-10.
[22] KOTNIK BF,GRABNAR I,GRABAR PB,et al. Association of genetic polymorphism in the folate metabolic pathway with methotrexate pharmacokinetics and toxicity in childhood acute lymphoblastic leukaemia and malignant lymphoma[J]. Eur J Clin Pharmacol,2011,67(10):993- 1006.
[23] 李天媛,王斌,徐康康,等.急性淋巴细胞白血病患儿亚甲基四氢叶酸还原酶基因C677T多态性与甲氨蝶呤毒副反应的研究[J].南京医科大学学报(自然科学版),2010,30(3):386-389.
[24] 李静,王捷,赵军,等.亚甲基四氢叶酸还原酶基因多态性与甲氨蝶呤不良反应的相关性[J].中国临床药理学杂志,2014,30(12):1086-1088.
[25] 李静,王捷,郁长治,等.亚甲基四氢叶酸还原酶基因多态性与急性淋巴细胞白血病患者甲氨蝶呤化疗药物不良反应的相关性研究[J].中国临床药理学杂志,2017,33(17):1634-1636.
[26] 廖清船,李晓蕾,刘思婷,等. MTHFR基因多态性及单体型与大剂量甲氨蝶呤化疗毒性反应的相关性研究[J].中华流行病学杂志,2012,33(7):735-739.
[27] 刘晶霞,陈洁平,谭文,等.亚甲基四氢叶酸还原酶基因多态性与急性淋巴细胞白血病患者甲氨蝶呤化疗毒副反应的研究[J].中國实验血液学杂志,2008,16(3):488- 492.
[28] LIU SG,LI ZG,CUI L,et al. Effects of methylenetetrahydrofolate reductase gene polymorphisms on toxicities during consolidation therapy in pediatric acute lymphoblastic leukemia in a Chinese population[J]. Leuk Lymphoma,2011,52(6):1030-1040.
[29] 聂朝霞,刘岚,崔巍. MTHRF基因C677T多态性与ALL患儿MTX血药浓度和毒副反应的相关性[J].医学临床研究,2012,29(2):295-298.
[30] ONGARO A,DE MATTEI M,DELLA PORTA MG,et al. Gene polymorphisms in folate metabolizing enzymes in adult acute lymphoblastic leukemia:effects on methotrexate-related toxicity and survival[J]. Haematologica,2009,94(10):1391-1398.
[31] PAKAKASAMA S,KANCHANAKAMHAENG K,KAJANACHUMPOL S,et al. Genetic polymorphisms of folate metabolic enzymes and toxicities of high dose methotrexate in children with acute lymphoblastic leukemia[J]. Ann Hematol,2007,86(8):609-611.
[32] SHIMASAKI N,MORI T,SAMEJIMA H,et al. Effects of methylenetetrahydrofolate reductase and reduced folate carrier 1 polymorphisms on high-dose methotrexate-induced toxicities in children with acute lymphoblastic leukemia or lymphoma[J]. Int J Pediatr Hematol Oncol,2006,28(2):64-68.
[33] SUTHANDIRAM S,GAN GG,ZAIN SM,et al. Effect of polymorphisms within methotrexate pathway genes on methotrexate toxicity and plasma levels in adults with hematological malignancies[J]. Pharmacogenomics,2014,15(11):1479-1494.
[34] TANTAWY AA,EL-BOSTANY EA,ADLY AA,et al. Methylene tetrahydrofolate reductase gene polymorphism in Egyptian children with acute lymphoblastic leukemia[J]. Blood Coagul Fibrinol,2010,21(1):28-34.
[35] 伍艳鹏,贺湘玲,邹润英,等.急性淋巴细胞白血病患儿 MTHFR基因多态性与大剂量甲氨蝶呤化疗后不良反应的关系[J].广东医学,2015,36(3):413-416.
[36] 郑苗苗,岳丽杰,陈小文,等.急性淋巴细胞白血病患儿MTHFR基因多态性与大剂量甲氨蝶呤毒副反应的关系[J].中国当代儿科杂志,2013,15(3):201-206.
[37] 焦力,周道斌,王书杰,等.血药浓度监测在大剂量甲氨蝶呤治疗中的应用价值[J].中国医学科学院学报,2009,31(5):564-566.
[38] KODIDELA S,SURESH CP,DUBASHI B. Pharmacogenetics of methotrexate in acute lymphoblastic leukaemia:why still at the bench level?[J]. Eur J Clin Pharmacol,2014,70(3):253-260.
[39] YAO P,HE X,ZHANG R,et al. The influence of MTHFR genetic polymorphisms on adverse reactions after methotrexate in patients with hematological malignancies:a meta-analysis[J]. Hematology,2018,24(1):10-19.
[40] 黃琳,于芝颖,顾群,等.亚甲基四氢叶酸还原酶基因多态性与甲氨蝶呤不良反应关系的Meta分析[J].中国临床药理学杂志,2016,32(2):183-185.
(收稿日期:2019-10-21 修回日期:2019-12-21)
(编辑:刘明伟)
