基于斑马鱼模型的知母皂苷BⅡ的血管保护作用及机制研究
2020-04-20杜孟姣陈坚平余嘉贤梅文杰余楚钦王延东
杜孟姣 陈坚平 余嘉贤 梅文杰 余楚钦 王延东

摘 要 目的:研究知母皂苷BⅡ(TB-Ⅱ)的血管保護作用,并探讨其可能的作用机制。方法:以养殖水为空白对照,考察100、200和400 μg/mL TB-Ⅱ培养受精后24 h(24 hpf)的正常斑马鱼胚胎48 h后对其肠下静脉血管(SIVs)的影响。采用酪氨酸激酶抑制剂PTK787(0.06 μg/mL)诱导斑马鱼肠下血管损伤模型;以0.1%二甲基亚砜、不加PTK787为空白对照,加PTK787、不加药物为模型对照,考察100、200、400 μg/mL TB-Ⅱ作用48 h后对血管损伤模型斑马鱼SIVs的影响,并采用实时荧光定量-聚合酶链式反应法检测斑马鱼体内fam样酪氨酸激酶1(Flt-l)、含激酶插入区受体(Kdr)、含激酶插入区受体l(Kdr-l)、血管内皮生长因子A(VEGF-A)以及肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6) mRNA的相对表达量。结果:100 μg/mL TB-Ⅱ作用后可显著增加正常斑马鱼的SIVs出芽数(P<0.05),200 μg/mL TB-Ⅱ作用后可显著增加正常斑马鱼的SIVs数(P<0.05)。与空白对照比较,PTK787作用后斑马鱼SIVs数显著减少(P<0.01),Flt-l、Kdr、Kdr-l、VEGF-A、TNF-α和IL-6 mRNA的相对表达量均显著降低(P<0.05或P<0.01);而经不同质量浓度的TB-Ⅱ作用后,血管损伤模型斑马鱼的SIVs数均不同程度地增加,Flt-l、Kdr、Kdr-l、VEGF-A、TNF-α和IL-6 mRNA相对表达量均不同程度地升高,除100 μg/mL TB-Ⅱ作用后斑马鱼SIVs数和Flt-l、TNF-α mRNA表达量以及400 μg/mL TB-Ⅱ作用后斑马鱼TNF-α mRNA表达量增加不显著外,其余指标差异均有统计学意义(P<0.05或P<0.01)。结论:TB-Ⅱ具有一定的促血管新生和修复受损血管的作用,其机制可能与上调血管内皮生长因子受体和促炎细胞因子的表达相关。
关键词 知母皂苷BⅡ;血管保护;斑马鱼;肠下静脉血管;机制
ABSTRACT OBJECTIVE: To study the protective effect of timosaponin BⅡ (TB-Ⅱ) on blood vessels and explore its possible mechanism. METHODS: Using aquaculture water as blank control, the effects of 100, 200 and 400 μg/mL TB-Ⅱ treatment for 48 h on the situation of subintestinal veins (SIVs) in normal zebrafish embryos 24 h after fertilization (24 hpf) were investigated. PTK787 (0.06 μg/mL), a tyrosine kinase inhibitor, was used to induce the model of zebrafish intestinal vascular injury; using combing with 0.1% dimethyl sulfoxide but no PTK787 as blank control, combing with PTK787 but no drug as model control, the effects treatment of 100, 200 and 400 μg/mL TB-Ⅱ for 48 h on the SIVs of zebrafish model with vascular injury were investigated. Relative expressions of fam-like tyrosine kinase 1 (Flt-1), kinase insert domain containing receptor (Kdr), kinase insert domain containing receptor l (Kdr-l), vascular endothelial growth factor A (VEGF-A), tumor necrosis factor α (TNF-α) and interleukin 6 (IL-6) mRNA were detected by RT-PCR. RESULTS: 100 μg/mL TB-Ⅱ could significantly increase the sprouting vessel of normal zebrafish SIVs sprouting vessel number (P<0.05), and 200 μg/mL TB-Ⅱ could significantly increase SIVs number of normal zebrafish (P<0.05). Compared with blank control, SIVs number of zebrafish decreased significantly after PTK787 treatment (P<0.01), and the relative expressions of Flt-l, Kdr, Kdr-l, VEGF-A, TNF-α and IL-6 mRNA were alse decreased significantly (P<0.05 or P<0.01). After treated with different concentrations of TB-Ⅱ, SIVs number of vascular injury model zebrafish increased to different extents; relative expressions of Flt-l, Kdr, Kdr-l, VEGF-A, TNF-α and IL-6 mRNA were increased to different extents. There was no significant difference in SIVs number and the expression of Flt-l, TNF-α mRNA in zebrafish treated with 100 μg/mL TB-Ⅱ and the expression of TNF-α mRNA in zebrafish treated with 400 μg/mL TB-Ⅱ, but there was statistical significance in other indexes (P<0.05 or P<0.01). CONCLUSIONS: TB-Ⅱ has a certain function of promoting angiogenesis and repairing damaged blood vessels, and its mechanism is related to the up-regulation of vascular endothelial growth factor receptor and pro-inflammatory cytokine expression.
KEYWORDS Timosaponin BⅡ; Vascular protection; Zebrafish; Subintestinal veins; Mechanism
知母为百合科植物知母(Anemarrhena asphodeloides Bge.)的根茎[1],始载于《神农本草经》,性寒,味苦,具有滋阴降火、止渴除烦等药理作用,是中医临床常用的传统药物[2]。知母皂苷BⅡ(TB-Ⅱ)作为知母的主要活性成分,具有抗炎[3]、抗病毒[4]、抗癌[5]等多种药理活性。Guo CR等[6]在细胞层面的研究发现,TB-Ⅱ具有防止糖尿病心血管并发症的潜力,可能具有心血管保护作用。但关于TB-Ⅱ的血管保护作用在体内动物模型层面并未被证实,并且在基因层面,TB-Ⅱ的血管保护作用机制也不明确。目前,血管保护药物的筛选模型多为体外试验,其结果需要借助体内模型验证和评价。斑马鱼是一种优良的脊椎动物模型,借助具有快速筛选、高通量化、与人的遗传物相似度高等优点的转基因斑马鱼来作为药物筛选模型,得到了广泛的关注[7]。而且在斑马鱼发育过程中,其肠下静脉血管(SIVs)区域是一个光滑的篮网形结构,在发育初期清晰可见,利于观察和统计[8],已成为血管研究的重要模型[9]。因此,本研究以荧光转基因斑马鱼Tg(fli1:EGFP)为体内模型动物,探究TB-Ⅱ的血管保护作用,并利用实时荧光定量-聚合酶链式反应(PCR)法检测不同质量浓度TB-Ⅱ对斑马鱼体内fam样酪氨酸激酶1(Flt-l)、含激酶插入区受体(Kdr)、含激酶插入区受体1(Kdr-l)、血管内皮生长因子A(VEGF-A)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)的mRNA表达,从而探究TB-Ⅱ保护血管的可能机制,为TB-Ⅱ血管保护作用的进一步开发研究奠定基础。
1 材料
1.1 仪器
Z-A-S5型斑马鱼养殖单元(上海海圣生物实验设备有限公司);SZ780型连续变倍体视显微镜(重庆奥特光学仪器有限公司);CFX96型实时荧光定量-PCR仪(伯乐生命医学产品有限公司);ZXSD-A1090型生化培养箱(上海智诚分析仪器制造有限公司);DMi8型荧光显微镜(德国Leica公司);CP225D型十万分之一电子天平(北京赛多利斯仪器系统有限公司);1424R型低温冷冻离心机(珠海黑马医学仪器有限公司);K2800型微量分光光度计(北京凯奥科技有限公司)。
1.2 药品与试剂
TB-Ⅱ对照品 (西安汇林生物科技有限公司,批号:18041004,纯度:≥98%);酪氨酸激酶抑制剂PTK787(批号:A0625AS,纯度:>98%);胰蛋白酶(批号:19030710,纯度:≥99%)均购自大连美仑生物技术有限公司;RNA抽提试剂Trizol(美国Invitrogen公司,批号:15596026);PCR反应试剂盒、逆转录试剂盒(日本Takara公司,批号分别为RR420AA、2641A-1);二甲基亚砜(DMSO)、异丙醇、三羟甲基氨基甲烷(Tris)碱(广州化学制剂总厂,均为分析纯);PCR引物由深圳优迪生物技术有限公司设计合成;水为自制养殖水。
1.3 动物
成年荧光转基因斑马鱼Tg(fli1:EGFP),雌雄兼有,购自中国斑马鱼资源中心。斑马鱼饲养于循环水产养殖系统中,水温控制在(28.5±1.0) ℃、pH为 6.9~7.5、光照(14 h)/黑暗(10 h)周期交替,每天喂食3次盐水虾。
2 方法
2.1 斑马鱼胚胎的培养与收集
在繁殖的前一天晚上,将雌雄斑马鱼按照1 ∶ 1的比例放入繁殖盒中,使用隔板将不同性别的斑马鱼隔开。次日清晨,将繁殖隔板拆掉,在灯亮(光照强度54~324 lux)条件下30 min内,由斑马鱼自然交配,自然产生斑马鱼胚胎。收集斑马鱼胚胎,用水清洗多次,转入干净的培养皿中,即获得了实验所需的斑马鱼胚胎。
2.2 TB-Ⅱ对正常斑马鱼血管新生的影响考察
将受精后24 h(24 hpf)的斑马鱼胚胎用胰蛋白酶进行脱膜处理后,在体视显微镜下将其随机暴露于24孔板中,每孔16个胚胎。实验设置TB-Ⅱ不同质量浓度组(100、200、400 μg/mL,以水为溶剂制备)和空白对照组(水),每孔加入相应溶液1 mL。加药完毕后,将24孔板用锡纸遮光,置于温度28.5 ℃、光照(14 h)/黑暗(10 h)交替的环境下培养。培养48 h后,在荧光显微镜下观察各组斑马鱼SIVs数和SIVs出芽数。
2.3 TB-Ⅱ对PTK787诱导的血管损伤斑马鱼血管新生的影响考察
将24 hpf的斑马鱼胚胎用胰蛋白酶进行脱膜处理后,在体视显微镜下随机暴露于24孔板中,每孔16个胚胎。采用酪氨酸激酶抑制剂PTK787诱导斑马鱼肠下血管损伤模型。实验设置TB-Ⅱ不同质量浓度组(100、200、400 μg/mL TB-Ⅱ溶液+0.06 μg/mL PTK787溶液,DMSO终浓度为0.1%)、模型对照组(0.06 μg/mL PTK787溶液,DMSO终浓度为0.1%)和空白对照组(0.1%DMSO),每组均按1 mL/孔加入相应溶液。加藥完毕后,将24孔板用锡纸遮光,置于温度28.5 ℃、光照(14 h)/黑暗(10 h)交替的环境下培养。培养48 h后,在荧光显微镜下观察各组斑马鱼SIVs数。
2.4 TB-Ⅱ对PTK787诱导的血管损伤斑马鱼体内相关因子mRNA表达的影响考察
采用实时荧光定量PCR法进行检测。将24 hpf的斑马鱼胚胎用胰蛋白酶进行脱膜处理后,在体视显微镜下随机暴露于24孔板中,每孔16个胚胎。实验分组、给药及培养情况同“2.3”项。培养48 h后,每孔随机抽取3条斑马鱼,按照Trizol试剂说明书操作提取斑马鱼总RNA,再按逆转录试剂盒说明书方法逆转录合成cDNA,并以cDNA为模板采用两步法进行PCR扩增。扩增条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火和延伸34 s,39个循环;反应体系:cDNA(稀释5倍)5 μL,SYBR Premix Ex Taq (Tli RNaseH Plus) 10 μL,上、下游引物各0.5 μL,ddH2O 4 μL,共20 μL。以甘酒醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用2-ΔΔct法计算各目标基因的相对表达量。引物序列及产物长度详见表1。
2.5 统计学方法
采用GraphPad Prism 6软件进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,方差齐性时组间两两比较采用Dunnett检验,方差不齐性时组间两两比较采用Dunnetts T3检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 TB-Ⅱ对正常转基因斑马鱼血管新生的影响
与空白对照组比较,TB-Ⅱ 100 μg/mL组斑马鱼SIVs出芽数显著增加(P<0.05),TB-Ⅱ 200 μg/mL组斑马鱼SIVs数显著增加(P<0.01),提示TB-Ⅱ具有促进斑马鱼血管新生的作用,结果详见图1、表2。
3.2 TB-Ⅱ对血管损伤斑马鱼血管新生的影响
与空白对照组比较,模型对照组斑马鱼SIVs数显著
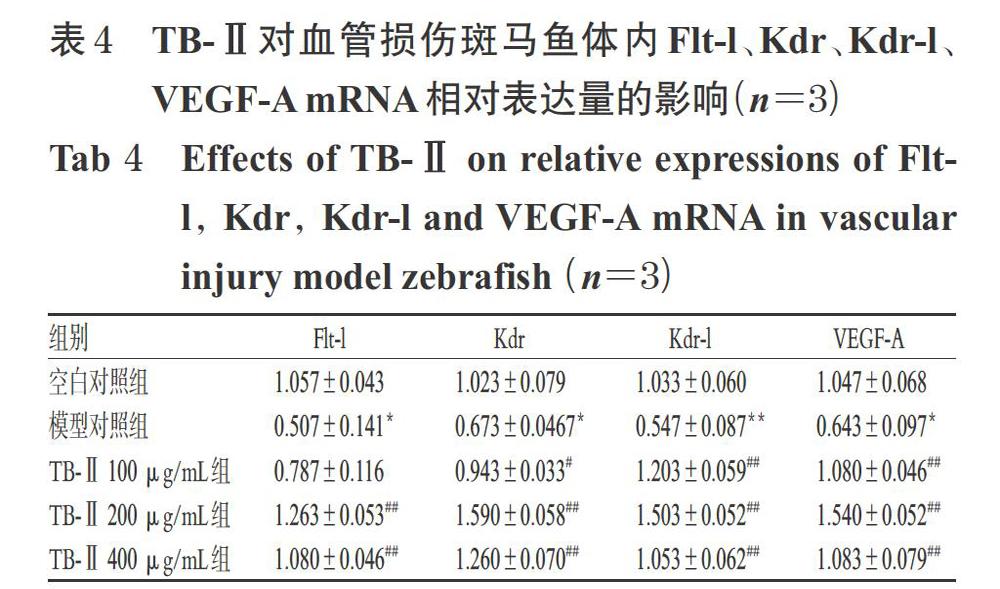
3.3 TB-Ⅱ对血管损伤斑马鱼体内Flt-l、Kdr、Kdr-l、VEGF-A mRNA表达的影响
与空白对照组比较,模型对照组斑马鱼体内Flt-l、Kdr、Kdr-l、VEGF-A mRNA的相对表达量显著降低(P<0.05或P<0.01)。与模型对照组比较,TB-Ⅱ 100 μg/mL组斑马鱼体内Kdr、Kdr-l、VEGF-A mRNA的相对表达量显著升高(P<0.05或P<0.01),但Flt-l mRNA的相对表达量差异无统计学意义(P>0.05);TB-Ⅱ 200、400 μg/mL组斑马鱼体内Flt-l、Kdr、Kdr-l、VEGF-A mRNA的相对表达量均显著升高(P<0.01),结果详见表4。
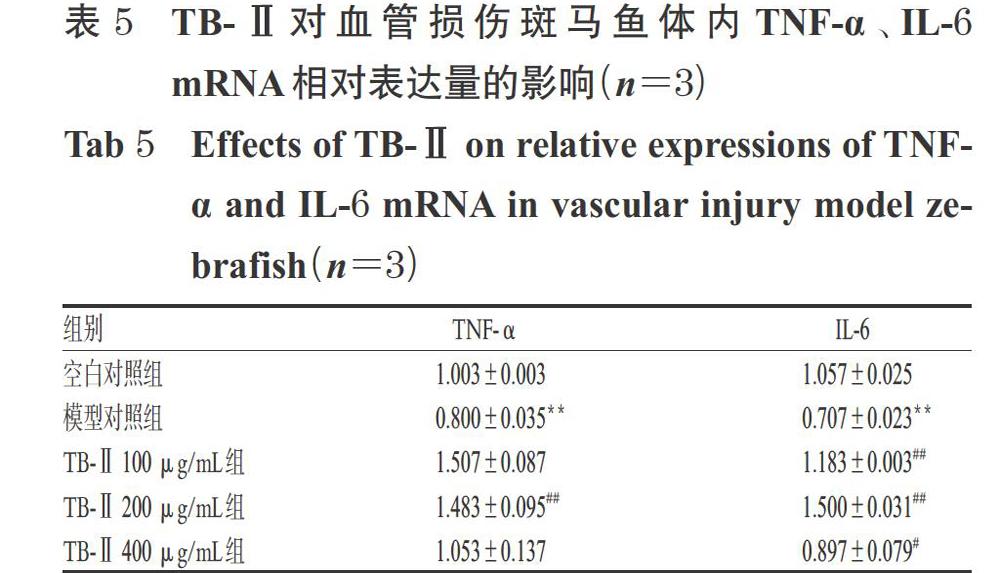
3.4 TB-Ⅱ对血管损伤斑马鱼体内TNF-α、IL-6 mRNA表达的影响
与空白对照组比较,模型对照组斑马鱼体内TNF-α、IL-6 mRNA的相对表达量显著降低(P<0.01)。与模型对照组比较,TB-Ⅱ 100、400 μg/mL组斑马鱼体内TNF-α mRNA的相对表达量差异无统计学意义(P>0.05),IL-6 mRNA的相对表达量显著升高(P<0.05或P<0.01);而TB-Ⅱ 200 μg/mL组斑马鱼体内TNF-α、IL-6 mRNA的相对表达量均显著升高(P<0.01),结果详见表5。
4 讨论
在前期研究中,笔者根据经济合作与发展组织提案斑马鱼胚胎毒性试验(OECD,2013)进行了斑马鱼胚胎的急性毒性评价[10],结果显示,在96 hpf时,100、200、400、600 μg/mL TB-Ⅱ作用后斑马鱼胚胎的存活率分别为100%、94.8%、98.2%、100%;在72 hpf时,100、200、400、600 μg/mL TB-Ⅱ作用后斑马鱼胚胎全部孵化(存活率为100%),但是600 μg/mL TB-Ⅱ作用后斑马鱼胚胎出现了畸形、心包水肿。因此,本研究选用100、200、400 μg/mL这3个质量浓度作为本研究的实验浓度。PTK787是一种酪氨酸激酶抑制剂,其能够显著抑制Kdr,从而引起血管损伤[11]。因此,本研究利用PTK787来构建血管损伤模型,模拟缺血区域的血管内皮损伤。
血管新生是指从原有的血管结构中生成新的血管,涉及内皮细胞增殖和迁移、基底膜降解、血管管腔形成等一系列复杂的生物学过程[12]。VEGF及VEGF受体(VEGFR)是血管生成的关键信号分子,两者结合后能够诱导内皮细胞一氧化氮合酶(eNOS)的释放,从而引起血管舒张,使血管通透性增加,达到促血管新生的作用[13]。VEGF是一个家族,包括了VEGF-A、VEGF-B、VEGF-C、VEGF-D和胎盘生长因子(PIGF)。VEGFR主要有3类,分别为Flt-l、Kdr和VEGFR-3。其中,Flt-l主要分布于血管内皮细胞、造血肝细胞、巨噬细胞等,Kdr分布于血管内皮细胞及淋巴内皮细胞,VEGFR-3主要分布于成人淋巴内皮表面[14]。其中,Flt-l和Kdr可调控VEGF/VEGFR系统,促进血管新生。另外VEGF-A是血管生成的主要调控因子,其可结合并激活2种酪氨酸激酶受体Flt-l和Kdr[15]。近年研究发现,Kdr-l亦和血管新生有关联[16]。因此,本研究选用Flt-l、Kdr、Kdr-l和VEGF-A来研究TB-Ⅱ对VEGFR的调控能力。此外,已有研究报道,免疫系统在血管生成中具有重要的作用,促炎细胞因子(如IL-6、TNF-α等)已被报道具有促进血管生成的作用[17-18]。因此,本研究通过观察TB-Ⅱ对斑马鱼体内IL-6和TNF-α mRNA表达的影响,从炎症免疫角度阐释TB-Ⅱ血管保护的机制,从而为TB-Ⅱ防治心血管疾病提供实验依据。
从本研究结果可知,在正常转基因斑马鱼中,一定浓度的TB-Ⅱ可显著增加SIVs数和SIVs出芽数,表明TB-Ⅱ对正常斑马鱼有促血管生成作用。而在PTK787诱导的血管损伤模型斑马鱼中,100、200、400 μg/mL TB-Ⅱ均可不同程度地抑制PTK787对血管的损伤,增加SIVs数,这表明TB-Ⅱ对受损血管亦具有改善作用。在基因层面上,100、200、400 μg/mL的TB-Ⅱ均能夠不同程度地逆转PTK787诱导的斑马鱼体内Flt-l、Kdr、Kdr-l、VEGF-A、TNF-α和IL-6 mRNA表达量的下降,从而修复血管损伤,发挥血管改善作用。因此,笔者推断TB-Ⅱ可通过上调VEGFR和促炎细胞因子,发挥其促血管新生以及修复受损血管的作用。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:212-213.
[ 2 ] 孙兴欢,张宇伟,黄雪峰.知母的化学成分和药效研究进展[J].海峡药学,2015,27(3):6-12.
[ 3 ] YUAN YL,LIN BQ,ZHANG CF,et al. Timosaponin B-Ⅱ ameliorates palmitate-induced insulin resistance and inflammation via IRS-1/PI3K/Akt and IKK/NF-κB pathways[J]. Am J Chin Med,2016,44 (4):755-769.
[ 4 ] GOSSE B,GNABRE J,BATES RB,et al. Antiviral saponins from Tieghemella heckelii[J]. J Nat Prod,2002,65 (12):1942-1944.
[ 5 ] 庞涛,陆文铨,陈小玲,等.知母皂苷B-Ⅱ抑制人胃癌细胞增值和迁移的作用机制[J].第二军医大学学报,2018,39(4):38-45.
[ 6 ] GUO CR,LI L,YANG XL,et al. Protective effects of timosaponin B-Ⅱ on high glucose-induced apoptosis in human umbilical vein endothelial cells[J]. Science Direct,2014,37(1):37-44.
[ 7 ] 向本旭,刘婷婷,孙芳玲,等. VEGF相关信号通路在血管新生中的研究进展[J].中国比较医学杂志,2015,25(12):81-86.
[ 8 ] CHILDS S,CHEN JN,GARRITY DM,et al. Patterning of angiogenesis in the zebrafish embryo[J]. Development,2002,129(4):973-982.
[ 9 ] 侯林,周芹芹,崔清华,等.不同分子质量段全蝎蛋白对转基因斑马鱼血管生成的影响[J].中国药房,2015,26(25):3490-3492.
[10] LIAN BW,WU Q,ZHANG SY,et al. Tissue regeneration promotion effects of phenanthroimidazole derivaties through pro-inflammatory pathway activation[J]. Fish Shellfish,2018.DOI:10.1016/j.fsi.2018.06.029.
[11] 段文娟,李月,杨国红,等.白芍对斑马鱼血管生成和抗血栓作用的研究[J].时珍国医国药,2018,29(4):72-75.
[12] XU YY,XU XG,GAO XH,et al. Shikonin suppresses IL-17-induced VEGF expression via blockage of JAK2/STAT3 pathway[J]. Int Immunopharmacol,2014,19(2):327-333.
[13] FERRARA N.Vascular endothelial growth factor[J]. Arterioscler Thromb Vasc Biol,2009,29(6):789-791.
[14] MAKINEN T,JUSSILA L,VEIKKOLA T,et al. Inhibition of lymphangiogenesis with resulting lymphedema in transgenic mice expressing soluble VEGF receptor-3[J]. Nat Med,2001,7(2):199-205.
[15] TSE HYG,HUI MNY,LI L,et al. Angiogenic efficacy of simplified 2-herb formula (NF3) in zebrafish embryos in vivo and rat aortic ring in vitro[J]. J Ethnopharmacol,2012,139(2):447-453.
[16] BUSSMANN J,LAWSON N,ZON L,et al. Zebrafish VEGF receptors:a guideline to nomenclature[J]. PLoS Genet,2008.DOI:10.137/journal.pgen.1000064.
[17] QUERQUES G,DELLENOCI N. Proinflammatory cytokines and angiogenic and antiangiogenic factors in vitreous of patients with proliferative diabetic retinopathy and Eales disease (ED)[J]. Retina,2009,29(1):121-123.
[18] 蔣伟青,袁欣,刘晨,等.内源性 γ-干扰素对斑马鱼血管发育的影响[J].安徽医科大学学报,2018,53(9):5-8.
(收稿日期:2019-11-20 修回日期:2020-01-19)
(编辑:林 静)
