CYP2E1基因启动子区组蛋白高乙酰化作用促进异烟肼诱导的肝细胞凋
2020-04-20亡王雪张咪吴冬雪
亡王雪 张咪 吴冬雪
摘要 目的:探讨异烟肼(INH)诱导肝细胞CYP2E1启动子区组蛋白乙酰化对肝细胞凋亡的影响。方法:INH浓度1000μg/mL,Garcinol为5μmol/L,药物作用6 h。ELISA检测乙酰化酶HAT与去乙酰化酶HDAC活性。Chip检测H3K56、H4K5水平。RT-PCR检测CYP2E1、JNK、Bax、Bcl2表达。结果:INH组与对照比,HAT活性降低,HDAC及CYP2E1启动子区acH3K56和acH4K5水平升高,JNK、Bax的mRNA增加,Bcl2下降。与INH组比,INH + Garcinol组HAT活性、acH3K56、acH4K5表达及JNK、Bax降低,Bcl2升高。结论:抑制肝细胞CYP2E1基因启动子乙酰化可减少INH诱导的肝细胞凋亡。
【关键词】INH;肝损伤;组蛋白乙酰化;CYP2E1
中图分类号 R575 文献标识码 B 文章编号 1671-0223(2020)02-022-04
Abstract Objective To investigate the effect of isoniazid (INH) on the apoptosis of hepatocytes induced by histone acetylation in the CYP2E1 promoter region of hepatocytes. Methods The concentration of INH was 1000μg / mL, Garcinol was 5μmol / L, and the duration of drug action was 6 h. ELISA detected the activity of acetylase HAT and deacetylase HDAC. Chip detects H3K56, H4K5 levels. RT-PCR detected the expression of CYP2E1, JNK, Bax, and Bcl2. Results Compared with the control group, the HAT activity decreased in the INH group, the levels of acH3K56 and acH4K5 in the promoter regions of HDAC and CYP2E1 were increased, the mRNAs of JNK and Bax were increased and dacreased expression of Bcl2 mRNA. Compared with the INH group, HAT activity, acH3K56, acH4K5 expression, JNK and Bax decreased, and Bcl2 increased in the INH + Garcinol group. Conclusion Inhibition of CYP2E1 gene promoter acetylation in hepatocytes can reduce hepatocyte apoptosis induced by INH.
Key words INH; Liver injury; Histone acetylation; CYP2E1
1 引言
全世界大致200万人每年因为结核病而死亡[1]。每年有100万新病例出现在中国,其中13万人因结核病失去生命[2]。一线抗结核药物中的INH可有效治疗结核病,但其在肝脏中的新陈代谢会使肝细胞受损,导致耐药结核病的发生[3]。CYP450家族成员CYP2E1在内、外源化合物的代谢中起显著作用,并且与肝脏的化学毒性和癌变有关[4,5]。异烟肼由肝细胞中的乙酰基转移酶2和细胞色素P450酶催化,其最终有毒代谢物和乙酰基衍生物能与肝细胞中的大分子物质共价结合,生成内源性超氧阴离子,促进活性氧的产生[6,7]。JNK通路可被氧化应激激活,引起肝细胞凋亡促进肝损伤[8]。
组蛋白乙酰化是可逆的动态过程,是组蛋白修饰的主要形式,受HAT和HDAC调控。HAT可促进基因激活,而HDAC则抑制基因转录[9]。杨等发现HDAC抑制剂TSA可使胞中CYP2E1基因启动子区的H3乙酰化,并增加CYP2E1的表达以促进肝癌细胞的凋亡[10]。但是,组蛋白乙酰化受乙酰酶和脱乙酰酶的调节,仅研究脱乙酰基酶抑制剂不能反映组蛋白的整体乙酰化。
2 材料和方法
2.1细胞和试剂
细胞系是购自上海科学院的人正常肝细胞HL-7702。配置含90%RPMI 1640(CORNING)、1%双抗体和10%胎牛血清(CLARK)的培养基,细胞培养在5%CO2 37℃培养箱中。INH购自日本TCI公司,Garcinol购自开曼公司。
2.2细胞处理
异烟肼分别稀释至600、800、1000和1200μg/mL,Garcinol分别稀释至1、5和10μmol/L作用于肝细胞,CCK8法确定最佳实验药物浓度和试剂浓度。将细胞悬液调至密度为1×105/mL并接种在96孔板,每孔加100μL悬浮液培养24h,吸出培养液并取100μL培养液添加到对照孔,将不同浓度的药物添加到测试孔并继续孵化。24h后,吸出液体并用无菌PBS溶液洗涤。將100μLCCK8稀释液加到每孔中。空白孔仅添加100μLCCK8稀释液作为对照。将96孔板在培养箱中孵育1h,用酶标仪测量在450nm波长处测量吸光度并计算吸光度之比。
2.3 RT-PCR
用Trizol提取总RNA。反转录条件:37℃ 15min;85℃ 5s;4℃ 1min。20μL的PCR体系,其中SYRB Green为10μL,6.8μL的dH2O,上游和下游引物各0.4μL,0.4μL的Rox,cDNA为2μL。PCR条件:预变性95℃30 s,变性95℃5 s,退火60℃30 s,共40个循环。内参为GAPDH,mRNA用2-ΔΔct计算。
2.4 ELISA测定
收集细胞,按照ELISA试剂盒操作。试剂盒购自北京东格维业生物技术有限公司。
2.5免疫沉淀
甲醛交联和细胞超声处理用于免疫沉淀,收集特异性DNA并严格按照试剂盒说明使用q-PCR分析H3K56和H4K5乙酰化。试剂盒购自武汉爱宝泰生物技术有限公司。
2.6 统计分析
数据分析软件用SPSS 22.0,计量资料采用“均值±标准差”表示,组间均数比较采用t检验,P <0.05为差异有统计学意义。
3 结果
3.1构建肝细胞损伤模型
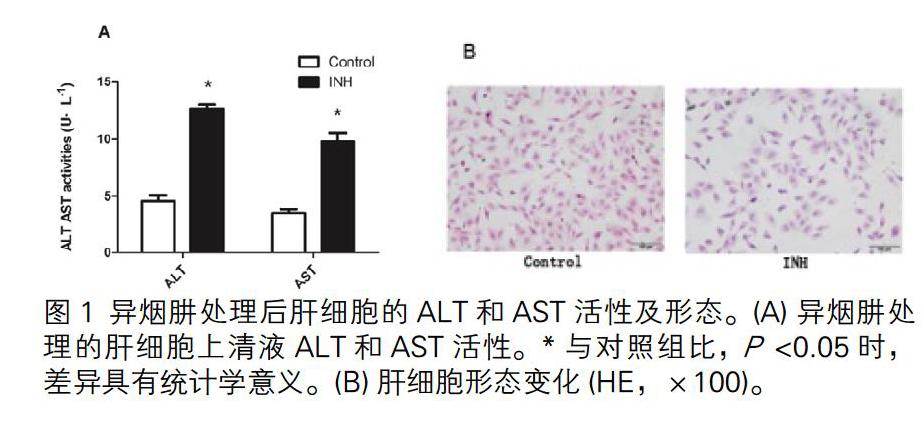
将不同稀释浓度INH应用于肝细胞,CCK8法检测细胞存活率在80%至85%之间的INH浓度(1000μg/ mL),选择最大无毒剂量为抑制剂浓度(Garcinol 5μmol/ L)。该浓度下分别培养细胞6 h、24 h和48 h。CYP2E1 mRNA在给药6h后表达增加,确定最佳给药时间为6小时。图1中INH组ALT和AST活性及细胞病理变化均表明肝细胞损伤模型建立成功。
3.2 INH组组蛋白乙酰化水平,CYP2E1 mRNA表达的变化
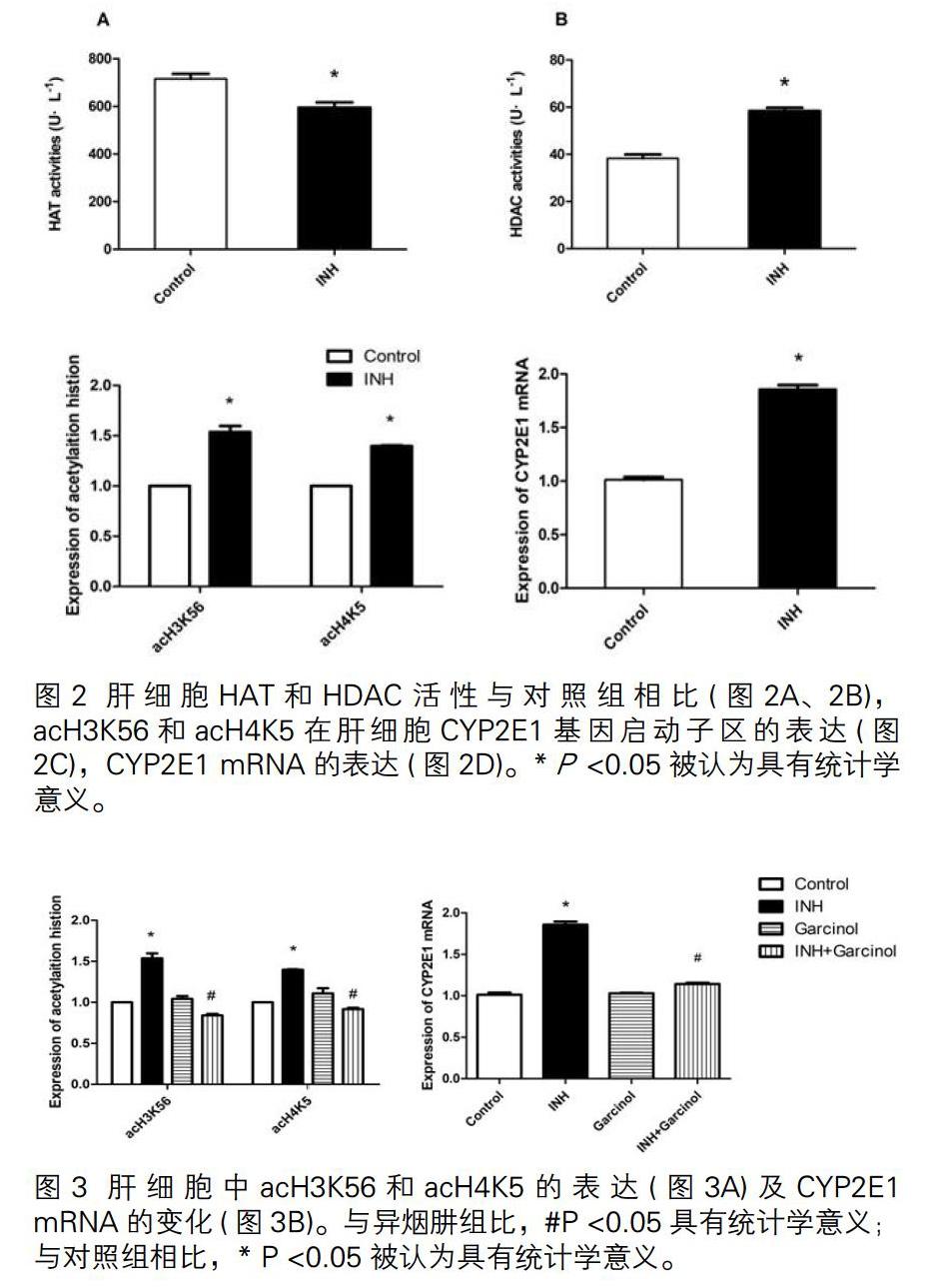
检测HAT和HDAC活性、CYP2E1基因启动子区域中acH3K56和acH4K5的表达水平及CYP2E1基因的mRNA表达。与对照组相比,INH组HAT活性降低,HDAC活性升高,CYP2E1基因启动子区组蛋白乙酰化水平及CYP2E1 mRNA的表达均增加,表明异烟肼导致CYP2E1基因启动子区组蛋白乙酰化水平增加。(图2)
3.3 INH+Garcinol组组蛋白乙酰化水平,CYP2E1 mRNA表达的变化
检测CYP2E1基因启动子区acH3K56、acH4K5的表达水平及CYP2E1基因mRNA表达(图3)。与INH组比,INH + Garcinol组acH3K56和acH4K5表达水平降低,表明Garcinol激活了CYP2E1基因。对该区域的乙酰化水平也具有抑制作用。CYP2E1基因mRNA表达,表明在启动子区域中组蛋白乙酰化受到抑制CYP2E1基因可以被还原。
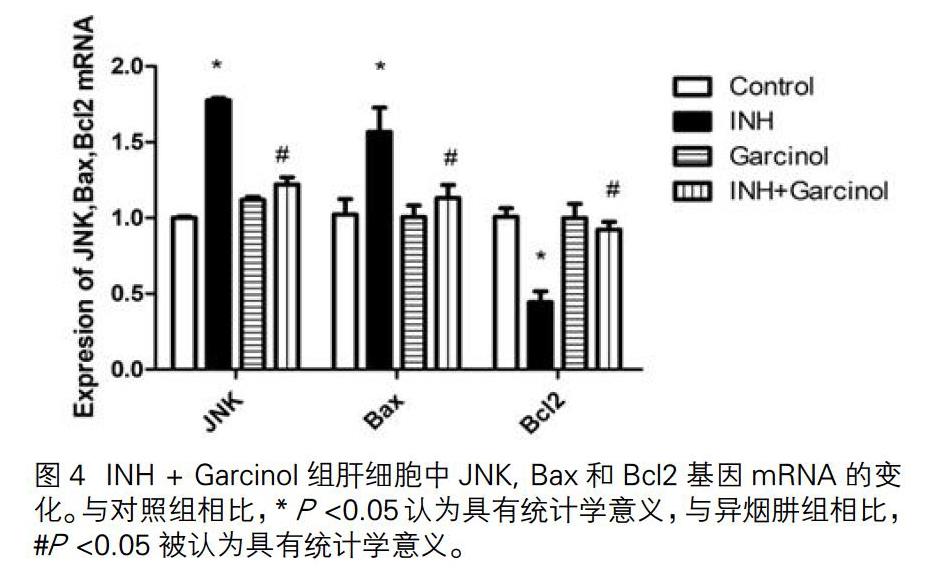
3.4 INH和 INH+Garcinol组对肝细胞凋亡的影响
检测JNK, Bax和Bcl2的mRNA水平。与对照组相比,INH组JNK和Bax的mRNA水平升高。Bcl2的mRNA水平下降。与INH组比,INH+Garcinol组JNK和Bax mRNA水平降低,Bcl2 mRNA水平升高(图4),表明肝细胞凋亡是由异烟肼引起的,且异烟肼与抑制剂组合可抑制细胞凋亡。与对照组相比,抑制剂对照组中JNK,Bax和Bcl2基因的mRNA水平变化不大,表明单独使用抑制剂不会引起肝细胞凋亡。
4 讨论
实验证实INH加重肝损伤并使CYP2E1表达增加,INH引起的肝损伤中CYP2E1表达的增加与组蛋白乙酰化水平的变化有关。Garcinol对INH引起的肝损伤具有保护作用,可以为预防和治疗INH致肝损伤提供理论基础。
异烟肼可使20%的患者血清丙氨酸氨基轉移酶水平增加,2%的患者表现出明显肝细胞毒性[11]。肝细胞用INH处理后,HAT活性降低而HDAC升高,CYP2E1基因启动子区域中acH3K56和acH4K5表达增加。CYP2E1基因mRNA表达增加。
CYP2E1亚型主要分布在肝脏中,是一种重要的药物代谢酶,可将INH中间体乙酰肼氧化为肝毒素,如乙酰二氮烯和乙酰乙酸铵[12]。Yang的研究表明,细胞中CYP2E1基因启动子区的组蛋白乙酰化会影响CYP2E1基因的表达[13]。组蛋白受HAT和HDAC调节,HAT使组蛋白赖氨酸乙酰化,促进基因转录。HDAC使高度乙酰化的组蛋白脱乙酰化,从而抑制基因转录。在本研究中,异烟肼导致细胞HAT活性降低和HDAC升高,CYH2E1启动子区域acH3K56和acH4K5表达水平升高,Garcinol组的HAT活性低于对照组,表明Garcinol对HAT活性有明显抑制作用。INH +Garcinol组与INH组比,HAT活性降低,CYH2E1启动子区域acH3K56和acH4K5表达水平降低,并且CYP2E1 mRNA表达水平降低,提示降低CYP2E1基因启动子区组蛋白乙酰化水平可以抑制CYP2E1的转录。Garcinol是体内和体外组蛋白乙酰基转移酶p300和PCAF的有效抑制剂[14,15,16]. Garcinol已被证明具有乙酰基转移酶抑制剂的抗炎和抗氧化作用,并且在某些肿瘤细胞中已显示出剂量依赖性的肿瘤细胞特异性生长抑制作用。以上结果表明,改变CYP2E1基因的启动子区域中的组蛋白乙酰化水平可以改变CYP2E1基因的表达。
检测JNK, Bax和Bcl2 mRNA表达及细胞形态发现,对照组相比实验组JNK和Bax mRNA表达增加,而Bcl2 mRNA的表达下降。与异烟肼组相比,异烟肼联合Garcinol抑制CYP2E1的表达,降低JNK和Bax mRNA的表达,并增加Bcl2 mRNA的表达。
参考文献
[1]Fattorini L, Piccaro G, Mustazzolu A, et al. Targeting dormant bacilli to fight tuberculosis[J]. Mediterr J Hematol Infect Dis, 2013, 5(1): e2013072.
[2]Yang C, Gao Q. Recent transmission of Mycobacterium tuberculosis in China: the implication of molecular epidemiology for tuberculosis control[J]. Front Med, 2018, 12(1): 76-83.
[3]Sonika U, Kar P. Tuberculosis and liver disease: management issues[J]. Trop Gastroenterol. 2012, 33(2): 102-106.
[4]Toussirot ?, Wendling D, Herbein G. Biological treatments given in patients with rheumatoid arthritis or ankylosing spondylitis modify HAT/HDAC (histone acetyltransferase/histone deacetylase) balance[J]. Joint Bone Spine, 2014, 81(6): 544-545.
[5]Chen H P, Zhao Y T, Zhao T C. Histone deacetylases and mechanisms of regulation of gene expression[J]. Crit Rev Oncog, 2015, 20(1-2): 35-47.
[6]Sarich T C, Youssefi M, Zhou T, et al. Role of hydrazine in the mechanism of isoniazid hepatotoxicity in rabbits[J]. Arch Toxicol, 1996, 70(12): 835-840.
[7]Singh N, Dubey S, Chinnaraj S, et al. Study of NAT2 gene polymorphisms in an Indian population: association with plasma isoniazid concentration in a cohort of tuberculosis patients[J]. Mol Diagn Ther, 2009, 13(1): 49-58.
[8]Wang X, Wu D, Yang L, et al. Hepatotoxicity mediated by pyrazole (cytochrome P450 2E1) plus tumor necrosis factor alpha treatment occurs in c-Jun N-terminal kinase 2 ?/? but not in c-Jun N-terminal kinase 1 ?/? mice ? ?[J]. Hepatology, 2011, 54(5): 1753–1766.
[9]Chen H P, Zhao Y T, Zhao T C. Histone deacetylases and mechanisms of regulation of gene expression[J]. Crit Rev Oncog, 2015, 20(1-2): 35-47.
[10]Yang H, Nie Y, Li Y, et al. Histone modification-mediated CYP2E1 gene expression and apoptosis of HepG2 cells[J]. Exp Biol Med (Maywood), 2010, 235(1): 32-39.
[11]Hassan H M, Guo H L, Yousef B A, et al. Hepatotoxicity mechanisms of isoniazid: A mini-review[J]. J Appl Toxicol, 2015, 35(12): 1427-1432.
[12]Wang F J, Wang Y, Niu T, et al. Update meta-analysis of the CYP2E1 RsaI/PstI and DraI polymorphisms and risk of antituberculosis drug-induced hepatotoxicity: evidence from 26 studies[J]. J Clin Pharm Ther, 2016, 41(3): 334.
[13]Yang H, Nie Y, Li Y, et al. Histone modification-mediated CYP2E1 gene expression and apoptosis of HepG2 cells[J]. Exp Biol Med (Maywood), 2010, 235(1): 32.
[14]Yamaguchi F, Saito M, Ariga T, et al. Free radical scavenging activity and antiulcer activity of garcinol from Garcinia indica fruit rind[J]. J Agric Food Chem, 2000, 48(6): 2320-2325.
[15]Padhye S, Ahmad A, Oswal N, et al. Emerging role of Garcinol, the antioxidant chalcone from Garcinia indica Choisy and its synthetic analogs[J]. J Hematol Oncol, 2009, 2: 38.
[16]Yuan H, Wan J, Li L, et al. Therapeutic benefits of the group B3 vitamin nicotinamide in mice with lethal endotoxemia and polymicrobial sepsis[J]. Pharmacol Res, 2012, 65(3): 328-337.
[2020-01-07收稿]
