文峪河上游河岸带不同植被类型土壤nirS反硝化菌群结构及功能
2020-04-20韩晓丽黄春国张芸香郭晋平
韩晓丽,黄春国,张芸香,郭晋平,*
1 山西农业大学,林学院,太谷 030801 2 北方功能油料树种培育与研发山西省重点实验室,太谷 030801 3 山西农业大学农学院,太谷 030801
河岸带植物群落是介于河流生态系统和陆地生态系统之间的关键功能型森林群落系统,是二者之间进行物质循环、能量转化和信息交换的重要过渡区域,在维持流域景观稳定性和生态安全方面发挥着重要作用[1-3]。河岸带植物群落演替过程,不仅受河岸带高度复杂地形地貌等生境条件影响,还受到洪水引起的侵蚀和沉积的干扰[4],使得整个流域河岸带植物群落类型呈现出明显的演替差异。而处于不同演替阶段的河岸带植被类型,对整个流域生态系统发挥着独特的水文功能和生态功能[5-6]。
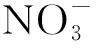
为阐明文峪河上游河岸带氮素滤除机制,特别是反硝化作用及其影响的环境因子间的作用关系。本文以该地区河岸带不同演替阶段的植被类型为研究对象,对土壤主要理化性质、反硝化菌群多样性及群落组成和反硝化酶活性等进行分析,揭示不同植被类型土壤反硝化菌群多样性及群落组成和反硝化酶活性变化规律,并解析差异变化与土壤主要理化性质的关联性,阐明土壤反硝化菌群多样性及群落组成与河岸带植物群落演替的控制关系,为进一步研究该区域河岸带氮素循环及水体污染防治提供重要参考依据。
1 材料与方法
1.1 研究区概况
文峪河,属于黄河支流汾河的支流,全长155 km,其上游段自发源地关帝山主峰孝文山南麓庞泉沟起始至文峪河水库一段,称中西河,位于吕梁山脉中段关帝山林区的庞泉沟国家级自然保护区内。该保护区位于山西省交城、文水、方山、娄烦等县交界处,地理坐标为111°22′—111°33′ E,37°45′—37°55′ N,海拔1600—2831 m。气候属于受季风影响和控制的暖温带大陆性山地气候,年平均气温4.2 ℃,年平均降雨量822.6 mm,主要集中在7—9月,占全年总量的83%以上。土壤类型从低海拔到高海拔(1650—2830 m)依次为山地褐土、山地淋溶褐土、山地棕壤和亚高山草甸土。区域内植物物种多样性较高,有种子植物89科359属809种[14];其中河岸带植被优势植物有青杄 (Piceawilsonii)、白杄 (P.meyeri)、华北落叶松 (Larixprincipis-rupprechtii)、白桦 (Betulaplatyphylla)、山杨 (PopuluscathayanaRehd.)、沙棘 (Hippophaerhamnoides)、密齿柳 (SalixcharacterSchneid)等[4,15]。
1.2 试验设计和采样
根据已有的调查数据和图面材料,结合实地踏查,于2016年在文峪河上游主河道及支流人为干扰较少的地段,选址设置8种具代表类型的河岸植被类型样地,每种类型选取立地条件相似的3个样地重复,每个样地内设置3个样方,乔木20 m×20 m,灌木10 m×10 m,草本2 m×2 m,样方间距大于10 m,样方内使用“S”型5点采样法,清除土壤表层杂质后,采取0—15 cm(A层)和15—30 cm(B层)不同土层土样,分别分层将5处土壤并混合为一个土样。样品放置于冰袋冷藏箱中运送回实验室。实验室内对土样进行过筛(2 mm)并混匀,去除植物根系和石头等杂质。再采用四分法将每个土样分为两份,一份室内风干用于测定土壤理化指标,一份保存于-70℃冰箱内用于土壤反硝化菌群多样性及群落组成的测定。
同时,依据高润梅[4]和吉久昌等[15]关于文峪河上游河岸林演替分析及群落类型研究结果,将本实验8种植被类型归类为6个演替阶段,即:五花草甸(WH, Multi-flower meadow)属于演替I阶段、沙棘灌木林(HR, Hippophae shrub)和柳树灌木林(SS, Salix shrub)群落类型属于演替II阶段、山杨林群落类型(PC, Poplar forest)和山杨白桦混交林(PQ, Poplar birch forest)属于演替III阶段、山杨白桦落叶松混交林(PQL, Poplar birch and larix forest)属于演替IV阶段、落叶松云杉混交林(LP, Larix and picea forest)属于演替V阶段、云杉林群落类型(PM, Picea forest)属于演替VI阶段。样地基本概况见表1。
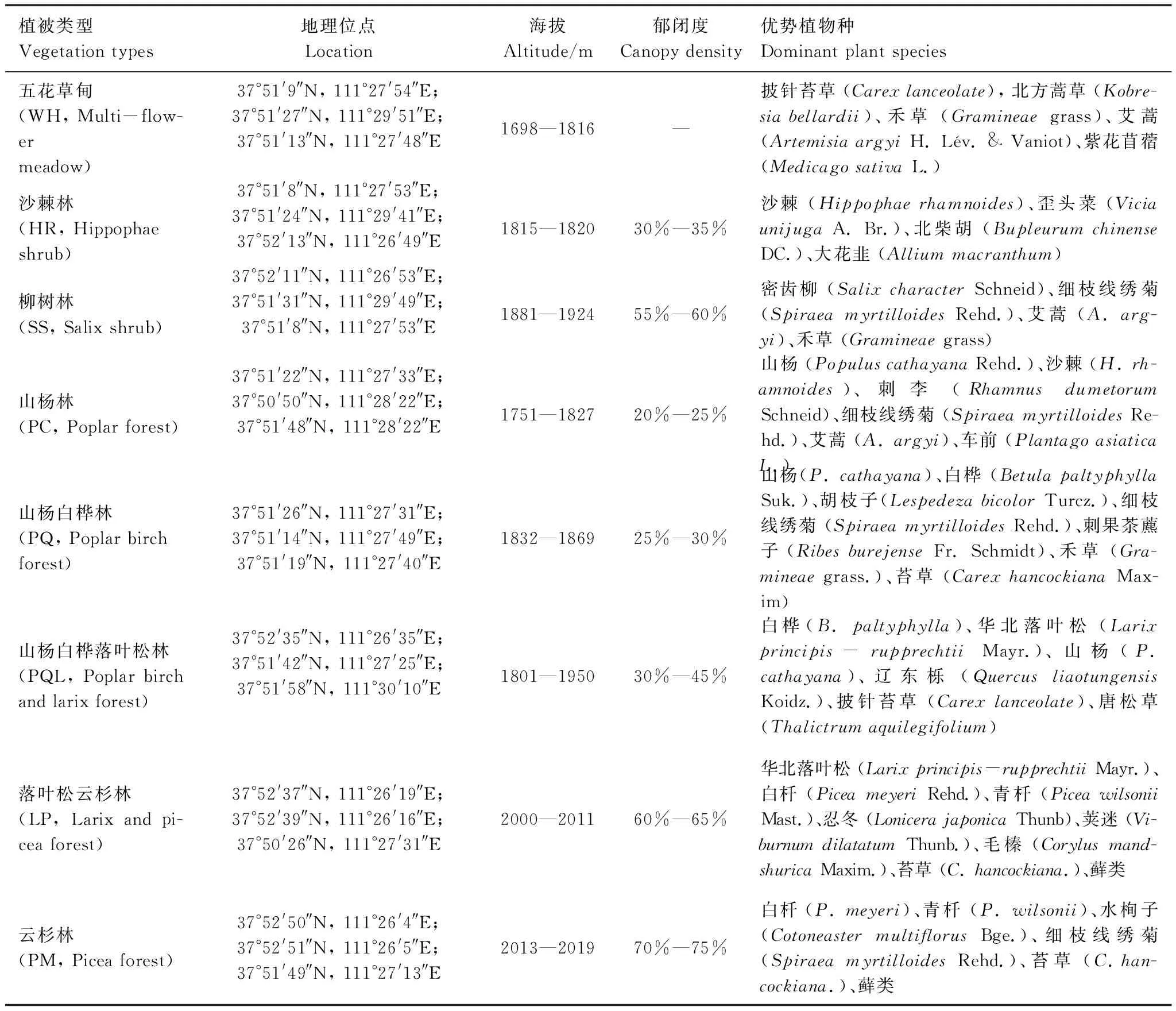
表1 文峪河上游河岸带不同植被类型采样地概况及优势植物种
1.3 数据测定及分析

土壤反硝化菌群多样性及群落组成采用第二代高通量测序平台 (Illumina Miseq)进行测序分析。PCR扩增采用的是nirS基因引物:Cd3aF(5′-GTSAACGTSAAGGARACSGG-3′)和R3cd(5′-GASTTCGGRTGSGTCTTGA-3′);扩增反应体系:2 μL的纯化DNA,5 μL的Q5反应缓冲液(5×),5 μL的Q5高保真GC缓冲液(5×),0.25 μL的Q5高保真DNA聚合酶(5U/μL),2 μL的dNTPs液(2.5 mmol/L),上游引物和下游引物(10 μmol/L)各1 μL,8.75 μL的去离子水;扩增条件:98℃预变性2 min,98℃变性15 sec,55℃退火30 sec,72℃延伸30 sec,25个循环,最后72℃延伸5 min。运用uclust软件对序列进行聚类,序列相似性定位0.97,操作分类单元被认为可能接近于属。使用QIIME软件和R语言软件包(v3.6.1)进行反硝化菌群Alpha多样性分析。
1.4 数据统计与分析
使用SPSS 20.0软件对土壤理化性质、土壤反硝化酶活性和菌群多样性及群落组成等数据进行双因素方差分析和多重比较,以及Spearman相关性分析;使用R 3.6.1(vegan)软件包对不同植被类型的土壤理化性质与反硝化菌群多样性及群落组成进行冗余分析(RDA)。
2 结果与分析
2.1 不同植被类型及土层间土壤理化性质
不同植被类型土壤理化性质存在较大差异(表2),五花草甸(WH)型土壤pH显著高于其他植被类型,土壤有机碳(SOC)、速效磷(AP)、土壤含水量(SM)和土壤全氮(TN)等却较低;柳树灌木林(SS)土壤全氮(TN)较高,而土壤pH值和铵态氮含量较低;山杨白桦混交林(PQ)土壤铵态氮较高;落叶松云杉混交林(LP)土壤有机碳(SOC)和土壤含水量(SM)较高;云杉林(PM)土壤速效磷(AP)和土壤含水量(SM)较高。同时,土壤理化性质在不同土层间差异显著。0—15 cm土层土壤有机碳(SOC)含量、速效磷(AP)、土壤含水量(SM)、全氮(TN)和铵态氮显著高于15—30 cm土壤层,但土壤pH显著低于15—30 cm土壤。另外,土壤硝态氮受植被类型和土层相互作用的影响(图1)。其中柳树灌木林(SS)群落类型0—15 cm土层硝态氮含量显著性高于其他植被类型的各个土层,山杨林(PC) 0—15 cm及15—30 cm土层、五花草甸(WH) 15—30 cm土层硝态氮含量较低,且相互之间差异不显著。
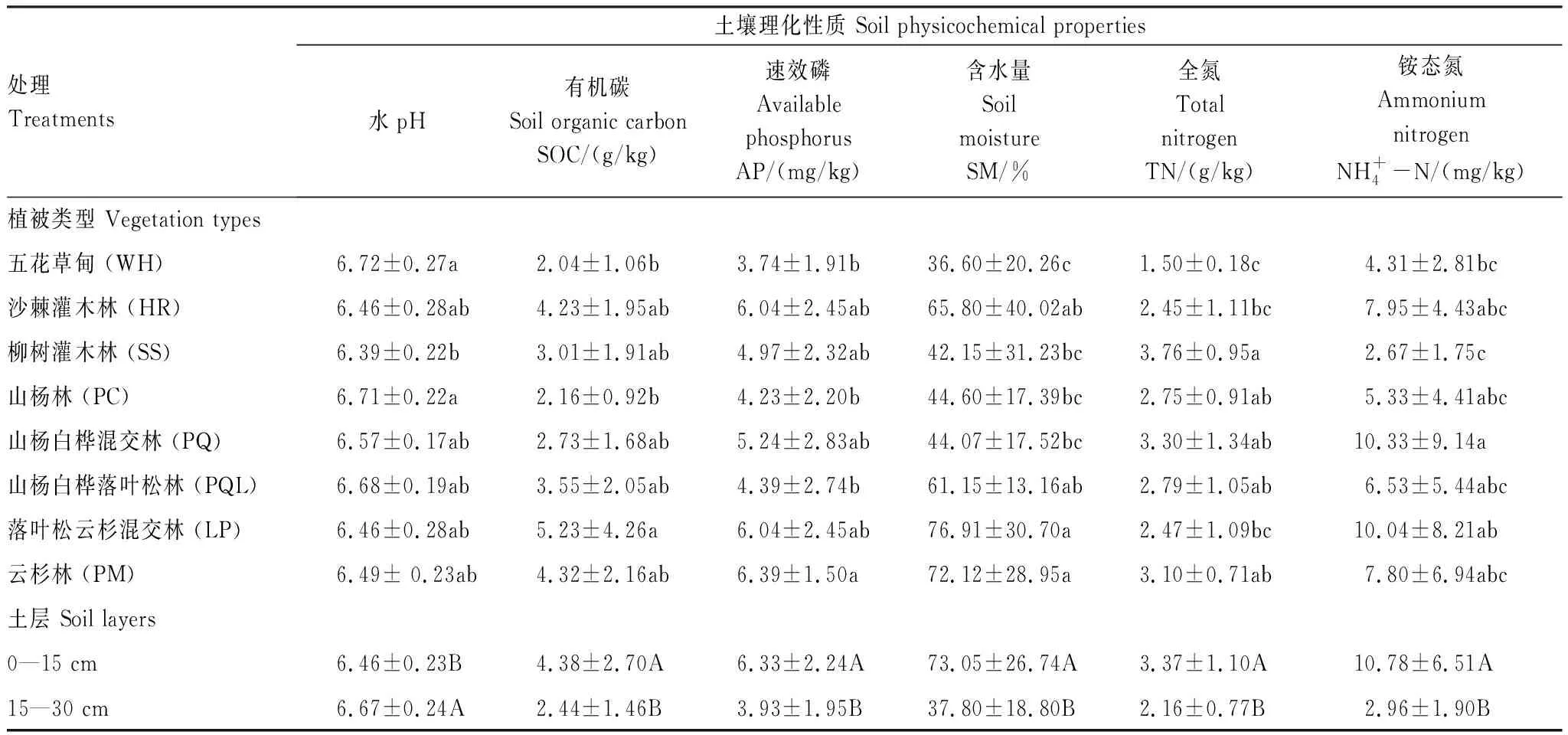
表2 文峪河上游不同植被类型和土层土壤理化性质
植被类型×土层交互作用不显著,但主因子作用均显著。表中数值为平均值±标准差,同一列中不同字母表示彼此在P≤0.05 水平上差异显著(Tukey 检验法);小写字母表示不同植被类型间差异显著,大写字母表示不同土层间差异显著
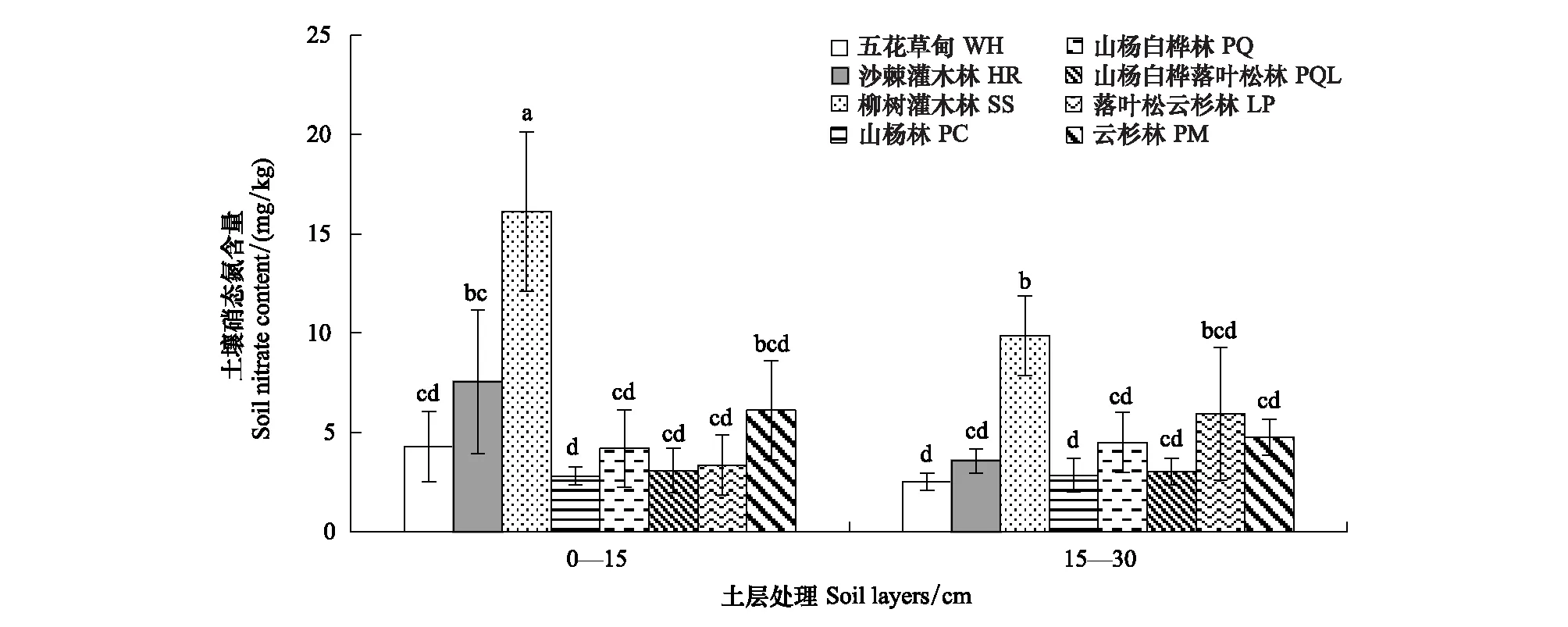
图1 文峪河上游河岸不同植被类型和土层土壤硝态氮含量Fig.1 Soil nitrate content in different riparian vegetations and soil layers of upper Wenyuhe watershed 植被类型×土层交互作用显著(P≤0.05). 图中误差线为标准差,每个柱上方字母表示彼此在P ≤0.05 水平上差异显著(Tukey 检验法);WH:五花草甸Multi-flower meadow;HR:沙棘灌木林Hippophae shrub;SS:柳树灌木林Salix shrub; PC:山杨林Poplar forest;PQ:山杨白桦林Poplar birch forest; PQL:山杨白桦落叶松林Poplar birch and larix forest; LP:落叶松云杉林Larix and picea forest;PM:云杉林 Picea forest
2.2 不同植被类型及土层间土壤反硝化菌群多样性及反硝化酶活性
土壤反硝化菌群多样性受植被类型和土层相互作用的影响(图2)。沙棘灌木林(HR)15—30 cm土层反硝化菌群多样性Chao1指数显著高于其他植被类型各土层,山杨白桦落叶松林 (PQL)15—30 cm土层Chao1指数最低;云杉林(PM) 0—15 cm土层、山杨白桦落叶松林(PQL) 0—15 cm土层和五花草甸(WH)15—30 cm土层Shannon指数最高,山杨白桦落叶松林(PQL)15—30 cm土层最低,且差异显著。结合植被类型演替分析,土壤反硝化菌群多样性指数变化大致呈“W”型趋势,即五花草甸(WH)(演替I期)、山杨白桦林(PQ)(演替III期)和云杉林(PM)(演替VI期)土壤反硝化菌群多样性较高。
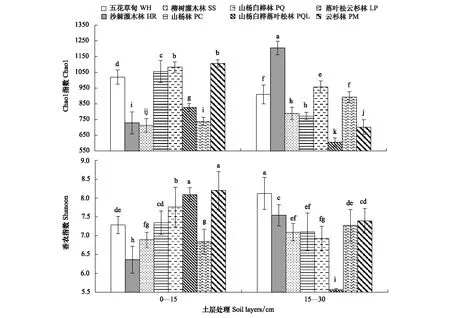
图2 文峪河上游河岸不同植被类型和土层土壤中反硝化菌群多样性Fig.2 Soil denitrifying bacterial diversity in different riparian vegetations and soil layers of upper Wenyuhe watershed 植被类型×土层交互作用显著(P≤0.05). 图中误差线为标准差,每个柱上方字母表示彼此在P≤0.05 水平上差异显著(Tukey 检验法)
土壤反硝化酶活性是反映土壤反硝化功能重要指标。由图3可知,土壤反硝化酶活性受植被类型和土层相互作用的影响,演替II阶段,沙棘灌木林(HR)和柳树灌木林(SS) 0—15 cm土层土壤反硝化酶活性最高,其15—30 cm土层土壤反硝化酶活性次之,且二者之间差异不显著。即与其他植被类型相比,沙棘灌木林(HR)和柳树灌木林(SS)土壤反硝化功能较强。结合植被类型演替分析,土壤反硝化酶活性变化呈倒“V”型趋势,即演替II期的沙棘灌木林(HR)和柳树灌木林(SS)土壤反硝化酶活性较强。
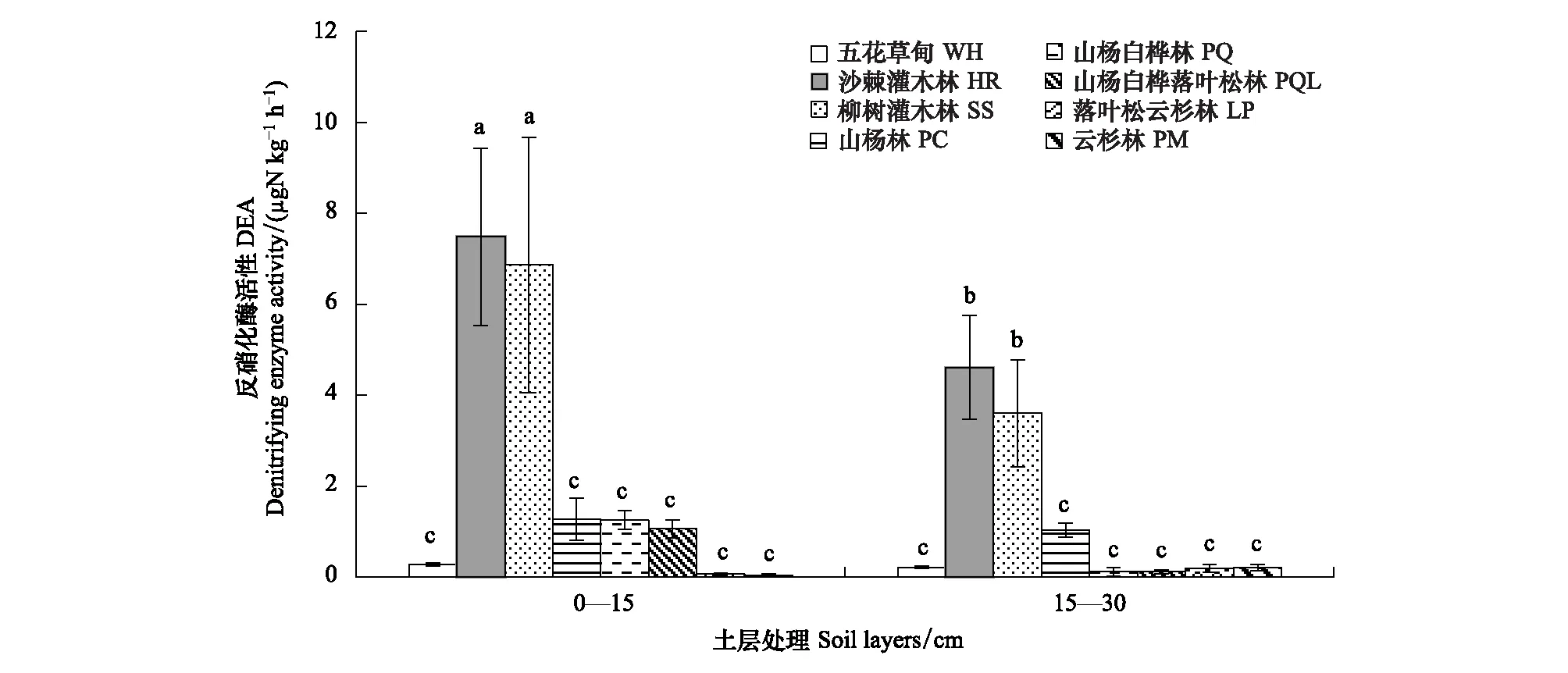
图3 文峪河上游河岸不同植被类型和土层土壤反硝化酶活性Fig.3 Denitrifying enzyme activity in different riparian vegetation and soil layers of upper Wenyuhe watershed植被类型×土层交互作用显著(P≤0.05). 图中误差线为标准差,每个柱上方字母表示彼此在 P≤0.05 水平上差异显著(Tukey 检验法)
2.3 不同植被类型及土层间土壤反硝化菌群落组成及优势菌群
土壤反硝化菌群落组成及优势菌群受植被类型和土层相互作用影响。由图4可知,门水平上,土壤反硝化菌群落组成主要包括了变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)。其中,变形菌门(Proteobacteria)在柳树灌木林0—15 cm土层(SSA)土壤中相对丰度最高,属于优势菌群,厚壁菌门(Firmicutes)是五花草甸0—15 cm土层(WHA)优势菌群,放线菌门(Actinobacteria)在沙棘灌木林0—15 cm土层(HRA)和柳树灌木林0—15 cm土层(SSA)属于优势菌群,绿弯菌门(Chloroflexi)是山杨白桦落叶松林混交林0—15 cm土层(PQLA)优势菌群;而浮霉菌门(Planctomycetes)仅在落叶松云杉混交林15—30 cm土层(LPB)和云杉林15—30 cm土层(PMB)土壤中有分布,且二者之间差异不显著。同时,柳树灌木林15—30 cm土层(SSB)和云杉林15—30 cm土层(PMB)土壤反硝化菌群落组成较丰富,均含有四种不同门的反硝化菌群。其中,柳树灌木林15—30 cm土层(SSB)除变形菌门(Proteobacteria)为优势菌群外,仍含有少量的厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi);云杉林15—30 cm土层(PMB)土壤中优势菌群为变形杆菌门(Proteobacteria)和厚壁菌门(Firmicutes);而演替III期山杨林(PC)和山杨白桦混交林(PQ)土壤中反硝化菌群落组成较稀少,仅含有变形杆菌门(Proteobacteria)和厚壁菌门(Firmicutes);云杉林0—15 cm土层(PMA)仅有变形杆菌门(Proteobacteria)和绿弯菌门(Chloroflexi)。
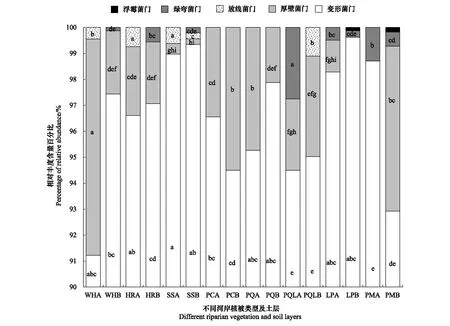
图4 文峪河上游河岸不同植被类型土壤nirS 型反硝化菌群相对丰度组成(门水平)Fig.4 Composition and abundance of nirS denitrifiers at phylum level of different riparian vegetations of upper Wenyuhe watershed柱内字母分别表示同一反硝化细菌门在不同植被类型及土层样本间相对丰度在 P≤0.05 水平上差异显著(Tukey 检验法);横坐标标签后加A表示0—15 cm土层;加B表示15—30 cm土层
在属水平上,对相对丰度前10的属进行分析可知(表3):五花草甸土壤中芽孢杆菌属(Bacillus)在0—15 cm土层相对丰度含量较高,贪铜菌属(Cupriavidus)在15—30 cm土层较高;沙棘灌木林中固氮菌属(Azoarcus)和硫针菌属(Sulfuritalea)在0—15 cm土层中相对丰度较高,红长命菌属(Rubrivivax)在15—30 cm土层中相对丰度较高;柳树灌木林0—15 cm土层(SSA)中罗河杆菌属(Rhodanobacter)较高;山杨白桦混交林土壤中固氮螺菌属(Azospirillum)和多形菌属(Polymorphum)在0—15 cm土层相对丰度较高,假单孢菌属(Pseudomonas)在15—30 cm土层含量较高;落叶松云杉混交林土壤中红长命菌属(Rubrivivax)在0—15 cm土层中含量较高,固氮螺菌属(Azospira)在15—30 cm土层中相对丰度较高;云杉林土壤中贪铜菌属(Cupriavidus)在15—30 cm土层中相对丰度较高。
表3 文峪河上游河岸不同植被类型和土层土壤中反硝化菌的相对丰度差异(属水平)
Table 3 Abundance of soil denitrifying bacterial (nirS) at genus leve as influenced by vegetation types and soil layers in upper Wenyuhe watershed (2-way ANOVA)
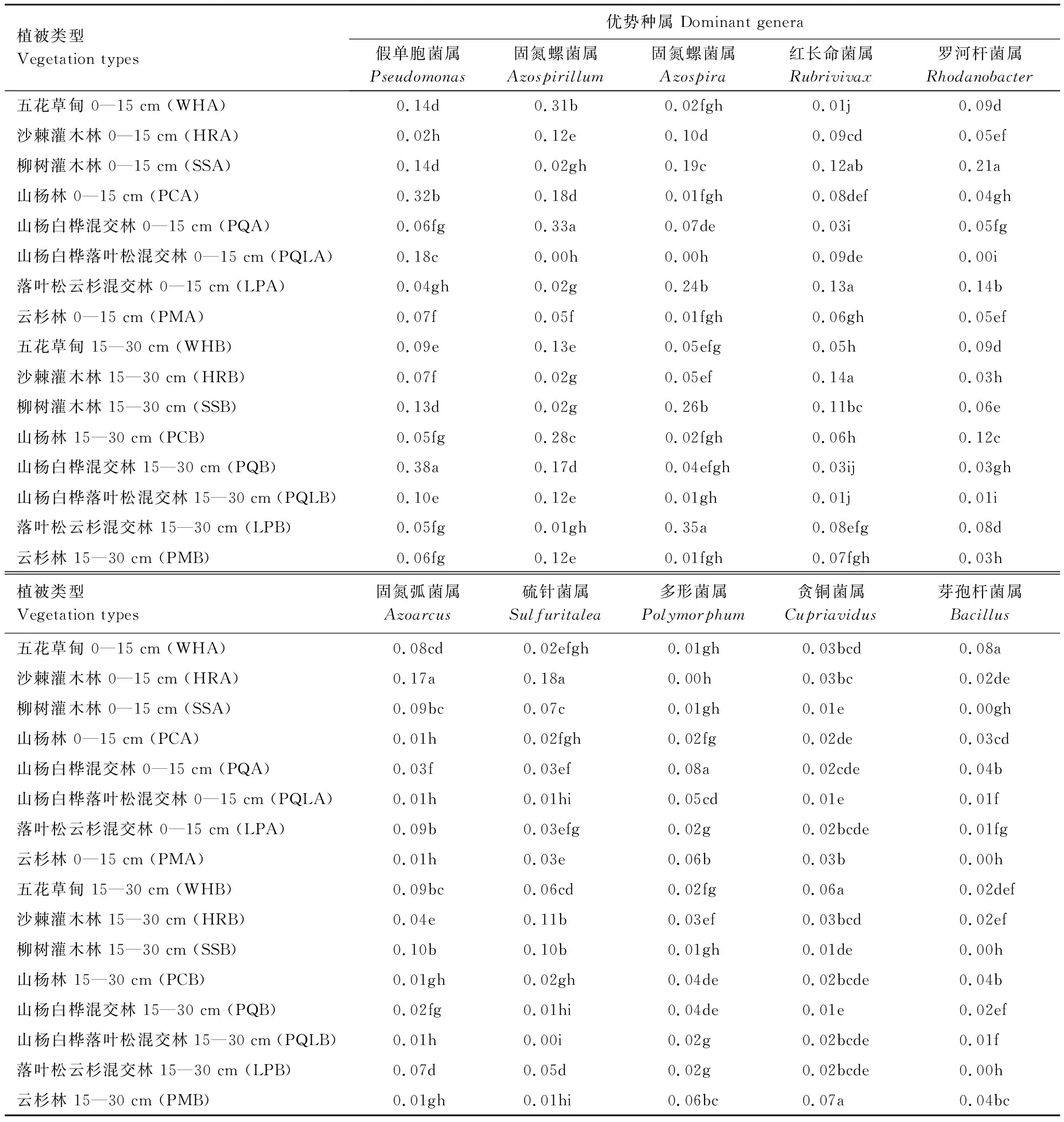
植被类型Vegetation types优势种属 Dominant genera假单胞菌属Pseudomonas固氮螺菌属Azospirillum固氮螺菌属Azospira红长命菌属Rubrivivax罗河杆菌属Rhodanobacter五花草甸 0—15 cm (WHA)0.14d0.31b0.02fgh0.01j 0.09d沙棘灌木林 0—15 cm (HRA)0.02h0.12e0.10d0.09cd0.05ef柳树灌木林 0—15 cm (SSA)0.14d0.02gh 0.19c0.12ab0.21a山杨林 0—15 cm (PCA)0.32b0.18d0.01fgh0.08def0.04gh山杨白桦混交林 0—15 cm (PQA)0.06fg0.33a 0.07de0.03i 0.05fg山杨白桦落叶松混交林 0—15 cm (PQLA)0.18c0.00h 0.00h0.09de0.00i落叶松云杉混交林 0—15 cm (LPA)0.04gh0.02g 0.24b 0.13a0.14b云杉林 0—15 cm (PMA)0.07f0.05f0.01fgh0.06gh0.05ef 五花草甸 15—30 cm (WHB)0.09e0.13e 0.05efg0.05h 0.09d沙棘灌木林 15—30 cm (HRB)0.07f0.02g0.05ef0.14a0.03h 柳树灌木林 15—30 cm (SSB)0.13d0.02g 0.26b0.11bc 0.06e 山杨林 15—30 cm (PCB)0.05fg0.28c0.02fgh0.06h0.12c山杨白桦混交林 15—30 cm (PQB)0.38a0.17d0.04efgh 0.03ij 0.03gh 山杨白桦落叶松混交林 15—30 cm (PQLB)0.10e0.12e 0.01gh0.01j 0.01i落叶松云杉混交林 15—30 cm (LPB)0.05fg0.01gh 0.35a 0.08efg0.08d云杉林 15—30 cm (PMB)0.06fg0.12e0.01fgh0.07fgh 0.03h植被类型Vegetation types固氮弧菌属Azoarcus硫针菌属Sulfuritalea多形菌属Polymorphum贪铜菌属Cupriavidus芽孢杆菌属Bacillus五花草甸 0—15 cm (WHA)0.08cd0.02efgh0.01gh0.03bcd 0.08a 沙棘灌木林 0—15 cm (HRA)0.17a0.18a 0.00h 0.03bc 0.02de 柳树灌木林 0—15 cm (SSA)0.09bc 0.07c0.01gh0.01e0.00gh山杨林 0—15 cm (PCA)0.01h0.02fgh 0.02fg0.02de0.03cd 山杨白桦混交林 0—15 cm (PQA)0.03f0.03ef0.08a 0.02cde0.04b山杨白桦落叶松混交林 0—15 cm (PQLA)0.01h0.01hi0.05cd0.01e0.01f落叶松云杉混交林 0—15 cm (LPA)0.09b 0.03efg 0.02g 0.02bcde0.01fg 云杉林 0—15 cm (PMA)0.01h0.03e0.06b 0.03b0.00h 五花草甸 15—30 cm (WHB)0.09bc 0.06cd0.02fg0.06a0.02def沙棘灌木林 15—30 cm (HRB)0.04e0.11b0.03ef0.03bcd0.02ef柳树灌木林 15—30 cm (SSB)0.10b0.10b0.01gh0.01de0.00h山杨林 15—30 cm (PCB)0.01gh0.02gh 0.04de0.02bcde0.04b 山杨白桦混交林 15—30 cm (PQB)0.02fg0.01hi 0.04de0.01e 0.02ef山杨白桦落叶松混交林 15—30 cm (PQLB)0.01h0.00i 0.02g 0.02bcde 0.01f落叶松云杉混交林 15—30 cm (LPB)0.07d0.05d0.02g0.02bcde0.00h 云杉林 15—30 cm (PMB)0.01gh 0.01hi0.06bc 0.07a0.04bc
同一列均值后不同字母表明在P≤0.05 水平上差异显著(Tukey 检验法)
在属水平上,对不同植被类型土层间土壤反硝化菌群落组成相似度进行聚类树和热图分析可知(图5):16个样本聚类为四大类群。其中,柳树灌木林15—30 cm土层(SSB)与落叶松云杉林0—15 cm土层(LPA)、云杉林0—15 cm土层(PMA)与山杨白桦落叶松混交林0—15 cm土层(PQLA)土壤反硝化菌群落组成相似度较高;山杨白桦混交林15—30 cm土层(PQB)和山杨林0—15 cm土层(PCA),五花草甸0—15 cm土层(WHA)和山杨林15—30 cm土层(PCB)土壤反硝化菌群落组成较为相似;沙棘灌木林15—30 cm土层(HRB)和山杨白桦落叶松混交林15—30 cm土层(PQLB)土壤反硝化菌群落组成极为相似;而山杨白桦林0—15 cm土层(PQA)土壤反硝化菌群落组成与其他样本相比差异较大。同时,将相对丰度前50的属聚类为5大类群,分别归属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)等5个门。
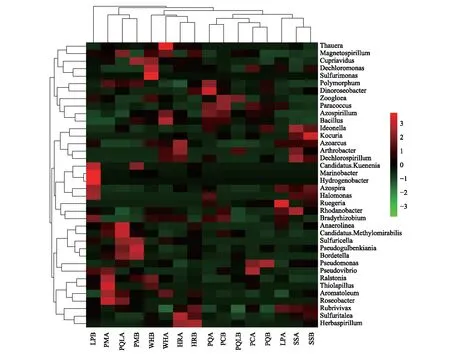
图5 文峪河上游河岸不同植被类型和土层土壤中反硝化菌优势属聚类热图Fig.5 Heat map and cluster of dominant denitrifiers at genus level in different riparian vegetation and soil layers of upper Wenyuhe watershed Nevskia 涅瓦河菌属;Bacillus 芽孢杆菌属;Psychrobacter 冷杆菌属;Lactococcus 乳酸球菌属;Arthrobacter 节杆菌属;Pseudomonas 假单胞菌属;Kineococcus 动球菌属;Conexibacter 康奈斯氏杆菌属; Pseudonocardia 假诺卡氏菌属;Microlunatus 小月菌属;Sphingomonas 鞘脂单胞菌属;Brevundimonas短波单胞菌属;Micrococcus 微球菌属;Acinetobacter 不动杆菌属;Propionibacterium 丙酸菌属;Burkholderia 伯克氏菌属; Rhodococcus 红球菌属;Microbacterium 微杆菌属;Pedomicrobium 土微菌属;Hyphomicrobium 生丝微菌属;Afifella 假红单胞杆菌属;Geobacter 地杆菌属;Candidatus.Rhabdochlamydia 棍衣原体属;Nitrospira 硝化螺菌属;Candidatus.Nitrosophaera 亚硝化螺菌属;Opitutus丰佑菌属;Couchioplanes 科氏游动菌属;Pilimelia 发仙菌属;Devosia 德沃斯氏菌属;Flavobacterium 黄杆菌属;Mycobacterium 分枝杆菌属;Planctomyces 浮霉状菌属;Steroidobacter 类固醇杆菌属;Pirellula 小梨形菌属;Lysobacter 溶杆菌属;Rubrivivax 红长命菌属;Gemmata 出牙菌属;Mesorhizobium 中慢生根瘤菌属;Phenylobacterium 苯基杆菌属;Rhizobium 根瘤菌属;Rhodoplanes 红游动菌属 PQ:山杨白桦林Poplar birch forest;PM:云杉林 Picea forest ;WH:五花草甸 Multi-flower meadow;HR:沙棘灌木林 Hippophae shrub;PQL:山杨白桦落叶松林 Poplar birch and larix forest;PC:山杨林 Poplar forest; LP:落叶松云杉林 Larix and picea forest;SS:柳树灌木林 Salix shrub;后加A表示0—15 cm土层;后加B表示15—30 cm土层
2.4 不同植被类型土壤反硝化菌群落特征与土壤理化因子相关性
对不同植被类型土壤反硝化酶活性、菌群多样性及优势菌群与土壤理化性质相关性分析(表4)表明:土壤有机碳(SOC)、速效磷(AP)和土壤含水量(SM)属于关键性土壤环境因子;土壤反硝化酶活性(DEA)与土壤硝态氮呈显著正相关(r=0.29,P≤0.05);土壤反硝化菌群多样性与铵态氮显著正相关(r=0.36,P≤0.05),而与其余理化因子相关性不强。同时,门水平上,土壤反硝化菌群落组成与土壤pH、土壤有机碳(SOC)和硝态氮呈显著相关;变形杆菌门(Proteobacteria)与硝态氮呈极显著正相关关系(r=0.46,P≤0.01);厚壁菌门(Firmicutes)与土壤pH呈显著正相关(r=0.3,P≤0.05),而与土壤有机碳(SOC)(r=-0.32,P≤0.05)和硝态氮(r=-0.37,P≤0.01)呈极显著负相关关系;放线菌门(Actinobacteria)与硝态氮呈极显著正相关(r=0.47,P≤0.01);绿弯菌门(Chloroflexi)与土壤有机碳(SOC)呈极显著正相关(r=0.47,P≤0.01)。
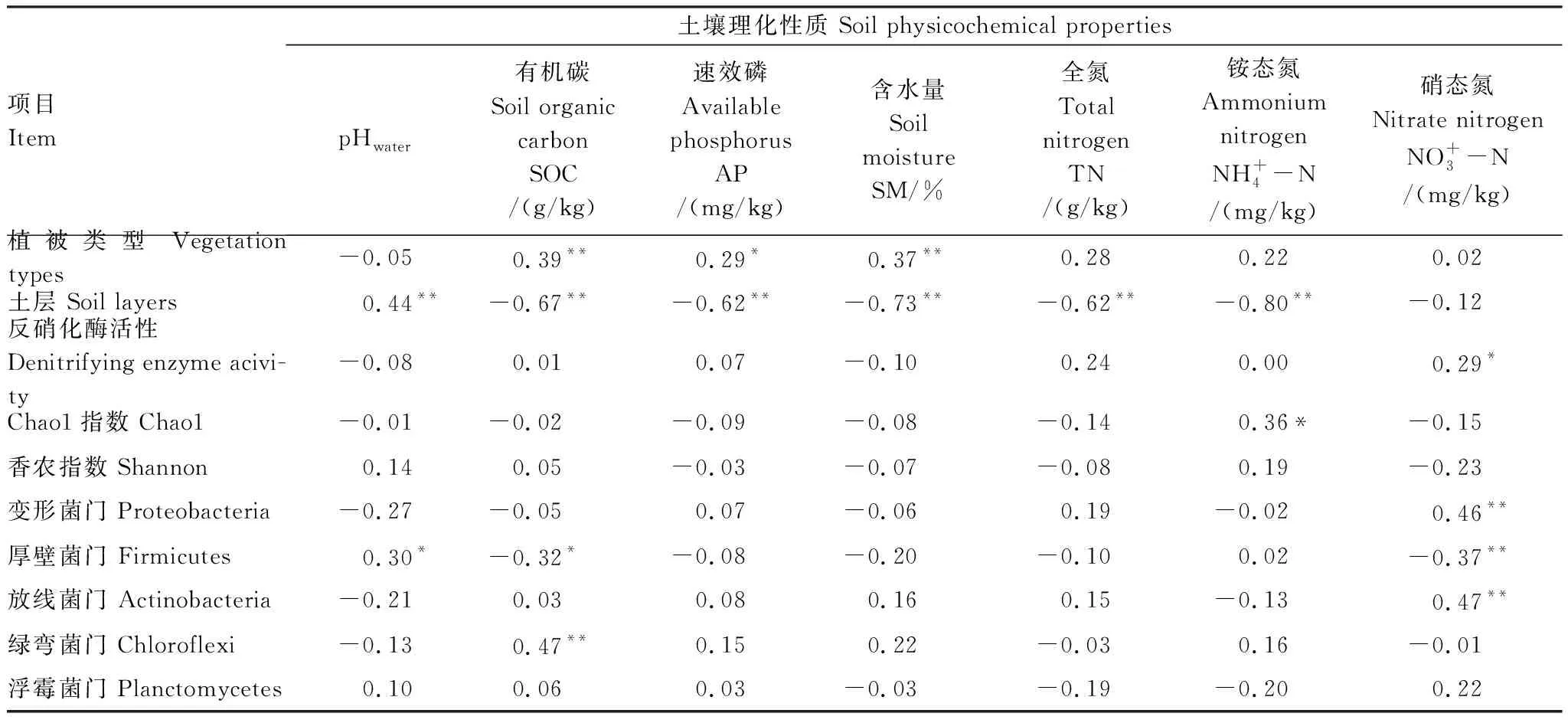
表4 文峪河上游河岸土壤反硝化酶活性、菌群多样性及优势菌群与土壤理化性质相关系数
*:在P≤0.05水平上差异显著,**:在P≤0.01水平上差异显著(Tukey 检验法)
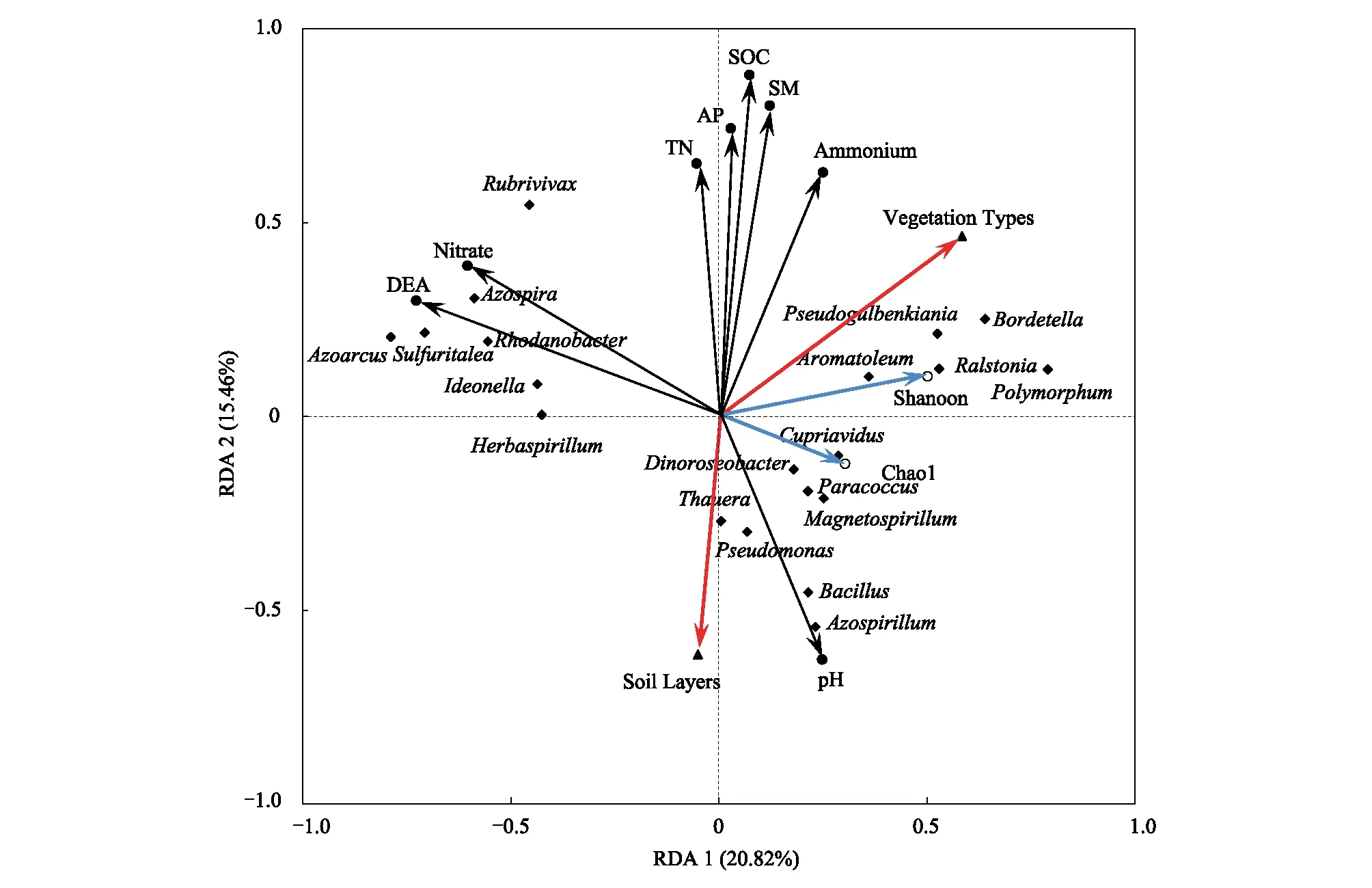
图6 文峪河上游河岸不同植被类型和土层土壤理化性质、反硝化菌群多样性及优势菌属的冗余分析Fig.6 RDA analysis of soil properties, denitrifiers diversiy and dominant taxas at genus level in different vegetation types and soil layers of upper Wenyuhe watershed 实心圆代表土壤理化因子;空心圆代表反硝化菌多样性指数;三角形代表处理方式;菱形代表反硝化菌优势属;SOC:土壤有机碳 Soil organic carbon;SM:土壤含水量 Soil moisture;AP:速效磷 Available phosphorus;TN:总氮Total nitrogen;DEA:土壤反硝化酶活性 Denitrifying enzyme acivity;Pseudomonas 假单胞菌属;Azpspria 固氮螺菌属;Azpsprillum 固氮螺菌属;Rubrivivax 红长命菌属;Rhodanobacter 罗河杆菌属;Azoarcus 固氮弧菌属;Sulfuritalea 硫针菌属;Polymorphum 多形菌属;Cupriavidus 贪铜菌属;Bacillus 芽孢杆菌属;Paracoccus副球菌属;Magnetospirillum 趋磁螺菌属; Thauera 陶厄氏菌属;Dinoroseobacter迪诺氏杆菌属;Herbaspirillum 草螺菌属;Ralstonia 劳尔氏菌属;Bordetella博德特氏菌属;Ideonella 艾德昂菌属
通过冗余分析可知(图6):土层深度与土壤总有机碳(SOC)、有效磷(AP)、土壤含水量(SM)、土壤总氮(TN)、土壤铵态氮和硝态氮含量呈极显著负相关关系,而与土壤pH值呈显著正相关关系;不同植物植被类型之间的土壤总有机碳(TOC)、有效磷(AP)、土壤含水量(SM)等土壤理化因子有明显的差异。红长命菌属(Rubrivivax)、固氮螺菌属(Azospira)、硫针菌属(Sulfuritalea)、罗河杆菌属(Rhodanobacter)、艾德昂菌属(Ideonella)、草螺菌属(Herbaspirillum)和固氮弧菌属(Azoarcus)等属受土壤硝态氮含量的影响较为显著,且对土壤反硝化酶活性的贡献值较大;贪铜菌属(Cupriavidus)、副球菌属(Paracoccus)、磁螺菌属(Magnetospirillum)、芽孢杆菌属(Bacillus)、固氮螺菌属(Azospirillum)、假单孢菌属(Pseudomonas)、陶厄氏菌属(Thauera)和迪诺氏杆菌属(Dinoroseobacter)等属受土层深度和土壤pH土壤值影响较为明显,对土壤反硝化菌群多样性贡献值较大;Pseudogulbenkiania属、博德特氏菌属(Bordetella)、多形菌属(Polymorphum)、劳尔氏菌属(Ralstonia)和Aromatoleum等属受植被类型差异影响较大。
3 讨论
目前,对文峪河上游河岸带植物群落类型及生态适应性[15]、演替分析与预测[4]以及群落环境梯度格局和演替过程[22]等方面研究较为深入,而对不同植被类型及土层土壤微生物多样性及功能等研究甚少。本研究对文峪河上游河岸带不同植被类型及土层土壤反硝化菌群多样性及群落组成和土壤反硝化酶活性进行了研究。结果表明:文峪河上游河岸带植被类型土壤反硝化菌群多样性及群落组成和土壤反硝化酶活性,不仅受地表植被类型差异的影响,还受土壤土层间环境因子差异的影响,二者之间存在互作效应。

土壤中反硝化菌群落数量及优势菌群会对土壤反硝化作用产生重要影响[32],在反硝化作用中发挥重要功能的微生物多属于异养、兼性厌氧细菌,如变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)等[33]。本研究结果表明:在文峪河上游河岸带不同植被类型土壤中,共有5个反硝化菌优势种群,即变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)。其中变形菌门(Proteobacteria)相对丰度最高,且在不同植被类型土壤中反硝化细菌群落组成大致相似,这与戴雅婷等[34]和牛晓燕等[35]研究结论相一致。另外,厚壁菌门(Firmicutes)属于五花草甸(WH)的优势菌群,放线菌门(Actinobacteria)属于沙棘灌木林(HR)和柳树灌木林(SSA)优势菌群,而浮霉菌门(Planctomycetes)仅在落叶松云杉混交林(LP)和云杉林(PM)土壤中被发现,表明处于不同演替阶段的植被类型土壤中存在各自独特的优势细菌类群[36]。
对不同植被类型土壤理化性质和优势菌群相关性分析和冗余分析得出:在门水平上,土壤反硝化菌群落组成及相对丰度与土壤pH、土壤有机碳(SOC)和硝态氮含量相关性显著,这说明这三个土壤理化性质影响影响土壤反硝化细菌优势类群相对丰度含量和群落组成。在属水平上,不同样本土壤反硝化细菌群落组成差异显著(表3),如在五花草甸(WH)土壤中芽孢杆菌属(Bacillus)和贪铜菌属(Cupriavidus)属于明显优势菌属,而在云杉林(PM)土壤中劳尔氏菌属(Ralstonia)、Aromatoleum属、贪铜菌属(Cupriavidus)属于明显优势菌属;同时,我们发现不同优势菌属在各样本中相对丰度差异显著,如假单孢菌属(Pseudomonas)在山杨白桦混交林(PQ)15—30 cm土层中相对丰度明显高于其他植被类型土层。这一研究结果充分表明,文峪河上游河岸带不同植被类型土壤中反硝化细菌优势菌群结构及组成因植被类群的不同而呈现出明显差异,这与柳春林等[37]研究结果相一致。
4 结论
结合植被类型演替分析得出,文峪河上游河岸带不同植被类型土壤反硝化菌群落结构和功能具有显著差异。土壤反硝化菌群多样性指数变化大致呈“W”型,即在演替初期五花草甸(WH)、演替中期山杨白桦林(PQ)和演替顶级云杉林(PM)土壤中反硝化菌群多样性较高;而土壤反硝化酶活性变化大致呈倒“V”型,即演替前中期沙棘灌木林(HR)和柳树灌木林(SS)土壤中反硝化酶活性及反硝化功能最强;不同土层间土壤反硝化菌群落结构和功能也存在显著差异,即0—15 cm土层土壤反硝化菌群多样性和反硝化酶活性显著高于15—30 cm土层。
文峪河上游河岸带植被类型土壤反硝化菌优势菌群主要隶属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)。不同植被类型不同土层土壤中反硝化细菌群落结构及组成差异显著,如浮霉菌门(Planctomycetes)仅在落叶松云杉混交林(LP)和云杉林(PM)15—30 cm土层中分布,有明显的特异性。表明植被类型和土层深度对土壤反硝化细菌群落结构及组成产生重要影响;而且土壤理化性质和优势菌群之间存在显著相关性,其中土壤pH、土壤有机碳、土壤铵态氮和硝态氮含量等环境因子是影响土壤反硝化细菌群落结构及组成的关键因子。
