miR-218-5p在胃癌细胞和胃癌组织中表达的临床意义及生物信息学分析*
2020-04-20杜正平李海龙刘春萍王转兄张雪燕
杜正平,李海龙,刘春萍,王转兄,张雪燕,顾 静,徐 燕
1.甘肃中医药大学临床医学院,甘肃兰州 730030;2.甘肃省中医方药挖掘与创新转化重点实验室,甘肃兰州 730030;3.甘肃省酒泉市第二人民医院检验科,甘肃酒泉 735000;4.甘肃省卫生职业学院医学检验系,甘肃兰州 730030;5.甘肃中医药大学基础医学院生理教研室,甘肃兰州730030;6.甘肃中医药大学学报编辑部,甘肃兰州 730030
微小RNA(miRNA)是近年来发现的内源性小型非编码RNA分子,其长度约为22个核苷酸,可通过直接诱导信使RNA(mRNA)降解或通过与靶mRNA 3′-非翻译区(3′-UTR)中的互补位点碱基配对而在动物和植物中发挥重要的基因调节作用[1]。miRNA参与细胞的发育、分化、增殖、迁移和应激反应等多种生理过程[2],其在体内的异常表达对肿瘤的发生、发展起着至关重要的作用。
miR-218是由miR-218-1和miR-218-2基因编码的内含子miRNA,位于肿瘤抑制基因SLIT2和SLIT3的内含子中[3]。ZARE等[4]发现,miR-218在胃癌中的表达呈现出缺失或者下调的状态;通过调节Robo1表达水平,miR-218可抑制肺癌细胞的迁移和侵袭[5];过表达miR-218可促进胆囊癌细胞的凋亡,恢复对吉西他滨的敏感性[6]。GUAN等[7]研究表明,miR-218在前列腺癌中低表达,过表达miR-218后可抑制肿瘤的迁移、上皮-间质转化和癌症干细胞特性。AHMADINEJAD等[8]通过计算机基因本体论和信号通路富集分析,阐明miR-218在人乳腺癌中的低表达与淋巴结转移和不良预后相关。虽有研究已阐明miR-218在胃癌细胞中的调控机制[9-10],但对其在不同分化程度细胞中的表达以及其调控的靶基因和对预后的影响进行系统研究的报道较少。因此,本研究将通过检测miR-218-5p在胃癌细胞和胃癌组织中的表达,分析其临床意义,并采用生物信息学方法,以明确其表达和意义,为胃癌的进一步研究提供线索。
1 材料与方法
1.1材料
1.1.1细胞株 胃癌细胞AGS、SGC-7901、MKN-45、MGC-803、BCG-823、HGC-27和正常胃黏膜上皮细胞GES-1购自中国科学院上海细胞库、北京协和肿瘤研究所细胞库和上海和元生物公司。
1.1.2组织标本 选取2009年10月至2010年4月甘肃省武威肿瘤医院接受手术治疗的37例胃癌患者作为研究对象,其中男21例,女16例;年龄35~76岁,中位年龄56岁。取胃癌及其周围组织标本(距离癌灶5 cm以上,且经HE染色证实均无癌细胞)进行研究,其中癌组织标本37例,癌旁组织标本37例。取材后,立即放入液氮中并转入-80 ℃长期保存。以上患者均有完整的临床资料,包括姓名、性别、年龄、肿瘤直径、肿瘤部位、分化程度、浸润深度、TNM分期及淋巴结转移情况等。所有患者术前均未接受过放、化疗。
1.2仪器与试剂 高糖DMED培养基(GE Healthcare Life sciences公司),胎牛血清(浙江天杭生物科技股份有限公司),RNA裂解液RNAiso Plus(Takara Bio公司),反转录试剂盒(All-in-OneTMmiRNA First-Strand cDNA Synthesis Kit,广州复能基因公司),内参照U6特异引物(美国GeneCopoeiaTM公司,序列编号HmiRQP9001),通用引物(Takara Bio公司,编号D350A),miR-218特异引物(美国GeneCopoeiaTM公司,序列编号HmiRQP0327),超微量分光光度计(P100+,Putton公司),实时定量PCR仪(LightCycler 9600,罗氏公司)。
1.3方法
1.3.1细胞培养 细胞在DMEM培养基中培养,补充10%胎牛血清和1%青霉素/链霉素,并在37 ℃、5%CO2中温育。细胞换液间隔时间为2~3 d,当细胞覆盖率达到培养皿底部的70%~80%时进行胰酶消化后传代。
1.3.2实时荧光定量PCR 根据制造商的说明,用Trizol试剂从培养的细胞和组织中提取总RNA,用反转录试剂盒合成cDNA。反转录过程在37 ℃ 60 min,85 ℃ 5 min这一条件下完成,将吸光度(A260/280)为1.8~2.2的标本置于-80 ℃冰箱,用于后续试验。PCR循环参数:预变性95 ℃ 10 s,变性95 ℃ 10 s,退火60℃ 20 s,共40个循环。完成扩增后进行熔解曲线分析,内参基因为U6,采用2-ΔΔCt法计算各组间miRNA水平的表达差异,试验重复3次。
1.3.3miR-218-5p的靶基因和靶基因富集信号通路分析 运用miRecords网站(http://c1.accurascience.com/miRecords/index.php)中的生物信息学软件对miR-218-5p潜在的靶基因进行预测,取其交集,使用DAVID6.7数据库对所获得的靶基因进行KEGG Pathway通路富集分析。
1.3.4miR-218-5p胃癌组织的表达和生存期分析 基于OncomiR数据库,分析miR-218-5p在胃癌细胞和正常胃黏膜上皮细胞中的表达,并利用cBioportal网站对其进行预后分析。
2 结 果
2.1胃癌细胞与正常胃黏膜上皮细胞中miR-218-5p水平的比较 正常胃黏膜上皮细胞GES-1中miR-218-5p水平为1.00±0.03,miR-218-5p在不同分化程度的胃癌细胞MKN-45、SGC-7901、MGC-803、BCG-823、HGC-27、AGS表达水平分别为0.15±0.04、0.34±0.03、0.26±0.06、0.10±0.01、0.23±0.05、0.03±0.02,低于正常胃黏膜上皮细胞,差异均有统计学意义(t=30.611、27.344、18.963、52.713、21.878、46.982,P<0.01)。
2.2胃癌组织和癌旁组织中miR-218-5p的表达 与癌旁组织比较,有2例患者胃癌组织中miR-218-5p表达上调,35例表达下调,差异有统计学意义(P<0.05),见图1。进一步进行临床病理参数分析发现,miR-218-5p在胃癌组织中的表达与淋巴结转移(P<0.001)和TNM分期(P<0.001)有关,而与年龄、性别、癌细胞分化程度、淋巴管转移、静脉转移、Borrmann分型、浸润深度无关,见表1。

图1 miR-218-5p在胃癌组织相对于癌旁组织中的表达情况
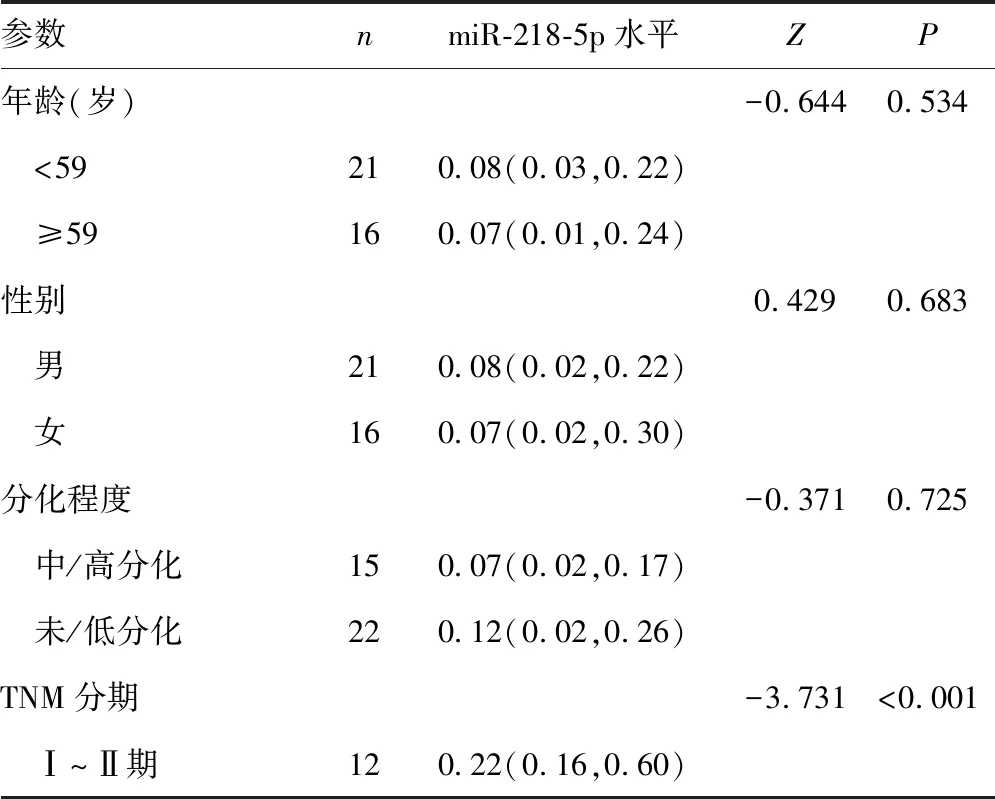
表1 miR-218 -5p在胃癌组织中的表达与临床病理参数的关系[M(P25,P75)]

续表1 miR-218 -5p在胃癌组织中的表达与临床病理参数的关系[M(P25,P75)]
2.3miR-218-5p的靶基因预测和靶基因富集的生物信息学分析 生物信息学分析结果可见,miR-218-5p的预测靶基因富集在60个信号通路中,其中与肿瘤密切相关的有30个,涉及多种肿瘤凋亡、细胞周期、增殖、代谢、侵袭转移以及多个关键的信号通路,见表2。

表2 miR-218-5p预测靶基因富集信号通路分析

续表2 miR-218-5p预测靶基因富集信号通路分析
2.4基于OncomiR数据库对miR-218-5p在胃癌中的表达及预后的生存分析 经OncomiR数据库(http://www.oncomir.org)检索发现,miR-218-5p在胃癌组织中的表达显著低于癌旁组织中的表达(P=3.10×10-3),见图2。为分析miR-218-5p在胃癌中的表达与预后之间的关系,本研究使用此数据库进一步分析了miR-218-5p在胃癌中的表达与生存期的关系。结果发现,miR-218-5p低表达患者其生存期显著短于表达正常患者(P=0.016 32),见图2。使用cBioportal(http://cbioportal.org)工具并对其进行Kaplan-Meier分析,结果显示,黏液腺癌(n=72)、乳头状腺癌(n=22)和弥漫型腺癌(n=8)患者中,低表达组的总生存期(OS)短于对照组(P=0.048),见图3。
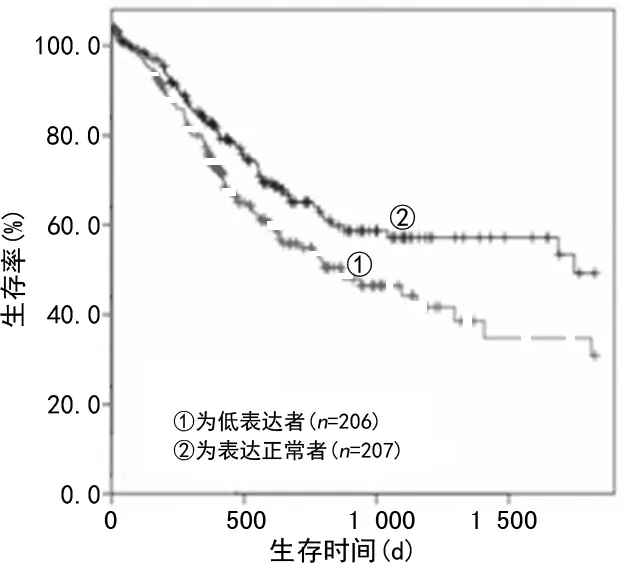
图2 利用OncomiR数据库分析miR-218-5p在胃癌中的表达与预后的关系

图3 利用cBioportal工具分析miR-218-5p表达与预后的关系
3 讨 论
近年来,通过研究miRNA在癌症中的表达及作用,越来越多的人对基因调控有了全新的认知[11]。miRNA在肿瘤的发生、发展中发挥作用,是一种重要的调节因子[12]。大量研究表明,不同类型癌症中异常表达的miRNA在肿瘤的发生、发展、侵袭和转移等生物过程发挥重要作用,可作为肿瘤患者预后分析的生物标志物[13-16]。
miR-218可以作为肿瘤抑制因子,在体内表达下调。多项报道指出,miR-218可抑制食管癌[17]、宫颈癌[18]、神经胶质瘤[19]、膀胱癌[20]、卵巢癌[21]和胃癌[22]等癌细胞的增殖、侵袭、迁移、上皮细胞-间充质转化、淋巴结转移和自我更新。此外,miR-218在一些造血系统疾病,如急性早幼粒细胞白血病(APL)中也表达下调,且其差异表达与APL的临床特征密切相关[23]。成熟的miR-218被剪切成miR-218-5p和miR-218-3p,miR-218-3p有两个亚型,分别为miR-218-1-3p和miR-218-2-3p。在本研究中,miR-218-5p在不同分化程度胃癌细胞中的表达明显低于正常胃黏膜GES-1细胞,此外,PCR显示,miR-218-5p在胃癌组织中的表达水平明显低于胃癌旁组织,这与较多报道结果一致[24-26],也与OncomiR数据库miR-218-5p的表达结果一致。临床病理参数分析发现,miR-218-5p在胃癌中的低表达,与肿瘤的淋巴结转移、TNM分期有关(P<0.001),而与年龄、性别、分化程度、静脉转移及Borrmann分型无相关性(P>0.05)。有研究表明,甘肃省武威地区为胃癌高发地区[27],且本研究标本来源于武威地区的患者,代表性强。部分研究表明,miR-218-5p通过靶向调控ROBO1、LASP1、WASF3、血管生成素-2等调节胃癌细胞的增殖、分化以及凋亡[28-30]。然而,还有更多的靶基因尚未得到验证,因此,本研究通过在miRecords网站上预测其靶基因并进行信号通路富集分析,结果显示,60个信号通路中,与肿瘤相关的信号通路有30个,包括PI3K-Akt、ErbB、Wnt、mTOR等涉及多种肿瘤细胞凋亡、增殖、代谢、侵袭、转移以及多个关键的信号通路。此外,为分析miR-218-5p和miR-218-3p两个亚型在胃癌中的表达与其预后之间的关系,本研究使用了OncomiR数据库和cBioportal工具对其进行预后分析,结果显示miR-218-5p在胃癌中的表达与胃癌患者OS具有显著相关性,miR-218-5p低表达患者其生存期时间显著短于表达正常患者(P=0.016 32)。且在黏液腺癌、乳头状腺癌和弥漫型腺癌患者中,低表达组的OS短于对照组(P=0.048)。本研究结果为miR-218-5p的功能研究提供了新的思路,该标志物可能成为胃癌新的治疗靶点和预后标志物。
