miR-125b通过TLR4/NF-κB信号通路对心脏成纤维细胞增殖和迁移的影响
2020-04-20余宝刚
万 琦,余宝刚
(河北医科大学附属唐山工人医院急诊内科,河北 唐山 063000)
心肌梗死发生心力衰竭的主要因素为心肌纤维化和心室重构的发展,抑制心肌成纤维细胞活化对延缓心肌梗死纤维化以及不良重塑过程具有重要意义。miRNA通过复杂的网络调控心肌梗死后心肌纤维化和心室重构过程[1]。miR-125b具有多种生物学功能,研究[2]发现:miR-125b在成纤维细胞中表达水平升高,可促进心脏成纤维细胞增殖,参与心肌纤维化进程。炎症反应在心肌纤维化的过程中具有重要作用,在炎性因子的作用下,心肌组织发生纤维化,心肌纤维化进一步促进炎性因子的分泌,形成恶性循环[3]。Toll样受体4(Toll-like receptor 4,TLR4)/核因子κB (nuclear factor-κB,NF-κB)是与炎症反应关系密切的信号通路,Toll样受体(Toll-like receptor,TLR)是免疫系统与心血管疾病发展之间的桥梁,TLR4是其中与心血管疾病关系最密切的因子,是介导心肌炎症的重要受体,其活化可增加NF-κB的表达量,引起一系列因子表达[4]。miR-125b和TLR4/NF-κB在心肌纤维化中的作用均已被证实,但miR-125b参与心肌纤维化进程是否与TLR4/NF-κB通路有关尚不十分清楚。本研究观察miR-125b对心脏成纤维细胞增殖、迁移和TLR4/NF-κB信号通路的影响,探讨miR-125b在心肌纤维化中的作用机制。
1 材料与方法
1.1 细胞、主要试剂和仪器心脏成纤维细胞系HEH2(上海心语生物科技有限公司)。兔抗人Ⅰ型胶原蛋白(type Ⅰcollagen,Col Ⅰ)单克隆抗体、兔抗人Ⅲ型胶原蛋白(type Ⅲ collagen,Col Ⅲ)单克隆抗体和兔抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体、兔抗人TLR4单克隆抗体和兔抗人NF-κB单克隆抗体(美国BPB公司),逆转录聚合酶链式反应 (RT-PCR)试剂盒、反转录试剂盒、TRIzol试剂和ECL化学发光试剂盒(美国Santa Cruz公司),MTT试剂、DMEM培养基、脂质体Lipofectamine 2000和胰蛋白酶(美国Sigma公司),阴性对照 inhibitors和miR-125b inhibitors[生工生物工程(上海)有限公司]。Multiskan FC酶标仪(美国Thermo公司),PCR成像仪(型号JS-680D,上海培清科技有限公司), WB显影仪(型号Tanon-5200,上海天能科技有限公司),金属浴(型号TU-100,上海一恒科技有限公司)。
1.2 HEH2细胞培养取液氮罐中的心脏成纤维细胞HEH2,快速转移到37℃水浴中,待细胞完全融化后加入含胎牛血清(fetal bovine serum,FBS)的DMEM细胞生长液混匀,转移到离心管中,1 000 r·min-1离心10 min,弃去上清液,加入DMEM悬浮细胞,将悬浮后细胞接种到细胞培养板中培养48 h。待细胞达90%以上融合时倒掉培养液,PBS洗涤,加入胰蛋白酶消化细胞,将消化后细胞移到离心管中,1 000 r·min-1离心10 min,弃去上清液,加入PBS洗涤细胞沉淀,加入DMEM培养液混匀后接种到培养板中培养。2 d传代1次,取第3代细胞进行后续研究。
1.3 HEH2细胞分组和转染将对数生长期的HEH2细胞随机分为空白对照组、阴性对照组和miR-125b inhibitors组。将阴性对照inhibitors和miR-125b inhibitors加入到EP管中,加入100 μL无核酸酶水,分装备用。将对数生长期的HEH2细胞加入胰蛋白酶消化,加入不完全培养液(不含FBS),接种到细胞培养板中培养1 h,将阴性对照inhibitors和miR-125b inhibitors与不完全培养基混合均匀,静置6 min,作为A液。将转染试剂Lipofectamine 2000和不完全培养基混合均匀孵育20 min,作为B液,将A液和B液混合均匀。miR-125b inhibitors组HEH2细胞中加入含miR-125b inhibitors的混合液,阴性对照组HEH2细胞中加入含阴性对照inhibitors的混合液,空白对照组HEH2细胞不进行转染。转染后培养6 h后更换完全培养基(含FBS)继续进行培养。
1.4 HEH2细胞中miR-125b水平测定取各组转染后24 h的HEH2细胞,每组设7个复孔,加入TRIzol细胞裂解液裂解细胞,3 min后反复吹打细胞,将细胞裂解液转移到新的EP管中,加入氯仿振荡15 s,放置5 min后,12 000 r·min-1离心15 min,取上层水相层到新的EP管中,加入异丙醇混匀,静置10 min,12 000 r·min-1离心15 min,弃去上清液,加入乙醇混匀,10 000 r·min-1离心10 min,弃去上清液,加入DEPC溶解RNA,紫外分光光度计测定RNA浓度,将RNA反转录合成miR-125b的cDNA,采用RT-PCR法测定细胞中miR-125b水平,PCR反应条件:95℃、30 s,95℃、5 s,58℃、30 s,共42个循环。以2-ΔΔCt法计算细胞中miR-125b水平。
1.5 HEH2细胞增殖活性测定取各组转染后HEH2细胞培养至对数生长期,每组设7个复孔,在细胞中加入胰蛋白酶消化细胞,1 000 r·min-1离心10 min,弃去上清液,在细胞沉淀中加入培养液将细胞密度调整为5×104mL-1,接种到96孔细胞培养板中培养,每天在每孔中加入20 μL MTT溶液孵育4 h,吸去上清液,加入DMSO溶液混匀,酶标仪测定每孔吸光度(A)值,以A值表示细胞增殖活性。
1.6 HEH2细胞迁移能力测定取各组转染后HEH2细胞培养至对数生长期,每组设7个复孔,细胞中加入胰蛋白酶消化细胞,加入不含FBS的培养液,接种到细胞培养板中培养24 h。取Transwell小室,在上室中加入不含FBS的培养液,下室加入含FBS的培养基孵育1 h,收集HEH2细胞,将细胞浓度调整为2×105mL-1,取100 μL细胞悬液加入到Transwell小室上室,将600 μL含FBS的DMEM培养液加入到小室下室,孵育4 h,小室上层膜用PBS洗涤,甲醛固定,结晶紫染色,棉签擦掉附着细胞,观察细胞迁移情况,计数迁移细胞数。
1.7 HEH2细胞中Col Ⅰ、Col Ⅲ、α-SMA、TLR4和NF-κB蛋白表达水平测定取各组转染48 h的细胞,每组设7个复孔,在细胞中加入裂解液,冰上裂解30 min,10 000 r·min-1离心10 min,将上清液转移到新的EP管中,采用BCA法测定蛋白浓度,取蛋白样品和Loading Buffer混合,在100℃孵育器上孵育5 min使其变性,取50 μL蛋白样品加入上样孔中,电泳30 min,经转膜、封闭,加入一抗过夜孵育,以β-actin为内参照,加入二抗封闭1 h,化学发光,显影,采用FluorChem Q多功能成像和分析系统采集图像,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白灰度值/β-actin灰度值。

2 结 果
2.1 各组HEH2细胞中miR-125b水平miR-125b inhibitors组HEH2细胞中miR-125b水平(0.41±0.06)低于空白对照组(0.00±0.08)和阴性对照组(0.97±0.09)(P<0.05),空白对照组和阴性对照组HEH2细胞中miR-125b水平比较差异无统计学意义(P>0.05)。
2.2 各组HEH2细胞增殖活性培养1、3和5 d后miR-125b inhibitors组HEH2细胞增殖活性低于空白对照组和阴性对照组(P<0.05);空白对照组和阴性对照组HEH2细胞增殖活性比较差异无统计学意义(P>0.05)。见表1。
表1 各组HEH2细胞增殖活性
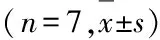

GroupProliferation activity(t/d) 135Blank control 0.153±0.0120.584±0.0181.184±0.036Negative control 0.151±0.0100.579±0.0191.178±0.034MiR-125b inhibitors 0.132±0.009∗△0.423±0.016∗△0.745±0.028∗△F8.680187.021411.267P0.002<0.01<0.01
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group.
2.3 各组HEH2细胞迁移数miR-125b inhibitors组HEH2细胞迁移数(56.47±11.04)低于空白对照组(114.21±15.02)和阴性对照组(112.16±14.23)(P<0.05);空白对照组和阴性对照组HEH2细胞迁移数比较差异无统计学意义(P>0.05)。见图1(插页三)。
2.4 各组HEH2细胞中ColⅠ、Col Ⅲ和α-SMA蛋白表达水平miR-125b inhibitors组HEH2细胞中ColⅠ、Col Ⅲ和α-SMA蛋白表达水平低于空白对照组和阴性对照组(P<0.05);空白对照组和阴性对照组HEH2细胞中ColⅠ、Col Ⅲ和α-SMA蛋白表达水平比较差异无统计学意义(P>0.05)。见表2和图2。
表2 各组HEH2细胞中ColⅠ、Col Ⅲ和α-SMA蛋白表达水平
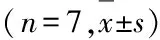

GroupCol Ⅰ Col Ⅲ α-SMA Blank control 0.34±0.080.27±0.040.75±0.12Negative control 0.35±0.070.28±0.050.77±0.13MiR-125b inhibitors 0.18±0.05∗△0.11±0.03∗△0.38±0.11∗△F13.84838.22023.339P<0.01<0.01<0.01
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group.

Lane 1:Blank control group;Lane 2:Negative control group;Lane 3:MiR-125b inhibitors group.
图2 各组HEH2细胞中Col Ⅰ、Col Ⅲ和α-SMA蛋白表达电泳图
Fig.2 Electrophoregram of expressions of Col Ⅰ,Col Ⅲ and α-SMA proteins in HEH2 cells in various groups
2.5 各组HEH2细胞中TLR4和NF-κB蛋白表达水平miR-125b inhibitors组HEH2细胞中TLR4和NF-κB蛋白表达水平低于空白对照组和阴性对照组(P<0.05),空白对照组和阴性对照组HEH2细胞中TLR4和NF-κB蛋白表达水平比较差异无统计学意义(P>0.05)。见表3和图3。
3 讨 论
急性心肌梗死是冠状动脉急性缺血或者血流中断引起的心肌坏死,心肌梗死进展为心力衰竭的重要病理过程为心室重构,心室病理性重构为心肌细胞和细胞外基质发生适应不良性改变所引起,包括心室形态、组织结构、大小和功能状态的改变,心室病理性重构是影响心肌梗死预后的主要因素[5]。
表3 各组HEH2细胞中TLR4和NF-κB蛋白表达水平
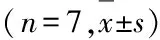
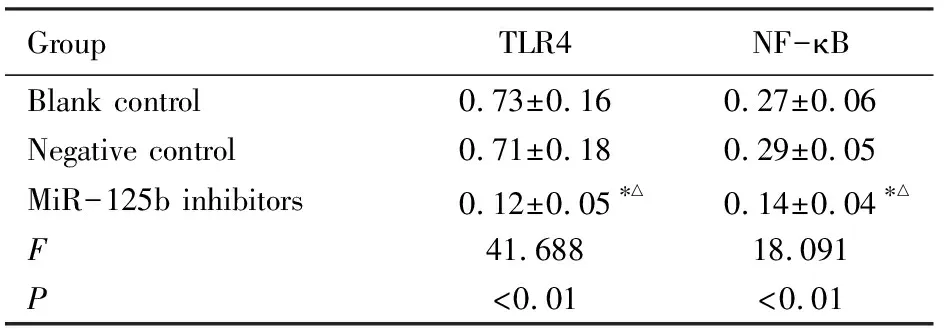
GroupTLR4 NF-κBBlank control 0.73±0.160.27±0.06Negative control0.71±0.180.29±0.05MiR-125b inhibitors 0.12±0.05∗△0.14±0.04∗△F41.68818.091P<0.01<0.01
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group.
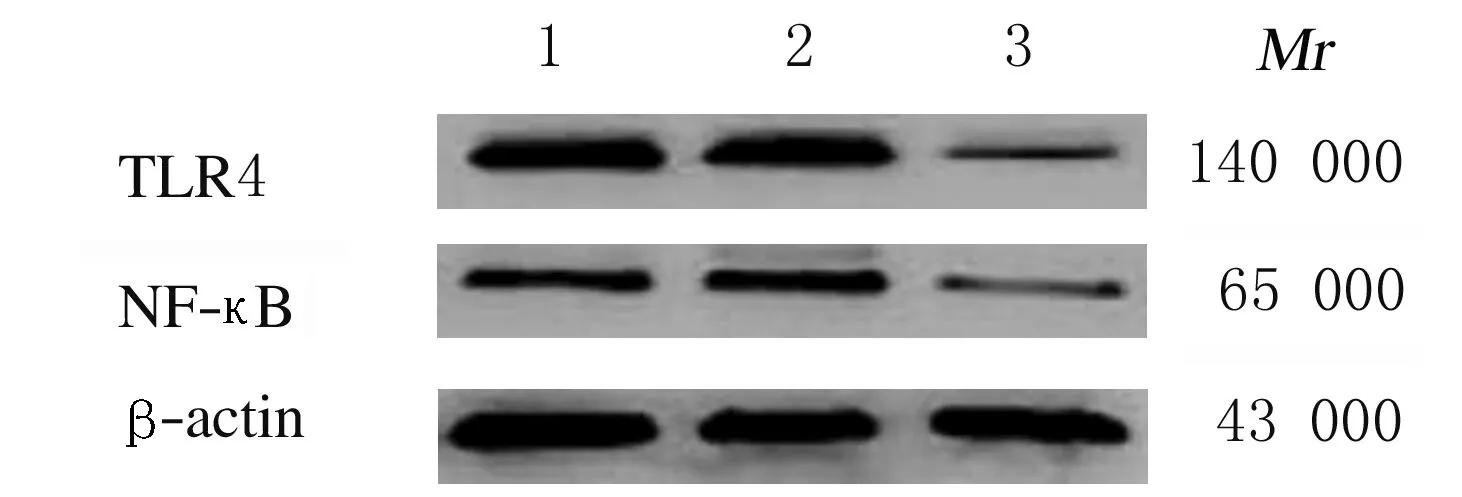
Lane 1:Blank control group;Lane 2:Negative control group;Lane 3:MiR-125b inhibitors group.
图3 各组HEH2细胞中TLR4和NF-κB蛋白表达电泳图
Fig.3 Electrophoregram of expressions of TLR4 and NF-κB proteins in HEH2 cells in various groups
心肌纤维化的关键效应细胞为心脏成纤维细胞,心脏成纤维细胞在心肌细胞外基质形成中具有关键性作用,心肌纤维化加速的重要机制为心脏成纤维细胞的增殖和活化。心肌梗死后心肌细胞分泌白细胞介素1、白细胞介素6和肿瘤坏死因子α等促炎性细胞因子,并分泌去甲肾上腺素和血管活性因子等多种因子,影响心脏成纤维细胞与其分化为肌成纤维细胞之间的平衡状态,使心脏成纤维细胞分化成肌成纤维细胞,使其处于活化状态[6]。肌成纤维细胞特征性分泌α-SMA蛋白,并且具有更强的分泌ColⅠ和Col Ⅲ的能力,Col Ⅰ、Col Ⅲ和α-SMA是引起心肌纤维化的主要原因[7]。因此抑制心脏成纤维细胞增殖和活化是减轻心肌梗死后心肌纤维化及心室不良重构的关键。
miRNA是无编码功能的单链小分子RNA,由约22个核苷酸组成,在各种生物体中广泛存在,可通过与靶基因的mRNA 3′非编码区互补配对,通过形成RNA诱导的沉默复合体促进靶基因mRNA的降解或者抑制其翻译,对靶基因的表达发挥负调控作用,抑制其表达,从而发挥生物学作用[8-9]。在心肌梗死后心力衰竭的进程中存在miRNA的异常表达和慢性炎症激活,miRNA通过与mRNA靶点部分结合,在转录水平上抑制蛋白的合成,从而参与心力衰竭的炎症通路过程,调节心肌肥大和心力衰竭等心脏疾病的发生发展过程[10]。miR-125b在多种疾病的发生发展中发挥作用[11-13],在恶性肿瘤中发挥癌基因和抑癌基因作用,在恶性肿瘤组织中高表达可通过促进肿瘤细胞增殖和迁移、抑制抑癌基因活性和肿瘤细胞凋亡发挥癌基因作用;miR-125b在乳腺癌和肺癌等组织中低表达,发挥抑癌基因作用[14-15]。miR-125b在心肌纤维化进程中也发挥重要作用[11]。沈志方等[16]研究发现:miR-125b可通过TGF-β1/Smad信号通路参与心肌纤维化进程;别自东等[17]通过对心肌梗死模型小鼠研究发现:miR-125b通过作用于分泌型卷曲相关蛋白5调节急性心肌梗死后心室重构。本研究结果显示:下调HEH2细胞中miR-125b水平可抑制HEH2细胞的增殖和迁移能力,降低细胞中Col Ⅰ、Col Ⅲ和α-SMA蛋白表达水平。本研究结果与上述研究结果一致,表明下调miR-125b水平可抑制心脏成纤维细胞增殖和迁移,抑制心脏成纤维细胞活化,从而抑制心肌纤维化进程。
心肌梗死后心力衰竭过程存在慢性炎症激活,TLR4/NF-κB信号通路在心力衰竭炎症中被广泛研究[18]。白细胞介素和肿瘤坏死因子等促炎细胞因子参与心力衰竭的炎症反应过程,多种促炎因子和TLR4/NF-κB等信号通路导致心肌细胞凋亡、纤维化和心肌细胞肥大,炎症反应激活、炎症通路中间因子激活与疾病进展之间形成复杂的病理网络,最终引起心肌功能减退,引起心力衰竭的发生[19-20]。miRNA通过抑制蛋白合成参与心肌梗死后心力衰竭的炎症通路过程,从而调节心力衰竭的发生发展过程。miR-125b是否通过TLR4/NF-κB信号通路调控心肌纤维化的发生尚不十分清楚,本研究结果显示:下调miR-125b水平可降低心脏成纤维细胞中TLR4和NF-κB蛋白表达水平,表明下调miR-125b可抑制HEH2细胞中NF-κB信号通路的激活。下调miR-125b可能通过抑制TLR4/NF-κB信号通路抑制促炎细胞因子的分泌和炎性反应的激活,从而抑制心脏成纤维细胞的增殖和活化、心肌纤维化进程及心肌重构和心力衰竭的发生发展。
综上所述,下调心脏成纤维细胞中miR-125b水平可通过抑制TLR4/NF-κB信号通路抑制细胞增殖和活化,本研究为心肌纤维化的治疗提供了新的思路。但本研究仅探讨了下调miR-125b对TLR4/NF-κB信号通路的影响,有关miR-125b对TLR4/NF-κB信号通路及其下游炎性因子的具体调控过程需进一步深入研究。
