开农系列高油酸花生遗传多样性分析
2020-04-20郭敏杰殷君华邓丽苗建利李阳芦振华房元瑾李绍伟任
郭敏杰殷君华邓 丽苗建利李 阳芦振华房元瑾李绍伟任 丽
(开封市农林科学研究院,河南 开封 475004)
花生(ArachishypogaeaL.)是一种重要的豆科类作物,主要种植于亚洲、非洲和美洲等一百多个国家。花生作为我国第二大油料作物,全国总产为1.74亿t[1]。油酸是影响花生油化学稳定性和营养价值的重要品质指标之一,高油酸花生的油酸含量在70%以上,具有许多优点,如能够提高花生及其制品的耐贮藏性,显著延长其货架期[2],还能降低患心血管疾病的风险[3-4],另外高油酸花生的脂肪酸组成非常接近橄榄油,物美价廉。提高花生及其制品的油酸含量是改进产品营养价值和保障质量安全的关键。
自1987年第一个高油酸花生突变体F435被发现之后[5],高油酸育种已经成为了当前我国花生品质改良研究的重要方向。截止2018年底,我国高油酸花生品种高达50余个,其中开农系列高油酸花生培育较早[6],由开农30×开选016这一组合培育了一大批高油酸花生新品种和材料,开农30为普通型中早熟大果花生品种,开选016为重要的高油酸花生供体材料,油酸含量分别为45.71%和76.02%,二者具有较高的配合力。目前,有关高油酸花生品种间遗传差异性方面的研究较少,采用SSR 标记分析开选016衍生的开农系列高油酸花生品种间的遗传多样性研究还未见报道。Simple sequence repeat (SSR) 具有稳定性好、多态性高等优点,是构建遗传图谱和DNA指纹图谱、杂交种鉴定的首要标记,利用SSR 标记分析品种间的遗传差异性已被广泛应用于花生、水稻等多个作物中[7-9]。区分品种间的遗传差异性时,传统上的表型性状不能满足亲缘关系相近的品种的遗传变异分析,然而,SSR 标记为在基因组水平上鉴定不同品种间的差异提供了新的方法。
本研究首次以开农系列高油酸花生为例,利用SSR多态性分子标记分析其品种间的遗传多样性。对亲本及衍生高油酸品种在表型和基因组水平上进行双向分析,旨在揭示开农系列高油酸花生品种的遗传学基础,为深入开展高油酸花生育种研究提供参考,同时为种子真实性鉴定及纯度检测和品种知识产权保护提供理论依据和技术支撑。
1 材料和方法
1.1 试验材料及设计
各品种在河南省开封市(114°27′E,34°77′N)种植,采用随机区组排列试验设计[10],3次重复,每品种种植3行,行长6.67m,宽2.00m,穴距20cm,每穴1 粒。试验田肥力中等、排灌方便、地形平坦,土质为沙壤土。花生生育期间及时进行中耕锄草、浇水、治虫,成熟后及时收获、考种。品种类型、系谱等见表1。

表1 品种的名称、类型、系谱和审定Table 1 Name,type,pedigree and certification situation of the varieties
1.2 农艺性状调查
根据花生新品种DUS的检测原理和技术[17]对包含主茎高、侧枝长、分枝数、结果枝数、单株结果数、单株生产力、叶长、叶宽、荚果长、百果质量、百仁质量和出米率等19个农艺性状进行了调查。
1.3 品质检测
使用近红外分析仪Perton DA7250 进行品质检测,包括蛋白质含量、脂肪含量、油酸含量、亚油酸含量和油酸与亚油酸之比(O/L)。
1.4 DNA 提取和SSR 引物
利用改良的CTAB 法[11]从生长三周的花生嫩叶(约100 mg)中提取基因组DNA。在1%浓度的琼脂糖凝胶上评估DNA 的质量。DNA 样品储存在-20℃。本研究中使用的217对SSR 引物序列均从Kazusa Marker 数据库(http://marker.kazusa.or.jp/)和其他研究中获得[12-16],由生工生物工程(上海)股份有限公司合成。利用MapChart 2.2获得了一个包含20个连锁群、总长为2087 cM 的密度均匀且准确度好的栽培种花生遗传图谱。20个连锁群的长度范围在61.8 cM~173.6 cM 之间,每个连锁群的标记数在8~18个之间,标记间的平均距离为10 cM (图1)。
1.5 PCR 扩增及电泳
PCR反应在10μL的体系中进行,包含1μL 10×EasyTaqBuffer,0.8μL 2.5mmol·L-1dNTP,0.6μL 10mol·L-1正向和反向引物,0.1μL 5 units×Easy Taq DNA聚合酶,1μL 50 ng·L-1DNA 和6.5μL ddH2O。除引物和DNA 模板外,所有试剂均购自天根生化科技(北京)有限公司。PCR扩增程序:预变性95℃ 5min;变性94℃ 45s,退火53~66℃ 45s,延伸72℃ 45s,循环数34;延伸72℃ 10 min。PCR产物用8%聚丙烯酰胺变性凝胶电泳分离。电泳结束后进行银染显色,在含有10%乙醇和0.2%AgNO3的凝胶银染8 min,去离子水中洗涤5~10s。最后将平板凝胶放入含有1%NaOH 和0.5%甲醛的去离子水中5~8 min显色。
1.6 数据分析
利用Microsoft Excel 2010整理和计算表型及产量数据。运用基于Genstat18th Edition 软件进行单因素方差分析。统计每份材料扩增的条带,与母本相同的带型记为“1”,与父本相同的带型记为“2”,不同于双亲的带型记为“3”,缺失带型记为“0”。建立数据库,分别计算双亲对衍生高油酸品种的遗传贡献率和品种间的遗传相似系数。遗传贡献率=与亲本相同条带数/总条带数。遗传相似系数=2Nij/(Ni+Nj)。Nij指任意两个品种之间共有的等位基因条带数,Ni和Nj分别是品种i和j的条带数的总和。
2 结果与分析
2.1 品种间农艺性状比较分析
农艺性状调查结果显示,所有品种均为连续开花,叶片椭圆形,花冠黄色,荚果网纹中等深度,种皮浅红色。区别在于开选016的荚果为茧形,籽仁圆形,株型半蔓,开农30及姊妹系的荚果为普通形,籽仁椭圆形,株型直立。荚果和籽仁表型差异如图2所示。
表2所示,开农1760的主茎和侧枝最小,除开农306外,开农1760与其他品种差异达显著水平;开选016总分枝数高达24.92个,远多于开农30及其后代品种,但单株生产力最小,为24.97g,叶长和荚果长最小,分别为4.87 cm 和2.47 cm,与其他品种相比差异显著;开农1768结实枝数和单株结果数最多;开农30的百果质量和百仁质量最大,开选016最小;不同品种之间出仁率差异较大,其中开农1760最高为75.23%。两亲本之间在总分枝数、单株生产力、叶长、荚果长、百果质量、百仁质量和出仁率方面差异显著。综上所述,两个亲本之间在产量性状方面差异显著;开农1768的总分枝数、结实枝数和单株结果数最多,叶长、荚果长、百果质量和百仁质量最小;开农1715的单株生产力、荚果长、百果质量和百仁质量最大;开农61和开农1760之间性状差异最大,开农1768和开农306之间性状差异最小。
2.2 亲本与高油酸花生姊妹系的品质检测比较
对亲本和8个姊妹系品质性状进行测定(表3),结果表明姊妹系的蛋白质含量24.48%~27.21%,含油量52.05%~52.98%,油酸含量为73.47%~81.38%,油亚比为6.27~21.78,棕榈酸含量为5.33%~6.29%。显著性检验结果显示,开农30的油酸含量和油亚比最低,与开选016和8个姊妹系相比差异显著。


图2 品种间荚果和籽仁的表型差异Fig.2 Differences in phenotype of pods and seeds between the peanut varieties

表2 花生品种间的表型变异Table 2 Phenotypic variation of the peanut cultivars

表3 花生品种的品质检测Table 3 The quality values of peanut cultivars
2.3 分子标记多态性和特异性位点检测
利用均匀分布于花生基因组上的217对SSR引物检测两个亲本间的多态性,其中32对具有多态性性,分析姊妹系在基因组水平上的遗传差异,结果见表4。8个品种中有3个具有特征性条带,仅用一对引物就可将其与其他品种区分开,引物PM50、AhTE0129、pPGPseq3A8分别在开农58、开农1715、开农71基因组中扩增到特异性遗传位点(图3)。品种间进行比较显示,开农1760可用2 对 引 物pPGPseq3A8 与 GA110 或pPGPseq4F1或Seq7G02鉴别出来;开农61可用2对引物PM434和AHGS2111或AhTE1029鉴别出来;开农176可用3对引物AhTE0129、Seq3E10和PM434 或Ah1TC2D06 鉴别出来;开农1768和开农306仅需2 对引物pPGSseq15C12 和GM2067即可鉴别出来。
2.4 亲本对高油酸姊妹系的遗传贡献率分析
利用32对多态性引物分析了亲本对姊妹系的遗传贡献率(表5),结果显示:开农30对高油酸品种的遗传贡献率变幅为40.63%~71.88%,其中对开农306的遗传贡献率最大。开选016的遗传贡献率变幅为28.13%~556.25%,其中对开农71的遗传贡献率最大。开农30对开农61、开农176、开农1715、开农1768和开农306的遗传贡献率高,开选016对开农58、开农71和开农1760的遗传贡献率高。

表4 利用32对引物分析8个姊妹系的遗传多样性Table 4 The SSR genetic diversity analysis of eight sib-lines by 32 polymorphism markers

图3 特异性引物PM50、AhTE0129和pPGPseq3A8扩增条带Fig.3 Alleles of ten peanut cultivars amplified by the primers PM50,pPGPseq3A8 and AhTE0129

表5 亲本对8个姊妹系的遗传贡献率/%Table 5 Genetic contribution rate of the parents for eight sib-lines/%
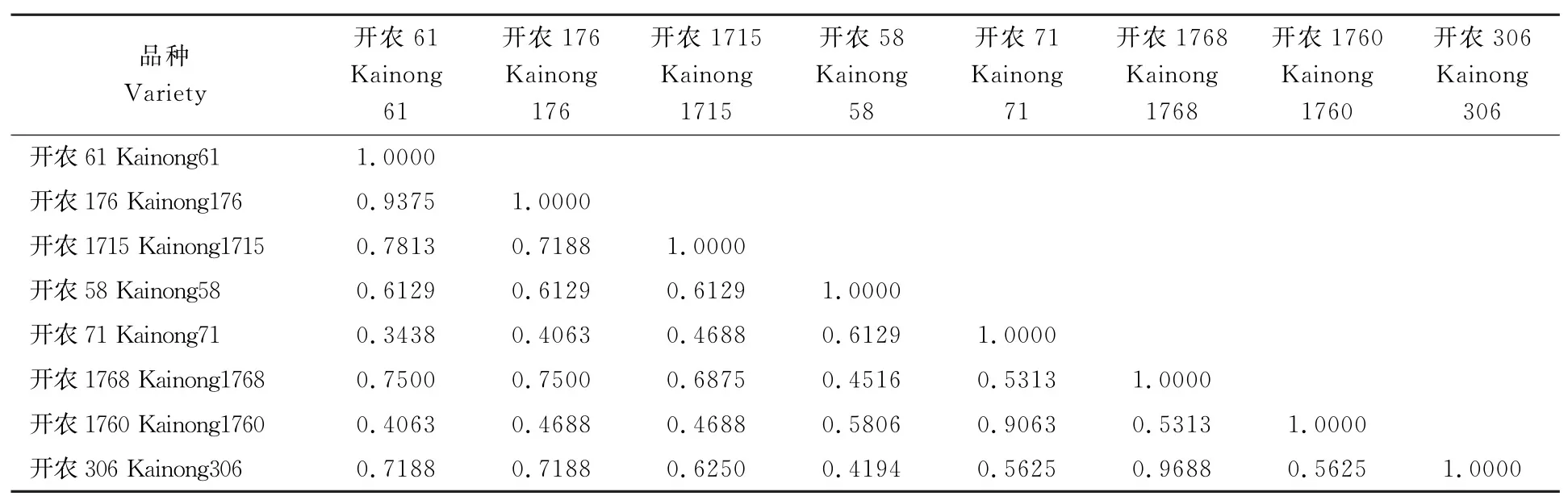
表6 高油酸姊妹系间的遗传相似系数Table 6 The genetic similarity coefficients of eight high oleic acid peanut cultivars
2.5 高油酸姊妹系间的遗传相似系数分析
利用遗传相似系数评估姊妹系的遗传相似性(表6),8个品种间的遗传相似系数变异范围为0.3438~0.9688,平均为0.6149,说明品种间的遗传基础相对狭窄。其中开农61和开农71的遗传相似系数最小,为0.3438,说明二者的遗传差异最大;开农1768与开农306的遗传相似系数最大,为0.9688,并且在农艺性状调查中除结果枝数、荚果长和百仁质量外其他性状均无显著差异,说明二者的遗传差异最小。
3 讨论
高油酸花生有益人体健康的研究已多有报道,它能够减少心脑血管疾病、耐贮藏和口感好的诸多优点,受到了广大消费者的青睐。与国外相比,我国高油酸花生育种起步虽晚但发展迅速,培育了一大批高油酸花生新品种[18]。
本研究同时从表型和基因型水平分析了以“开农30×开选016”组合育成的8个高油酸姊妹系品种的遗传构成和遗传差异性。表型性状分析结果表明,8个高油酸姊妹系品种集合了开农30的高产和开选016高油酸的优良特点,该组合具有较高的配合力。国内以开选016为亲本还育成了一批高产优质花生新品种如开农69、开192、秋乐花177 等[19]。表型分析中开农1768 和开农306表型差异最小,与遗传相似性分析结果一致。开农61和开农1760表型差异最大,但遗传相似性分析结果显示开农61和开农71的遗传相似系数最小,主要是由于花生基因组大,重复序列多[20],本研究虽然挑选了均匀分布于花生染色体的217对SSR 引物,但是覆盖率较小,不能仅靠这些标记就能完全反映出品种间的遗传相似系数,这需要更大密度的分子标记进行验证。
SSR标记鉴定出了品种的特异性位点,可为开农系列高油酸花生品种的真实性鉴定提供依据。表5显示开农71在pPGPseq3A8位点出现一条不同于双亲的变异带,许多学者认为品种的纯合是相对的,随着时间、地点和条件的改变,会发生基因突变、异花授粉等情况,它的遗传组成就会发生变异[21-22],本研究中变异带出现的原因主要考虑基因突变。
本研究中双亲对8个高油酸姊妹系品种的遗传贡献率分别为40.63%~71.88%、28.13%~56.25%,杂交理论上两个亲本对后代的遗传贡献率应均为50%,但由于人工选择的影响,就出现了亲本遗传贡献在基因组水平上与系谱分析存在不一致的现象[23-24],本研究农艺性状调查结果和王庆专等人的研究结果一致[25]。
SSR分子标记是鉴定种子真实性最直接的方法,但效率低。随着花生基因组测序的完成[26-27],利用基因芯片及SNP分子扫描技术将会大大提高效率,从而建立手段先进、监管有力的种子管理体系。
4 结论
由开农30×开选016组合培育的8个高油酸姊妹系品种集合了母本开农30高产、父本开选016高油酸的优点,更多地继承了开农30的遗传成分;该组合具有强大的配合力,培育出一大批高产、高油酸花生新品种;育成的高油酸品种的遗传多样性相对狭窄,需扩大亲本利用范围;利用筛选出的分子标记可快速有效地鉴定品种的纯度和真实性。
