生物杀虫剂甲氨基阿维菌素苯甲酸盐与人血清白蛋白相互作用的荧光光谱研究
2020-04-17陈佳佳纪仁静潘卫东田大雨张国平
陈佳佳,纪仁静,潘卫东,田大雨,张国平
(淮北师范大学,安徽淮北235000)
0 引言
甲氨基阿维菌素苯甲酸盐(EmamectinBenzo⁃ate,EB)又称甲维盐,是一种生物合成农药,其分子结构如图1 所示。作为一种新型高效抗生素杀虫剂,EB 因具有高活性、安全、低残留等优势而被广泛使用[1-5]。
血清白蛋白是血浆中含量最丰富的重要载体蛋白,可与很多内源和外源物质结合,研究药物与血清蛋白的相互作用,对于了解药物的作用机理具有重要的生物学及临床意义。近年来,人们已经做了许多蛋白质与药物相互作用方面的研究,如牛血清白蛋白[6]、胰蛋白酶[7]、木瓜酶[8-9]等,而有关农药小分子与蛋白质大分子相互作用的研究有关报道相对较少。本文采用荧光光谱法研究EB 与人血清白蛋白(HSA)的相互作用,探讨它们的猝灭机理及结合常数、结合位点数、结合作用力类型。同时,采用同步荧光说明HSA 的构象是否发生变化。这对了解生物杀虫剂EB 在人体内的代谢过程及药物的毒理作用等方面具有一定的意义。
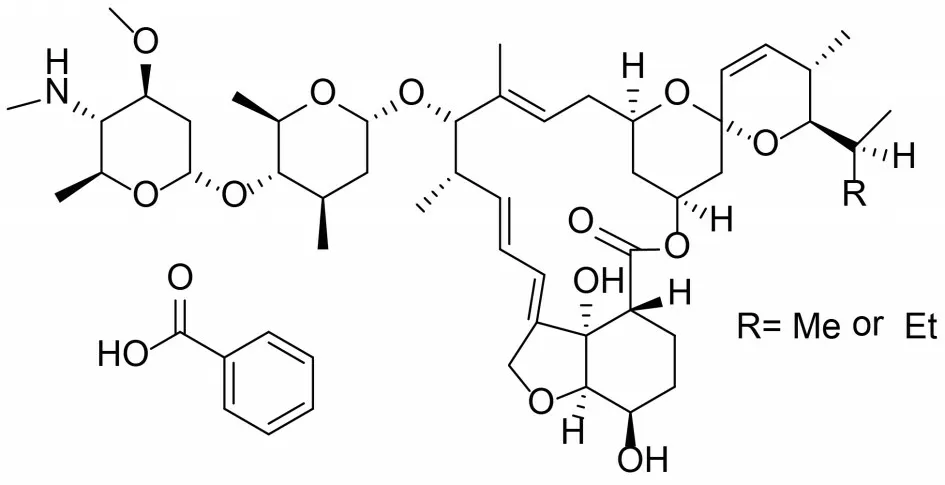
图1 甲氨基阿维菌素的分子结构
1 实验部分
1.1 试剂与仪器
TU1901 紫外可见光谱仪(北京,中国);FP-8300 荧光光谱仪(日本);PHS-23 型精密pH 计(上海虹益仪器仪表有限公司);501 型超级恒温箱(上海市实验仪器厂)。
取0.2740 g EB(分析纯试剂)稀释于500 mL 的蒸馏水配制成5×10-4mol·L-1的EB储备液;取0.3340 g HSA(65,000 Da,上海新兴公司)溶解于250 mL 的蒸馏水配制成2×10-5mol·L-1的HSA 溶液,0.04 mol·L-1的H3PO4,HAc和H3BO3与0.20 mol·L-1的NaOH以相同的比例配制成B-R缓冲溶液(pH=7.40),0.2mol·L-1NaCl 溶液,其他试剂均为分析纯,实验用水均为二次蒸馏水。
1.2 实验方法
在10 mL 比色管中依次加入pH=7.40 的B-R缓冲溶液1 mL,2.0×10-5mol·L-1HSA 溶液1 mL,0.20 mol·L-1NaCl溶液2.5 mL以及一定量5×10-4mol·L-1EB 溶液,用蒸馏水稀释至刻度后混匀,在一定温度下反应30 分钟,然后该溶液用1 cm 石英比色皿,激发波长278 nm,绘制300~500 nm 的荧光光谱,激发和发射狭缝宽度分别为5 nm和10 nm。
2 结果与讨论
2.1 EB与HSA的荧光猝灭类型
任何降低荧光强度的过程都叫荧光猝灭[10],分子重排、激发态反应、基态络合物的形成、能量转换以及碰撞猝灭中的分子间反应,都会导致猝灭。图2为加入不同含量EB 后HSA 的光谱图。随着EB 的加入,HSA 的内源荧光强度逐渐降低,且314 nm~338 nm之间的最大发射波长蓝移,说明EB与HSA之间发生了相互作用,使得HSA 中荧光发色团的微环境发生改变。随着EB浓度的增加,体系在440 nm有明显的峰值,这是EB 自身的峰值,而HSA 没有这样的特征峰,且此峰值对于EB 与HSA 之间的反应是没有影响的,因此可以不用考虑。(λex=278 nm,λem=338 nm,CHSA=2×10-6mol·L-1;CEB(1-10)= 0,1.5,3,4.5,6,7.5,9,10.5,12,13.50×10-5mol·L-1)

图2 EB-HSA体系的荧光光谱图
为确定EB-HSA 内源荧光的猝灭机制,根据Stern-Volmer方程处理上述体系[11]:

其中,F0和F分别是EB 不存在与存在条件下HSA的荧光强度,[Q]是EB 的浓度,Kq是生物大分子的猝灭速率常数,Ksv是动态猝灭常数,τ0是生物大分子的平均寿命,一般为1×10-8s-1。
图3 为F0/F与[Q]之间的关系图。从图中可以发现,当温度分别为290 K,300 K 和310 K 时,随着EB 浓度的增加,Stern-Volmer 曲线是线性的,表明EB-HSA 体系为单一猝灭机制,即动态猝灭或静态猝灭[12-14]。体系的猝灭常数Ksv、Kq计算结果列于表1。计算得出的Kq量级为1011L·mol-1·s-1,这已经超过了最大扩散碰撞猝灭速度常数(2.0×1010L·mol-1·s-1)[15],说明HSA的荧光猝灭过程是静态猝灭过程[16]。
2.2 结合常数与结合位点数
在静态猝灭过程中,独立小分子将绑定到大分子的等同位置[17-18]。当小分子独立绑定在大分子的等同位置时,自由分子与绑定分子之间的平衡可由方程(2)得出[19],
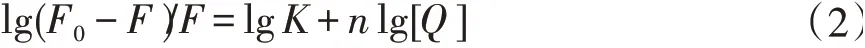
其中,K是结合常数,n是结合位点数。

图3 不同温度下F0/F与[Q]的关系图

表1 不同温度下EB对HSA的荧光猝灭常数
对于EB-HSA 体系,在三种温度下K与n的值可由图4 中的截距与斜率得到,其计算结果列于表2。结果表明,EB与HSA作用时只有1个结合位点,并且随温度的升高结合常数增大[20]。
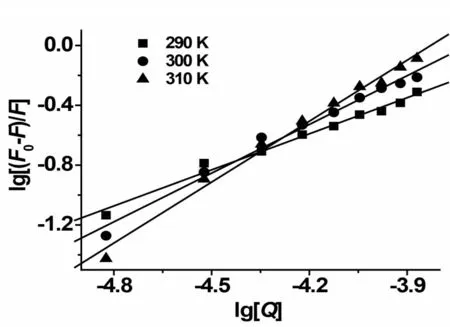
图4 不同温度下lg(F0-F)/F与lg[Q]的关系图
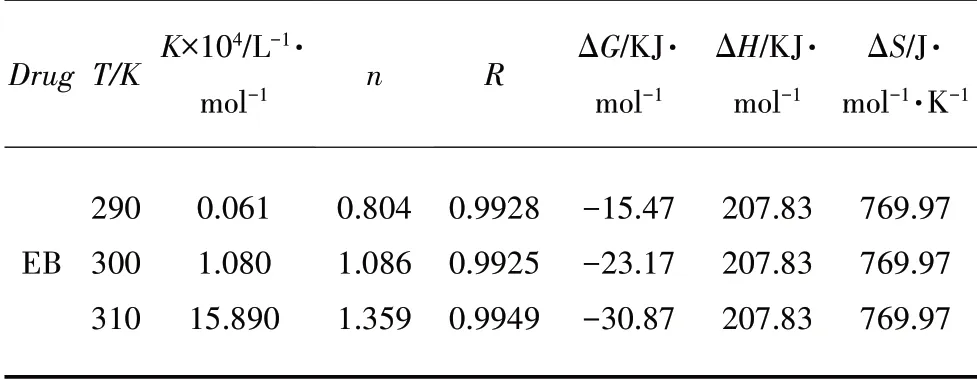
表2 不同温度下EB-HSA体系的Stern-Volmer猝灭常数
2.3 EB-HSA体系的结合方式
生物大分子与小分子之间的作用力包括氢键、范德华力、静电作用与疏水作用等,其作用力的类型可根据反应的热力学参数,如自由能(ΔG)、焓(ΔH)与熵(ΔS),加以判断。ΔH>0、ΔS>0 分子间的作用力为典型的疏水作用力;ΔH<0、ΔS<0为氢键和范德华力;ΔH<0、ΔS>0为静电作用力[21]。如果焓随温度改变不大,那么熵则由Van’t Hoff 方程决定:

其中,T是实验温度,K是相应的结合常数,R是气体常数。对于EB-HSA 体系,lnK正比于1/T,ΔH和ΔS可由曲线的斜率与截距得到,不同温度下吉布斯自由能(ΔG)可由方程(4)计算得到:

EB-HSA 体系的ΔG、ΔH和ΔS的计算结果列于表2。可知ΔG为负值、ΔS为正值表示结合过程是由焓、熵驱动的自发过程;同时ΔH为正值,则进一步表明EB 与HSA 之间主要的作用力是疏水作用力。
2.4 同步荧光光谱
同步荧光可用来说明生物大分子发光官能团受外源小分子加入后微环境的变化。HSA 的荧光性是由色氨酸、苯丙氨酸、酪氨酸残基决定,其色氨酸和酪氨酸残基的波长间隔(Δλ)分别是60 nm 和15 nm。图5为EB与HSA作用的同步荧光光谱。随着农药小分子EB的加入,HSA中色氨酸的发光强度明显减弱,而最大发射波长没发生移动,见图5(a),酪氨酸的发光强度及最大发射波长没发生明显变化,见图5(b)。可知加入的EB 主要与HSA 中色氨酸残基结合,且没有使HSA的构象发生变化。
2.5 EB与HSA之间的能量转换
根据Förster’s 能量共振转移理论[22]研究EB 在HSA 中的精确位置,体系的能量转移是由HSA 的发射荧光与EB 的紫外光谱决定的(见图6),EB 与HSA 之间的荧光猝灭说明体系发生了能量转移,能量E可由方程(5)计算[23,24]:

其中,F0和F是EB 不存在与存在条件下HSA 的荧光强度,R是EB与HSA之间的距离,R0是临界距离,其值由方程(6)计算得出:
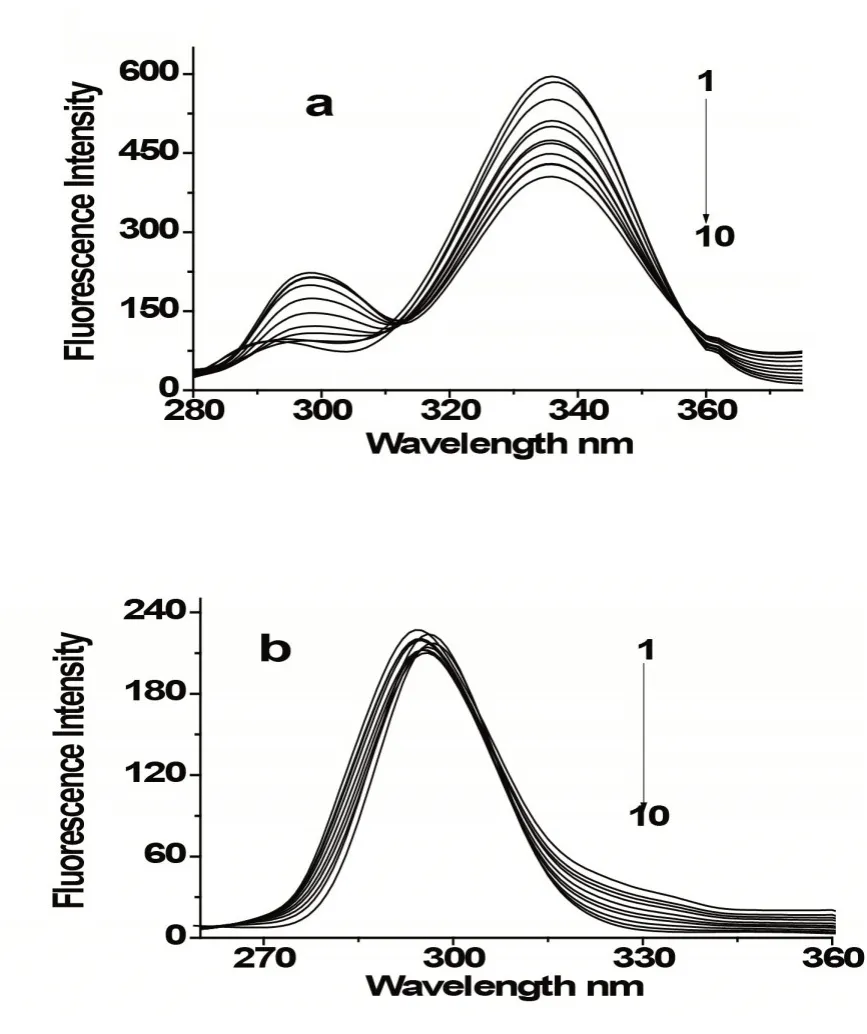
图5 EB-HSA体系的同步荧光光谱图(a):△λ=60 nm;

图6 EB的紫外吸收光谱与HSA的荧光发射光谱的斜率
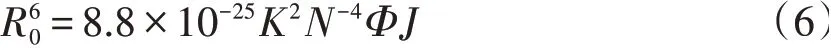
其中,K2是偶极子的空间去向因素,N是介质的折射率,Φ是荧光量子产率,J由方程(7)计算

F(λ)是HSA 在波长λ时的荧光强度,ε(λ)是EB在波长λ时的摩尔吸光系数,当λ=85 nm 时,K2=2/3,N=1.336,Φ=0.118[25]。
由以上方程得出数据:J=8.792×10-18cm3·L·mol-1,R0=0.759 nm,E=0.103,R=1.09 nm。EB 与HSA 的距离R<7 nm[26],表明EB 与HSA 之间发生了非辐射能量转移,从而促使HSA内在荧光的猝灭。
3 结论
采用荧光光谱,在pH = 7.40 条件下研究EB 与HSA 之间的相互作用,实验结果表明,EB 与HSA 之间是静态猝灭方式;在300K 时,其结合常数K 为1.08×104L-1·mol-1,结合点n为1.1,说明EB 与HSA之间有中等强度的结合作用;热力学参数ΔH>0,ΔS>0,表明EB与HSA之间的作用力主要是靠疏水作用引起的。同步荧光光谱显示EB 与HSA 之间络合时没有引起蛋白构象的改变;通过紫外和荧光光谱计算出EB 与HSA 之间的间距为R= 1.09 nm,表明整个体系发生了非辐射能量转移。通过研究EB与HSA 之间的相互作用,可以了解EB 的毒性效应及毒性的分子机制,在临床医学及药物学方面有较重要的意义。
