并发不孕的子宫内膜异位症患者阴道菌群的微生物组学研究
2020-04-17陈思凯谷智越冷金花郎景和
陈思凯,谷智越,郑 萍,戴 毅,冷金花,郎景和
子宫内膜异位症(EMs)作为一种慢性疾病,发生率约在10%左右,其主要症状表现为痛经、不孕、盆腔包块及慢性盆腔痛,其中不孕患者高达25%~50%,可严重影响患者的生活质量[1]。目前对于EMs的治疗尚无根治的方法,主要的治疗策略是通过手术治疗和药物的长期管理以达到解决疼痛症状、保留生育功能的目的[2]。因此,对于生育功能的保留是EMs治疗的一项重要目标。EMs的发生和发展与多种免疫因子和免疫细胞的紊乱有关,而这些免疫因子和细胞的紊乱,例如白细胞介素(interleukine,IL)升高、巨噬细胞活化、前列腺素升高和氧化应激作用都与不孕相关[3]。但并非所有的EMs患者都有不孕的症状,因此关于EMs的不孕机制还需进一步研究。
自人类微生物组研究发起以来,越来越多的研究旨在探讨微生物与人类宿主的关系,例如肠道微生物[4]、胎盘微生物[5]、口腔微生物[6]、泌尿系统微生物[7]和皮肤微生物[8]等,揭示了细菌与人类机体共生的机制。细菌扩增子16S核糖体RNA(16S-rRNA)测序技术的发展代替了传统的微生物培养技术,可识别更多的丰度小并且难以培养的细菌,为人类更深入地进行微生物组学研究提供了更好的方法学。
女性阴道作为一个富含细菌群落的器官,主要是以乳酸杆菌为主导的细菌群落,其分泌的乳酸可维持阴道的弱酸性环境,以抵御外来细菌和病毒的侵袭[9-10]。有许多针对不孕患者的生殖道微生物研究都揭示了阴道内细菌或者宫腔内细菌的多样性与不孕有关[11-12],例如乳酸杆菌比例的增多对于生育结局有着积极的影响。但是目前大多数微生物组学的研究旨在针对总体不孕人群,而鲜有研究提及在EMs人群中不孕患者的微生物组学特点。本研究的目的旨在使用扩增子16S-rRNA测序技术对EMs合并不孕人群的微生物组学进行研究,通过生物信息学算法挖掘生物学标识,为今后诊断EMs不孕建立细菌筛查模型。此外,对于细菌组学的鉴别也可以从细菌代谢机制方面为今后EMs发病机制的研究做出一定铺垫。
1 对象与方法
1.1 研究对象本研究为单中心微生物组学及生物信息学研究,于中国医学科学院北京协和医院妇产科进行,时间从2018年4月—2019年9月。经门诊检查评估,入组患者符合EMs诊断并符合手术治疗标准,研究者对于将要进行手术的住院患者及门诊患者的阴道后穹窿微生物进行收集,对于符合入组标准的患者进行筛选,后续进行生物信息学分析。本研究共纳入66例诊断为EMs的患者,其诊断结果由术后手术记录及病理切片诊断或超声检查确认,包括卵巢型EMs 55例、深部浸润型EMs 22例及浅表腹膜型EMs 12例,3种不同类型的EMs有重叠。其中EMs合并不孕的患者17例为不孕组,EMs不伴有不孕史的患者49例为对照组。本研究通过北京协和医院伦理审查委员会批准(伦理审查号JS-1532)。扩增子16S-rRNA原始数据已上传至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)公共数据库GenBank,数据编号MN663272-MN665377。
1.2 患者筛选纳入标准:所有入组患者经手术后病理检查及手术记录证实为EMs患者。①年龄>18岁且<45岁;②取样当日前30 d未服用过抗生素;③2 d内无性生活;④5 d内无阴道冲洗或用药等操作。排除标准:①细菌性阴道病(通过患者自述症状及门诊阴道分泌物核酸检查排除);②全身急性炎症期;③恶性肿瘤患者;④自身免疫性疾病患者;⑤孕期;⑥月经期;⑦宫内放置节育环。
1.3 取样方法选取病房次日将要行手术的患者或门诊就诊患者,于患者术前阴道冲洗前取样。患者保持截石位,用一次性塑料扩阴器扩张阴道,暴露宫颈,使用临床用阴拭子,于阴道后穹窿蘸取分泌物。取出阴拭子时应避免与阴道壁接触污染,取出后将阴拭子置于冰盒,后于-80℃冰箱保存。
1.4 核糖体16S-RNA测序
1.4.1 DNA提取和聚合酶链反应(PCR)扩增 根据E.Z.N.A.soil试剂盒(OmegaBiotek,Norcross,GA,U.S.)说明书进行总DNA提取,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F和806R引物对V3V4可变区进行PCR扩增。
1.4.2 Illumina MiSeq测序 使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris盐酸洗脱,2%琼脂糖凝胶电泳检测。利用QuantiFluorTMST(Promega,USA)进行检测定量。根据 Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库。
1.5 数据处理根据重叠碱基将两端序列进行拼接,去除无法拼接的序列。根据100%的相似度对序列生成扩增子序列变异表(amplicon sequence variants,ASV)。经过去除冗余数据和删除嵌合子序列,最终生成受试分类单元表(operational taxonomy unit,OTU)。
1.6 统计学方法符合正态分布的定量资料用均数±标准差表示,组间比较采用t检验;不符合正态分布的定量资料用中位数和四分位数表示,组间比较采用秩和检验,Stata 12软件进行计算,STAMP 2.1.3软件制作柱状图。微生物组学alpha与beta多样性采用R语言在Rstudio使用Linux平台进行分析,使用R语言将数据制图可视化。LeFSe分析使用在线分析平台www.ehbio.com。主坐标分析(principle co-ordinate analysis,PCoA)是将不同组别间多种微生物菌落进行丰度比较所产生的一种高维度矩阵算法,并将多维度的数据以最大差异平面投影到二维平面。从Bray-Curtis矩阵和Unifrac矩阵算法对2组微生物组间差异进行比较算法,并且进行加权计算。线性判别式计算(linear discriminative analysis,LDA)与LeFSe(LDA effect size)是用来计算不同组间的生物学标识。学术界普遍采用LDA(log10)评分>4为有生物学标识的潜能。P<0.05为差异有统计学意义。
2 结果
2.1 2组一般资料比较2组年龄、身高和体质量比较,差异无统计学意义(P>0.05);不孕组痛经程度(VAS评分)低于对照组,差异有统计学意义(P<0.05),见表1。
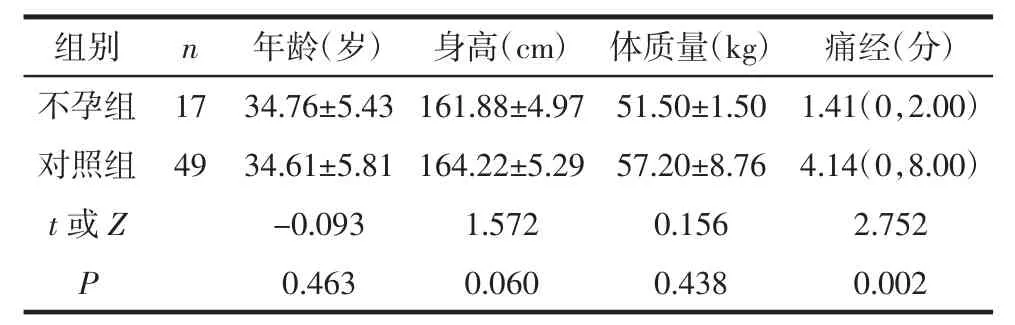
表1 2组一般资料比较
2.2 2组4种alpha多样性与beta多样性比较2组4种alpha多样性指数比较差异均无统计学意义(P>0.05),见图 1。
从beta多样性柱状图中可以看出,对于不孕组患者,无论是在科水平还是属水平,乳酸杆菌的含量比对照组稍低;并且从平均丰度来看,乳酸杆菌仍是阴道后穹窿中占主导地位的细菌,见图2(见封三)。不孕组与对照组间的微生物群落并未有明显的分离,大部分为重叠面积,见图3(见封三)。
普氏菌属(Prevotella)、巨型球菌属(Megasphere)和小类杆菌属(Dialister)这3类细菌属在不孕组的相对平均丰度较对照组升高,差异有统计学意义(P<0.05),见图4。对于阴道后穹窿的细菌群落的总体统计,选择相对丰度大于0.01%并且可供数据库参考识别的细菌,共有65个细菌属,占主导地位的仍是乳酸杆菌属,但不孕组的乳酸杆菌与对照组比较差异无统计学意义(P>0.05),见表2和图4。
在不孕患者和对照组患者的LeFSe分析中,变形菌门(Proteobacteria)和 γ-变形菌纲(Gammaproteobacteria)的 LDA(log10)>4,见图 5。
3 讨论
3.1 EMs、免疫与细菌的交联关系EMs导致不孕的机制是多方面的,包括基因、解剖、内分泌,甚至环境因素。EMs本身为一种炎症性疾病,巨噬细胞等免疫细胞的异常活化或IL等细胞因子的异常都与其发生有关,并且会影响受精卵的着床或精子和卵子的结合[3]。有研究对总体不孕患者的宫腔或阴道微生物群落进行了分析,发现一些有差异的细菌种类,例如脲原体(Ureaplasma)和加德纳菌(Gardnerella)在不孕患者的子宫内膜显著增加[11],并且在不孕患者中乳酸杆菌的含量明显减少[12]。这与本研究的结果相似。乳酸杆菌作为一种主导阴道环境的细菌,其对于育龄期女性的生育功能有着十分重要的意义,但是其具体机制仍需要进一步研究,可能是因为乳酸杆菌产生的弱酸性环境和生物膜效应可在免疫学水平维持生殖道微环境的平衡[9],从而保证受精卵着床时的免疫环境处在一个正常水平。
3.2 16S-rRNA测序方法学的不足之处本研究将阴道后穹窿作为一个取样位点,而没有将子宫内膜作为取样位点,其原因是目前学术界对于子宫内膜是否有细菌尚有争议。在测序技术发展以前,以细菌培养作为研究微生物作为主要手段的时代,普遍接受的观点是子宫内膜应为无菌的;但16S-rRNA测序技术发展后,许多研究都证实子宫内膜[13]甚至胎盘[5]也存在定植菌群,并且对于一些疾病和胎儿生长都有着十分重要的关系[14],但是这些研究并未阐明宫腔内细菌到底是外来入侵还是正常定植[13]。《自然》杂志最新的一项研究显示,此前对于胎盘定植细菌的研究可能是由于测序方法不完善所导致的污染[15],该观点在学界引发了新的争议。因此笔者认为,内膜是否有菌应该分特殊情况,不能一概而论,一些生殖道的亚临床感染可能并无症状,也较难以做出临床诊断,但是这些感染可能也与EMs的发生、发展有着十分重要的关系[16-17]。此外,若能在将来以细菌组学特征作为诊断方法,后穹窿作为一个易于进行门诊筛查的位点,可以用来进行快速无创的筛查。因此,本研究针对阴道后穹窿进行了微生物组学研究而并未将内膜微生物纳入研究范畴。
3.3 痛经与生殖道微生态的关系本研究对于样本人群特点的统计中,发现不孕患者的痛经程度较对照组低(P<0.05),其原因可能是本研究的样本人群偏倚导致的。在纳入研究的统计人群中大部分是通过手术确诊的EMs,不孕患者手术的原因多为解决不孕的问题,而对照组患者手术的原因为EMs导致的疼痛或盆腔包块,因此导致不孕患者痛经程度较低的统计学结论。目前对于合并不孕的EMs患者痛经程度尚无确切的研究,但有对于无痛经的卵巢型EMs患者进行研究发现该类患者合并其他种类盆腔EMs的比例较高且临床分期高[18]。在微生物水平的研究中,本研究得出的结论与已有研究结论大致相符[12],即在不孕患者中乳酸杆菌的含量有所减少。在Ⅳ型阴道群落内,巨型球菌属或普氏菌属等厌氧菌也可产生乳酸,表现出与乳酸杆菌类似的生理作用;但同时巨型球菌属可能也会通过产生氨基酸等物质促进细菌性阴道病相关细菌的生长,例如阴道加德纳菌或厌氧消化链球菌(Peptostreptococcus anaerobius)[10]。因此,以上这些细菌含量的改变可能是由于潜在的炎症作用导致宿主免疫系统紊乱,从而导致患者不孕的发生。其具体的机制还需进一步研究。

图1 微生物组学群落特征4种alpha多样性指数的分析

图4 差异有统计学意义的微生物种类挖掘
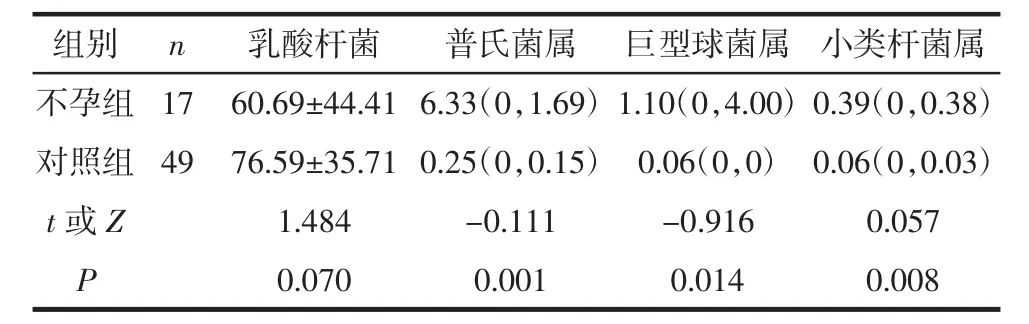
表2 2组细菌属平均菌群丰度比较 (%)
综上,本研究对于EMs合并不孕和无不孕患者的阴道细菌群落进行了比较和生物学标识挖掘。2组患者的细菌群落在alpha多样性中未见显著差异,在beta多样性中可观察到不孕组的乳酸杆菌含量略有减少。在对于细菌相对丰度进行统计学计算方面,有3种细菌属表现出了显著的统计学差异,分别是普氏菌属、巨型球菌属和小类杆菌属,它们在不孕组患者明显升高。PCoA矩阵分析未表现出显著的差异。门水平的变形菌门和纲水平的γ-变形菌纲可能是潜在的生物学标识物。纠正生殖道炎症相关细菌的比例以及增加乳酸杆菌的含量有可能是未来改善EMs不孕的治疗方法。此外,不同的细菌种类在不同个体差异较大,造成此差异的原因也是未来的研究重点。通过对EMs患者是否不孕的问题进行了微生物组学角度的分析,为今后EMs不孕的机制研究和微生物诊断学发展奠定了理论学基础。

图5 生物学标识的挖掘计算
