细胞自噬在子宫腺肌病发病机制中作用的研究进展
2020-04-17谢云凯白艺璇关红卫邹永辉
谢云凯,刘 威,白艺璇,关红卫,邹永辉
子宫腺肌病(adenomyosis)是一种雌激素依赖的子宫内膜于子宫肌壁层生长所引发的疾病,在我国成年女性中具有较高发病率,常导致盆腔疼痛甚至不孕等症状,以至于常需要手术治疗[1]。目前广泛接受的理论是子宫基底膜内陷学说,也有学者提出化生学说、苗勒管残留学说和组织重构等学说,基因、免疫、炎症因子及环境因素等也证明与子宫腺肌病的发生发展有关[1-3]。自噬(autophagy)是一种由细胞内溶酶体介导的细胞自我降解过程,细胞通过调控自噬以帮助各种原因损伤的细胞维持自身平衡[4]。自噬可能在包括女性生殖道在内的各种组织的正常发育和维持体内平衡中发挥重要作用[5]。随着相关研究的不断深入,细胞自噬在子宫腺肌病发生、发展中的作用被不断认识,其在子宫腺肌病的发生、发展中可能发挥着重要作用。
1 细胞自噬的概念、作用及分子机制
1.1 细胞自噬的细胞生物学机制及意义自噬是指细胞自身由溶酶体介导的细胞自我降解,即细胞在自噬相关基因(autophagy related gene,Atg)的调控下利用溶酶体降解细胞内受损细胞器和大分子物质的过程。自噬过程包括:①亚细胞膜的重新排列隔离底物形成自噬小体(autophagosome);②随后自噬小体与溶酶体融合形成自噬溶酶体(autolysosome);③底物在自噬溶酶体中进行降解和回收(见图1)[6-7]。根据底物进入溶酶体的过程不同,可把自噬分为巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。但几种方式在底物进行降解的最后步骤和降解物质的最终回收方面基本相同[6]。自噬在细胞对于环境变化的反应以及对细胞新陈代谢起着重要作用。同时,自噬已被证实与肿瘤增殖及抑制存在密切关系,但其作用目前尚存在争议。有研究表明自噬可能参与肿瘤细胞应对放化疗损伤的过程[8-9],因此某些情况下抑制自噬可能作为抑制肿瘤生长的治疗靶点[10]。
1.2 细胞自噬的基本过程及其分子机制自噬是细胞对各种应激的反应行为,在哺乳动物细胞中应激刺激对自噬的调控主要发生在翻译后水平,即需要翻译后修饰酶的参与[11]。自噬的整个过程都受到某些特定的自噬复合体的调控。其作用机制可概括如下(见图1)。
UNC-51样激酶(ULK)复合体由蛋白激酶ULK1和ULK2组成,结合了FAK家族相互作用蛋白(FIP200)以及调控亚基Atg13和Atg101,这些亚基可以通过诱导构象改变来激活ULK蛋白,进而将应激信号传递至自噬小体形成的部位[12]。活化的ULK1通过磷酸化BECN1基因相关蛋白(Beclin-1)来提高空泡分选蛋白34(VPS34)复合体的活性,VPS34复合体Ⅰ由Ⅲ类磷脂酰肌醇 3 激酶(PI3K)VPS34、Beclin-1、Atg4以及催化调控亚基组装所需的VPS15支架蛋白组成,这种复合物促进磷脂酰肌醇3磷酸(PI3P)形成,而PI3P可募集自噬前体膜成核所需的自噬因子,促进自噬前体的形成[13-14]。因此ULK1对Beclin-1的磷酸化是哺乳动物自噬起始的必要条件。
自噬泡膜的延长则需要Atg9以及包括微管相关蛋白3(LC3)和伽马氨基丁酸A型受体相关蛋白(GABARAP)亚族在内的酵母Atg8基因家族参与。含有跨膜蛋白Atg9的囊泡穿梭于高尔基体、内质网和自噬泡之间[15],可能为自噬泡提供细胞膜来源;LC3、GABARAP和高尔基体相关ATP酶增强子16(GATE16)对自噬泡膜的延长和融合发挥着不同的功能,其中LC3是Atg8同源家族中最具代表性的一个,也是目前研究最为透彻的。在自噬过程中,LC3的膜结合及半融合行为可以调控自噬小体的大小[16],同时,LC3可能还与自噬小体的选择性降解有关[17]。
最后,参与调控自噬小体与溶酶体融合的蛋白与细胞胞吞途径的蛋白存在共同之处。它们包括VPS34 复合物Ⅱ、Beclin-1、VPS34、VPS15、Ras相关蛋白7(RAB7)效应蛋白以及同源融合和液泡蛋白分选复合物(HOPS)等分子[11]。
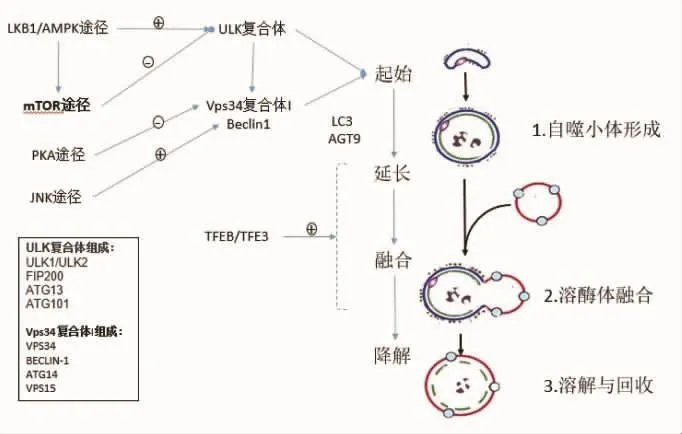
图1 自噬基本过程
1.3 自噬的调控细胞自噬的调控机制极其复杂,主要包括:①哺乳动物雷帕霉素靶蛋白(mTOR)途径。mTOR蛋白激酶是自噬主要负调控因子,在细胞营养充足条件下,氨基酸和生长因子可以通过激活mTOR激酶复合体中的哺乳动物雷帕霉素靶蛋白复合体1(mTORC1)靶点,进而抑制ULK复合体,从而抑制自噬;而在营养缺乏时,mTOR信号通路会被抑制,进而激活ULK1及下游自噬靶点,诱导自噬[18]。②肝激酶 B1(LKB1)/腺苷酸活化蛋白激酶(AMPK)途径。AMPK作为细胞主要能量感受器,当能量缺乏时,升高的磷酸腺苷(AMP)/三磷酸腺苷(ATP)比值可激活LKB1/AMPK通路,AMPK通过在多个位点磷酸化ULK1激活自噬。同时AMPK也可通过抑制mTORC1中调节相关蛋白(Raptor)激活mTORC1抑制剂马铃薯球蛋白(TSC2)来抑制mTOR活性,间接激活自噬[19]。③蛋白激酶A(PKA)途径。细胞能量充足时,PKA能促进ULK1和Atg13磷酸化,阻止Atg13定位到自噬前体结构(PAS)。另外,PKA也能磷酸化并激活TORC1或通过抑制AMPK间接激活mTORC1,从而抑制自噬[20]。④c-Jun氨基末端激酶(JNK)途径。当能量缺乏时可激活JNK-1激酶,进而阻碍Beclin-1与B细胞淋巴瘤蛋白2(Bcl-2)间的相互作用,释放游离Beclin-1,进而促进自噬发生[21]。此外,钙离子途径、葡萄糖调节蛋白78(GRP78)蛋白途径、三磷酸肌醇(IP3)途径、真核生物翻译起始因子 2α 激酶 2(EIF2AK2)/蛋白激酶 R(PKR)依赖途径等通路同样对自噬起调控作用。同时,值得注意的是近年转录因子家族的转录因子EB(TFEB)和转录因子E3(TFE3)被认为是参与自噬下游调控的重要因子,在胞质中TFEB可被mTORC1直接磷酸化并减少入核,调控溶酶体和自噬相关基因表达,增强自噬活性[22]。
2 自噬与子宫腺肌病
2.1 自噬与子宫腺肌病的发生发展目前“在位内膜决定论”仍是子宫腺肌病主流学说,认为该病是由于基底层子宫内膜及基质细胞因各种原因侵入子宫肌层生长所致[23],在此过程中在位内膜自身特性起决定性作用。而研究表明,子宫腺肌病患者中在位内膜组织自噬的失调,可能与子宫腺肌病的发生有关。一项对子宫腺肌病患者及正常女性在位内膜细胞的对比研究发现,子宫腺肌病患者在位内膜基质细胞及内膜组织中Beclin-1表达水平较正常女性明显下降,且Beclin-1分子表达与CA125水平呈明显负相关[24]。该研究提示子宫腺肌病患者内膜组织存在自噬紊乱,这种在位内膜自噬的下调可能与子宫腺肌病的发生密切相关。自噬同样参与子宫在位内膜细胞周期的调控过程。Li等[25]研究发现,在子宫内膜分泌期,正常内膜组织中自噬相关基因LC3-B的表达较增生期明显增多;而子宫内膜异位症患者在位内膜及异位内膜组织中均未检测到这种变化;并且异位内膜组织中LC3-B表达水平显著低于在位内膜,提示内膜细胞自噬周期性变化的消失以及异位内膜自噬下调可能与子宫腺肌病的发生密切相关。
目前多数研究倾向于认为异位内膜细胞中存在自噬抑制。例如,异位内膜基质细胞YAP分子表达的增加可通过调控mTOR通路降低细胞自噬水平[26]。同时,研究发现高雌激素作为子宫腺肌病重要发病机制之一,其可以通过上调趋化因子基质细胞衍生因子 12(CXCL12)/趋化因子受体 4(CXCR4)介导的自噬抑制,促进人分泌期子宫内膜基质细胞(HESCs)的存活[27]。但关于异位内膜组织中自噬的作用尚存在争议,例如Liu等[28]发现低氧条件可诱导自噬,从而促进HESCs的上皮间质转化(epithelial-mesenchymal transition,EMT),进而增强HESCs的增殖及侵袭能力,这一过程可能由低氧诱导因子1α(HIF-1α)所介导,HESCs在低氧处理后自噬增强且表现为增殖及侵袭能力增强,而该自噬过程依赖HIF-1α,在低表达HIF-1α下调自噬后,可检测到异位内膜细胞侵袭能力的下降[29]。该研究一定程度上支持子宫腺肌病发病机制中的EMT理论。
有研究证实,PI3K/蛋白激酶 B(AKT)/mTOR 通路激活可以抑制自噬,进而促进子宫内膜癌细胞的孕激素抵抗[30]。在子宫内膜异位症异位内膜细胞中尚缺乏相关研究,提示自噬可能也参与了异位内膜细胞孕激素抵抗过程。
2.2 自噬与子宫腺肌病的症状及并发症
2.2.1 自噬与子宫腺肌病患者的不孕症 子宫腺肌病被认为可能导致女性不孕,但其具体机制尚不明确。子宫腺肌病患者中子宫内膜间质细胞自噬的降低可以通过PI3K-AKT-mTOR途径影响蜕膜化[31],这可能是子宫腺肌病导致女性不孕的机制之一。进一步的研究中,Mestre Citrinovitz等[32]发现在人子宫内膜间质细胞体外蜕膜化过程中,自噬存在明显上调;通过抑制内膜基质细胞自噬相关蛋白Atg7和Atg5的表达可破坏蜕膜化过程。这些研究表明子宫腺肌病患者内膜细胞的自噬失调可能导致不孕。
2.2.2 自噬与子宫腺肌病患者的盆腔周期性疼痛 子宫腺肌病所导致的周期性疼痛与病灶神经及血管的再生关系密切。子宫腺肌病的神经起源假说认为各种原因造成的子宫神经损伤可引起局部神经介质及神经递质释放,进而诱导内膜细胞种植。研究发现,出现疼痛的子宫腺肌病患者病灶组织出现大量异常神经纤维增生[33],提示神经再生与子宫腺肌病发病及疼痛症状密切相关。而研究证实自噬在神经元损伤修复、突触再生等过程中发挥重要作用[34]。同样,血管生成是子宫腺肌病异位内膜细胞种植的必要条件。研究已证实子宫腺肌病组织中存在异常的血管再生[35],而自噬已在神经损伤修复、肿瘤等疾病中被证明可调控血管的再生、重构及迁徙过程[36]。但目前尚无相关研究阐释自噬在子宫腺肌病病灶神经及血管异常增生过程中的作用机制,因此有望成为进一步研究的方向之一。
2.3 自噬与子宫腺肌病治疗促性腺激素释放激素类似物(GnRHa)是治疗子宫腺肌病重要的二线药物,在该病的保守治疗中发挥了重要作用。Guo等[37]研究发现在接受GnRHa处理的子宫腺肌病模型小鼠中,检测到自噬小体和Beclin-1、LC-3蛋白表达较未经处理的子宫腺肌病模型组显著提高。提示了GnRHa可逆转子宫腺肌病导致的自噬抑制,进而缓解子宫腺肌病相关症状。孕激素类似物如地诺孕素(Dienogest)同样被证实可调节细胞自噬,Choi等[38]使用地诺孕素处理异位内膜细胞后检测到LC3-Ⅱ表达上调,此过程是因地诺孕素降低了异位内膜细胞中AKT、细胞外调节蛋白激酶1/2(ERK1/2)以及核糖体S6蛋白激酶(S6K)的活性,进而抑制mTOR通路,刺激自噬小体的形成。另有研究发现,mTOR通路抑制剂替西罗莫司(Temsirolimus)可通过阻断mTOR/AKT通路,进而治疗大鼠深部浸润型子宫内膜异位症(DIE)[39]。这些研究为通过自噬抑制剂下调细胞自噬,进而治疗和缓解子宫腺肌病提供了可能。
3 结语
子宫腺肌病发病机制复杂,与该疾病发生、发展相关的学说众多,自噬作为细胞重要的应激反应及代谢调节机制,在子宫内膜细胞生长、代谢及子宫腺肌病的发生、发展过程中发挥着重要作用。现有研究表明,子宫腺肌病患者在位内膜中Beclin-1表达下降,伴随自噬水平的下降;而子宫腺肌病患者异位内膜中自噬发挥的作用目前尚无定论。在子宫腺肌病的治疗方面,GnRHa可通过上调Beclin-1、LC-3进而激活异位内膜细胞自噬,地诺孕素、替西罗莫司可分别通过 AKT、ERK1/2、S6K途径抑制 mTOR/AKT通路激活异位内膜细胞自噬,从而缓解子宫腺肌病症状。细胞自噬在子宫腺肌病细胞周期的作用、神经血管再生、孕激素抵抗、子宫腺肌病治疗等方面亟待更深入的研究。深入了解自噬与子宫腺肌病的关系,将为子宫腺肌病的治疗提供更多可能性。
