羊栖菜多糖抗肿瘤及其作用机制研究进展
2020-04-17丁浩淼洪嘉瑶陈雪佳李沁清李贵锋汪财生钱国英
丁浩淼, 洪嘉瑶, 陈雪佳, 李沁清, 李贵锋, 汪财生, 钱国英
羊栖菜多糖抗肿瘤及其作用机制研究进展
丁浩淼, 洪嘉瑶, 陈雪佳, 李沁清, 李贵锋, 汪财生, 钱国英
(浙江万里学院 生物与环境学院, 浙江 宁波 315100)
羊栖菜()多糖在多种肿瘤细胞系中表现出良好的抗癌活性, 具有针对肿瘤细胞的选择活性和较小的毒副作用, 可以作为现有肿瘤化疗药物的替代品进行开发。羊栖菜多糖主要通过诱导细胞凋亡作用于肿瘤细胞, 其通过细胞周期停滞, 增强机体免疫功能, 改变细胞膜钙通道与流动性, 破坏线粒体膜和产生一氧化氮来杀死癌细胞并防止转移。本文就国内外发表的羊栖菜多糖抗肿瘤功能及作用机制进行系统的归纳和总结, 旨在为羊栖菜多糖抗肿瘤药物的深入研究、开发提供理论依据。
羊栖菜(); 多糖; 抗肿瘤作用机制
肿瘤是以细胞异常增殖为特点的一类疾病, 常在机体中形成肿块, 有些肿瘤生长迅速, 侵袭性强, 可以从原发部位播散到身体的其他部位, 对人体的危害大, 医学上称为恶性肿瘤, 其又称为癌症, 是严重威胁人类健康的常见病、多发病、慢性病[1-3]。天然产物已被广泛用作治疗有效药物的重要来源, 当前的趋势是将研究对象转向海洋生物。最近, 已发现源自海藻的多糖具有抗肿瘤作用, 例如: 从台湾海带(s)、海带()、钝型凹顶藻()、墨角藻()等提取的多糖可抑制淋巴癌或髓系细胞增殖[4-7]。
羊栖菜()隶属褐藻门(Phaeophuta)墨角藻目(Fucales)马尾藻科(Sargassaceae), 又名玉草、六角菜、鹿角尖, 在我国辽东半岛、山东、浙江、福建、广东浅海域均有分布, 日本和韩国也有生长, 其含有丰富的多糖[8-10]。羊栖菜多糖(SFPS)的主要成分是褐藻酸、褐藻多糖硫酸酯、褐藻淀粉; 其中, 褐藻多糖硫酸酯生物活性丰富, 因其具有抗辐射[11]、抗病毒[12]、调节血糖[13]、提高记忆力[14]、免疫调节[15]、清除自由基[16]的多种药理性质, 这些功效与褐藻糖胶这类硫酸酯多糖密切相关。国内外文献资料表明羊栖菜多糖对肿瘤细胞具有抑制效果, 因此, 本文着重研究介绍了羊栖菜多糖对肿瘤细胞抗癌机理分类研究, 为羊栖菜多糖在抗肿瘤作用类药物的开发提供参考。
1 羊栖菜多糖的抗肿瘤作用
羊栖菜多糖已经通过多种肿瘤细胞系和合适的动物模型体内研究证明其具有抗肿瘤的作用, 如表1所示。许多疾病如肿瘤、风湿病和某些类型的炎症导致红细胞的电迁移率增加, Ji等[17]通过灌胃S180肿瘤小鼠各种剂量SFPS, 测量其红细胞的迁移率, 发现高剂量组, 中剂量组和低剂量组的红细胞迁移时间短于阴性对照组, 表明SFPS可能改变肿瘤小鼠体内红细胞表面电荷密度。Yu等[18]从羊栖菜中提取SFPS, 并对SFPS采用氯磺酸吡啶法增加其硫酸化程度, 通过MTT法检测多糖化学修饰前后对HepG2细胞体外增殖的抑制作用, 实验结果发现两种多糖对HepG2细胞均有一定的抑制效果, 改性多糖对HepG2细胞生长的抑制作用与从羊栖菜中提取SFPS相比有所提高。Cong等[19]从羊栖菜中分离出多糖组分04S2P, 通过硫酸化反应获得04S2P-S, 在5种不同的肿瘤细胞系测试其抗肿瘤活性, 发现04S2P-S仅在Bel7402细胞系上显示出明显的抗肿瘤作用, 而对SMMC7721细胞、HT-29细胞、Huh7细胞和Caco-2细胞没有明显的抗肿瘤作用。况炜等[20]采用不同组分的SFPS浓度梯度对人肺癌细胞SPC-A-1进行药物刺激, 后用MTT法检测肿瘤细胞增殖情况, 结果表明, SFPS具有抗肿瘤效果, 初步测得300 mg/L及1 000 mg/L的SFPS可以有效对人肺癌细胞的增殖活性产生抑制作用。Chen等[21]通过SFPS对体内外肿瘤细胞的生长进行了研究, 发现SFPS具有抑制肿瘤生长作用; 体外研究主要针对SFPS对A549细胞系的细胞毒性以及对细胞生长的影响, 体内研究中将接种A549细胞的小鼠按100 μg/kg和200 μg/kg体重的剂量口服SFPS, 观察携带A549癌细胞的小鼠体内肿瘤的生长情况, 发现小鼠体内的肿瘤生长受到抑制。岑颖洲等[22]用热水提取, 乙醇、氯化钙沉淀分离及酸水解制备了6种羊栖菜多糖样品, 发现各羊栖菜多糖样品对肝细胞HepG2均有一定的抑制作用, 抑制率均未超过40%。早在1998年, Shan等[23]从6种海藻中获得粗提物, 发现羊栖菜水提物能够显著刺激人体淋巴细胞增殖, 而这种功能与SFPS活性有关。
羊栖菜多糖通过多种途径起作用, 一些作用机制尚未明确定义, 确定的常见机制是阻滞细胞周期, 线粒体膜电位去极化, 一氧化氮途径和免疫调节[24], 如图1所示。
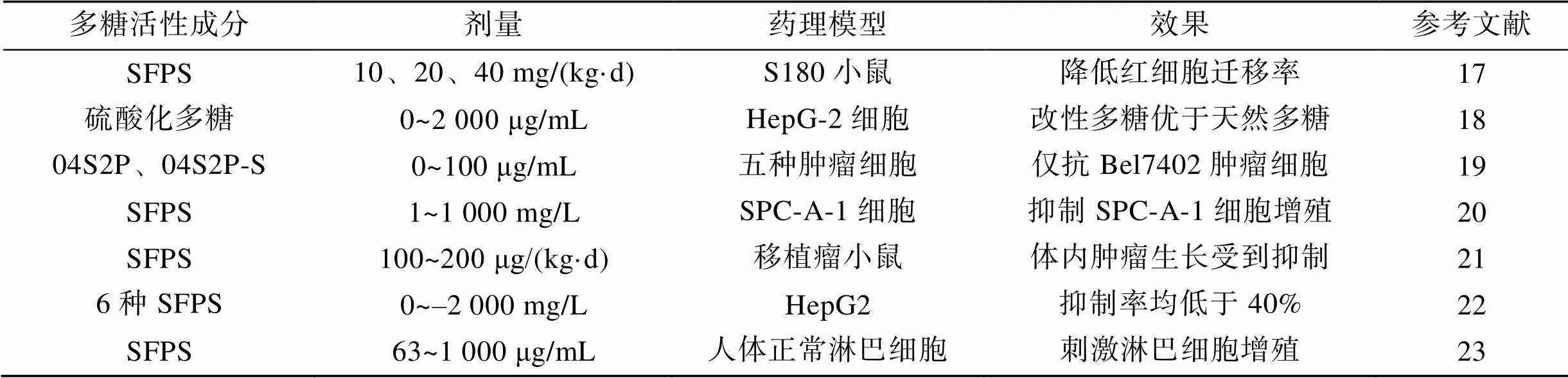
表1 羊栖菜多糖抗肿瘤实例

图1 羊栖菜多糖抗肿瘤作用机制
2 羊栖菜多糖抗肿瘤机制
2.1 细胞周期阻滞
在多细胞生物中, 细胞增殖和细胞死亡是由机体精确调节以维持组织稳态。大多数的肿瘤细胞都有一个共同特点, 即与细胞增殖相关的基因被开启或激活, 而与细胞分化有关的基因被关闭或抑制, 从而表现为不受机体约束的无限增值状态。已有报道羊栖菜多糖通过使细胞周期停滞在G2/M期、S期或G0/G1期起作用。胡晨熙等[25]分离纯化获得羊栖菜褐藻糖胶(CSFP-1)并作用于肺癌细胞A549、宫颈癌细胞HeLa和肝癌细胞Hep3B, 结果发现CSFP-1具有选择性细胞毒性, 对A549和Hep3B细胞无明显影响, 但对HeLa细胞具有显著抑制作用, 当剂量为300 μg/mL CFPS-1处理Hela细胞时, 其抑制率达到35.1%。HeLa细胞经过CSFP-1处理24 h后, G1期细胞比例明显减少, 48 h后S期比例显著增加, G2期细胞比例显著减少。Chen等[26]通过体外研究发现SFPS抑制人肺腺癌SPC-A-1细胞的增殖呈浓度依赖性, 低浓度(30 mg/L)至高浓度(300 mg/L)的SFPS都能有效诱导细胞周期阻滞于G2/M期, 并显著增加人脐静脉内皮细胞HUVECs的凋亡, 并能抑制HUVEC细胞中VEGF-A的表达。季宇彬等[27]通过体外抗肿瘤实验观察SFPS对6种不同肿瘤细胞的抑制作用, 发现SFPS对人胃癌细胞SGC-7901和直肠癌COLO-205有较好的疗效, 可以阻滞SGC-7901人胃癌细胞由G0/G1期进入S期。梁倩[28]和张华芳[29]等研究SFPS对人白血病HL-60细胞增殖的影响, 结果表明, SFPS诱导HL-60细胞凋亡并呈浓度和时间依赖性, 24 h的IC50为390 mg/L; 同时G2/M期细胞比例增多。王建光等[30]研究SFPS对乳腺癌MCF-7细胞凋亡的诱导作用, 发现SFPS可阻滞MCF-7由G0/G1期进入S期, 升高细胞凋亡指数(APO)。陈金星等[31]研究SFPS对人大肠癌Lovo细胞和RKO细胞增殖的作用, 实验发现SFPS对Lovo 细胞和RKO细胞作用24 h的IC50分别为149和123 mg/L。RKO细胞G0/G1期的细胞比例随着浓度的增加而增高, 相应的S期细胞比例显著下降, 而Lovo细胞的细胞周期时相比无明显改变。将肿瘤细胞阻滞于G0/G1和G2/M期, 降低S期的细胞比例被认为是由于细胞周期蛋白依赖性激酶受到抑制和细胞周期检查点激活导致凋亡小体的产生, 随后导致细胞死亡。
2.2 增强免疫机制
目前常用的一些抗癌药物具有免疫抑制作用, 如环孢素, 有报道称用该药后, 患者肿瘤发生率高达一般人的30倍。Yoon等[32]研究SFPS对小鼠巨噬细胞RAW 264.7和整个脾脏细胞的作用, 研究发现SFPS可以激活RAW 264.7细胞产生细胞因子, 如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6), 并且刺激了全脾细胞的有丝分裂。陈柳君等[33]体内实验表明, SFPS能显著影响小鼠脾指数和胸腺指数; 体外实验表明, SFPS对RAW 264.7细胞的增值能力和吞噬能力影响不一, 但都能明显促进TNF-α。王扬等[34]通过腹腔注射得率最高的羊栖菜多糖F1和f1组分, 发现对小鼠抗SRBC抗体生成有促进作用, 同时明显提高小鼠脾指数。况炜等[35]研究SFPS对离体小鼠脾细胞免疫调节活性发现SFPS能显著升高小鼠脾细胞IL-2、TNF-α和IFN-γ。严全能等[36]通过腹腔注射SFP2发现其能显著提高小鼠胸腺指数, 提高小鼠NK细胞杀伤活性及腹腔巨噬细胞的吞噬活性。Chen等[21]利用环磷酰胺治疗肿瘤小鼠使其产生免疫抑制, 实验结果表明, 经SFPS刺激后小鼠的脾淋巴细胞开始增殖, 显著增加了腹膜巨噬细胞的吞噬率和细胞因子(IL-2、IL-6和TNF-α)的分泌。同年, Chen等[37]对接种A549细胞的小鼠口服使用SFPS 28d, 实验结果表明, SFPS不仅显著抑制小鼠肺腺癌A549的生长, 而且能显著提高血清中TNF-α含量, 促进A549荷瘤小鼠腹腔巨噬细胞产生IL-1和TNF-α以及脾细胞的增殖。Toll样受体(TLRs)是一种膜结合受体, 对病原体的识别通过诱导促炎细胞因子的产生和共刺激分子的上调来快速激活先天免疫。TLR信号通路被分为两组: MyD88依赖途径导致促炎细胞因子的生产快速激活NF-κB和MAPK通路, IFN-β与缓慢成熟的树突细胞激活NF-κB和MAPK通路。当使用Toll 样受体特异性抗体和NF-κB特异性抑制剂预处理腹膜巨噬细胞发现SFPS诱导的细胞因子TNF-α和IL-1减少, 表明SFPS诱导巨噬细胞分泌细胞因子至少部分是由TLRs/NF-κB信号传导途径所介导的[38]。但是SFPS通过NF-κB信号途径调节免疫应答的确切机制尚未阐明, Chen[39]通过PDTC、BAY11-7082、IKK16和SB203580等特异性抑制剂研究, 发现SFPS通过CD14/IKK和P38激活NF-κB信号传导途径。Fan等[40]通过研究SFPS对HepG2细胞的作用, 也发现SFPS可以在HepG2荷瘤小鼠中促进腹膜巨噬细胞分泌细胞因子TNF-α和IL-1。Fan等[41]进一步通过SFPS对鼻咽癌进行抗肿瘤研究, 发现SFPS能增加脾脏中IgM水平, 用抗TLR4和TLR2的特异性抗体预处理脾淋巴细胞, 能显著抑制脾淋巴细胞的增殖并阻断SFPS诱导IgM产生。丝裂原活化蛋白激酶(MAPK)级联是一个高度保守的模块, 参与细胞的各种功能, 包括细胞迁移, 增殖以及对环境的应激适应和炎症反应, MAPK可分为4个亚族: ERK、p38、JNK和ERK5。SB203580是p38 MAPK的特异性抑制剂, 处理脾淋巴细胞后有效抑制SFPS诱导的IgM分泌, 因此SFPS的免疫活性至少部分由TLR2/TLR4受体和p38 MAPK信号通路介导。因此增强肿瘤患者的宿主免疫可以恢复肿瘤细胞和免疫反应之间的动态平衡, 从而发挥潜在的抗肿瘤作用。
2.3 抑制肿瘤微血管的形成
血管生成是肿瘤发生的重要过程, 持续血管生成是恶性肿瘤的特征之一。VEGF也称为VEGF-A, 与VEGF受体-2接合导致不同信号通路的级联, 介导内皮细胞增殖和迁移、促进其存活和血管通透性的基因上调, 是血管形成的关键因子。VEGFR-2被认为是生理性和病理性血管生成的一个重要对的信号转换器, Chen等[25]通过研究SFPS对肿瘤血管生长的影响, 进而探索SFPS对肺癌的抑制作用, 结果发现, 40 mg/kg SFPS能显著减少肿瘤块的质量, 具有诱导人脐静脉内皮细胞凋亡(HUVECs)的能力, 显著降低了CD31、VEGF-A的表达及其受体VEGFR-2在HUVECs中的表达, SFPS在体外实验中对SPC-A-1细胞的增殖和体内肿瘤生长均有抑制性, 降低了肿瘤微血管密度(MVD)。Chen 等[42]发现羊栖菜多糖FP08S2在16.84 μmol/L 时能显著损害HMEC-1细胞形成毛细血管的能力, 还可以抑制人类微血管内皮细胞(HMEC-1)癌细胞的迁移和侵袭; 进一步的研究表明, FP08S2可以结合VEGF和VEGFR-2以干扰VEGF-EGFR-2相互作用阻碍了裸鼠A549和转移、生长, 并呈现出显著的抗肿瘤微血管生成活性。况炜等[20]研究发现, 300及1000 mg/L 的SFPS可通过抑制肿瘤血管内皮细胞的增殖而抑制肿瘤的生长。陈慧玲等[43]研究发现, 30~100 mg/L SFPS能显著降低人胃癌MGC-803细胞培养基上清VEGF的含量, 具有抑制肿瘤血管内皮细胞增殖的作用, 其作用机制与下调肿瘤细胞VEGF-A和肿瘤血管内皮细胞VEGFR-2的表达有关。这些发现表明, SFPS除了直接抑制肿瘤细胞生长外, 还能通过阻断VEGF信号来抑制微血管生成, 可以在细胞和血管两个方面控制肿瘤生长, 提升肿瘤治愈机率, 为药物治疗肿瘤开辟新路径。
2.4 改变细胞膜流动性和钙通道
肿瘤的发生不仅是因为细胞分裂失控所导致细胞过度增生, 还可能与细胞凋亡通路受阻所致, 凋亡的诱导和抑制与信号转导通路有关, 而Ca2+作为第二信使使其功能与细胞信号转导密切相关, 因此, Ca2+与细胞凋亡密切相关。季宇彬[44]通过建立S180肿瘤动物模型, 分低、中、高剂量空腹给予SFPS 7d, 采集制备红细胞悬液发现中剂量组(20 mg/(kg·d))SFPS能降低荷瘤小鼠红细胞内[Ca2+]i, 升高膜表面唾液酸含量, 增强膜表面Na+、K+-ATPase及Ca2+, Mg2+- ATPase的活性, 排除离子跨膜转运障碍, 提高红细胞的电泳合淌度增加红细胞在血循环中黏附肿瘤细胞的可能性[45]。季宇彬等[46]发现SFPS可以通过升高SGC-7901肿瘤细胞内[Ca2+]i启动肿瘤细胞凋亡机制而达到抗肿瘤作用。高世勇等[47]进一步观察SFPS对SGC-7901细胞内Ca2+含量的变化, 发现50 mg/L 的SFPS诱导肿瘤细胞凋亡可以通过升高人胃癌细胞内的[Ca2+]i而达到的, [Ca2+]i升高时Ca2+来源于细胞内的钙库释放。李杰女等[48]分离纯化获得羊栖菜多糖SFPS-B1, 测得SFPS-B1对SGC-7901细胞的IC50为189.30 mg/L, 并发现SFPS-B1作用肿瘤细胞后, SGC-7901细胞内[Ca2+]i明显上升, pH值明显降低, 使得与细胞凋亡相关的酶和蛋白活性发生改变, 最终引起了细胞凋亡。
2.5 改变凋亡相关基因表达
肿瘤细胞发生凋亡时, 凋亡相关的基因及蛋白也会发生明显的变化。严璘璘等[49]发现SFPS作用Lovo细胞24 h的IC50为375 mg/L, Lovo细胞中Caspase-3酶原蛋白表达降低, Caspase-3的mRNA高表达, 提示Caspase-3的活化参与了SFPS诱导Lovo细胞凋亡的调控。其进一步研究SFPS诱导Lovo细胞凋亡过程中Caspase-3、Caspase-8、Caspase-9的活性变化, 实验发现Caspase-3、Caspase-8、Caspase-9活性均有时间依赖性增高的趋势, 但Caspase-8活性变化不明显, 这提示SFPS作用Lovo细胞后, 通过激活启动Caspase-9, 进而激活下游效应Caspase-3的级联反应来实现的[50]。王建光等[29]研究SFPS对MCF-7细胞凋亡相关基因的影响中发现50 mg/L的SFPS能够上调凋亡相关蛋白Fas和FasL的表达, 促进肿瘤细胞凋亡。胡晨熙等[24]以300 μg/mL羊栖菜褐藻糖胶(CSFP-1)处理48 h Bcl-2蛋白表达显著减少, Beclin-1蛋白表达显著增加, 且存在时间和剂量相关性。季宇彬等[51]通过对SFPS对肿瘤细胞P53基因表达研究发现给药组400 μg/mL SFPS组P53基因的表达率明显高于阴性对照组, 表明SFPS可显著诱导肿瘤细胞P53水平的增加从而达到抗肿瘤的作用。Ji[52]在体外培养的人胃癌细胞系SGC-7901中加入同浓度的SFPS-B2进行药物刺激, SFPS-B2可以抑制SGC-7901细胞的生长, 相关凋亡酶 Caspase-3、Caspase-9的活性增强, 对增殖基因Bcl-2的表达起抑制作用, 并对凋亡基因Bax、细胞色素C基因的表达起促进作用。
2.6 其他作用机制
季宇彬等[44]分析SFPS对S180荷瘤小鼠红细胞相关生化功能影响, 通过流式细胞仪发现SFPS能提高红细胞膜电位水平, 可调节或恢复S180荷瘤小鼠红细胞多种生理生化功能。陈慧玲[53]等通过将不同浓度的SFPS作用于离体小鼠NK细胞和小鼠腹腔巨噬细胞, 研究发现30 mg/L 的SFPS能明显增强离体小鼠NK细胞活性, 促进巨噬细胞释放NO。Yoon等[32]发现羊栖菜多糖能调节小鼠巨噬细胞RAW 264.7中的NO。Fan等[40]研究发现1 000 μg/mL 的SFPS能极显著增加HepG2荷瘤小鼠血清中NO水平, 同时通过增加Bax基因表达, 抑制Bcl-2基因表达来诱导HepG2细胞凋亡。Ji[52]在体外培养的人胃癌细胞系SGC-7901中加入不同浓度的SFPS-B2进行药物刺激72 h, 其IC50为189.30 g/L, 且细胞内线粒体通透性转换孔(MPTP)被激活且线粒体膜电位(MMP)含量下降。
3 讨论
目前治疗恶性肿瘤的主要方法是手术切除, 放射治疗, 激素治疗, 抗激素治疗和化疗。肿瘤化疗的两大障碍是药物的毒性和耐药性, 细胞毒类抗肿瘤药物由于对肿瘤细胞的选择性低, 在杀伤肿瘤细胞的同时对正常的组织细胞产生不同程度的毒性, 导致脱发, 贫血, 免疫缺陷, 疲劳, 生育及神经等问题, 毒性反应成为肿瘤化疗时药物用量受限的关键因素。此外, 化疗过程中肿瘤细胞对药物耐药性是肿瘤化疗失败的重要原因, 也是肿瘤化疗急需要解决的问题。因此, 寻找新化合物作为潜在抗癌药物的探索有助于研究各种来源多糖的抗癌活性。在过去的十年里, 超过100多种来源的多糖被证实在一系列的癌细胞系中表现出良好的抗癌活性, 同时证明了大多数多糖克服了常规化疗中的主要缺点, 比如甲壳质类多糖对肿瘤细胞具有选择性细胞毒性, 其他几种多糖能够起到免疫调节剂的作用, 不仅可以增强人体对癌细胞的防御作用还可以与常规化疗药物联合使用, 降低化疗药物引起的免疫机制。
近十年来, 对羊栖菜多糖的研究已经显示出作为抗癌药物的一线希望。羊栖菜多糖具有良好的药用前景, 因其对肿瘤细胞的增殖凋亡起控制作用, 针对正常人胃黏膜上皮细胞进行细胞毒性实验[50], 发现SFPS在5~5 000 mg/L浓度范围内无明显杀伤力, 表明SFPS具有选择细胞毒性能力, 而且SFPS具有提升免疫应答水平的功能; SFPS已经对许多肿瘤细胞进行了体外实验, 但有必要使用不同癌症的动物模型对其体内研究进行评估。刘雪等[54]用CaCl2溶液提取羊栖菜多糖, 分离纯化后的SFP-2主要由岩藻糖和半乳糖构成, 红外图谱显示具有硫酸基团吸收峰。具有良好的抗氧化活性。李媛等[55]利用核磁共振波谱仪对从羊栖菜中分离纯化的褐藻胶结构进行分析, 发现β-D-甘露糖醛酸与α-L-古罗糖醛酸的比值为0.98, G嵌段的平均长度为16.2。肖保衡等[56]从羊栖菜中获得褐藻糖胶, 纯化发现CSFP2的硫酸基含量最高, 仪器分析表明其结构可能以Gal为主链, 以1→6糖苷键连接, 在C3、C4和C6位置上连接甘露糖, 在C3位上含有硫酸根基团。目前对羊栖菜多糖的结构均有一定报道, 但是羊栖菜多糖的构效关系较少, 尤其是抗肿瘤方面的构效鲜有报道。Jin等[57]研究羊栖菜来源的岩藻聚糖硫酸酯抗补体活性, 发现高分子质量及高硫酸化岩藻聚糖硫酸酯具有更好的抗补体活性。Wei等[58]研究海带中提取的岩藻聚糖硫酸酯及脱硫酸盐衍生物的抗血管生成活性及抗肿瘤活性, 发现岩藻聚糖硫酸酯比脱硫酸基衍生物具有较强的抗血管生成作用。研究膀胱癌细胞系时, Chen等[59]从半叶马尾藻中分离出的低分子质量的岩藻聚糖硫酸酯能显著抑制血管生成。Matsubara等[60]研究表明, 低分子质量的岩藻聚糖硫酸酯可以促进人脐静脉内皮细胞新生血管, 高分子岩藻聚糖硫酸酯对人脐静脉内皮细胞新生血管有抑制作用。王雪妹[61]等研究表明来源于海带中低分子质量多糖硫酸酯抗炎效果明显高于高分子质量多糖硫酸酯。多糖的结构-活性关系全面研究有助于开发具有抗癌活性的多糖及其合成类似物, 通过靶抑制实验可以研制其作用途径。此外, 不同种属来源的岩藻聚糖硫酸酯结构差异巨大, 羊栖菜多糖的结构与抗肿瘤活性之间的构效关系尚未研究透彻, 因此探寻羊栖菜多糖的抑制功效及其抑制机制, 增强药用活性和专一性, 不仅深入了羊栖菜多糖药理性的研究, 而且将提升羊栖菜综合利用价值带动养殖户经济效益。
[1] Smit A J. Medicinal and pharmaceutical uses of seaweed natural products: A review[J]. Journal of Applied Phycology, 2004, 16(4): 245-262.
[2] Pang G, Wang F, Zhang L W. Dose matters: Direct killing or immunoregulatory effects of natural polysaccharides in cancer treatment[J]. Carbohydrate Polymers, 2018, 195: 243-256.
[3] 姚高妍, 丁小云. 肿瘤出芽在消化系统肿瘤的研究进展[J]. 肿瘤, 2018, 38(11): 1082-1089. Yao Gaoyan, Ding Xiaoyun. Tumor budding in gastrointestinal carcinomas: recent advances[J]. Tumor, 2018, 38(11): 1082-1089.
[4] Chao T L, Wang T Y, Lee C H, et al. Anti-cancerous effect ofpolysaccharide extract on human acute monocytic leukemia cells through ROS- independent intrinsic mitochondrial pathway.[J], 2018, 19(2), 1-13.
[5] Wei X Q, Cai L Q, Liu H L, et al. Chain conformation and biological activities of hyperbranched fucoidan derived from brown algae and its desulfated derivative[J]. Carbohydrate Polymers, 2019, 208: 86-96.
[6] Lajili S, Ammar H H, Mzoughi Z, et al. Characterization of sulfated polysaccharide fromand its apoptotic, gastroprotective and antioxidant activities[J]. International Journal of Biological Macromolecules, 2019, 126: 326-336.
[7] Hyun J H, Kim S C, Kang, J I, et al. Apoptosis inducing activity of fucoidan in HCT-15 colon carcinoma cells[J]. Biological and Pharmmaceutical Bulletin, 2009, 32(10): 1760-1764.
[8] Li Y T, Chen B J, Wu W D, et al. Antioxidant and antimicrobial evaluation of carboxylmethylated and hydroxamated degraded polysaccharides from[J]. International Journal of Biological Macromolecules, 2018, 118: 1550-1557.
[9] Sun Y H, Chen X L, Liu A, et al. Preparation of low molecular weightpolysaccharide and its anticoagulant activity[J]. Chinese Journal of Oceanology Limnology, 2018, 36(3): 882-891.
[10] 丁浩淼, 谢作亮, 谢琰, 等. 羊栖菜活性多糖的提取与生物活性研究进展[J]. 药物生物技术, 2015, 22(4): 369-372. Ding Haomiao, Xie Zuoliang, Xie Yan, et al. Research progress of extraction and biological activities in polysaccharides from[J]. Pharmaceutical Biotechnology, 2015, 22(4): 369-372.
[11] Ye Y H, Ji D S, You L J, et al. Structural properties and protective effect ofpolysaccharides against ultraviolet B radiation in hairless Kun Ming mice[J]. Journal of Functional Foods, 2018, 43: 8-16.
[12] Fu Z F, Liu H B, Hu S M, et al. Bioassay-guided extraction of crude fucose-containing sulphated polysaccharides fromwith response surface methodology[J]. Journal of Ocean University of China, 2016, 15(3): 533-540.
[13] 丁浩淼, 孙弢, 夏彭奎, 等. 羊栖菜组分多糖对α-葡萄糖苷酶的抑制作用[J]. 核农学报, 2018, 33(2): 297- 304. Ding Haomiao, Sun Tao, Xia Pengkui, et al. Inhibition of polysaccharide fraction ofon the α-glucoside[J]. Journal of Nuclear Agricultural Sciences, 2018, 33(2): 297-304.
[14] Hu P, Li Z Z, Chen M C, et al. Structural elucidation and protective role of a polysaccharide fromon ameliorating learning and memory deficiencies in mice[J]. Carbohydrate Polymers, 2015, 139: 150-158.
[15] Chen P, Yang S, Hu S, et al.polysaccharide rejuvenates the small intestine in mice through altering its physiology and gut microbiota composition[J]. Current Molecular Medicine, 2017, 17(5): 350-358.
[16] Chen B J, Shi M J, Cui S, et al. Improved antioxidant and anti-tyrosinase activity of polysaccharide fromby degradation[J]. International Journal of Biological Macromolecules, 2016, 92: 715- 722.
[17] Ji Y B, Wang C, Wu T, et al. Effect ofpolysaccharides on the complex mobility of erythrocytes in tumor-bearing organisms using high performance capillary electrophoresis[J]. Chinese Journal of Chromatography, 2007, 25(3): 322-325.
[18] Yu M, Ji Y B, Qi Z, et al. Anti-tumor activity of sulfated polysaccharides from[J]. Saudi Pharmaceutical Journal, 2017, 25(4): 464-468.
[19] Cong Q F, Xiao F, Liao W F, et al. Structure and biological activities of an alginate from, and its sulfated derivative[J]. International Journal of Biological Macromolecules, 2014, 69: 252-259.
[20] 况炜, 陈慧琳. 羊栖菜多糖对人肺癌细胞及肿瘤血管内皮细胞模型增殖活性的影响[J]. 现代实用医学, 2011, 23(3): 256-267. Kuang Wei, Chen Huiling. Effects ofpolysaccharides on proliferate activity of lung cancer cells and tumor vascular endothelial cell model[J]. Modern Practical Medicine, 2011, 23(3): 256-267.
[21] Chen X M, Nie W J, Yu G Q, et al. Antitumor and immunomodulatory activity of polysaccharides from[J]. Food Chemical Toxicology, 2012, 50(3/4): 695-700.
[22] 岑颖洲, 马夏军, 王凌云, 等. 羊栖菜多糖的制备及其对HepG2细胞的抑制作用[J]. 中国海洋药物, 2005, 24(1): 21-24. Cen Yingzhou, Ma Xiajun, Wang Lingyun, et al. Preparation of polysaccharides fromand its inhibitory effect on the HepG2 cell[J]. Chinese Journal of Marine Drugs, 2005, 24(1): 21-24.
[23] Shan B E, Yoshida Y, Kuroda E, et al. Brief communication immunomodulating activity of seaweed extract on human lymphocytes in vitro[J]. International Journal of Immunopharmacology, 1999, 21(1): 59-70.
[24] Khan T, Date A, Chawda H, et al. Polysaccharides as potential anticancer agents-A review of their progress[J]. Carbohydrate Polymers, 2019, 210: 412-428.
[25] 胡晨熙, 肖保衡, 刘剑, 等. 羊栖菜褐藻糖胶CSFP-1抗肿瘤活性及机制研究[J]. 药物评价研究, 2018, 41(9): 1581-1588. Hu Chenxi, Xiao Baoheng, Liu Jian, et al. Preliminary study on anti-tumor activity of fucoidan of[J]. Drug Evaluation Research, 2018, 41(9): 1581-1588.
[26] Chen H L, Zhang L, Long X G, et al.polysaccharides inhibit VEGF-A-related angiogenesis and proliferation of lung cancer in vitro and in vivo[J]. Biomedicine Pharmacotherapy, 2017, 85: 22-27.
[27] 季宇彬, 高世勇. 羊栖菜多糖体外抗肿瘤作用及作用机制的研究[J]. 中草药, 2003, 34(12): 1111-1114. Ji Yubin, Gao Shiyong. Studies on antitumor activities ofpolysaccharide in vitro and its mechanism[J]. Chinese Traditional and Herbal Drugs, 2003, 34(12): 1111-1114.
[28] 梁倩, 李继承, 张华芳. 羊栖菜多糖诱导HL-60细胞凋亡的研究[J]. 实验生物学报, 2004, 37(2): 125-132. Liang Qian, Li Jicheng, Zhang Huafang. Study on the apoptosis of HL-60 human promyeloid leukemia cells induced by SFPS[J]. Acta Biologiae Experimentalis Sinica, 2004, 37(2): 125-132.
[29] 张华芳, 金京顺, 俞朝阳. 羊栖菜多糖诱导肿瘤细胞凋亡的实验研究[J]. 时珍国医药, 2006, 17(7): 1124- 1125. Zhang Huafang, Jin Jingshun, Yu Zhaoyang. Apoptosis in tumor cells induced by polysaccharides from[J]. Li Shi Zhen Medicine and Materia Medica Research, 2006, 17(7): 1124-1125.
[30] 王建光, 杨新宇. 羊栖菜多糖诱导MCF-7细胞凋亡机制的研究[J]. 中国老年学杂志, 2005, 25(5): 567- 569. Wang Jianguang, Yang Xinyu. Study on the apoptosis mechanism of MCF-7 cell induced by SFPS[J]. Chinese Journal of Gerontology, 2005, 25(5): 567-569.
[31] 陈金星, 胡昔城, 杨维, 等. 羊栖菜多糖体外诱导人大肠癌细胞凋亡[J]. 基础医学与临床, 2008, 28(2): 154-159. Chen Jinxing, Hu Xicheng, Yang Wei, et al. The in vivo apoptosis of human colon cancer cells induced by SFPS[J]. Basic and Clinical Medicine, 2008, 28(2): 154-159.
[32] Yoon Y D, Lee E S, Park J P, et al. Immunostimulatory effect by aqueous extract ofin raw 264.7 macrophage and whole spleen cells[J]. Biotechnology and Bioprocess Engineering, 2011, 16(6): 1099- 1105.
[33] 陈柳君, 宁亚静, 康彩峰, 等. 羊栖菜多糖提取及免疫活性初步探究[J]. 中国海洋药物, 2017, 36(3): 81- 88. Chen Liujun, Ning Yajing, Kang Caifeng, et al. Study on extraction, purification and immunobiological activities of polysaccharides from[J]. Chinese Journal of Marine Drugs, 2017, 36(3): 81-88.
[34] 王扬, 何良强, 王海洪, 等. 羊栖菜多糖对小鼠免疫功能的影响[J]. 宁波大学学报, 2003, 16(3): 245-247. Wang Yang, He Liangqiang, Wang Haihong, et al. Effect ofon immunity of mice[J]. Journal of Ningbo University, 2003, 16(3): 245-247.
[35] 况炜, 陈慧玲, 章皓, 等. 羊栖菜多糖免疫调节活性的实验研究[J]. 实用医学杂志, 2012, 28(23): 3872- 3873. Kuang Wei, Chen Huiling, Zhang Hao, et al. Study on immunomodulatory activity of SFPS[J]. The Journal of Pract ical Medicine, 28(23): 3872-3873.
[36] 严全能, 陈均忠, 陈晓文, 等. 羊栖菜多糖的分离纯化及对小鼠免疫功能的影响[J]. 实用医学杂志, 2008, 24(12): 2046-2048. Yan Quanneng, Chen Junzhong, Chen Xiaowen, et al. Isolation of polysaccharides fromand their immune regulation effects in mice[J]. The Journal of Pract ical Medicine, 2008, 24(12): 2046-2048.
[37] Chen X M, Nie W J, Fan S R, et al. A polysaccharide fromprotects against immunosuppression in cyclophosphamide-treated mice[J]. Carbohydrate Polymers, 2012, 90: 1114-1119.
[38] Chen X M, Yu G Q, Fan S R, et al.polysaccharide activates nuclear factor kappa-B(NF-κB) and induces cytokine production via Toll-like receptors[J]. Carbohydrate Polymers, 2014, 105: 113-120.
[39] Chen L J, Chen P C, Liu J, et al.polysaccharide SFP-F2 activates the NF-κB signaling pathway via CD14/IKK and P38 axes in RAW264.7 cells[J]. Marine Drugs, 2018, 16(8): 1-15.
[40] Fan S R, Zhang J F, Nie W J, et al. Antitumor effects of polysaccharide fromagainst human hepatocellular carcinoma HepG2 cells[J]. Food Chemical Toxicology, 2017, 102: 53-62.
[41] Fan S R, Yu G Q, Nie W J, et al. Antitumor activity and underlying mechanism ofpolysaccharides in CNE-bearing mice[J]. International Journal of Biological Macromolecules, 2018, 112: 516-522.
[42] Chen H J, Cong Q F, Du Z Y, et al. Sulfated fucoidan FP08S2 inhibits lung cancer cell growth in vivo by disrupting angiogenesis via targeting VEGFR2/VEGF and blocking VEGFR2/Erk/VEGF signaling[J]. Cancer Letters, 2016, 382(1): 44-52.
[43] 陈慧玲, 李培飞, 陈声灿, 等. 羊栖菜多糖通过VEGF途径抑制胃癌细胞诱导的肿瘤血管内皮细胞增殖的实验研究[J]. 现代实用医学, 2016, 28(6): 710-712. Chen Huiling, Li Peifei, Chen Shengcan, et al. Inhibition ofpolysaccharides on the proliferation of tumor vascular endothelial cells induced by gastric tumor cells via regulating vascular endothelial growth factor[J]. Modern Practical Medicine, 2016, 28(6): 710-712.
[44] 季宇彬, 汲晨锋, 王翀, 等. 羊栖菜多糖对S180荷瘤小鼠红细胞相关生化功能影响的研究[J]. 中国药学杂志, 2009, 44(1): 22-25. Ji Yubin, Ji Chenfeng, Wang Chong, et al. Effect ofpolysaccharides on biochemistry function of erythrocyte membrane in s180 mice[J]. Chinese Pharmaceutical Journal, 2009, 44(1): 22-25.
[45] 季宇彬, 孔琪, 高世勇. 羊栖菜多糖对荷瘤小鼠红细胞膜Na+, K+-ATPase活性的影响[J]. 哈尔滨商业大学学报, 2001, 17(1): 1-4. Ji Yubin, Kong Qi, Gao Shiyong. Influence of SFPS on the activities of Na+, K+-ATPase in erythrocyte membrane of mice bearing tumor[J]. Journal of Harbin Commercial University Natural Science Edition, 2001, 17(1): 1-4.
[46] 季宇彬, 高世勇, 张秀娟. 羊栖菜多糖诱导肿瘤细胞凋亡的研究[J]. 中国中药杂志, 2004, 29(3): 245-247. Ji Yubin, Gao Shiyong, Zhang Xiujuan. Influence ofpolysaccharide on apoptosis of tumor cells[J]. China Journal of Chinese Materia Medica, 2004, 29(3): 245-247.
[47] 高世勇, 季宇彬. 羊栖菜多糖对SGC-7901人胃癌细胞内[Ca2+]i的影响[J]. 天津中医药, 2003, 20(4): 62- 64. Gao Shiyong, Ji Yubin. Influence of SFPS on [Ca2+]i of SGC-7901[J]. Tianjin Journal of Traditional Chinese Medicine, 2003, 20(4): 62-64.
[48] 李杰女, 汲晨锋, 季宇彬. 羊栖菜多糖SFPS-B1诱导SGC-7901细胞凋亡及对细胞[Ca2+] i和pH值的影响[J].中草药, 2009, 40: 205-208. Li Jienu, Ji Chenfeng, Ji Yubin. Apoptosis of SGC-7901 cells induced bySFPS-B1 and its effect on [Ca2+] i and pH values[J]. Chinese Traditional and Herbal Drugs, 2009, 40: 205-208.
[49] 严璘璘, 梁倩, 李继承. 羊栖菜多糖诱导Lovo细胞凋亡及其机理探讨[J]. 实验生物学报, 2005, 38(5): 447-455. Yan Linlin, Liang Qian, Li Jicheng. Study on the apoptosis and its mechanism of Lovo human colorectal cancer cells induced by cells[J]. Acta Biologiae Experimentalis Sinica, 2005, 38(5): 447-455.
[50] 严璘璘, 梁倩, 李继承. 羊栖菜多糖通过激活Caspase途径诱导Lovo细胞凋亡[J]. 细胞生物学杂志, 2006, 28(2): 193-200. Yan Linlin, Liang Qian, Li Jicheng. Apoptosis in Lovo cells induced by SFPS was associated with a activation of Caspase-3 mediated by Caspase-9[J]. Chinese Journal of Cell Biology, 2006, 28(2): 193-200.
[51] 季宇彬, 高世勇, 孔琪, 等. 羊栖菜多糖对P53基因蛋白表达的影响[J]. 哈尔滨商业大学, 2001, 17(2): 1-3. Ji Yubin, Gao Shiyong, Kong Qi, et al. Effect of alga polysaccharide on P53 gene expression of tumors cells[J]. Journal of Harbin Commercial University Natural Science Edition, 2001, 17(2): 1-3.
[52] Ji Y B, Ji C F, Yue L. Human gastric cancer cell line SGC-7901 apoptosis induced by SFPS-B2 via a mitochondrial-mediated pathway[J]. Bio-Medical Materials and Engineering, 2014, 24(1): 1141-1147.
[53] 陈慧玲, 况炜, 章皓, 等. 羊栖菜多糖对离体小鼠NK细胞活性和巨噬细胞功能的影响[J]. 现代实用医学, 2009, 21(7): 691-695. Chen Huiling, Kuang Wei, Zhang Hao, et al. Effects ofpolysaccharides on mouse NK cell activity and the function of mouse peritoneal macrophage in vivo[J]. Modern Practical Medicine, 2009, 21(7): 691-695.
[54] 刘雪, 王桂宏, 赵福江, 等. 羊栖菜褐藻糖胶的结构表征及其抗氧化活性[J]. 食品工业科技, 2019, 40(3): 79-84. Liu Xue, Wang Guihong, Zhao Fujiang, et al. Structural characterization and antioxidant activities of fucoidan from[J]. Science and Technology of Food Industry, 2019, 40(3): 79-84.
[55] 李媛, 杨方, 高沛, 等. 羊栖菜中的褐藻胶的分离纯化与结构鉴定[J]. 食品科技, 2018, 43(5): 219-223. Li Yuan, Yang Fang, Gao Pei, et al. Purification and structure identification of algin in[J]. Food Science and Technology, 2018, 43(5): 219-223.
[56] 肖保衡, 张旭, 陈培超, 等. 羊栖菜褐藻糖胶CSFP2的结构研究[J]. 浙江海洋大学学报, 2017, 36(5): 396- 402. Xiao Baoheng, Zhang Xu, Chen Peichao, et al. Study on the structure of CSFP2 fucoidan of[J]. Journal of Zhejiang Ocean University, 2017, 36(5): 396-402.
[57] Jin W, Zhang W, Liang H, et al. The structure-activity relationship between marine algae polysaccharides and anti-complement activity[J]. Marine Drugs, 2016, 14(1): 3.
[58] Wei X Q, Cai L Q, Liu H L, et al. Chain conformation and biological activities of hyperbranched fucoidan derived from brown algae and its desulfated derivative[J]. Carbohydrate Polymers, 2018, 208: 86-96.
[59] Chen M C, Hsu W L, Wang P A, et al. Low molecular weight fucoidan inhibits tumor angiogenesis through downregulation of HIF-1/VEGF signaling under hypoxia[J]. Marine Drugs, 2015, 13: 4436-4451.
[60] Matsubara K, Xue C, Zhao X, et al. Effects of middle molecular weight fucoidan on in vitro and ex vivo angiogenesis of endothelial cells[J]. International Journal of Molecular Medicine, 2005, 15: 695-699.
[61] 王雪妹, 王晶, 张全斌. 褐藻多糖硫酸酯对脂多糖诱导大鼠肾小球系膜细胞NO产生量的影响[J]. 海洋科学, 2014, 38(10): 1-5. Wang Xuemei, Wang Jing, Zhang Quanbin. Effect of fucoidan on NO production induced by LPS in rat glomerular mesangial cells[J]. Marine Science, 2014, 38(10): 1-5.
Progress in research on the antitumor activities ofpolysaccharides and their underlying mechanisms
DING Hao-miao, HONG Jia-yao, CHEN Xue-jia, LI Qin-qing, LI Gui-feng, WANG Cai-sheng, QIAN Guo-ying
(College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, China)
Apolysaccharide isolated fromis a succedaneum being developed for chemotherapeutic medicine. It displays antitumor activity in various tumor cell lines, exhibits good anticancer activity in several cancer cell lines, and possesses selective activity against tumor cells with minimal toxic side effects. Polysaccharides isolated fromhave been reported to act on malignant cells mainly via induction of apoptosis. They kill cancer cells, prevent metastasis via cell cycle arrest, enhance immunity, effect changes in calcium channels, alter cell membrane fluidity, disrupt mitochondrial membrane, and produce nitric oxide. The present study aimed to review previous research conducted on the antitumor activities ofpolysaccharides and the mechanisms underlying these antitumor activities to provide a theoretical and evidential basis for in-depth exploration and understanding of these polysaccharides.
; polysaccharides; antitumor mechanism
Sep. 16, 2019
R285
A
1000-3096(2020)03-0129-09
10.11759/hykx20190916001
2019-09-16;
2019-12-02
宁波“十三五”海洋经济创新发展示范项目资助 (NBHY-2017-S5, NBHY-2017(1)); 海藻化妆品开放研究及产业化示范 (1740004099)
[Ningbo “13th Five-Year Plan” Demonstration Project of Marine Economy Innovation and Development, No. NBHY-2017-S5, NBHY-2017(1); Open Research and Industrialization Demonstration of Seaweed Cosmetic , No. 1740004099]
丁浩淼(1991-), 男, 浙江宁波人, 博士, 主要从事天然产物功能研究, Email: 1601091039@nbu.edu.cn; 汪财生, 男,通信作者, 高级实验师, 电话: 0574-88222232; E-mail: wangcaisheng@zwu.edu.cn;钱国英, 女, 通信作者, 教授, 电话: 0574-88225850; E-mail: qiangy@ zwu.edu.cn
(本文编辑: 康亦兼)
