香港牡蛎二倍体及三倍体幼虫生物学特征比较
2020-04-17秦艳平张跃环莫日馆马海涛喻子牛
秦艳平, 张跃环, 莫日馆, 4, 李 军, 肖 述, 马海涛, 喻子牛
香港牡蛎二倍体及三倍体幼虫生物学特征比较
秦艳平1, 2, 3, 张跃环1, 2, 莫日馆1, 2, 3, 4, 李 军1, 2, 肖 述1, 2, 马海涛1, 2, 喻子牛1, 2
(1. 中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室 广东省应用海洋生物学重点实验室, 广东 广州 501310; 2. 南海生物资源开发与利用协同创新中心, 广东 广州 501275; 3. 中国科学院大学, 北京 100049; 4. 广西阿蚌丁海产科技有限公司, 广西 南宁 530000)
为了评估香港牡蛎二倍体及三倍体幼虫生物学特征, 于2013~2015年, 在湛江和北海两地比较了二倍体及三倍体幼虫生长、存活及变态差异, 计算了三倍体优势率, 评估了倍性与环境效应互作对其表型性状的影响。结果表明: 三倍体D形幼虫显著大于二倍体幼虫, 之后, 伴随着个体增长, 生长优势逐渐增大, 15日龄时的三倍体优势率为8.9%~9.1%。三倍体幼虫存活力与二倍体相当, 未出现大量致死现象。三倍体变态规格显著大于二倍体, 其优势率为5.1%~5.3%; 三倍体变态时间显著低于二倍体, 但其变态率与二倍体相当, 不存在显著差异(>0.05)。经过双因子分析模型的方差分析检测, 发现倍性和环境效应都会对香港牡蛎幼虫生长产生显著影响(<0.001), 环境是影响幼虫存活率及变态的主要因子(<0.05)。
香港牡蛎; 三倍体; 幼虫生物学; P×E互作
香港牡蛎(是一种半咸水型牡蛎, 主要分布在我国的南方沿海, 包括福建、广东、广西、海南等地, 具有生长快、个体大、味道鲜美等优点[1]。在华南地区, 香港牡蛎俗称“白蚝”, 是2003年从原来的近江牡蛎()中分离出来的一个新种[2-4]。香港牡蛎具有悠久的养殖历史, 至2017年, 其年产量近176万吨, 占我国牡蛎产量的36.5%, 贝类总产量的15%, 已经成为华南沿海贝类产业发展的最主要经济贝类之一[5]。
近些年, 学者们先后进行了香港牡蛎遗传育种工作, 采用巢式平衡设计建立了多个香港牡蛎家系, 评估了遗传力与遗传相关[6]; 开展了香港牡蛎选育工作, 计算了生长性状的选择反应及现实遗传力, 选育了速生系和抗逆系[7]; 进行了系间及种间杂交育种, 评估了杂种优势与杂种潜力, 培育出具有生长、抗逆双重优势的香港牡蛎杂交系[8-9]; 构建了以香港牡蛎为核心物种的远缘杂交育种体系, 通过种间杂交、种间回交、分子辅助育种等技术手段培育出我国南方第1个牡蛎新品种“华南1号”, 为香港牡蛎养殖产业可持续发展提供了可靠的技术保障[9~11]。与此同时, 学者们开展了香港牡蛎多倍体育种工作, 但是关于倍性和环境对香港牡蛎三倍体幼虫生长及存活影响的研究较少。本文在成功实现香港牡蛎三倍体高效诱导的基础上[12-14], 以二倍体幼虫为对照, 评估香港牡蛎三倍体幼虫生物学特征与生产性能, 以期为香港牡蛎多倍体育种体系构建基础。
1 材料与方法
1.1 幼虫生产
在2013—2015年每年的5—7月, 以性腺成熟的香港牡蛎(珠海群体)为亲本, 通过解剖法获得精卵, 选择9个卵子质量较好的个体作为母本, 3个精子活跃的个体作为父本, 按照40~50个/mL的卵子密度授精, 3个真重复实验组。其中, 1/3的受精卵用作二倍体对照组, 参照生产香港牡蛎全三倍体的时间点定量方法[13], 采用0.5 mg/L的细胞松弛素B处理2/3的受精卵, 抑制其第二极体排放, 能够获得100%三倍体幼虫[12]。
1.2 幼虫培养
2013—2015年期间, 为了比较二、三倍体幼虫生物学差异, 每年分别采用3个400 L黑桶培养二倍体, 3个400 L黑桶培养三倍体幼虫, 采用微充气模式进行培养, 幼虫密度控制在3~4个/mL, 每天换水量30%, 投喂金藻5 000~10 000个/(mL∙d)。为了比较环境对幼虫生长性能影响, 在中国科学院南海海洋研究所湛江经济动物实验站(以下简称: 湛江站)和广西北海贝类综合实验站(以下简称: 北海站)两地开展以上实验。在此期间, 湛江站海水温度为28~ 31.5℃, 盐度为16~18, pH为8.1~8.4; 北海站站海水温度为27.3~29.6℃, 盐度为18~21, pH为7.9~8.0。
1.3 指标测定
分别用光学显微镜测量D形幼虫壳长, 3、9、15日龄幼虫壳高及3、9、15日龄的存活率。变态规格是指初生壳与次生壳交界处的幼虫壳高; 变态时间是从受精至90%眼点幼虫出现鳃、次生壳, 完全固着在附着基上的时间; 变态率是指完成变态稚贝数量与眼点幼虫数量百分比。存活率是指边际存活率, 即两个时间点间幼虫数量的比值[16]。每个实验组设3个重复, 每个重复随机测量30个个体。
1.4 数据分析
用SPSS19.0统计软件对数据进行分析处理, 不同实验组间数据的比较采用单因素方差分析方法(One-way ANOVA), 用Turkey法进行组间多重比较, 差异显著性设置为<0.05。
为了评估三倍体幼虫的三倍体优势, 参照Zhang等[14]的方法, 利用如下公式计算三倍体优势率:
Td(%)=(3–2)×100/2, (1)
式中: Td(%)表示三倍体优势率,3表示三倍体幼虫壳高或存活率,2表示二倍体幼虫壳高或存活率。Td值为正数代表三倍体有优势, Td值为负数代表二倍体有优势。
为了检测倍性效应及其环境效应对表型性状的影响, 参照Qin等方法[15-16], 利用双因子分析模型检测倍性(ploidy, P)及环境(Environment, E)对各实验组代表型性状的影响:
Y=+P+E+(P×E)+e, (2)
式中:Y为个重复个基因型种环境下的壳高(存活率);为常数; P为壳高、存活率等的基因型(=1, 2); E为壳高、存活率等的环境效应(=1, 2); (P×E)为基因型与环境的交互作用;e为随机误差(=1, 2, 3)。为了提高正态性和方差齐性, 壳高数据在分析前进行对数转换, 存活率数据在分析之前进行反正弦转换[16]。
2 结果
2.1 生长
从表1中可以出, 刚孵化出的三倍体D形幼虫壳长(73.6~74.5 μm)显著大于二倍体(70.3~71.4 μm), 三倍体优势率为4.3%~4.7%。3日龄时, 幼虫发育至壳顶前期阶段, 湛江站的二、三倍体幼虫壳高分别为90.5±3.6 μm、96.3±4.5 μm, 三倍体优势率为6.4%; 北海站的二、三倍体壳高分别为99.7±4.7 μm、106.3±5.2 μm, 三倍体优势率为6.6%。9日龄时, 幼虫发育至壳顶中期阶段, 湛江站的二、三倍体幼虫壳高分别为155.2±12.8 μm、165.7±15.7 μm, 三倍体优势率为6.8%; 北海站的二、三倍体壳高分别为175.4± 16.0 μm、188.6±17.9 μm, 三倍体优势率为12.5%。15日龄时, 湛江站的二、三倍体幼虫的壳高分别为252.7±199.7 μm、275.6±22.1 μm, 三倍体优势率为9.1%; 北海站的二、三倍体壳高分别为295.4±25.6 μm、321.7±28.1 μm, 三倍体优势率为8.9%(表1)。
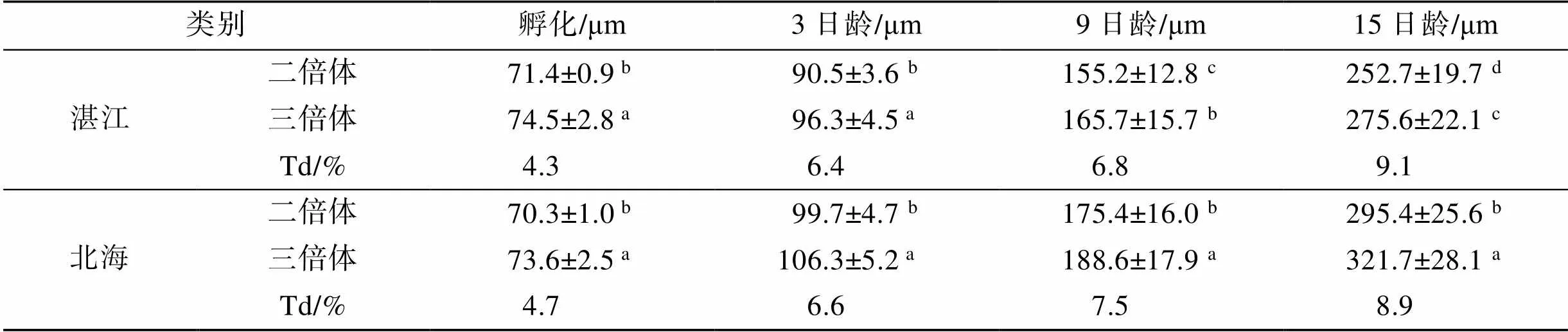
表1 二、三倍体幼虫生长比较及优势率
注: Td表示三倍体优势; 同一列不同上标字母表示有显著性差异(< 0.05)
由此可见, 两个实验站中北海站更适合于香港牡蛎幼虫生长, 无论是二倍体还是三倍体均快于湛江站; 而且, 两个站点三倍体幼虫一直大于二倍体, 说明三倍体在幼虫阶段就具有明显的三倍体优势。通过双因子分析模型检测发现, 倍性效应和环境效应都对香港牡蛎幼虫生长产生了极显著的影响, 而在幼虫生长的过程中二者间交互作用也产生了显著影响(表2)。
2.2 存活
3日龄时, 湛江站的二、三倍体存活率分别为85.4%、83.2%, 三倍体优势率为–2.6%; 北海站的二、三倍体存活率分别为90.6%、91.7%, 三倍体优势率为1.2%。9日龄时, 湛江站的二、三倍体存活率分别为76.1%、73.7%, 三倍体优势率为–3.2%; 北海站的二、三倍体存活率分别为85.2%、83.7%, 三倍体优势率为2.5%。15日龄时, 湛江站的二、三倍体存活率分别为45.5%、42.3%, 三倍体优势率为–7.0%, 北海站的二、三倍体存活率分别为67.7%、70.2%, 三倍体优势率为3.7%(表3)。
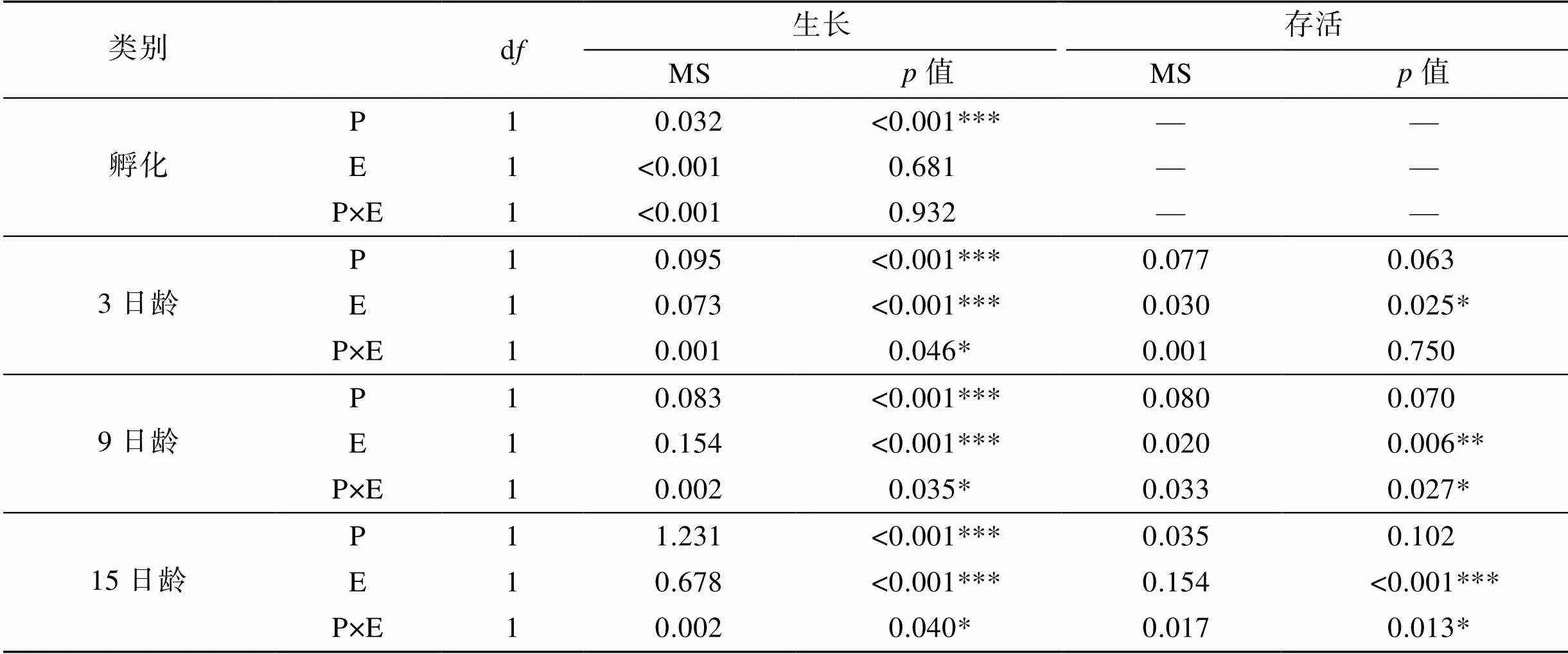
表2 幼虫期倍型与环境互作(P×E模型)对存活及生长性状影响的方差分析

表3 二、三倍体幼虫存活率比较及其优势率
注: Td表示三倍体优势; 同一列不同上标字母表示有显著性差异(<0.05)
上述结果显示: 北海站二、三倍体幼虫存活率均高于湛江站点, 且同一站的二、三倍体之间存活率相当, 差异不显著。经过双因子分析模型检测, 发现环境效应对于香港牡蛎幼虫存活率一直有极显著影响, 倍性与环境间的交互作用也对幼虫存活率有显著影响, 但是倍性效应并不会显著影响幼虫存活率(表2)。
2.3 变态
三倍体幼虫变态规格显著大于二倍体, 表现出一定的三倍体优势, 湛江站和北海站的三倍体优势率分别为5.1%、5.3%。而且三倍体幼虫变态时间较二倍体短, 湛江二、三倍体的变态时间分别为23.3 d、19.7 d, 北海二、三倍体的变态时间分别为20.3 d、17.3 d。从其变态率上看, 同一站的三倍体变态率略高于二倍体, 但二、三倍体间无显著差异, 且北海站培养的二、三倍体幼虫变态率均显著高于湛江站(表4)。
3 讨论
3.1 倍性和环境效应对香港牡蛎幼虫生长有显著影响
倍性和环境的交叉作用分析发现, 倍性和环境效应都会对香港牡蛎幼虫生长产生极显著的影响(<0.001), 这也和在其他种牡蛎中的研究结果相似。很多研究者已经证明了三倍体贝类的快速生长特性, 包括在美国硬壳蛤()[17]、扇贝()[18]、美洲牡蛎()[19]及太平洋牡蛎()[20-21]等。通常情况下, 三倍体比二倍体牡蛎生长速度快, 主要可归因于3个方面: (1) 细胞巨态, 三倍体细胞比二倍体大; (2)杂合度高, 三倍体杂合度较二倍体高, 导致生长速度快; (3)育性差, 三倍体高度不育, 在繁殖季节将生殖能量转化为生长能量[22-24]。对于香港牡蛎而言, 笔者也发现三倍体细胞确实大于二倍体, 而且三倍体的杂合度也高于二倍体, 可能是导致三倍体幼虫生长快的主要因素(待发表)。由于幼虫没有性成熟, 所以本文中的三倍体幼虫生长快, 不能用育性差解释。此外, 笔者也发现香港牡蛎三倍体生长相关通路即类胰岛素通路中大部分关键基因表达量较高, 具有较强的正向调节作用, 这可能是解释三倍体生长快的另外一种机制[16]。

表4 二、三倍体幼虫变态参数比较
注: Td表示三倍体优势; 同一列不同上标字母表示有显著性差异(<0.05)
环境会对香港牡蛎的幼虫生长产生显著性影响, 在其他贝类也发现了类似的结果[24-26]。Casas等发现温度和盐度对美洲牡蛎生长及生理产生很大影响[25]; Nell等发现太平洋牡蛎在相对高温条件下, 展现出快速生长能力[26]; 杜俊鹏等发现盐度会显著性影响香港牡蛎的生长、香港牡蛎幼虫在盐度20和25情况下生长较快[27]。环境因子对牡蛎幼虫生长的影响主要是通过影响其摄食及代谢, 林丽华等发现盐度会对香港牡蛎的摄食及代谢产生显著影响[28]。上述研究结果都说明环境效应的确能对香港牡蛎幼虫生长产生显著影响。
3.2 环境效应对香港牡蛎幼虫存活有显著影响
三倍体牡蛎的存活力往往比二倍体差, 尤其是早期阶段, 如孵化、幼虫培养和变态等阶段, 由于药物处理诱导的原因, 部分幼虫存活能力较低, 但一旦形成稚贝, 存活力往往会比二倍体高, 因为三倍体免疫力大多高于二倍体[29]。这也和其他贝类的研究结果相似, Zhang等在香港牡蛎三倍体[14]、Callam等在美洲牡蛎三倍体中[19]、Ibarra等在太平洋牡蛎三倍体中都发现浮游幼虫前期三倍体存活率较低[20], 而后期二、三倍体存活没有显著性差异。
杜俊鹏等发现盐度过高或过低都会引起香港牡蛎幼虫死亡率升高[27]; Piferrer等也确认了环境条件对牡蛎幼虫存活率有显著影响[29]。而在本研究中, 我们也发现三倍体幼虫存活力与二倍体相当, 虽然湛江站表现出存活力劣势, 但是三倍体存活率与二倍体相差不大; 双因素分析发现, 环境效应是影响存活率的主要因素[30-31], 这也和前述的研究结果一致。
3.3 倍性对香港牡蛎幼虫变态有一定影响
变态是海洋软体动物生命周期的最关键的转折点, 是从幼虫到稚贝的桥梁。对于牡蛎而言, 一旦完成变态, 生活方式从浮游生活转变为底栖生活, 呼吸和滤食方式从用面盘中口纤毛环到用鳃, 贝壳结构发生变化由原来的几丁质初生壳到长出出钙质次生壳[32]。在本研究中, 三倍体香港牡蛎幼虫相对于二倍体而言, 具有生长快、变态时间短的特点, 尚未出现延迟变态现象。二、三倍体变态率相当, 说明三倍体幼虫也可以正常变态, 形成稚贝。这也和在太平洋牡蛎、美洲牡蛎中的研究结果一致[19-20, 23-34], 说明倍性虽然会对牡蛎变态时间产生一定影响, 但是对于变态率没有显著影响。
总之, 通过比较二、三倍体香港牡蛎幼虫生物学的差异, 发现三倍体香港牡蛎幼虫相对二倍体生长快, 表现出三倍体优势; 存活力及变态水平相当, 说明三倍体从幼虫到变态阶段并未表现出明显的生理缺陷; 倍性及环境效应都会显著影响幼虫的生长, 环境效应是影响幼虫存活率的最主要因素。
[1] 张跃环, 王昭萍, 闫喜武, 等. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状[J]. 生态学报, 2012, 32(4): 1105-1114. Zhang Yuehuan, Wang Zhaoping, Yan Xiwu, et al. Phenotypic traits of both larvae and juvenileand[J]. Acta Ecologica Sinica, 2012, 32(4): 1105-1114.
[2] Boudry P, Heurtebise S, Lapegue S. Mitochondrial and nuclear DNA sequence variation of presumedandspecimens: a new oyster species in Hong Kong?[J]. Aquaculture, 2003, 28(1): 15-25.
[3] Lam K, Morton B. Mitochondrial DNA and morphological identification of a new species of(Bivalvia: Ostreidae) cultured for centuries in the Pearl River Delta, Hong Kong, China[J]. Aquaculture, 2003, 228(1): 1-13.
[4] 钟方杰, 严雪瑜, 高扬, 等. 广西茅尾海牡蛎天然种苗种类鉴定和群体组成的初步分析[J]. 海洋科学, 2014, 38(3): 91-93. Zhong Fangjie, Yan Xueyu, Gao Yang, et al. Species identification species group structure analysis of the common oysters from the Maowei sea in Guangxi[J]. Marine Sciences, 2014, 38(3): 91-93.
[5] 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2018.Bureau of Fisheries, Ministry of Agriculture. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2018.
[6] 肖述. 香港巨牡蛎 () 数量遗传学与选择育种研究[D]. 广州: 中国科学院南海海洋研究所, 2010. Xiao Shu. Studies on quantitative genetics and selective breeding of the Hong Kong oyster,[D]. Guang Zhou: South China Sea Institute of Oceanology Chinese Academy of Sciences, 2010.
[7] 肖述, 喻子牛. 养殖牡蛎的选择育种研究与实践[J]. 水产学报, 2008, 32(2): 287-295. Xiao Shu, Yu Ziniu. Review of selective breeding research and practice in oyster cultivation[J]. Journal of fisheries of China, 2008, 32(2): 287-295.
[8] Zhang Y, Su J, Li J, et al. Survival and growth of reciprocal crosses between two stocks of the Hong Kong oyster(Lam & Morton, 2003) in southern China[J]. Aquaculture Research, 2017, 48(5): 2344-2354.
[9] Zhang Y, Wang Z, Yan X, et al. Laboratory hybridization between two oyster:and[J]. Journal of Shellfish Research, 2012, 31(3): 619-625.
[10] Zhang Y, Zhang Y, Li J, et al. Phenotypic trait of♀×♂ hybrids in southern China[J]. Aquaculture Research, 2015, 47(11): 3399-3409.
[11] 张跃环, 王昭萍, 喻子牛, 等. 香港牡蛎()与长牡蛎()种间杂种遗传力评估[J]. 海洋与湖沼, 2014, 45(6): 1367-1373. Zhang Yuehuan, Wang Zhaoping, Yu Ziniu, et al. Evalution on vross-heritability of interspecific hybrids between femaleand male[J]. Oceanologia et Limnologia sinica, 2014, 45(6): 1367-1373.
[12] 秦艳平, 张跃环, 周颖力, 等. CB与6-DMAP诱导香港牡蛎三倍体的效果比较[J]. 水产学报, 2017, 41(2): 250- 257. Qin Yanping, Zhang Yuehuan, Zhou Yingli, et al. Comparative studies on triploidy induction using CB and 6-DMAP in[J]. Journal of Fisheries of China, 2017, 41(2): 250-257.
[13] 张跃环, 喻子牛, 苏家齐, 等. 一种生产香港牡蛎全三倍体的时间点定量处理方法[P]. 国家发明专利, 专利号: ZL201410403580.9. Zhang Yuehuan, Yu Ziniu, Su Jiaqi, et al. A time-point quantitative treatment method for the production of triploid Hong Kong oysters[P]. Patent: ZL201410403580.9.
[14] Zhang Y, Zhang Y, Wang Z, et al. Phenotypic trait analysis of diploid and triploid hybrids from female× male[J]. Aquaculture, 2014, 434(20): 307-314.
[15] 秦艳平, 张跃环, 莫日馆, 等. 三种香港牡蛎三倍体幼虫诱导方法的效果比较[J]. 中国水产科学, 2019, 26(4): 677-685. Qin Yanping, Zhang Yuehuan, Mo Riguan, et al. Three comparison methods of triploid induction in[J]. Journal of Fishery Sciences of China, 2019, 26(4): 677-685.
[16] Qin Y P, Zhang Y, Mo R, et al. Influence of ploidy and environment on grow-out traits of diploid and triploid Hong Kong oystersin southern China[J]. Aquaculture, 2019, 507: 108-118.
[17] Elwazzan E, Scarpa J. Comparative growth of triploid and diploid juvenile hard clamsunder controlled laboratory conditions[J]. Aquaculture, 2009, 289: 236-243.
[18] Ruiz-verdugo C A., Ramirez J L, Allen S k jr , et al. Triploid catarina scallop (Sowerby II, 1842): growth, gametogenesis, and suppression of functional hermaphroditism[J]. Aquaculture, 2000, 186(1-2): 13-32.
[19] Callam B R, Jr S K A, Frank-Lawale A. Genetic and environmental influence on triploidgrown in Chesapeake Bay: growth[J]. Aquaculture, 2016, 452(1): 97-106.
[20] Ibarra A M, Ascenciomichel R, Ramírez J L, et al. Performance of diploid and triploid(Thunberg, 1793) grown in tropical versus temperate natural environmental conditions[J]. Journal of Shellfish Research, 2017, 36(1): 119-139.
[21] Wadsworth P, Wilson A E, Walton W C. A meta-analysis of growth rate in diploid and triploid oysters[J]. Aquaculture, 2019, 499: 9-16.
[22] Comai L. The advantages and disadvantages of being polyploidy[J]. Nature reviews genetics, 2005, 6(11): 836-846.
[23] Allen S K, Downing S L, et al. Performance of triploid Pacific oysters,(Thunberg). I. Survival, growth, glycogen content, and sexual maturation in yearlings[J]. J. Exp. Mar. Biol. Ecol. 1986, 102(2-3): 197-208.
[24] Nell J A. Farming triploid oysters[J]. Aquaculture, 2002, 210(1-4): 69-88.
[25] Casas S M, Filgueira R, Lavaud R, et al. Combined effects of temperature and salinity on the physiology of two geographically-distant eastern oyster populations[J]. Journal of Experimental Marine Biology and Ecology, 2018, 506(sep): 82-90.
[26] Nell J A, Perkins B. Studies on triploid oysters in Australia: farming potential of all-triploid Pacific oysters,(Thunberg), in Port Stephens, New South Wales, Australia[J]. Aquaculture research, 2005, 36(6): 530-536.
[27] 杜俊鹏, 王昭萍, 于瑞海, 等. 盐度对香港巨牡蛎♀×葡萄牙牡蛎♂杂交子代早期杂种优势的影响[J]. 中国海洋大学学报, 2018, 48(1): 31-39. Du Junpeng, Wang Zhaoping, Yu Ruihai, et al. Effect of salinity on early heterosis of hybrid larvae between♀×♂[J]. Periodical of Ocean university of China, 2018, 48(1): 31-39.
[28] 林丽华, 廖文崇, 谢建文, 等. 盐度对香港巨牡蛎摄食和代谢的影响[J]. 广东农业科学, 2012, 39(11): 10-14. Lin Lihua, Liao Wenchong, Xie Jianwen, et al. Effect of salinity on the feeding and metabolic physiology of[J]. Guangdong Agricultural Sciences, 2012, 39(11): 10-14.
[29] Piferrer F, Beaumont A, Falguière J C, et al. Polyploid fish and shell fish: production, biology and applications to aquaculture for performance improvement and genetic containment[J]. Aquaculture, 2009, 293(3): 125-156.
[30] Degremont L, Garcia C, Frank-Lawale A, et al. Triploid oysters in the Chesapeake Bay: comparison of diploid and triploid[J]. Journal of Shellfish Research, 2012, 31(1): 21-31.
[31] Dégremont L, Soletchnik P, Boudry P. Summer mortality of selected juvenile Pacific oysterunder laboratory conditions and in comparison with field performance[J]. Journal of Shellfish Research, 2010, 29(4): 847-856.
[32] Yan X, Zhang Y, Huo Z, et al. Effects of starvation on larval growth, survival, and metamorphosis of Manila clam[J]. Acta Ecologica Sinica, 2009, 29(6): 327-334.
Comparison of biological characteristics between diploid and triploidlarvae
QIN Yan-ping1, 2, 3, ZHANG Yue-huan1, 2, MO Ri-guan1, 2, 3, 4, LI Jun1,2, XIAO Shu1, 2, MA Hai-tao1, 2, YU Zi-niu1, 2
(1. Key Laboratory of Tropical Marine Bio-resources and Ecology, Guangdong Provincial Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 501310, China; 2. South China Sea Bio-Resource Exploitation and Utilization Collaborative Innovation Center, Guangzhou 510275, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Guangxi A Bang-ding Marine Technology Company, Nanning 530000, China)
Survival, growth, and metamorphosis of diploid and triploid larvae of the Hong Kong oysterwere investigated. Larvae were collected from sites at Zhangjiang and Beihai from 2013 to 2015. The advantage offered and the effects of ploidy and environment on phenotype were assessed. Triploid D larvae were significantly larger than diploid larvae. This growth advantage gradually increased, reaching 8.9%–9.1% at the age of 15 days. No significant mortality was observed, and viability of diploid and triploid larvae was comparable. At metamorphosis, triploid larvae were larger than diploid larvae, with a triploid advantage of 5.1%–5.3%. Moreover, the duration of metamorphosis of triploid larvae was shorter than that of diploid larvae. No notable differences in metamorphosis as such are observed between diploid and triploid larvae. Using the P×E method, ploidy and environment are found to significantly influence larval growth (< 0.001). Environment is the primary factor that affects survival and metamorphosis of Hong Kong oyster larvae (< 0.05).
; triploid; biological characteristics; Ploidy and environment interaction
Aug. 27, 2019
S968.3
A
1000-3096(2020)03-0123-06
10.11759/hykx20190827001
2019-08-27;
2019-09-18
国家重点研发计划专项(2018YFD0901400);广东省科技厅项目(2013B020201002, 2014B020202011, 2014B030301064); 国家农业产业体系建设项目(CARS-48)
[Chinese Ministry of Science and Technology through the National Key Research and Development Program of China, No. 2018YFD0901400; the Guangdong Province Program, China, No. 2013B020201002, No. 2014B020202011, No. 2014B030301064]; the China Agriculture Research System, No. CARS-49]
秦艳平(1990-), 男, 博士, 助理研究员, 研究方向: 贝类繁育及遗传育种, E-mail: qinyanping@scsio.ac.cn; 张跃环,通信作者, 博士, 副研究员, 研究方向: 贝类繁育及遗传育种, E-mail: yhzhang@ scsio.ac.cn; 喻子牛, 共同通信作者, 男, 博士, 研究员, 研究方向: 贝类繁育及遗传育种, E-mail: carlzyu@scsio.ac.cn
(本文编辑: 丛培秀)
