大港原油对毛蚶部分抗氧化酶和代谢酶的影响研究
2020-04-17李永仁郭永军
张 超, 李永仁, 郭永军, 梁 健
大港原油对毛蚶部分抗氧化酶和代谢酶的影响研究
张 超, 李永仁, 郭永军, 梁 健
(天津农学院水产科学系天津市水产生态及养殖重点实验室, 天津 300384)
为研究港原油对毛蚶部分抗氧化酶和代谢酶的影响, 设置0.01、0.1、1、3 mg/L大港原油水溶液性成分(WSF), 采用暴露法研究毛蚶天津群体的鳃、斧足中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)抗氧化酶等抗氧化酶及酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、钠/钾泵(Na+/K+ATPase)、钙泵(Ga2+/Mg2+ATPase)等代谢相关酶的活性变化, 测定丙二醛(MDA)含量, 采用整合生物标志物(Integrated biomarker response, IBR)进行分析。结果表明, 毛蚶鳃和斧足中SOD、CAT、GPX表现出一定的剂量-效应关系, MDA含量呈先升高后降低的趋势, 3 mg/L组表现出MDA累积; ACP、AKP、Na+/K+ATPase、Ga2+/Mg2+ATPase表现出一定剂量-效应关系, 酸性磷酸酶较碱性磷酸酶响应更迅速, Na+/K+ATPase较Ga2+/Mg2+ATPase更易受WSF影响; 鳃中酶类活性受WSF影响更明显。鳃中SOD、GPX、MDA较斧足高, 而CAT则相反。斧足、鳃组织RIB值呈现先下降后上升趋势, 与WSF浓度及暴露时间存在剂量-效应关系和时间-效应关系, 两组之间存在差异性, 斧足累积RIB值高于鳃组织。
毛蚶; 原油; 抗氧化酶; 代谢酶
石油是一种构成复杂的混合物, 主要成分为烃类物质, 如烷烃、芳烃和脂环烃等[1], 另外, 还含有苯系化合物、菲、蒽、芘及酚类等[2]多种毒性有机物, 对海洋生态系统极具破坏性。对海洋生物的影响包括物理作用和化学作用: 石油中难溶于水的部分可在与水表形成油膜, 隔绝水气交换, 造成区域性缺氧[3-4]; 部分可与水形成稳定的乳状液, 其组分能低浓度溶入水中, 形成石油水溶液成分(water soluble fraction of oil, WSF)[5], 易随水生动物呼吸黏附于体表和鳃, 造成呼吸障碍, 并诱发突变、致病、致畸等现象[6]。
贝类移动性差, 易受石油污染的长期影响, 造成石油烃在体内累积, 抑制其免疫力, 增加疾病的易感性[7-8], 对贝类养殖造成危害并通过食物链进入人体, 危及健康[9], 因此, 关于海水经济动物对石油烃胁迫响应的研究多有开展: 毕研军[6]等研究了0#柴油慢性胁迫下缢蛏SOD、GPX、AKP的活性变化, 高翔[10]等研究消油剂处理燃料油对海水青鳉胚胎抗氧化酶活性的影响, 任加云[11]研究了石油烃暴露对四角蛤蜊和文蛤解毒指标的影响, 赵升[12]等研究了原油水溶性成分对紫贻贝的毒理效应。自Beliaeff[13]等使用整合生物标志物(IBR)以来, 研究者引入IBR分析石油类污染物对水生生物的毒性效应: 蒋玫[14]等基于IBR研究0#柴油对黑鲷的毒性效应, 李磊[15]等基于IBR评价苯并芘对脊尾白虾的毒性效应, 张林宝[16]等使用IBR研究0#柴油WSF对菲律宾蛤仔抗氧化功能的影响, Kim[17]等使用IBR研究了BaP对大西洋虾肌肉组织的毒性效应,Song[18]等使用IBR研究了BaP、DDT对翡翠贻贝胚胎的影响。但缺少在胁迫下对代谢相关指标的分析及抗氧化、代谢综合分析的研究。但未见石油污染对毛蚶(Lischke)相关酶指标影响的研究及IBR分析。
毛蚶, 俗称毛蛤、毛蚬子, 属软体动物门, 双壳纲, 列齿目, 蚶科, 毛蚶属。多栖于低潮线以下至水深二十米的泥质海底, 主要分布于日本、朝鲜和中国沿海, 以黄渤海资源尤为丰富, 是我国重要的海产经济贝类之一[19]。研究表明, 毛蚶对石油成分的富集能力强于多数海水经济生物[20], 本研究分析了毛蚶天津群体暴露于大港原油WSF, 其抗氧化、代谢及丙二醛等指标的变化特征, 旨在为毛蚶的养殖及石油污染净化提供参考。
1 实验方法
1.1 实验材料
实验用毛蚶为采自天津大神堂南部浅海(39°09′N, 117°59′E)的野生群体, 淡水清洗壳表, 于盐度25、水温16±3℃、pH 7.5的人工海水中暂养7 d, 选择活力良好、体长在2.0 cm±0.5 cm的个体待用。
实验用原油取自大港油田。按1︰9将大港原油与人工海水混合, 超声分散4 h, 分液漏斗中静置2 h, 取下层水相作为母液, 避光保存。紫外分光光度法测定石油母液浓度[21]。
1.2 实验设计
设置4个WSF浓度梯度, 分别为0.01 mg/L, 0.1 mg/L, 1 mg/L, 3 mg/L, 1个对照组, 每组设3个重复, 养殖箱规格为375 mm×255 mm×125 mm。每箱加海水5 L, 内置毛蚶20只, 实验期间不充氧、不投饵。为稳定石油浓度, 每天换水2次且以封口膜封口。从实验第1 d开始, 每2 d取样1次, 至第9 d结束共取样5次, 采样时, 每组取毛蚶1只, 分离斧足及鳃组织, 0.86%生理盐水冲洗, 装入冻存管, –80℃冻存。
1.3 酶指标的测定
取组织样本0.1 g, 加0.86%生理盐水0.9 mL, 匀浆, 使用南京建成公司试剂盒测定斧足及鳃组织总蛋白、丙二醛(MDA)含量, 以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、钠/钾泵(Na+/K+ATPase)、钙泵(Ga2+/Mg2+ATPase)的活性。
1.4 数据处理
原始数据经Microsoft excel 计算结果, 使用平均值±标准差(Means±SD)表示, 采用SPSS软件进行单因素方差分析(ANOVA)和Duncan检验, 参考Beliaeff[13]等方法进行RIB计算。
2 实验结果
2.1 抗氧化指标及脂质过氧化物含量
大港原油对毛蚶鳃组织抗氧化指标的影响见图1。与对照组比较, 0.01 mg/L组SOD、MDA差异不显著(0.05), CAT 在1 d显著下降(0.05), GPX在5 d显著上升(0.05); 0.1 mg/L组SOD在5 d显著上升(0.05), CAT在1 d显著下降(0.05), 3 d、7 d显著上升(0.05), GPX在5 d显著上升(0.05), MDA差异不显著(0.05); 1 mg/L组SOD在5 d、7 d显著上升(0.05), CAT在1 d显著下降(0.05), 3 d、7 d显著上升(0.05), GPX在5 d显著上升(0.05), MDA无显著变化(0.05); 3 mg/L组SOD实验期间显著上升(0.05), CAT在1 d下降(0.05), 3 d、5 d显著上升(0.05), GPX实验期间与对照差异不显著(0.05), MDA在5 d、9 d有显著上升(0.05)。
鳃组织中, SOD在0.01 mg/L组持续抑制, 0.1 mg/L组、1 mg/L组1 d、3 d与对照组差异不显著(0.05), 之后表现出诱导-抑制规律, 3 mg/L组呈诱导-抑制-诱导趋势; 各实验组CAT呈抑制-诱导趋势, 3 mg/L组最为明显; 各实验组GPX在1 d、3 d均无显著差异(0.05), 之后表现出诱导-抑制现象。各实验组MDA在1 d、3 d均无显著差异(0.05), 之后呈诱导-抑制趋势, 1 mg/L组较其它实验组变化最小。
大港原油对毛蚶斧足抗氧化指标的影响见图2。与对照组比较, 0.01 mg/L组SOD差异不显著(0.05), CAT在1 d有显著上升(0.05), GPX在1 d、3 d、5 d、7 d显著上升(0.05), MDA实验期间差异不显著(0.05); 0.1 mg/L组SOD、GPX、MDA实验期间与对照差异不显著(0.05), CAT在3 d出现显著下降(0.05), 7 d、9 d显著上升(0.05); 1 mg/L组SOD实验期间与对照差异不显著(0.05), CAT在3 d显著下降(0.05), GPX在9 d显著下降(0.05), MDA在3d出现显著上升(0.05); 3 mg/L组SOD在3 d显著上升(0.05), CAT在7 d、9 d显著上升(0.05), GPX在1 d、3 d、7 d显著上升(0.05), MDA在3 d、7 d显著上升(0.05), 其余时间与对照差异不显著(0.05)。
斧足中, SOD变化相对鳃组织不敏感, 低浓度组(0.01 mg/L、0.1 mg/L)在1 d、3 d、5 d无显著变化(0.05), 之后被诱导, 1 mg/L组5 d后被抑制, 3 mg/L组基本呈诱导趋势; 各实验组CAT均呈诱导-抑制-诱导趋势; 3 mg/L组GPX未见明显规律, 1 mg/L组呈诱导-抑制趋势, 其它组均呈诱导趋势。各实验组MDA基本呈诱导-抑制趋势, 但高浓度组(1 mg/L、3 mg/L)较低浓度组(0.01 mg/L、0.1 mg/L)诱导峰值后移, 表现出一定的剂量-效应关系。
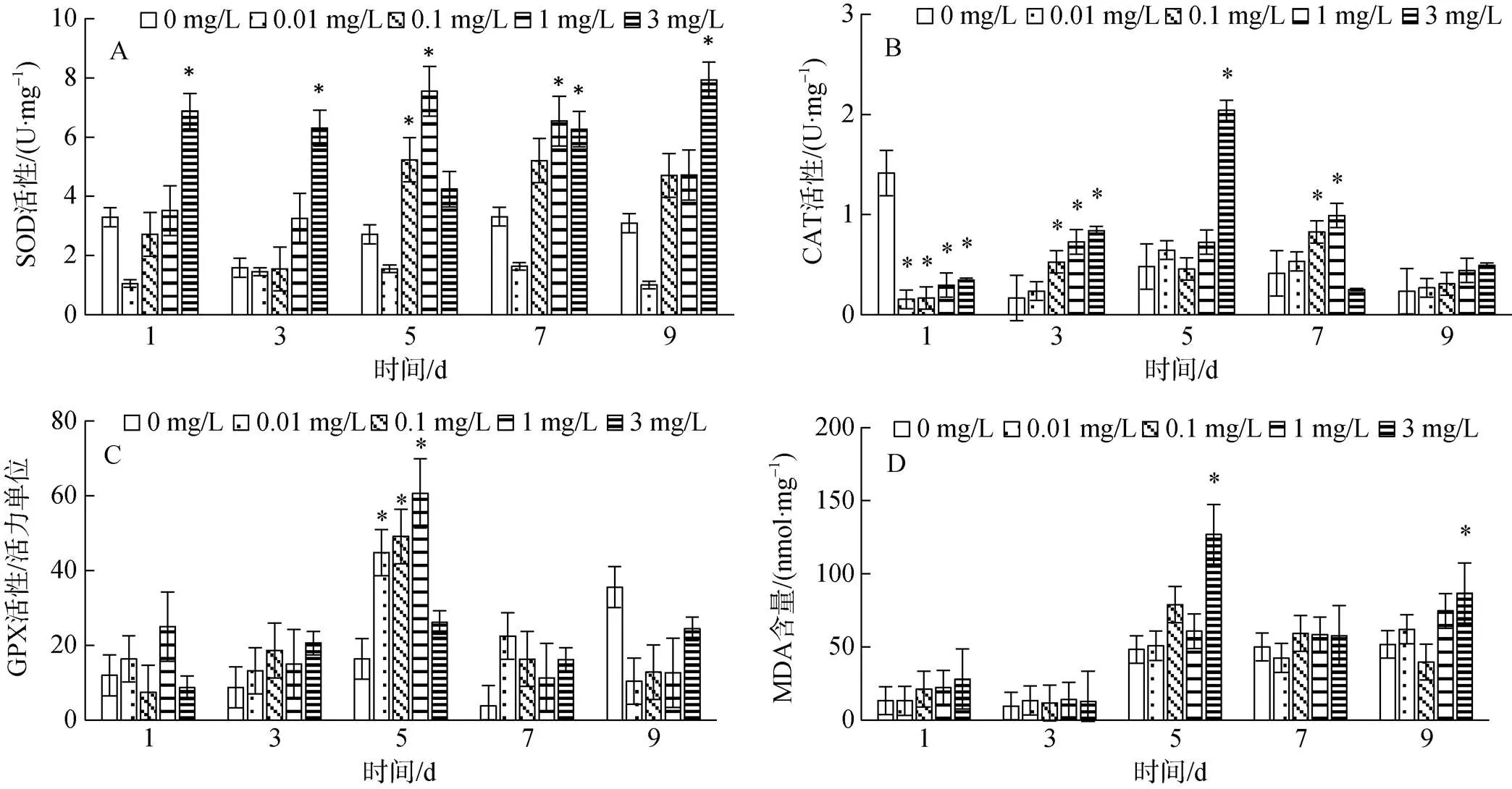
图1 大港原油对毛蚶鳃SOD、CAT、GPX活性和MDA含量的影响
注: *表示与对照组差异显著(0.05)

图2 大港原油对毛蚶斧足SOD、CAT、GPX活性和MDA含量的影响
注: *表示与对照组差异显著(0.05)
2.2 代谢酶活性
大港原油对毛蚶鳃组织代谢酶活性的影响见图3。与对照组比较, 0.01 mg/L组ACP在5 d显著上升(0.05), AKP在1 d显著下降(0.05), Na+/K+ATPase在7 d出现显著上升(0.05), Ga2+/Mg2+ATPase在9 d显著上升(0.05); 0.1 mg/L组ACP在5 d显著上升(0.05), AKP在1 d显著下降(0.05), Na+/K+ATPase在1 d、7 d显著上升(0.05)Ga2+/Mg2+ATPase在1 d显著上升(0.05); 1 mg/L组ACP实验期间与对照差异不显著(0.05), AKP在3 d显著上升(0.05), Na+/ K+ATPase在1 d、3 d、7 d显著上升(0.05), Ga2+/Mg2+ATPase在1 d显著上升(0.05); 3 mg/L组ACP在1 d、5 d、7 d显著上升(0.05), AKP在3 d、5 d、7 d显著上升(0.05), Na+/K+ATPase在1 d、5 d显著上升(0.05), 7 d显著下降(0.05), Ga2+/Mg2+ATPase在1 d、3 d、7 d显著上升(0.05), 5 d、9 d显著下降(0.05)。
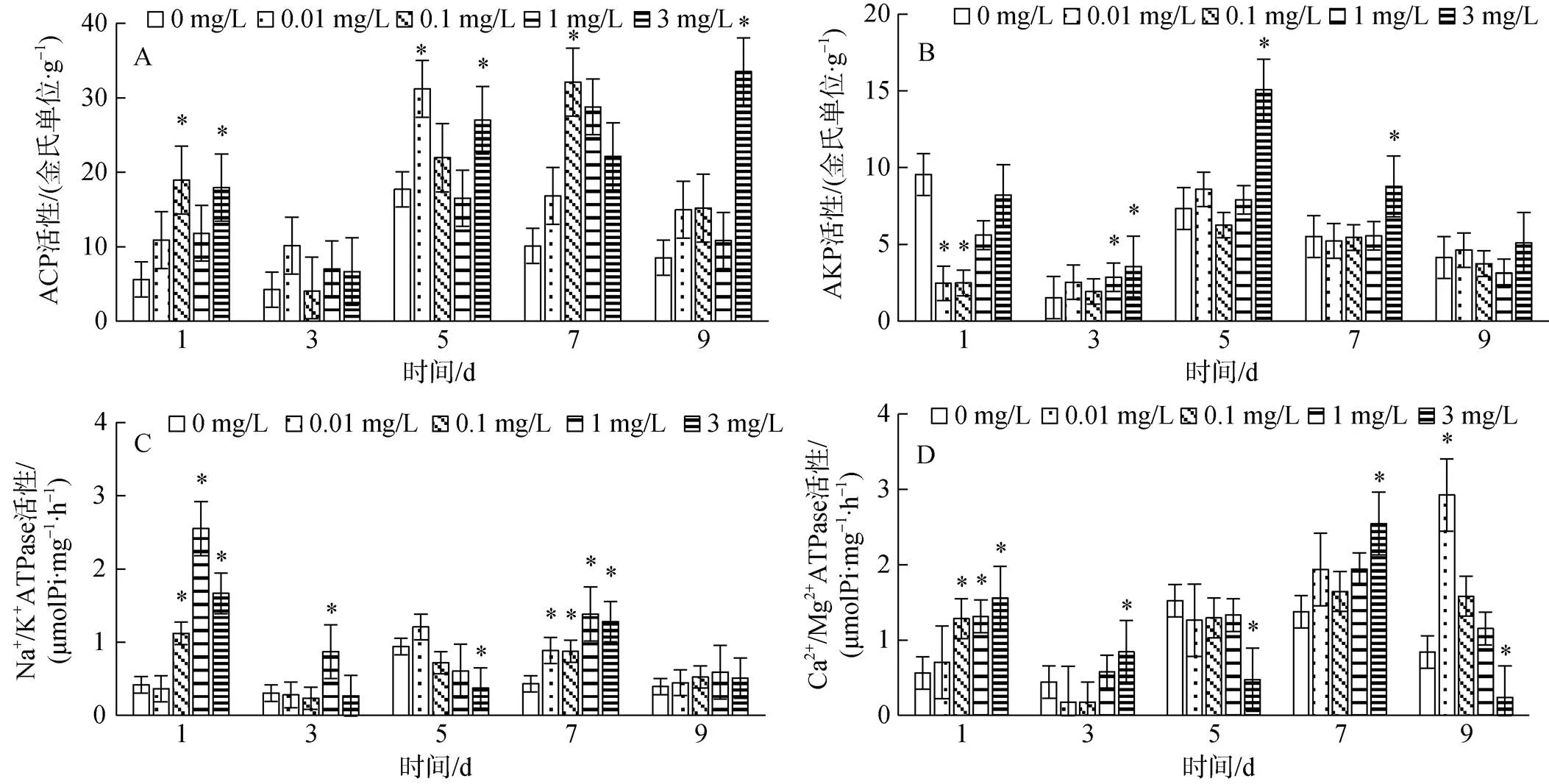
图3 大港原油对毛蚶鳃ACP、AKP、Na+/K+ ATPase、Ga2+/Mg2+ ATPase活性的影响
注: *表示与对照组差异显著(0.05)
鳃组织中, 3 mg/L组ACP呈诱导趋势, 且诱导峰值随WSF浓度增加后移, 其他组呈诱导-抑制趋势, 表现出一定的剂量-效应关系; 3 mg/L组AKP呈诱导趋势, 但第9 d与对照组差异不显著(0.05), 其余各实验组AKP无明显规律; 各实验组Na+/K+ATPase在1 d显著诱导, 之后逐渐波动至对照水平; 低浓度组Ga2+/Mg2+ATPase基本呈诱导趋势, 高浓度组基本呈诱导-抑制趋势。
大港原油对毛蚶斧足代谢酶活性的影响见图4。与对照组比较, 0.01 mg/L组ACP在1 d、3 d显著上升(0.05), AKP在9 d显著上升(P<0.05), Na+/K+ATPase在5 d显著上升(0.05), Ga2+/Mg2+ATPase实验期间与对照差异不显著(0.05); 0.1 mg/L组ACP在3 d显著下降(0.05), 7 d显著上升(0.05), AKP在1 d、7 d显著上升(0.05), 3 d显著下降(0.05), Na+/K+ATPase在3 d显著下降(0.05), 5 d、9 d显著上升(0.05), Ga2+/Mg2+ATPase在3 d、5 d显著上升(0.05); 1 mg/L组ACP在9 d显著上升(0.05), AKP在3 d、5 d显著下降(0.05), 7 d显著上升(0.05), Na+/K+ATPase在5 d显著上升(0.05), Ga2+/Mg2+ATPase在1 d、5 d显著上升(0.05); 3 mg/L组ACP在1 d显著下降(0.05), 9 d显著上升(0.05), AKP在1 d显著上升(0.05), 5 d显著下降(0.05), Na+/K+ATPase在7 d显著下降(0.05), Ga2+/Mg2+ATPase在1 d、9 d显著上升(0.05), 7 d显著下降。
斧足中, 各实验组 ACP基本呈诱导趋势; 低浓度组AKP呈诱导趋势, 高浓度组未见明显规律; 高浓度组Na+/K+ATPase呈诱导趋势, 低浓度组未见明显规律; 0.01 mg/L组Ga2+/Mg2+ATPase实验期间与对照组差异不显著(0.05), 其他组在1 d被诱导, 后期无明显规律。
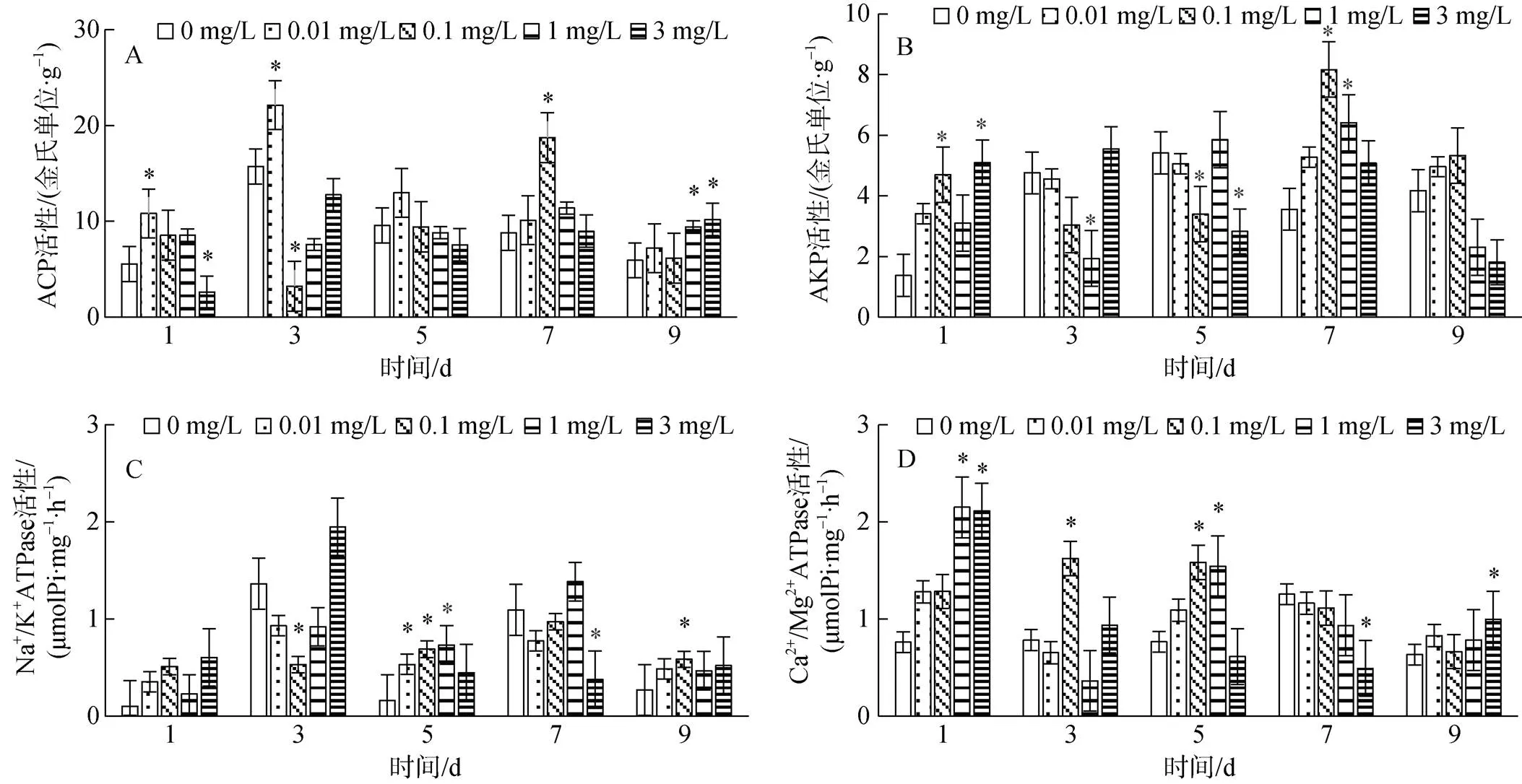
图4 大港原油对毛蚶斧足ACP、AKP、Na+/K+ ATPase、Ga2+/Mg2+ ATPase活性的影响
注: *表示与对照组差异显著(0.05)
2.3 整合生物标志物分析
大港原油对毛蚶的IBR见图5—10。图5—8中星状图多边形面积即为RIB值, 结果见图9—10。抗氧化指标方面, 不同取样时间, 0.1 mg/L、1 mg/L、3mg/L组表现出强烈的抑制或诱导, 0.01 mg/L组较对照组变化较小; 代谢酶活性方面, 各实验组较对照组均有抑制或诱导趋势。两种组织中, 以斧足的测试指标覆盖面积更大, 但相关指标变化较鳃组织小。
抗氧化指标方面, 鳃组织各实验组RIB值均在5 d时最高, 斧足低浓度组(0.01 mg/L, 0.1 mg/L)RIB值在5 d最高, 高浓度组(1 mg/L, 3 mg/L)RIB峰值滞后; 代谢酶活性方面, 鳃组织RIB值较斧足变化大, 各实验组峰值均在5 d及7 d出现, 并随WSF浓度增加而滞后。
抗氧化指标方面, 鳃组织累积RIB值较斧足低, WSF浓度低于1 mg/L时, 两种组织累积RIB值与WSF浓度呈反相关; 代谢酶活性方面, 两种组织累积RIB值差异不大, 鳃组织累积RIB值与WSF浓度呈反相关。
3 讨论
外源物质通过影响或阻断呼吸链、电子传递链和酶促反应等体内正常生理代谢, 影响生物生存、生长及繁衍[22-23]。WSF通过产生大量的氧自由基对机体产生氧化压力, 导致脂质过氧化、酶失活等一系列氧化损伤[24]。石油可溶性组分通过I相代谢酶细胞色素P450酶系代谢成为更具极性的代谢中间产物进入生物体内, 这些代谢产物在Ⅱ相代谢酶催化下与内源分子结合, 加快代谢产物排出体外的速度, 另一方面, 在代谢过程中产生的自由基诱导抗氧化酶类活性增加, 导致机体抗氧化酶等指标变化[25-27], 各类酶通过联合作用组成机体的抗氧化酶防御系统, 对积累的活性氧进行清除[28]。毛蚶作为滤食性软体动物, 以非特异性免疫应对外源物, 鳃作为其内外交换的第一环, 受WSF影响最为直接, 而肌肉组织对应激的响应较为滞后, 对这两种组织的检测研究, 可反映WSF对毛蚶机体的影响。
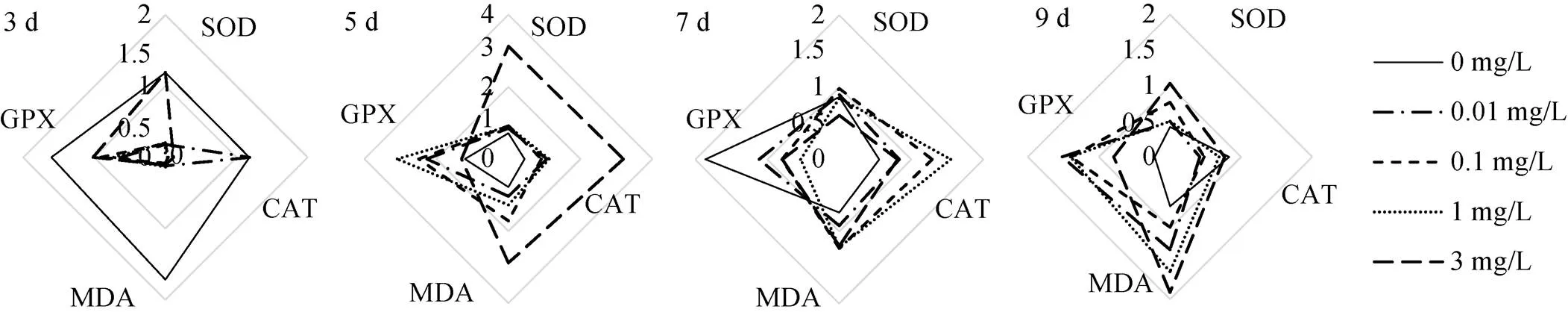
图5 大港原油对毛蚶鳃抗氧化能力影响RIB星状图
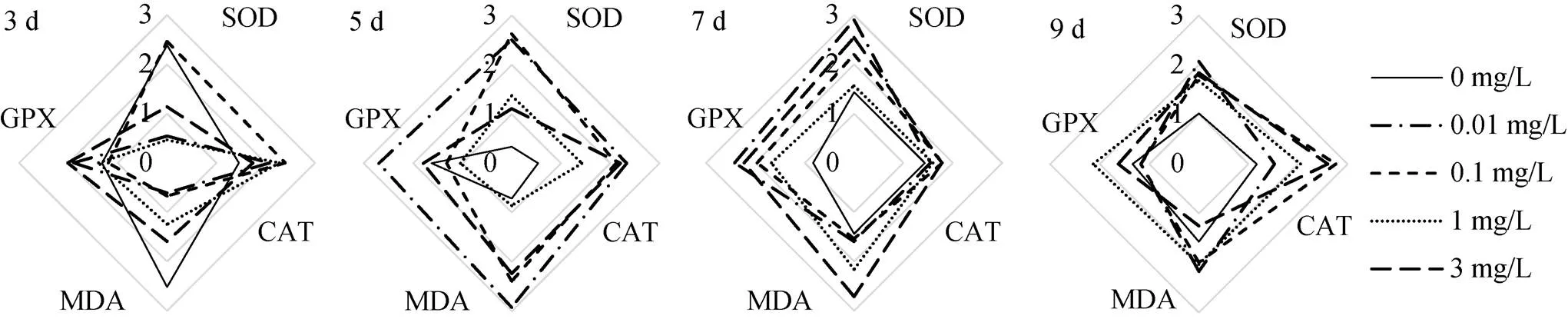
图7 不同时间下大港原油对毛蚶斧足抗氧化能力影响RIB星状图
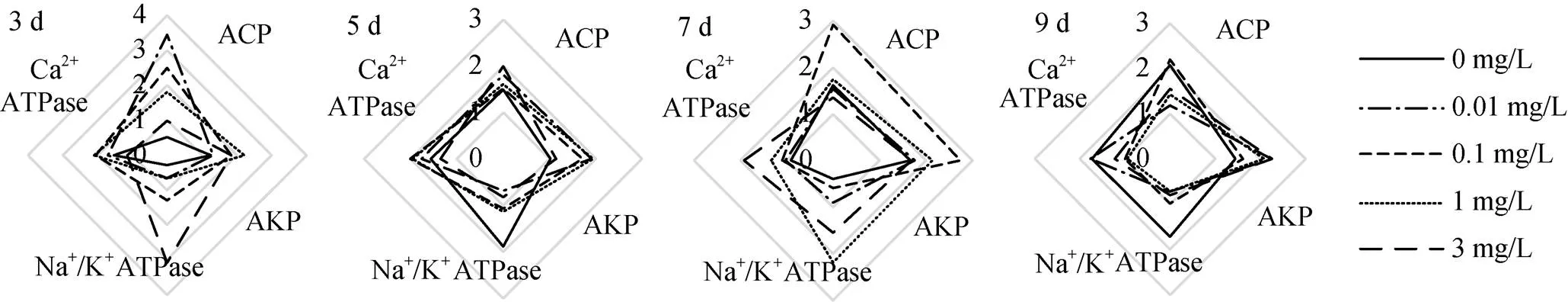
图8 不同时间下大港原油对毛蚶斧足代谢酶活性影响RIB星状图
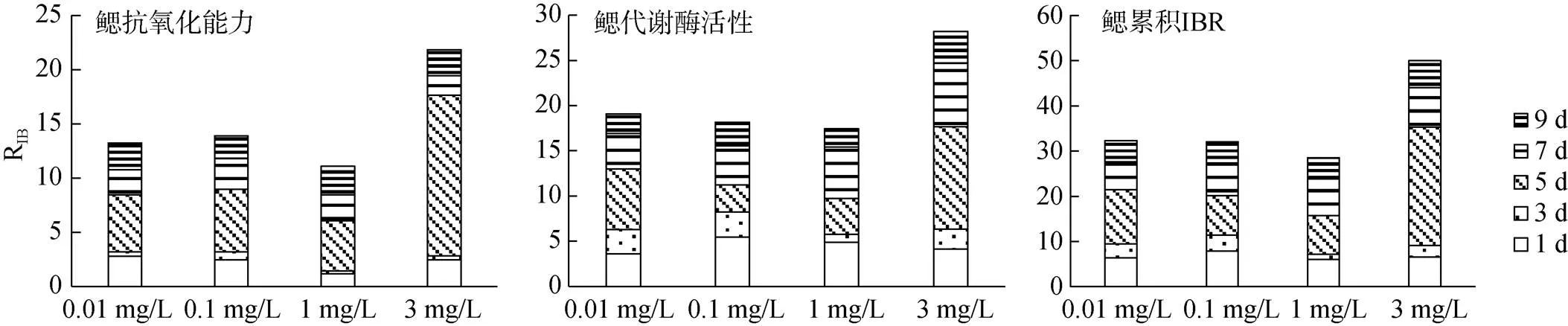
图9 大港原油胁迫下毛蚶鳃RIB值
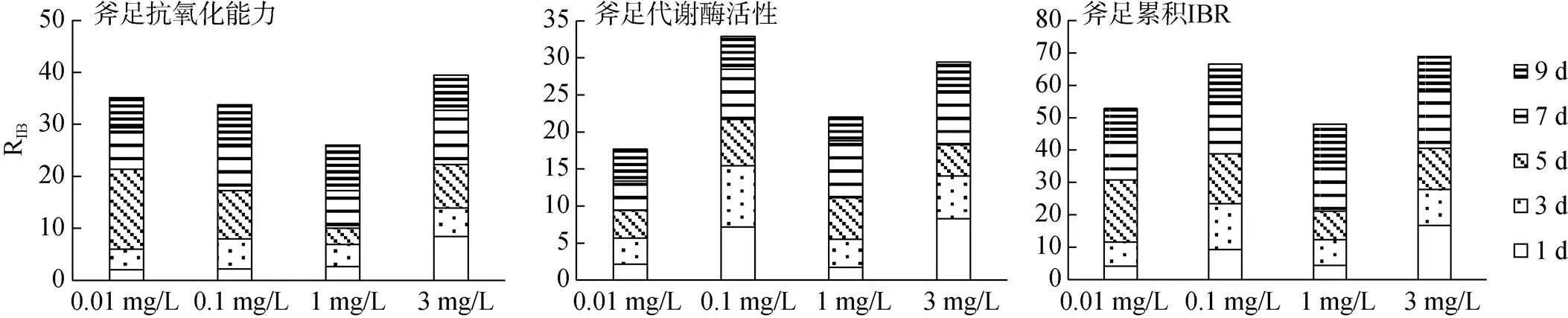
图10 大港原油胁迫下毛蚶斧足RIB值
3.1 抗氧化指标及脂质过氧化物含量
生物体内存在的抗氧化酶系统, 主要包括SOD、CAT、GPX等。SOD清除体内超氧阴离子自由基使之形成H2O2, 阻止脂质过氧化[29-30]。H2O2通过氧化作用在机体内生成过氧化物, 造成机体组织生物膜损伤、磷脂功能障碍、DNA断裂等[31]。CAT介导H2O2生成H2O和O2, 降低氧化损伤。MDA为脂质过氧化的终产物, 可间接反映机体受自由基攻击的程度[32]。本研究中, 毛蚶鳃组织抗氧化酶总体表现出一定的剂量-效应关系, 这与赵升[12]等对紫贻贝的相关研究结果相似, 其中, SOD和CAT较不敏感, 初期未见显著性差异, 从5 d开始表现出正负诱导反应和抑制反应, 且随石油烃浓度的增加, 反应越明显; MDA先上升后下降, 3 mg/L组MDA在5d出现峰值, 可能与SOD在5 d活性降低有关, 由此引发后续SOD活性持续上升, 但同期CAT活性出现下降, 造成MDA的累积并于9 d时显著上升。蒋玫[14]等研究0#柴油对黑鲷的毒性效应时发现鳃和肌肉中SOD、CAT、MDA呈现抑制诱导规律, 且MDA在肌肉中含量更高, 与本研究结果不完全相同, 可能与WSF浓度及实验生物种类有关。GPX可抑制脂质过氧化反应并部分替代CAT发挥作用[33], 本研究中, GPX表现出明显剂量-效应关系, 且3 mg/L组较其他组效应强, 说明3 mg/L的石油烃浓度超出毛蚶的短期耐受极限。任加云[34]等研究石油烃对栉孔扇贝酶活性影响时也发现其SOD、GPX低浓度诱导抑制, 高浓度抑制的现象。
3.2 代谢酶
磷酸酶在机体解毒、骨化及消化吸收转运过程中发挥作用, 同时参与细胞调节[35], ACP是溶酶体的标志酶, 可破坏表面带有磷酸酯的外源物, 以预防感染[36]; AKP与Ca2+的吸收、膜的吸收和转运及维持细胞内磷酸浓度有关, 在代谢过程中起到调控、解毒作用, 还与贝类壳角蛋白等蛋白质的分泌有关, 对贝壳的形成有重要作用[37]。本实验中, 毛蚶斧足ACP表现出明显的剂量—效应关系, 但鳃组织ACP变化规律不明显, AKP在鳃组织响应更迅速, 这与林芳[38]等对翡翠贻贝胚胎的相关研究结果类似, 但任加云[34]发现栉孔扇贝在1 mg/L石油暴露下, AKP除在0.5 d被激活外其余时间均被抑制, 这可能与毛蚶作为底栖贝类对底质高石油环境的长期适应有关。
P型离子泵存在于细胞质膜, 石油污染导致毛蚶体内过氧化物增加, 影响细胞膜流动性及跨膜运输系统, 张爱君[39]等发现石油污染的牡蛎细胞核、线粒体肿胀。本实验中, 毛蚶鳃组织和斧足两种P型离子泵(Na+/K+ATPase和Ga2+/Mg2+ATPase)均表现出时间-效应关系, 且最大值逐渐降低的趋势, 这与孙忠训[40]等对斑马鱼鳃钠/钾ATP酶的研究结果类似。
3.3 综合分析
本研究中, 鳃组织相比斧足对石油胁迫更敏感, 可能与组织结构差异有关。斧足CAT活性更高, 对比两者GPX、MDA的差异, 推测由于鳃组织中CAT活性不足以清除氧自由基产生的过氧化氢, 而使鳃组织GPX大量诱导, 蒋玫等[14]对黑鲷的鳃和肌肉组织抗氧化指标的研究中也发现了类似效应。抗氧化酶类及MDA在鳃组织中的累积RIB值较斧足低, 这与李磊[15]等研究BaP对脊尾白虾的毒性效应结果类似, 但蒋玫[14]等发现黑鲷各组织氧化应激能力为肝脏、鳃、肌肉递减, 推测因实验动物的种类、体型差异而导致, 例如小体型或低等的水生动物大量组织与水体均有接触, WSF可经多途径侵入机体, 造成此类现象。
[1] 曹云者, 李发生. 基于风险的石油烃污染土壤环境管理与标准值确立方法[J]. 农业环境科学学报, 2010, 29(7): 1225-1231. Cao Yunzhe, Li Fasheng. Risk-based environmental management of petroleum hydrocarbons contaminated soil and development of standards: A review[J]. Journal of Agro-Environment Science. 2010, 29(7): 1225-1231.
[2] 李丽和. 石油烃污染场地风险评价及案例研究[D]. 北京: 北京化工大学, 2007. Li Lihe. Petroleum-contaminated sites risk assessment and case study[D]. Beijing: Beijing University of Chemical Technology, 2007.
[3] 田立杰, 张瑞安. 海洋油污染对海洋生态环境的影响[J]. 海洋湖沼通报, 1999, (2): 65-69. Tian Lijie, Zhang Ruian. The effect of offshore oil pollution on marine ecological environment[J]. Transaction of Oceanology and Limnology, 1999, (2): 65-69.
[4] 李言涛. 海上溢油的处理与回收[J]. 海洋湖沼通报, 1996, (1): 73-83. Li Yantao. Treatment and recovery of oil spill at sea[J]. Transaction of Oceanology and Limnology, 1996, (1): 73-83.
[5] 夏北成. 环境污染物生物降解[M]. 北京: 化学工业出版社, 2002: 176-184. Xia Beicheng. Biodegradation of environmental pollutants[M]. Beijing: Chemical Industry Press, 2002: 176-184.
[6] 毕研军, 赵瑞婷, 刘心田, 等. 石油烃对海洋生物的毒性[J]. 河北渔业, 2019, 1(4): 7-13. Bi Yanjun, Zhao Ruiting, Liu Xintian, et al. Toxicity of petroleum hydrocarbon to marine organisms[J]. Hebei Fisheries, 2019, 1(4): 7-13.
[7] Chu F L E, Hale R C. Relationship between pollution and susceptibility to infectious disease in the eastern oyster,[J]. Marine Environmental Research, 1994, 38(4): 243-256.
[8] Grundy M M, Ratcliffe N A, Moore M N. Immune inhibition in marine mussels by polycyclic aromatic hydrocarbons[J]. Marine Environmental Research, 1996, 42(1): 187-190.
[9] Pérez-Cadahía B, Lafuente A, Cabaleiro T, et al. Initial study on the effects of Prestige oil on human health[J]. Environment International, 2007, 33(2): 176-185.
[10] 高翔, 丁光辉, 钱怡婷, 等. 消油剂处理120#燃料油对海水青鳉()胚胎抗氧化酶活性影响的研究[J]. 海洋科学, 2016, 40(8): 18-26. Gao Xiang, Ding Guanghui, Qian Yiting, et al. Effects of disperssant and #120 fuel oil exposure on antioxidant enzyme activity ofenbryos[J]. Marine Sciences, 2016, 40(8): 18-26.
[11] 任加云, 夏江宝, 苗晶晶. 石油烃暴露对文蛤和四角蛤蜊解毒指标影响的对比研究[J]. 海洋环境科学, 2017, 36(4): 552-559. Ren Jiayun, Xia Jiangbao, Miao Jingjing. Comparative study on detoxification biomarkers effects of clamandunder petroleum hydrocarbons exposure[J]. Marine Environmental Science, 2017, 36(4): 552-559.
[12] 赵升, 耿晓, 孙蓓蓓, 等. 重质原油和轻质原油水溶性组分对紫贻贝()毒理效应的研究[J]. 生态毒理学报, 2016, 11(4): 272-279. Zhao Sheng, Geng Xiao, Sun Peipei, et al. The toxicity of water-soluble composition of heavy crude and light crude oil to[J]. Asian Journal of Ecotoxicology, 2016, 11(4): 272-279.
[13] Beliaeff B, Burgeot T. Integrated biomarker response: a useful tool for ecological risk assessment[J]. Environmental Toxicology & Chemistry, 2002, 21(6): 1316- 1322.
[14] 蒋玫, 李磊, 沈新强, 等. 基于整合生物标志物响应指数评价0号柴油对黑鲷()的毒性效应[J]. 生态与农村环境学报, 2015, 31(2): 230- 237. Jiang Mei, Li Lei, Shen Xinqiang, et al. IBR index- based assessment of toxicity of No. 0 diesel fuel of[J]. Journal of Ecology and Rural Environment, 2015, 31(2): 230-237.
[15] 李磊, 刘金殿, 黄士林, 等. 基于综合生物标志物响应评价苯并芘对脊尾白虾()的毒性效应[J]. 海洋与湖沼, 2018, 49(2): 444-451. Li Lei, Liu Jindian, Huang Shilin, et al. Integrated assessment of biomarker responses inexposed to benzo[a]pyrene[J]. Oceanology et Limnologia Sinica, 2018, 49(2): 444-451.
[16] 张林宝, 孙伟, 黄南建, 等. 0#柴油水溶性成分对菲律宾蛤仔抗氧化防御系统的影响[J]. 南方水产科学, 2015, 11(6): 65-72. Zhang Linbao, Sun Wei, Huang Nanjian, et al. Effect of No.0 diesel oil water-soluble fraction on antioxidant defense systems of Manila clam ()[J]. South China Fisheries Science, 2015, 11(6): 65-72.
[17] Kim J, Kim W. Use of the integrated biomarker response to measure the effect of short-term exposure to dibenz[a, h]anthracene in common carp ()[J]. Bulletin of Environmental Contamination and Toxicology, 2016, 96(4): 496-501.
[18] Song Q, Zheng P, Qiu L, et al. Toxic effects of malegonad exposed to BaP, DDT and their mixture: A metabolomic and proteomic study of the underlying mechanism[J]. Toxicology Letters, 2016, 240(1): 185-195.
[19] 王如才, 王昭萍, 张健中. 海水贝类养殖学[M]. 青岛: 青岛海洋大学出版社, 1993: 293-294. Wang Rucai, Wang Zhaoping, Zhang Jianzhong. Marine shellfish culture[M]. Qingdao: Qingdao Ocean University Press, 1993: 293-294.
[20] 贾晓平, 林钦, 蔡文贵, 等. 原油和燃油对南海重要海水增养殖生物的急性毒性试验[J]. 水产学报. 2000, 24(1): 32-36. Jia Xiaoping, Lin Qin, Cai Wengui, et al. Toxicity of crude oil and fuel oils to important mariculture and mutilplication organisms of South China Sea[J]. Journal of Fisheries of China, 2000, 24(1): 32-36.
[21] 国家海洋局. 海洋监测规范[S]. GB 17378-2007. State Oceanic Administration People’s Republic of China. The specification for marine monitoring[S]. GB 17378-2007.
[22] Richardson B J, Mak E, De Luca-Abbott S B, et al. Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (): Do mussels “integrate” biomarker responses[J]. Marine Pollution Bulletin, 2008, 57(6): 503-514.
[23] Jena K B, Verlecar X N, Chainy G B N. Application of oxidative stress indices in natural populations ofas biomarker of environmental pollution[J]. Marine Pollution Bulletin, 2009, 58(1): 107-113.
[24] Lavarías S, Heras H, Pedrini N, et al. Antioxidant response and oxidative stress levels in Macrobrachium borellii () exposed to the water-soluble fraction of petroleum[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2011, 153(4): 415-421.
[25] Francioni E, de L. R. Wagener A, Scofield A L, et al. Evaluation of the musselas a biomonitor of polycyclic aromatic hydrocarbon (PAH) exposure and effects[J]. Marine Pollution Bulletin, 2007, 54(3): 329-338.
[26] 彭玲, 曾江宁, 黄伟, 等. 厚壳贻贝抗氧化酶活性和脂质过氧化物含量对Cd和Aroclor 1254胁迫的响应[J]. 生态学杂志. 2015, 34(3): 718-726. Peng Ling, Zeng Jiangning, Huang Wei, et al. Effects of cadmium and Aroclor 1254 on antioxidant enzyme activities and lipid peroxidation levels in[J]. Chinese Journal of Ecology, 2015, 34(3): 718-726.
[27] Winston G W, Giulio R T D. Prooxidant and antioxidant mechanisms in aquatic animals[J]. Aquatic Toxicology, 1991, 19(2): 137-161.
[28] 卓艺蓉. 基于双壳贝类的多环芳烃生物标志物检测技术的研究[J]. 渔业研究, 2018, 40(4): 268-278. Zhuo Yirong. The study on identification of PAHs biomarkers on the basis of bivale[J]. Journal of Fisheries Research, 2018, 40(4): 268-278.
[29] 袁勤生. 超氧化物岐化酶[M]. 上海: 华东理工大学出版社, 2009: 235-236. Yuan Qinsheng. Superoxide dismutase[M]. Shanghai: East China University of Science and Technology Press, 2009: 235-236.
[30] Kanner J, German J B, Kinsella J E, et al. Initiation of lipid peroxidation in biological systems[J]. Critical Reviews in Food Science & Nutrition, 1987, 25(4): 317-364.
[31] Mohamed M, Sulaiman S A, Jaafar H, et al. Antioxidant protective effect of honey in cigarette smoke-induced testicular damage in rats[J]. International Journal of Molecular Sciences, 2011, 12(9): 5508-5521.
[32] Pan L, Ren J, Zheng D. Effects of benzo(a)pyrene exposure on the antioxidant enzyme activity of scallop[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(1): 43-53.
[33] 方允中, 郑荣梁. 自由基生物学的理论与应用[M]. 北京: 科学出版社, 2002: 211-229. Fang Yunzhong, Zheng Rongliang. Theory and application of free radical biology[M]. Beijing: Science Press, 2002: 211-229.
[34] 任加云, 苗晶晶, 李学平. 石油暴露对栉孔扇贝免疫酶活性及血细胞稳定性的影响[J]. 中国水产科学, 2015, 22(6): 1219-1226. Ren Jiayun, Miao Jingjing, Li Xueping. Effect of oil exposure on immune enzyme activity and hemocyte membrane stability in scallop,[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1219-1226.
[35] 何海琪, 孙凤. 中国对虾酸性和碱性磷酸酶的特性研究[J]. 海洋与湖沼, 1992, 23(5): 555-560. He Haiqi, Sun Feng. Studies on the characteristics of acid and alkline phosphatases in Chinese shrimp,[J]. Oceanologia et Limnologia Sinica, 1992, 23(5): 555-560.
[36] Cheng T C. The role of lysosomal hydrolases in molluscan cellular response to immunologic challenge[M]. Bulla Jr L A, et al (eds.), Invertebrate models for biomedical research, New York: Springer Science + Business Media, 1978: 63-66.
[37] Peters L D, Porte C, Albaigés J, et al. 7-ethoxyresorufinO-deethylase (EROD) and antioxidant enzyme activities in larvae of sardine () from the north coast of Spain[J]. Marine Pollution Bulletin, 1994, 28(5): 299-304.
[38] 林芳, 毛楷林, 江秀, 等. BaP和DDT暴露对翡翠贻贝胚胎重要酶活性影响的比较研究[J]. 生态毒理学报, 2018, 13(3): 129-137. Lin Fang, Mao Kailin, Jiang Xiu, et al. Comparative studies of the critical enzymes activity ofembryo exposed to BaP and DDT[J]. Asian Journal of Ecotoxicology, 2018, 13(3): 129-137.
[39] 张爱君, 邹洁, 马兆党, 等. 石油污染对牡蛎超显微结构毒性效应的研究[J]. 海洋环境科学, 2006, 25(S1): 6-10. Zhang Aijun, Zou Jie, Ma Zhaodang, et al. Research on the toxic effect of petroleum pollution on ultramicroscopic structures of Pacific oyster ()[J]. Marine Environment Science, 2006, 25(S1): 6-10.
[40] 孙中训, 杜娟娟, 周绍辉, 等. 苯酚对斑马鱼的抗氧化酶活性及运动行为的影响[J]. 化学与生物工程, 2016, 33(12): 63-67. Sun Zhongxun, Du Juanjuan, Zhou Shaohui, et al. Effect of phenol on antioxidant enzyme activity and movement behavior of[J]. Chemistry & Bioengineering, 2016, 33(12): 63-67.
Effects of Dagang crude oil on partial antioxidant enzymes and metabolic enzymes inLischke
ZHANG Chao, LI Yong-ren, GUO Yong-jun, LIANG Jian
(Tianjin Key Laboratory of Aqua-Ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300384, China)
To measure the activities of antioxidant enzymes, i.e., superoxide dismutase (SOD), catalase (CAT), and glutathione peroxidase (GPX), and metabolic enzymes, i.e., acid phosphatase (ACP), alkaline phosphatase (AKP), Na+/K+ATPase, and Ca2+/Mg2+ATPase, in the gill and muscle tissues of local bivalve, the Tianjin population ofLischke was used. The lipid oxidation degree (content of malondialdehyde [MDA]) was also measured. Exposure tests of four concentrations (i.e., 0.01, 0.1, 1, and 3 mg/L) of the water-soluble fraction (WSF) of Dagang crude oil were conducted. The integrated biomarker response index was used. Results showed that, under the influence of the WSF, the SOD, CAT, and GPX activities exhibited a dose–effect relationship. MDA initially increased and subsequently decreased. In both gill and muscle tissues, MDA accumulated in the 3 mg/L group. The ACP, AKP, and Ca2+/Mg2+ATPase activities showed a slight dose–effect relationship. ACP responded more rapidly than AKP. Na+/K+ATPase was more vulnerable than Ca2+/Mg2+ATPase. During the exposure tests, the WSF influenced the gill tissues more obviously than the muscle tissues. As a result, the gill exhibited higher SOD, GPX, and MDA activities than the axe foot. By contrast, the gill exhibited lower CAT activity than the axe foot. The RIBvalues of the muscle and gill tissues initially decreased and subsequently increased. Dose–effect and time–effect relationships between WSF concentration and exposure time were observed. Moreover, differences between the two groups were detected. The cumulative RIBvalues of muscle tissues were higher than that of gill tissues.
Lischke; crude oil; antioxidant enzymes; metabolic enzymes
Jul. 22, 2019
S912
A
1000-3096(2020)03-0113-10
10.11759/hykx20190722001
2019-07-22;
2019-11-26
国家重点研发计划(2018YFD0901404); 天津市种业科技重大专项(17ZXZYNC00020); 天津市农业科技成果转化与推广项目(201602050);天津市现代产业技术体系-水产-贝类养殖岗位(ITTFRS2017013); 现代农业产业技术体系建设专项资金(CARS49)
[National Key R&D Program of China, No. 2018YFD0901404; Tianjin major project of seed science and technology, No. 17ZXZYNC00020; Tianjin agricultural science and technology achievements transformation and promotion project, No. 201602050; Tianjin modern Agro-indurty technology research systen-aquaculture-shellfish breeding positions, No. ITTFRS2017013; Earmarked fund for modern Agro-indurty technology research systen, No. CARS-49]
张超(1990-), 男, 山西临汾人, 硕士研究生, 主要从事海水养殖技术研究, E-mail: zchao2009@163.com; 李永仁,通信作者, 副教授, E-mail: lyr1018@163.com
(本文编辑: 赵卫红)
