广东沿海香港牡蛎消化道异养菌统计及其耐药性研究
2020-04-17王瑞旋谢燕纯牟红莉郭子晗王江勇
李 炳, 王瑞旋, 谢燕纯, 舒 琥, 牟红莉, 郭子晗, 王江勇
广东沿海香港牡蛎消化道异养菌统计及其耐药性研究
李 炳1, 3, 王瑞旋1, 2, 谢燕纯4, 舒 琥4, 牟红莉3, 郭子晗5, 王江勇1, 3
(1. 水产科学国家级实验教学示范中心(上海海洋大学), 上海 201306; 2. 韩山师范学院, 广东 潮州 521041; 3. 中国水产科学研究院南海水产研究所, 广东省渔业生态环境重点实验室, 农业部水产品加工重点实验室, 广东 广州 510300; 4. 广州大学, 广东 广州 510006; 5. 加利福尼亚浸会大学, 美国 加利福尼亚 92504)
本研究针对高温时期(6月、9月)广东沿海地区的香港牡蛎()体内异养细菌总数和弧菌总数进行了深入的调查, 并由添加单种抗生素(分别是: 庆大霉素、呋喃唑酮、利福平、环丙沙星、恩诺沙星、氯霉素、复方新诺明)的培养基中分离得到310个菌株。进一步采用纸片扩散法(kirby-bauer法)针对常见的抗生素对此310个菌株进行药敏测试, 了解不同来源菌株的耐药状况。结果表明310个菌株分属48个不同种属, 主要是肠杆菌()、弧菌()、芽孢杆菌()、肺炎克雷伯菌()、希瓦氏菌()、不动杆菌()、假单胞菌()、短波单胞菌()、发光杆菌()、黄杆菌()、盐单胞菌()等。在9月份从牡蛎体内分离的异养细菌比6月份分离的异养细菌高出1~2个数量级(除台山外)。6月份从台山地区牡蛎分离的异养细菌数(2.6×106~5.8×106cfu/g)最多, 高出其他地区1~3个数量级。药敏测试结果显示牡蛎体内异养细菌对20种抗生素普遍存在抗性, 尤其对青霉素、卡拉霉素、呋喃唑酮、阿莫西林、克林霉素及万古霉素表现出较高的耐药率。高温时期(6月、9月)分离的异养菌大多数为多重耐药细菌, 其比例分别为84.18 %和91.72 % 。本研究将为牡蛎养殖业的疾病控制以及水产养殖中细菌的耐药状况提供重要参考依据。
牡蛎; 异养细菌; 弧菌; 多重耐药性
香港牡蛎()隶属双壳纲, 牡蛎科, 主要分布于华南沿海咸淡水水域, 具有明显的地方特色, 已成为中国南部沿海最主要的牡蛎养殖种类[1-2]。随着养殖面积的扩大以及集约化养殖密度的增长, 大规模疾病暴发的风险也不断增加, 而其中细菌性疾病是阻碍水产养殖发展的重要因素。值得注意的是, 牡蛎大量死亡的现象一般出现在夏季, 往往水温较高的季节和地区更为严重[3-4]。当贝类体内细菌突增或养殖环境恶化致使贝类体质下降, 即可能引起细菌流行病的暴发, 并导致贝类的大量死亡[5]。如水温超过20℃时, 牡蛎幼体更易发病, 一旦发病, 死亡率高达90%[6]。其中, 异养细菌扮演着重要的角色。异养细菌是典型的基质限制性生物, 其个体微小、繁殖速度快、生命周期短, 异养细菌目前被认为是浮游生物群落的一个重要组成部分[7], 且异养细菌数量变化可间接反映养殖环境理化因子的状况[8]。
抗生素具有杀灭或抑制细菌的作用, 被广泛应用到水产养殖中, 常见的抗生素有磺胺类、四环素类、喹诺酮类等[9]。抗生素通过抑制细菌细胞壁的合成和控制细菌的代谢等途径影响细菌的生长[10], 因此, 抗生素的使用一定程度上缓解了细菌性疾病的暴发。由于在水产养殖中抗生素的不规范使用甚至滥用, 从而对环境造成了污染[11]。研究表明, 在用药的过程中, 动物通过生理代谢吸收了水环境中的部分抗生素, 而代谢率仅约为30%[12], 剩余的大部分抗生素及药物残留的代谢物重新被释放到环境中, 对环境中生物的群落结构造成很大破坏。特别是疾病发生过程中作为优势群体的病原菌, 在环境中残留药物的诱导作用下, 快速进化并产生耐药基因, 经过持续的积累, 进而形成多重耐药细菌[13-14]。耐药菌的产生以及其耐药基因的突变给水产病害的治疗增加难度, 在细菌防治中加大抗生素的剂量, 使得耐药问题更加突出, 威胁人类和其他动物的健康[15-16]。目前临床使用的抗生素也被用在水产养殖行业上, 当来源于水产动物体内的耐药菌对临床所用的抗生素产生抗性之后, 其携带的耐药基因一旦有机会进入人体, 将会对人类造成极大的威胁[17-18]。可见, 加大力度监测水环境中细菌的动态及耐药状况具有重要的意义和参考价值。而目前关于水生细菌耐药性的研究主要集中在高密度养殖的鱼类, 从网箱养殖鱼类分离的细菌对阿莫西林、红霉素、庆大霉素耐药率均在20%以上[19]。针对开放海域中的双壳贝类体内外细菌的耐药研究甚少, 而大部分的双壳贝类具有滤食性特点, 其与环境的关系最为密切, 也最能反应水体环境状况。因此本研究以广东沿海地区的典型双壳贝类——香港牡蛎为对象, 对其体内异养菌进行分离鉴定、分析, 研究牡蛎在高温时期(6月份、9月份)中异养细菌和弧菌数量、种类组成的变化以及对常用抗生素耐药率的变化, 旨在为牡蛎细菌性疾病的预警及海洋微生态的环境健康研究提供数据基础和参考依据。
1 材料与方法
1.1 样品采集与异养菌统计
2018年6月、9月在广东沿海地区采取香港牡蛎(图1)。 6月份采样地点: 汕头(117°08′E, 23°46′N)、惠州(114°57′E, 22°71′N)、阳江(111°79′E, 21°68′N)、江门(112°57′E, 21°77′N)、台山(112°78′E, 22°27′N)。9月份采样的地点为台山(112°78′E, 22°27′N)、汕尾(115°37′E, 22°78′N)、汕头(117°08′E, 23°46′N)、湛江(109°75′E, 20°89′N)、阳江(111°79′E, 21°68′N)。采样点温度: 25.4℃~29.8℃。采样点盐度: 18.4~32.5。在每个采样点随机选取5~10只牡蛎, 用无菌生理盐水清洗干净后, 称取0.5 g 的牡蛎消化道置于灭菌后的玻璃匀浆器中, 加入1 mL无菌生理盐水混合后磨成匀浆, 以10–2、10–3的稀释度进行稀释, 分别涂布于3种培养基Brain Heart Agar(BHA)培养基、Thiosulfate Citrate Bile Salts(TCBS)培养基、Mueller-Hinton Agar(MHA)培养基(均购于环凯生物科技有限公司)。各个梯度均设置3个平行组, 涂布后置于28℃恒温培养箱培养96 h, 然后对培养基的异养细菌和弧菌进行计数。BHA培养基计数结果为异养细菌总数, TCBS培养基计数结果为弧菌数, MHA培养基计数结果用于计算单种药物具有抗性的菌株比例见1.4。
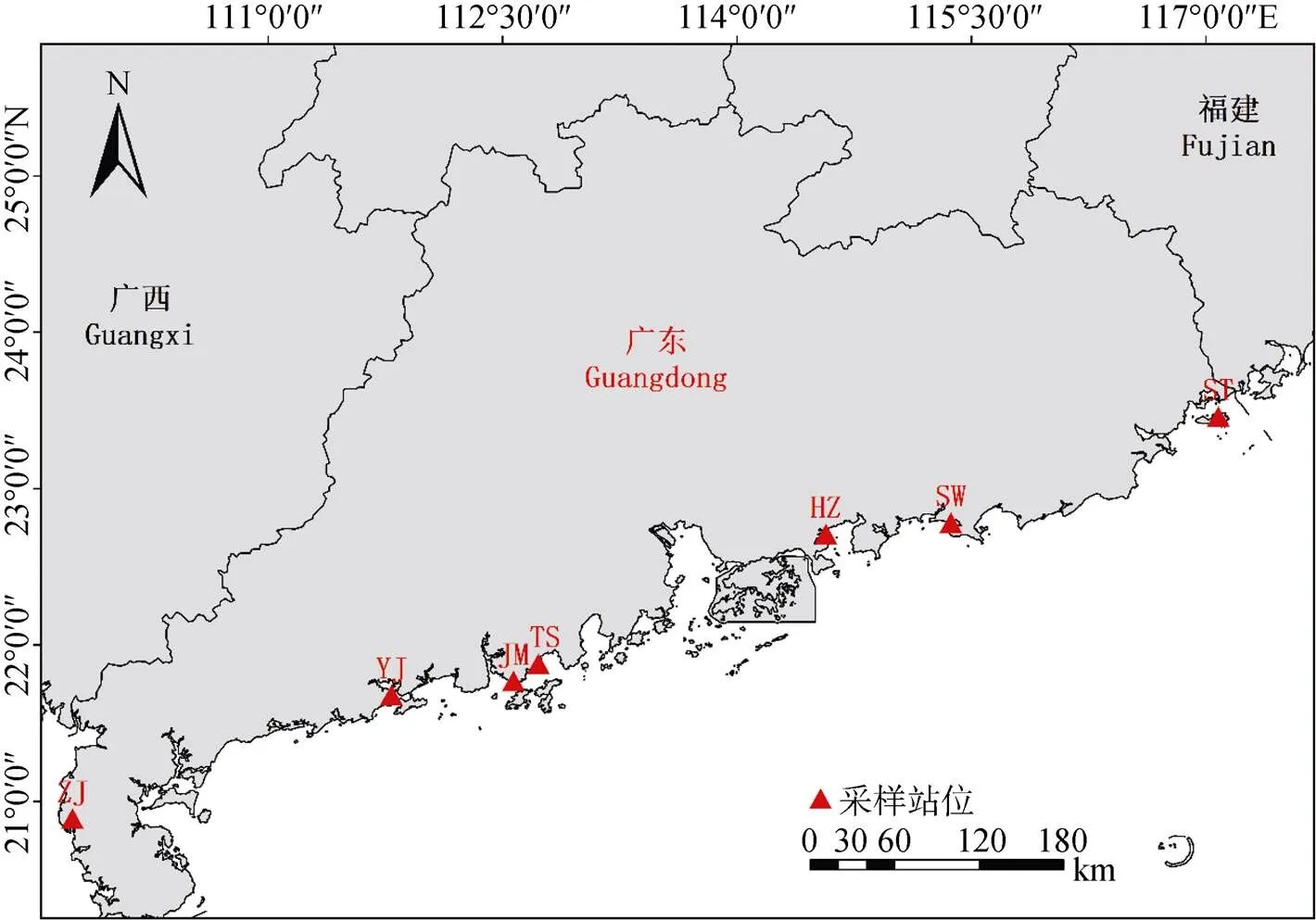
图1 广东省采样位点分布图
1.2 耐药菌株(单一药物)的分离
通过添加单种药物的培养基平板筛选培养耐药菌株, 取1.1中匀浆液(10–2稀释度)涂布于MHA培养基分别添加了庆大霉素、呋喃唑酮、利福平、环丙沙星、恩诺沙星、氯霉素、复方新诺明7种药物的MHA培养基, 涂布后置于28℃恒温培养箱培养96 h, 然后进行平板计数, 并随机挑取单菌落, 经划线分离纯化后用甘油进行保存(–80℃), 后续菌株鉴定见2.2和药敏测试分析见2.3。
1.3 细菌基因组DNA的提取及菌株的16S rDNA的PCR扩增
DNA Maker、PCR-mix (含有 Taq DNA 聚合酶、d NTPs、缓冲液等 PCR 扩增必需组分)、dd H2O均购于广州东盛科技有限公司; 细菌DNA提取试剂盒(Mabio)购于广州吉瑞生物科技有限公司; 引物由天一辉远生物科技有限公司合成。以质检合格的细菌DNA为模板, 进行16S rDNA的PCR扩增, 扩增体系及反应条件具体如下:
反应体系(25 μL体系): PCR-mix 12.5 μL、DNA模板1 μL、上下游引物各1 μL、ddH2O 9.5 μL。引物8F: 5′-AGAGTTTGATCCTGGCTCAG-3′和1492R: 5′-CGGTTACCTTGTTACGACTT-3′进行扩增。扩增条件为: 95℃ 5 min, 95℃ 40 s, 55℃ 40 s, 72℃ 45 s, 第2步到第四步进行30个循环, 72℃ 10 min, 4℃终止反应。
PCR扩增获得菌株的16S rDNA, 然后进行琼脂糖凝胶电泳, 得到单一条带之后, 将样品送由广州天一辉远基因科技有限公司进行双向测序, 将测序结果输入Gen Bank(www.ncbi.nlm.nih.gov)中进行比对, 确定菌株的种类。
1.4 药敏测试及耐药率分析
所用药敏纸片包括: 恩诺沙星(10 μg/片)、复方新诺明(25 μg/片)、庆大霉素(10 μg/片)、呋喃唑酮(10 μg/片)、新霉素(30 μg/片)、利福平(5 μg/片)、环丙沙星(5 μg/片)、四环素(30 μg/片)、青霉素(10 U/片)、链霉素(10 μg/片)、红霉素(15 μg/片)、卡那霉素(30 μg/片)、诺氟沙星(10 μg/片)、多西环素(30 μg/片)、阿莫西林(10 μg/片)、氧氟沙星(5 μg/片)、氟苯尼考(30 μg/片)、万古霉素(30 μg/片)、妥布霉素(10 μg/片)、克林霉素(20μg/片)(均购于杭州生物试剂有限公司)。添加到培养基中的药物粉剂分别是: 庆大霉素、呋喃唑酮、利福平、环丙沙星、恩诺沙星、氯霉素、复方新诺明(7种药粉均购于上海阿拉丁生化科技股份有限公司)。
药敏测试方法采用纸片扩散法(Kirby-bauer 扩散法, 简称 K-B法), 操作主要如下: 用斜面培养基活化菌株后在28℃培养箱中培养24 h, 加入1 mL无菌生理盐水, 涡旋震荡后将斜面培养基上的菌苔洗脱下来, 混匀后吸100 μL菌液在MHA培养基上, 用涂布棒均匀涂开, 待菌液干后, 用灭菌的镊子夹取药敏纸片分别贴在培养基表面, 确保其与培养基充分接触, 之后将其放在28℃培养箱中倒置培养24 h, 用游标卡尺测量抑菌圈, 记录抑菌圈的直径, 根据NCCLS 的药敏实验标准判定(表1)细菌对抗生素的敏感程度, 即敏感(S)、中度(I)、耐药(R)。将判定为R的菌株标记为耐药菌株, 同时对3种及3种以上的抗生素存在抗性的判定为多重耐药(Multiple-antibiotics resistance, MAR)。
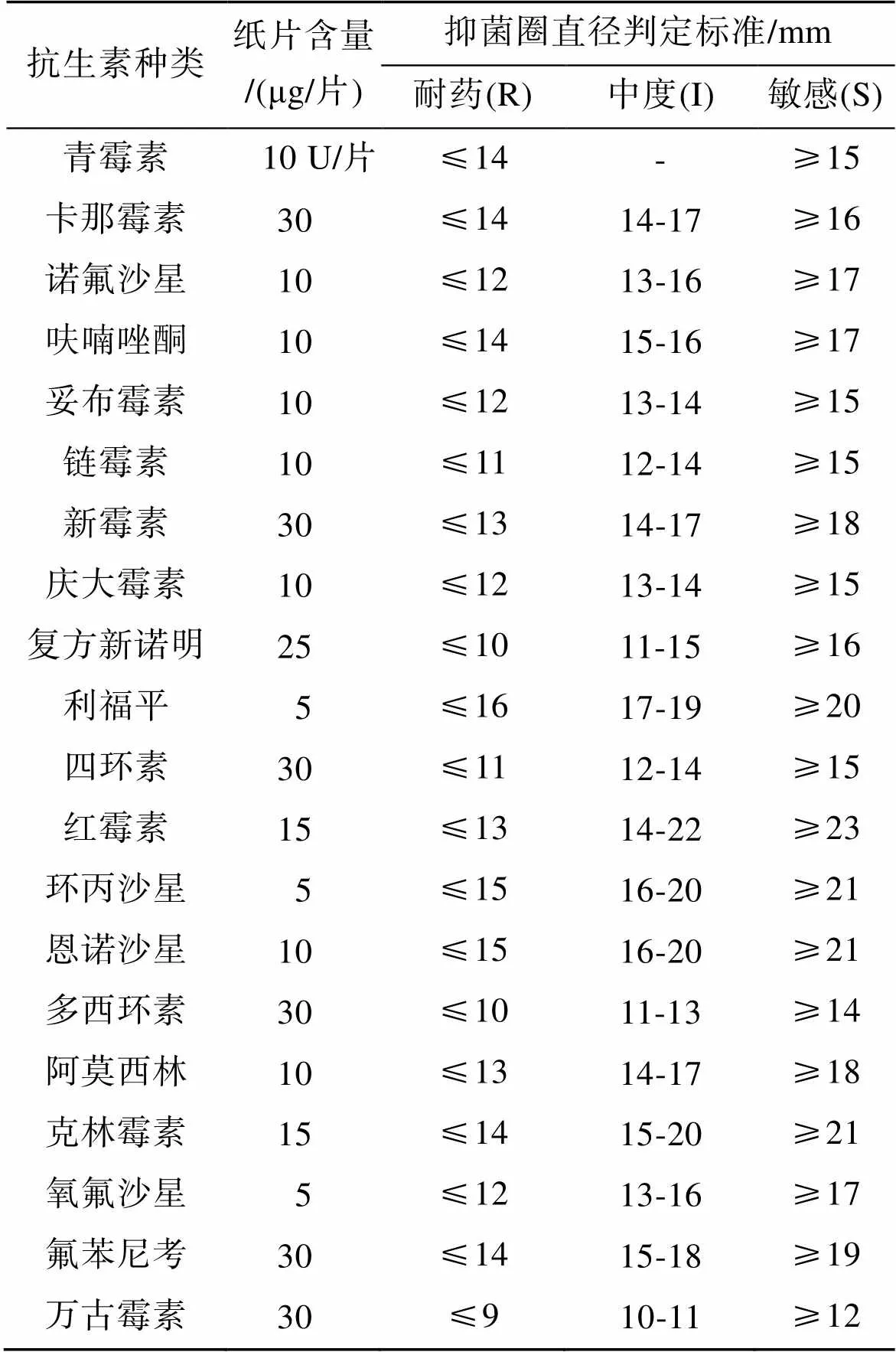
表1 20种抗生素的药敏试验判定标准
对单种药物具有抗性的细菌与异养细菌的比率:
对单种药物具有抗性的细菌比例=单种药物平板
计数结果/未加抗生素平板计数结果×100%
耐药菌株对多种药物的耐药率:
耐药率(%)=耐药菌株数量/受试菌株总数×100%
1.5 数据分析
实验数据采用 Excel 2010 软件整理, 各样品之间的差异性分析采用单因素方差分析(One-Way ANOVA)。
2 结果与讨论
2.1 不同采样地点牡蛎体内异养细菌和弧菌数量
6月份的数据显示, 广东各沿海养殖区牡蛎体内异养细菌数由高到低依次为: 台山(2.6×106~5.8× 106cfu/g)>江门(2.2×105~2.8×105cfu/g)>惠州(3.6× 104~7.8×104cfu/g)>汕头(4.2×104~5.2×104cfu/g)>阳江(6.6×103~9.8×103cfu/g)。如图2所示, 台山地区异养细菌数量高出其他地区1~3个数量级。各地牡蛎体内弧菌数量由高到低依次为: 台山(4.8×105~5.6× 105cfu/g)>江门(3.6×104~1.9×105cfu/g)>汕头(2.2×104~ 3.2×104cfu/g)>惠州(6.8×103~1.8×104cfu/g)>阳江(8.0× 102~3.2×103cfu/g)。
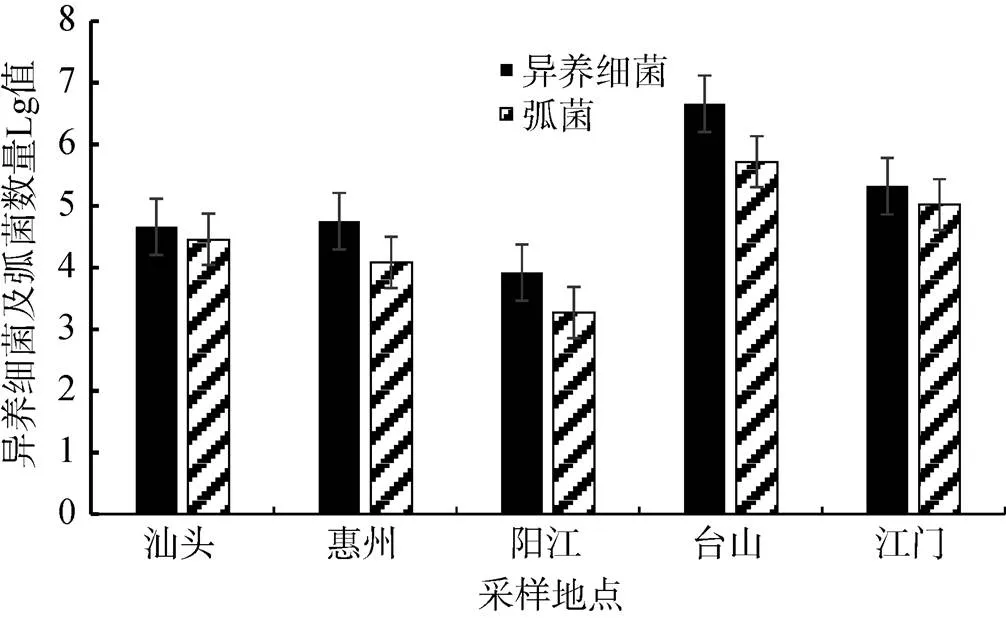
图2 6月份各采样点的异养细菌和弧菌数量
9月份广东各沿海养殖区牡蛎体内异养细菌总数由高到低依次为: 湛江(1.5×106~1.8×106cfu/g)>汕头(5.8×105cfu/g)>阳江(2.2×105~2.4×105cfu/g)>汕尾(1.2×105~1.4×105cfu/g)>台山(8×103~1.8×104cfu/g), 各地区之间异养细菌数量差异不显著, 均在1个数量级之间(图3)。各地牡蛎体内弧菌数量由高到低依次为: 湛江(8.0×103~1.9×104cfu/g)>阳江(6.6×103~6.8× 103cfu/g)>台山(6.6×103~6.8×103cfu/g)>汕头(2.0×103~ 4.0×103cfu/g)>汕尾(6.9×102~7.1×102cfu/g)。

图3 9月份各采样点的异养细菌和弧菌数量
据报道夏季养殖海水中营养丰富, 细菌将会大量增殖[20]。本研究显示, 在6月份与9月份汕头、台山及阳江的牡蛎体内异养细菌数量均处于较高水平, 而不同地区存在不同程度的差异, 而同一地区不同月份也存较大的差异, 总体上, 6月份牡蛎体内异养细菌比9月份异养细菌低1~2个数量级, 如阳江地区6月份与9月份的异养细菌数量差异极显著(<0.01), 相差1~2个数量级(图4)。其中比较特别的, 台山地区6月份异养细菌数量则比9月份异养细菌数量高1~2个数量级, 异养细菌数量差异极显著(<0.01)。其原因可能与台山养殖区降水较少导致盐度、温度升高有关, 已有报道异养细菌易受养殖环境(有机质、盐度、温度、pH及水体营养盐)的影响[21]。
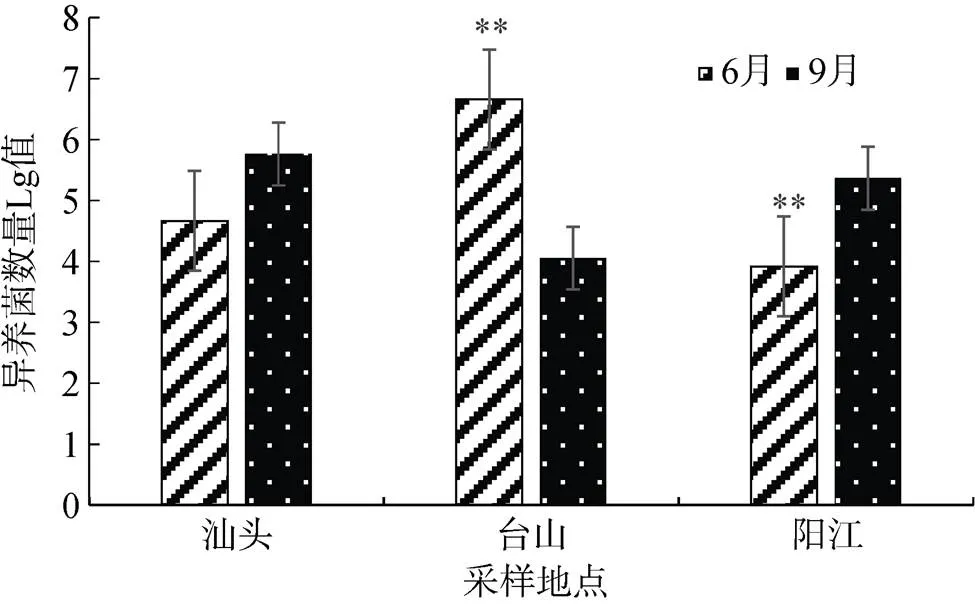
图4 6月与9月异养细菌数量
2.2 牡蛎体内耐药细菌的分析
本次研究由沿海采样点的香港牡蛎体内共分离纯化耐药菌株310个。其中, 阳江地区分离耐药菌株73个、台山地区分离耐药菌株64个、惠州地区分离耐药菌株49个、汕尾地区分离耐药菌株36个、汕头地区分离耐药菌株35个、湛江地区分离耐药菌株30个、江门地区分离耐药菌株23个。经16S rDNA序列分析比对结果显示, 此310个菌株分别属于48种不同种属, 主要为肠杆菌()、弧菌()、芽孢杆菌()、肺炎克雷伯菌()、希瓦氏菌()、不动杆菌()、假单胞菌()、短波单胞菌()、发光杆菌()、盐单胞菌()、黄杆菌()等。众所周知, 弧菌是一种嗜盐性细菌, 其广泛分布于海洋中, 属于条件致病菌, 当外部盐度条件发生改变或自身发生变异时, 就会大量增殖[22]。据报道弧菌的数量达到一定阈值, 水产动物将会被感染发病[23]。此外, 本次研究获得菌株经序列比对, 分离得到的不动杆菌属主要为鲍曼不动杆菌()。据报道, 近年来鲍曼不动杆菌耐药问题越来越严重, 鲍曼不动杆菌在环境中处于优势地位可能与耐药特性有关[24]。而在复杂的水环境中, 高温、高盐天气时, 弧菌、希瓦氏菌、不动杆菌等条件致病菌大量增殖, 对水产养殖动物来说是潜在的风险[25-26], 尤其是包括牡蛎在内的双壳贝类, 发病前甚至发病初期都难以及时发现症状, 因此, 在高温季节时期, 定时监测异养细菌和弧菌的数量动态变化, 有助于尽早发现养殖环境及养殖贝类的异常情况, 从而及时采取科学的防治措施, 有效预防和控制大规模细菌性疾病的暴发。
2.3 牡蛎体内异养细菌的耐药性
通过添加单种药物的MHA培养基和未加抗生素的MHA培养基得到对单种药物具有抗性的菌株比例, 由高到低为: 利福平(5.1%)>呋喃唑酮(4.2%)>庆大霉素(2.1%)>氯霉素(1.1%)>恩诺沙星(0.6%)>环丙沙星(0.3%)>复方新诺明(0.2%)。
另外, 对单种药物平板筛选得到的 310个菌株进行20种药物的药物敏感性实验, 结果如图5所示, 6月份筛选的菌株对呋喃唑酮耐药率高达86%, 万古霉素和克林霉素耐药率达到78%以上, 而对其他抗生素均表现一定程度的耐药性。9月份筛选的菌株对克林霉素、青霉素、呋喃唑酮耐药率均在78%以上, 其中对克林霉素耐药的菌株比例高达88%。除此之外, 所有受试菌株均对青霉素、卡拉霉素、呋喃唑酮、阿莫西林、克林霉素及万古霉素表现抗性, 而对氟苯尼考、恩诺沙星以及环丙沙星则较敏感。

图5 菌株对20种抗生素的耐药率
本研究中牡蛎体内异养细菌对青霉素、卡拉霉素、呋喃唑酮、阿莫西林、克林霉素及万古霉素普遍存在耐药性, 对这六种抗生素的耐药率均高于50%。其中6月份分离的菌株对呋喃唑酮和万古霉素耐药率明显高于其他抗生素, 均在81%以上。9月份分离的菌株对克林霉素、青霉素耐药率均在78%以上, 以往的研究表明青霉素的耐药率也较高[27]。因为青霉素、克林霉素主要针对革兰氏阳性菌(G+), 其作用是抑制G+细菌细胞壁上的肽聚糖合成, 而在水产养殖水体中主要是革兰氏阴性菌(G–)。
多重耐药性是指菌株同时对3种或3种以上抗生素存在抗性[15], 对牡蛎体内分离的菌株进行20种常见抗生素的敏感性试验, 结果显示, 6月份分离的多重耐药菌株占84.18%。9月份分离的多重耐药菌株占91.72%。其中6月份分离的菌株中有27.12%对10种以上抗生素表现出耐药性。9月份分离的菌株中有47.36%对10种以上抗生素表现出耐药性。
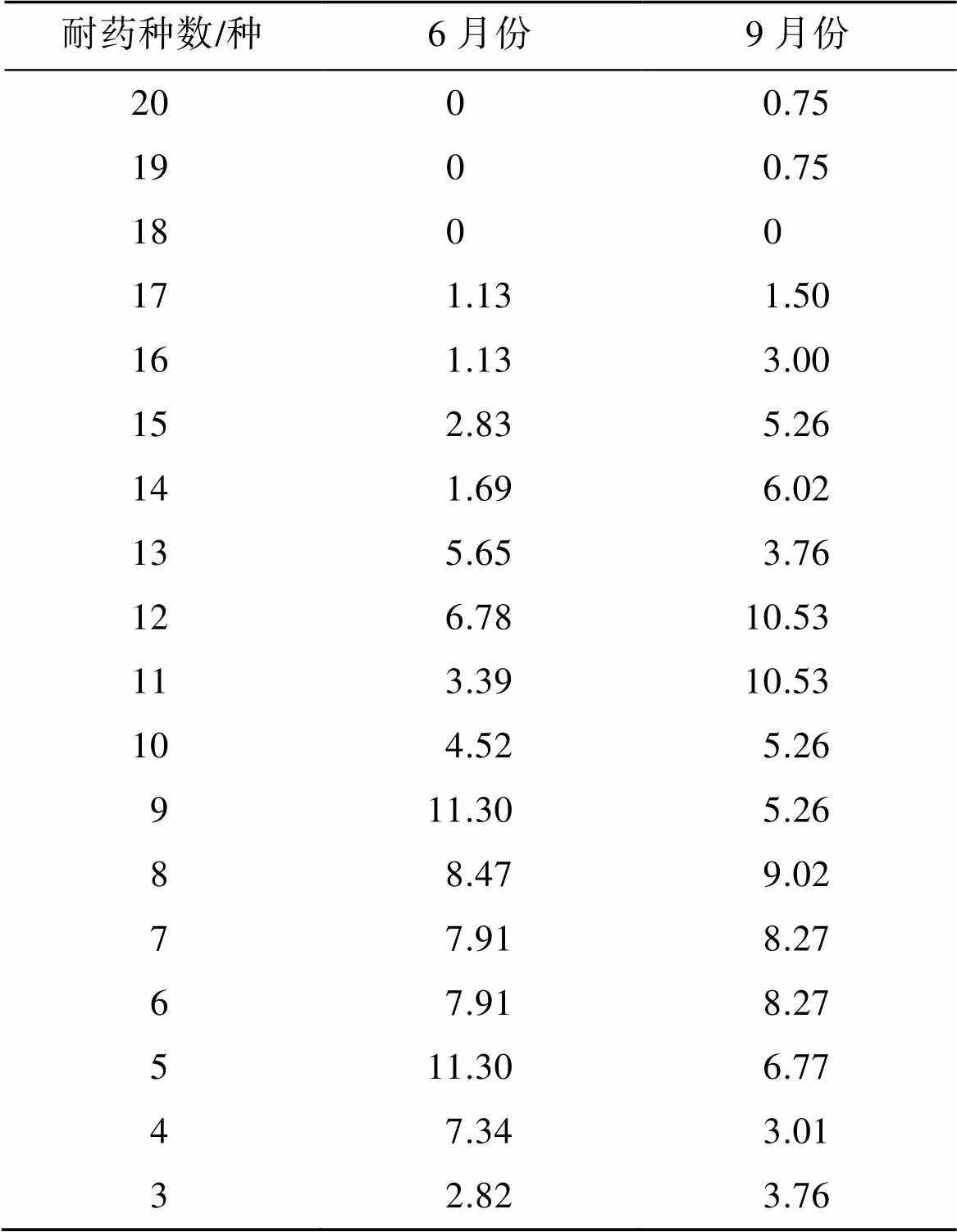
表2 牡蛎体内异养细菌的多重耐药率/%
自20世纪50年代多重耐药细菌的发现, 一直备受关注。在此前研究中从军曹鱼中分离的菌株多重耐药菌株占9.8%[27], 而本研究中分离的多重耐药菌株高达80%以上。在水产养殖中分离多重耐药细菌数量正逐年升高, 其耐药性通过基因水平转移方式不断传递、扩散, 威胁公共卫生健康。本研究还发现一个重要结果, 即经单种抗生素筛选分离得到的菌株对多种抗生素均表现出耐药性, 具有较强的多重耐药性。细菌主要通过膜的主动外排系统使细胞内泵中的抗生素排出和细胞膜的渗透性阻碍抗生素进入细菌内膜的靶位来实现多重耐药性[28]。另外, 高温季节细菌大量增殖, 且水生动物对抗生素的吸收与温度呈正相关[29-30]。而水温与水生细菌多重耐药性的形成是否存在关联, 有必要进一步深入研究。
2.4 水产养殖中抗生素的合理使用
由于养殖牡蛎的近海湾区富含各种浮游植物、无机盐等营养物质, 因而是牡蛎生长的理想区。但离人类生活区较近, 人类活动残留的抗生素没有完全消除, 抗生素通过废水排放和生物传递进入水生环境[31]。另外, 部分养殖户在养殖过程中滥用抗生素, 导致抗生素残留在水体中。这过程中残留的抗生素对细菌起到筛选的作用, 使细菌耐药性不断增强和扩散[32-33]。部分临床医学相关的致病菌如鲍曼不动杆菌, 其耐药性正不断扩散, 威胁人类和动物的健康[34]。绝大多数抗生素对细菌性疾病或真菌性疾病有效, 但是, 不同的细菌性疾病, 致病机理有所不同, 故所用的抗生素也不同[35]。因此我们在水产养殖的过程中对抗生素的使用要严格按照规定, 从养殖的实际情况出发合理使用抗生素。同时应该减少甚至禁止使用易于诱导细菌出现多重耐药性的抗生素, 制定水产养殖过程中抗生素使用规范条例及科学标准, 建立有效的监督机制。另一方面, 加强水生细菌的耐药性的相关研究已刻不容缓, 尤其是多重耐药性的形成机制以及耐药传播机理等方面。
3 结论
本文对广东沿海地区6月、9月的香港牡蛎体内异养细菌总数和弧菌总数分析表明牡蛎体内分离的异养细菌、弧菌多为嗜盐性细菌, 其受温度、盐度影响较大。总体上, 9月份分离的异养细菌和弧菌比6月份高出1~2个数量级。310个菌株进行药物敏感实验发现80%的菌株的表现出多重耐药性, 尤其对青霉素、卡拉霉素、呋喃唑酮、阿莫西林、克林霉素及万古霉素的耐药率都在50%以上。在水产养殖中分离多重耐药细菌数量正逐年升高, 病害防治中应该对症下药, 减少甚至禁止使用易于诱导细菌出现多重耐药性的抗生素。
[1] 刘琳琳, 秦小明, 刘亚, 等. 香港牡蛎挥发性成分及其加热处理变化[J]. 广东海洋大学学报, 2018, 38(5): 41-49. Liu Linlin, Qin Xiaoming, Liu Ya, et al. Analysis of volatile components in Hongkong Oyster meat and its changes after heating treatment[J]. Journal of Guangdong Ocean University, 2018, 38(5): 41-49.
[2] 李辉尚, 李坚明, 秦小明, 等. 中国牡蛎产业发展现状、问题与对策——基于鲁、闽、粤、桂四省区的实证分析[J]. 海洋科学, 2017, 41(11): 125-129. Li Huishang, Li Jianming, Qin Xiaoming, et al. The status, problems, and countermeasure of oyster industry in China-based on the an empirical analyses of Shandong Fujian and Guangdong Guangxi Provinces[J]. Marine Sciences, 2017, 41(11): 125-129.
[3] Samain J F, Dégremont L, Soletchnik P, et al. Genetically based resistance to summer mortality in the Pacific oyster () and its relationship with physiological, immunological characteristics and infection processes[J]. Aquaculture, 2007, 268(1): 227-243.
[4] Leung T L F, Bates A E. More rapid and severe disease outbreaks for aquaculture at the tropics: implications for food security[J]. Journal of Applied Ecology, 2013, 50(1): 215-222.
[5] 王瑞旋, 林韵锶, 郭志勋, 等. 海南陵水企鹅珍珠贝肠道及其养殖水体中异养细菌耐药性研究[J]. 热带海洋学报, 2013, 32(6): 96-100. Wang Ruixuan, Lin Yunsi, Guo Zhixun, et al. Study on antibiotic-resistance of heterotrophic bacteria from farming water and intestine of Pearl oyster () in Lingshui[J]. Journal of Tropical Oceanography, 2013, 32(6): 96-100.
[6] Ford S E, Borrero F J. Epizootiology and pathology of juvenile oyster disease in the Eastern Oyster,[J]. Journal of Invertebrate Pathology. 2001, 78(3): 141-154.
[7] Zaccone R, Caruso G, Calı C. Heterotrophic bacteria in the northern Adriatic Sea: seasonal changes and ectoenzyme profile[J]. Marine Environmental Research, 2002, 54(1): 1-19.
[8] 郑晓叶, 郑天伦, 曹飞飞, 等. 不同密度青蛤养殖塘异养细菌和弧菌的数量变化[J]. 浙江农业学报, 2018, 30(10): 1647-1654. Zheng Xiaoye, Zheng Tianlun, Cao Feifei, et al. Quantity dynamics of heterotrophic bacteria andinrearing ponds[J]. Acta Agriculturae Zhejiangensis, 2018, 30(10): 1647-1654.
[9] 吴小梅, 林茂, 鄢庆枇, 等. 美洲鳗鲡及其养殖水体分离耐药菌的多样性和耐药性分析[J]. 水产学报, 2015, 39(7): 1043-1053. Wu Xiaomei, Lin Mao, Yan Qingpi, et al. Diversity and antimicrobial susceptibility of drug-resistant bacteria isolated fromand the farming water[J]. Journal of Fisheries of China, 2015, 39(7): 1043-1053.
[10] 张红芝, 朱颖莹, 顾其芳, 等. 牡蛎污染耐药性细菌调查及整合子检测[J]. 中国病原生物学杂志, 2017, 12(7): 654-657. Zhang Hongzhi, Zhu Yingying, Gu Qifang, et al. A study to characterize the integrons and drug resistance of bacteria from oysters[J]. Journal of Pathogen Biology, 2017, 12(7): 654-657.
[11] 杜闻杉, 王瑞, 孙晓迪, 等. 细菌耐药性与抗生素的合理使用探究[J]. 中国医药导刊, 2018, 20(3): 163- 166. Du Wenshan, Wang Rui, Sun Xiaodi, et al. Research on bacterial resistance and rational use of antibiotics[J]. Chinese Journal of Medicinal Guide, 2018, 20(3): 163- 166.
[12] 李兆新, 董晓, 孙晓杰, 等. 渔业养殖环境中抗生素残留检测与控制技术研究进展[J]. 食品安全质量检测学报, 2017, 8(7): 2678-2686. Li Zhaoxin, Dong Xiao, Sun Xiaojie, et al. Advances in the detection and control of antibiotic residues in aquaculture environments[J]. Journal of Food Safety & Quality, 2017, 8(7): 2678-2686.
[13] 王瑞旋, 耿玉静, 王江勇, 等. 水产致病菌耐药基因的研究[J]. 海洋环境科学. 2012, 31(3): 323-328. Wang Ruixuan, Geng Yujing, Wang Jiangyong, et al. Antibiotic resistant genes in aquacultural bacteria[J]. Marine Environmental Science. 2012, 31(3): 323-328.
[14] Allen H J, Wang H, Cloud-Hansen K, et al. Call of the wild: antibiotic resistance genes in natural environments[J]. Nature Reviews Microbiology, 2010, 8(4): 251-259.
[15] 周显凤, 倪贤生, 吴越, 等. 细菌耐药性机制研究进展[J]. 热带医学杂志, 2011, 11(3): 356-357. Zhou Xianfeng, Ni Xiansheng, Wu Yue, et al. Progress in the mechanism of bacterial resistance[J]. Journal of Tropical Medicine, 2011, 11(3): 356-357.
[16] 吴立婷, 廖金轩, 庞茂达, 等. 大黄鱼中哈维氏弧菌毒力及耐药特性分析[J]. 食品安全质量检测学报, 2019, 10(8): 2111-2119. Wu Liting, Liao Jinxuan, Pang Maoda, et al.Virulence and antimicrobial resistance ofharveyi in large yellow croaker[J]. Journal of Food Safety & Quality, 2019, 10(8): 2111-2119.
[17] 季海波. 细菌对抗菌药物的耐药性分析[J]. 中外医疗, 2018, 37(2): 192-195. Ji Haibo. Analysis of bacterial resistance to antimicrobial agents[J]. China & Foreign Medical Treatment, 2018, 37(2): 192-195.
[18] 孙永婵, 王瑞旋, 赵曼曼, 等.鲍消化道及其养殖水体异养菌的耐药性研究[J].南方水产科学, 2017, 13(3): 58-65. Sun Yongchan, Wang Ruixuan, Zhao Manman, et al. Study of antibiotic-resistance of heterotrophic bacteria from intestines of abalone (Haliotis discus hannai) and farming water[J]. South China Fisheries Science, 2017, 13(3): 58-65.
[19] Wu J, Mao C, Deng Y, et al. Diversity and abundance of antibiotic resistance of bacteria during the seedling period in marine fish cage-culture areas of Hainan, China[J]. Marine Pollution Bulletin, 2019, 141: 343- 349.
[20] Wang R X, He J, Wang J. Heterotrophic bacterial abundance and diversity in the farming environment and guts of the oyster[J]. Journal of Shellfish Research, 2016, 35(2): 343-350.
[21] 贺成, 徐沙, 宋书群, 等. 北部湾北部海域水体异养细菌的时空分布特征研究[J]. 海洋学报, 2019, 41(4): 94-108. He Cheng, Xu Sha, Song Shuqun, et al. Study on the temporal and spatial distribution characteristics of heterotrophic bacteria in the northern Beibu Gulf[J]. Journal of oceanography, 2019, 41(4): 94-108.
[22] 裴晓燕, 余波, 张秀丽, 等. 中国内陆6省(自治区)淡水鱼养殖、销售和餐饮环节常见嗜盐性弧菌污染调查[J]. 中国食品卫生杂志, 2016, 28(1): 79-83. Pei Xiaoyan, Yu Bo, Zhang Xiuli, et al. Investigation on common salinophilic vibrio contamination in freshwater fish breeding, marketing and catering in 6 inland provinces (autonomous regions) of China[J]. Chinese Journal of Food Hygiene, 2016, 28(1): 79-83.
[23] 薛超波, 王建跃, 王世意, 等. 大黄鱼养殖网箱内外细菌的数量分布及区系组成[J]. 中国微生态学杂志, 2005, 17(5): 336-338. Xue Chaobo, Wang Jianyue, Wang Shiyi, et al. The quantitative distribution and the microbial flora of bacteria in the water nearby the marine cag[J]. Chinese Journal of Microecology, 2005, 17(5): 336-338.
[24] Dekić S, Klobučar G, Ivanković T, et al. Emerging humanpathogenin the natural aquatic environment: a public health risk?[J]. International Journal of Environmental Health Research, 2018, 28(3): 315-322.
[25] 马继波. 粤东大规模增养殖区柘林湾海洋微生物的生态学研究[D]. 广东汕头: 汕头大学, 2006. Ma Jibo. An ecological study on marine microorganisms in a large-scale mariculture—Zhelin Bay, Eastern Guangdong[D]. Shantou, Guangdong Province: Shantou University. 2006
[26] 李彬, 荣小军, 廖梅杰, 等. 刺参肠道与养殖池塘环境中异养细菌和弧菌数量周年变化[J].海洋科学, 2012, 36(4): 63-67.Li Bing, Rong Xiaojun, Liao Meijie, et al. Annual changes of total heterotrophic bacteria andin the intestine ofand its culture pond[J]. Marine Sciences. 2012, 36(4): 63-67.
[27] 王瑞旋, 王江勇, 徐力文, 等. 军曹鱼养殖水体及其肠道弧菌的耐药性研究[J]. 南方水产. 2007(5): 1-6. Wang Ruixuan, Wang Jiangyong, Xu Liwen, et al. Antibiotic resistance of vibrio strains isolated from cobia () farming water and their digestion guts[J]. South China Fisheries Science, 2007(5): 1-6.
[28] Mckeegan K, Borgeswalmsley M, Walmsley A. The structure and function of drug pumps.[J]. Trends in Microbiology, 2001, 9(2): 71-79.
[29] Abraham W, Macedo A J, Gomes L H, et al. Occurrence and resistance of pathogenic bacteria along the Tietê River downstream of São Paulo in Brazil[J]. Clean–Soil, Air, Water, 2007, 35(4): 339-347.
[30] Wang R X, Wang A, Wang J Y. Antibiotic resistance monitoring in heterotrophic bacteria from anthropogenic-polluted seawater and the intestines of oyster[J]. Ecotoxicology and Environmental Safety, 2014, 109: 27-31.
[31] Munir M, Xagoraraki I. Levels of antibiotic resistance genes in manure, biosolids, and fertilized Soil[J]. Journal of Environmental Quality, 2011, 40(1): 248-255.
[32] Aminov R I. The role of antibiotics and antibiotic resistance in nature[J]. Environmental Microbiology, 2010, 11(12): 2970-2988.
[33] Heuer O E, Kruse H K. Human health consequences of use of antimicrobial agents in aquaculture[J]. Chinese Journal of Infection & Chemotherapy, 2009, 49(8): 1248-1253.
[34] 董肖萌. 鲍曼不动杆菌感染临床特点及抗菌药物选择的体外研究[D]. 山东济南: 山东大学, 2016. Dong Xiaomeng. Clinical characteristics and antibiotic selection ofinfection in vitro[D]. Jinan, Shandong Province: Shandong University, 2016
[35] 姚晓东. 抗生素在水产养殖中应用存在的问题及对策[J]. 农业与技术, 2016, 36(24): 103. Yao Xiaodong. The problems and countermeasures of antibiotic application in aquaculture[J]. Agriculture and Technology, 2016, 36(24): 103.
Investigation on the quantity and species of bacteria and their antibiotic resistance infrom the coast in Guangdong province
LI Bing1, 3, WANG Rui-xuan1, 2, XIE Yan-chun4, SHU Hu4, MOU Hong-li3, GUO Zi-han5, WANG Jiang-yong1, 3
(1. National Demonstration Center for Experimental Fisheries Science Education (Shanghai Ocean University), Shanghai 201306, China; 2. College of Food Technology and Life Science, Hanshan Normal University, Chaozhou, 521041, China; 3. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Fishery Ecology and Environment, Guangdong Province; Key Laboratory of Aquatic Product Processing, Ministry of Agriculture and Rural Affairs South, Guangzhou 510300, China; 4. Guangzhou University, Guangzhou 510006, China; 5. California Baptist University, California 92504, USA)
Quantities of heterotrophic bacteria andspp. in oysters () from the coast of the Guangdong province during the high-temperature season (June and September) were analyzed. Antibiotic resistance of 310 bacterial strains isolated from medium containing different species with resistance to a single antibiotic, including gentamicin, furazolidone, rifampicin, ciprofloxacin, enrofloxacin, chloramphenicol, compound sulfamethoxazole, were further confirmed using the Kirby–Bauer method. Results showed that the 310 isolates belonged to 48 different species among the, andgenuses. The quantity of heterotrophic bacteria isolated from oysters in September was 1-2 orders of magnitude higher than that in June, with an exception of that in Taishan city. Heterotrophic bacteria quantities in oysters from the Taishan area peaked (2.6× 106to 5.8×106cfu/g) in June and were 1–3 orders of magnitude higher than those in other areas. Only 20 antibiotics were used for antibiotic susceptibility tests. Results showed that almost 310 strains were resistant to 20 antibiotics, with most strains resistant to penicillin, kanamycin, furazolidone, amoxicillin, clindamycin, and vancomycin. Multiple antibiotic resistance was widespread during the high-temperature period: 84.18% in June and 91.72% in September. Therefore, the present study provides an important reference for disease control in oyster farming and bacterial antibiotic resistance in aquaculture.
oysters; heterotrophic bacteria;; antibiotic resistance
Jul.14, 2019
S917.1
A
1000-3096(2020)03-0050-09
10.11759/hykx20191030001
2019-07-14;
2019-09-25
现代农业产业技术体系建设专项资金(CARS-49); 广东省渔业生态环境重点实验室开放基金项目(201620411); 广东省自然科学基金项目(2017A030313112)
[The Earmarked Fund for Modern Agro-industry Technology Research System, No.CARS-49; Fund project of key laboratory of fishery environment of guangdong province, No.201620411; The Natural science foundation of Guangdong province, No. 2017A030313112]
(并列第1作者, 同等贡献): 李炳(1995.10-), 男, 重庆璧山人, 硕士研究生, 主要从事细菌耐药性研究 E-mail: 1029148315@ qq.com; 王瑞旋(1979.8-), 女, 广东揭阳人, 副研究员, 博士, 主要从事水生生物病害防治 E-mail: wangruixuan@scsfri.ac.cn;通讯作者:王江勇, E-mail: wjy104@163.com
(本文编辑: 赵卫红)
