餐饮食品中蜡样芽孢杆菌的实时荧光PCR检测方法研究*
2020-04-17柯振华
柯振华
[福建省产品质量检验研究院 国家加工食品质量监督检验中心(福州),福建 福州 350002]
蜡样芽孢杆菌为革兰氏阳性菌,兼性需氧型,可形成椭圆形芽孢。大多数引起食物中毒的蜡样芽孢杆菌有鞭毛,可运动,在普通琼脂上生成的菌落呈不透明灰白色,表面干燥,边缘常呈扩展状,菌落较大,直径4~6 mm。
由蜡样芽孢杆菌引起的食物中毒一般发生在夏秋季,具有比较明显的季节性[1~5]。如果食物被少量蜡样芽孢杆菌污染,且继续置于适宜蜡样芽孢杆菌生长的温度下储存,菌体会迅速大量地繁殖,进而释放毒素,被人误食之后,严重的会导致死亡[6~9]。
我国由蜡样芽孢杆菌引起的食物中毒多为淀粉类食品引起,例如馊饭、米粉、酒酿、炒饭等,而国际上多是乳制品、肉、蔬菜、甜点心、调味汁等引起的食物中毒,该菌的致病能力与其分泌的毒素有关[10~17]。由于蜡样芽孢杆菌的广泛分布及其所分泌毒素对人们造成的严重威胁,建立高效稳定可靠的蜡样芽孢杆菌检测方法体系对食品安全具有重大意义。
随着外卖的兴起以及人民生活消费方式的转变,餐饮食品已经成为人们日常生活的重要部分,由于餐饮食品加工储运的特殊性以及自然界中蜡样芽孢杆菌的广泛分布,在餐饮食品中存在较大的蜡样芽孢杆菌污染风险。在我国,对蜡样芽孢杆菌的检测主要基于国家标准方法GB 4789.14—2014《食品安全国家标准 食品微生物学检验 蜡样芽胞杆菌检验》,该方法步骤较多,操作过程复杂,检测过程需要3~5 d的时间,难以满足餐饮食品快速检测需求,因此,急需开发一种快速准确的餐饮食品中蜡样芽孢杆菌的筛查方法。PCR作为基因检测技术,具有高灵敏度、高特异性等优点,目前已经被国内外科学家广泛应用于病原菌的筛查检测[18~24]。
为了节约检测时间,提高检测效率,本研究拟基于实时荧光PCR检测技术开发一套完整的餐饮食品中蜡样芽孢杆菌的检测方法体系。主要技术路线包括使用胰酪胨大豆多黏菌素肉汤培养基对样品中的目标菌进行预增菌,采用热裂解法提取样品核酸,运用实时荧光PCR技术特异性地检测样液中的蜡样芽孢杆菌基因成分。
在建立稳定可靠的蜡样芽孢杆菌检测体系后,为了验证所建立方法体系的有效性与适用性,我们在市场中随机抽样采集了315份餐饮食品样本开展检测工作。检测结果表明,应用本研究方法可在抽样检验的25份餐饮食品中检测出蜡样芽孢杆菌基因成分,检出率为7.93%。
1 材料与方法
1.1 材料
1.1.1 标准菌株
1.1.2 餐饮食品样品
购自市场中各大超市、餐馆、集体食堂、快餐店、小吃店等。采用无菌抽样方式采集样品,每份样品独立包装并按序列编号,做好标记,每份样品至少采集200 g(mL),冷藏(4 ℃)条件下4 h内送至实验室进行检验。
1.1.3 试剂
胰酪胨大豆多黏菌素肉汤培养基购自北京陆桥技术股份有限公司;
实时荧光PCR反应用预混液购自上海生工生物工程股份有限公司;
DNA提取试剂盒购自德国凯杰公司。
1.2 主要仪器
核酸蛋白测定仪:美国伯乐公司;
7500实时荧光定量PCR检测系统:美国应用生物系统有限公司;
台式离心机:德国艾本德公司;
生物安全柜:德国贝克公司;
Milli-Q超纯水仪:德国密理博公司;
VITEK Compact II全自动微生物鉴定药敏系统:法国梅里埃公司。
1.3 方法
1.3.1 预增菌
蜡样芽孢杆菌标准菌株接种于100 mL胰酪胨大豆多黏菌素肉汤培养基中,37 ℃振荡培养12 h。餐饮食品取25 g,加入225 mL 胰酪胨大豆多黏菌素肉汤培养基中,拍击混匀150 s,37 ℃振荡培养12 h。
1.3.2 DNA模板的制备方法
在核酸提取方法的选择上,我们主要采取两种方法提取试样DNA,第一种方法是热裂解法,第二种方法是试剂盒法。
⑴ 热裂解法提取DNA:用移液器小心移取预增菌液2.0 mL,置于离心管中,10000 r/min离心10 min。弃上清,沉淀用150 μL TE缓冲液悬浮,于100 ℃金属浴加热10 min,加热结束后,10000 r/min离心10 min。取上清作为DNA模板溶液。
⑵ 试剂盒法提取DNA:按照Qiagen试剂盒操作说明书进行DNA提取。
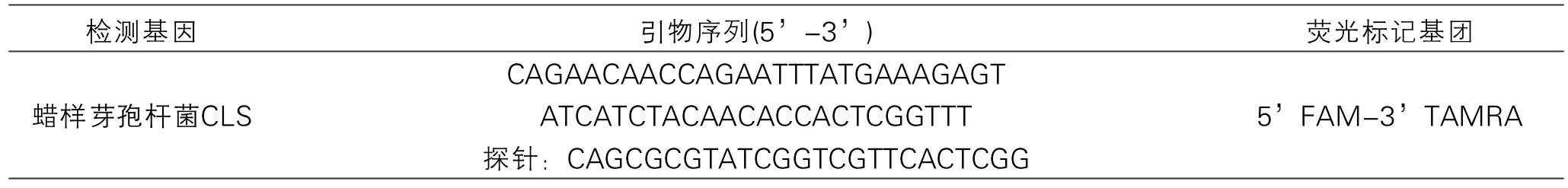
表1 引物探针信息
1.3.3 引物探针的设计与合成
本文根据蜡样芽孢杆菌基因组保守序列设计合成蜡样芽孢杆菌特异性的引物与探针,具体引物探针信息见表1,引物探针委托上海生工生物工程有限公司合成。
1.3.4 实时荧光PCR反应体系与反应参数
实时荧光PCR反应体系:在30 μL PCR体系中,实时荧光PCR预混液15 μL,上游、下游引物各1 μL,探针0.5 μL,模板DNA溶液3.0 μL,灭菌蒸馏水补足体积至30 μL。
实时PCR反应参数:94 ℃、10 min,94 ℃、15 s,60 ℃、1 min,45个循环。
1.3.5 灵敏度试验
采用热裂解法提取的蜡样芽孢杆菌基因组DNA作为模板溶液,使用核酸蛋白测定仪测定基因组DNA的浓度与纯度,将其梯度稀释后进行实时PCR反应,绘制各浓度梯度的PCR扩增曲线。
2 结果与分析
2.1 方法特异性验证试验
为了验证所建立蜡样芽孢杆菌实时荧光PCR方法的特异性,本研究将蜡样芽孢杆菌、沙门氏菌、金黄色葡萄球菌、副溶血性弧菌、大肠埃希氏菌O157∶H7、单核细胞增生李斯特氏菌与大肠埃希氏菌等菌株接种于前增菌培养液中,培养12 h后采用热裂解法提取各菌株的基因组DNA。
根据优化后的实时荧光PCR方法,使用蜡样芽孢杆菌检测引物探针对上述6株常见病原菌基因组DNA进行检测。结果显示,目标菌蜡样芽孢杆菌出现明显的扩增曲线,而在其他阴性对照菌株DNA样品中均无扩增曲线,特异性实验结果见图1。
2.2 方法灵敏度试验
我们采用TE缓冲液将提取得到的蜡样芽孢杆菌DNA溶液分别稀释至100、10、1.0、0.1、0.01、0.001、0.0001 ng/μL,使用本研究方法体系分别对上述7个浓度梯度的DNA溶液进行实时荧光PCR测试,实验重复6次。
在6次重复试验中,100、10、1.0、0.1、0.01 ng/μL浓度的蜡样芽孢杆菌DNA溶液中均出现了扩增曲线,结果如图2所示,0.001、0.0001 ng/μL的蜡样芽孢杆菌DNA溶液未出现扩增曲线。结果表明,在DNA浓度的水平上,本研究方法的检测灵敏度为0.01 ng/μL的蜡样芽孢杆菌DNA溶液。
2.3 315份餐饮食品中蜡样芽孢杆菌的检测结果
用本研究建立的检测方法对市场中采集的315份餐饮食品中的蜡样芽孢杆菌进行PCR检测分析。
结果表明,应用本方法在25份餐饮食品样品中检测出蜡样芽孢杆菌特异性基因成分,检出率为7.93%(25/315)。检出阳性结果的餐饮食品增菌液经微生物检测方法以及VITEK验证,均为阳性,结果说明本方法检测结果与微生物检验方法结果高度一致,充分说明本研究方法的准确性与可靠性。
3 讨论
蜡样芽孢杆菌由于其分布的广泛性及所分泌毒素的危害性,引起人们的普遍关注。我国现行的国家标准方法如GB 4789.14—2014对于蜡样芽孢杆菌的检测需要3~5 d的时间,难以满足餐饮食品对检验时效性的要求。鉴于餐饮食品的特殊性以及蜡样芽孢杆菌的危害性,本研究旨在建立一种能在短时间内精确筛查餐饮食品中蜡样芽孢杆菌的方法。
针对模板DNA的制备,本研究探索并比较了热裂解法与试剂盒法在细菌DNA提取中的应用差异。对同一份增菌液,本研究同时采用热裂解法以及试剂盒法进行DNA提取,PCR实验结果表明两种方法所提取菌液DNA都能扩增出目标基因序列,扩增曲线以及CT值无显著性差异。但是,由于试剂盒成本较高且提取步骤多、耗时长,针对大批量样品的DNA制备适用性不强,而热裂解法提取菌液DNA时只需加入TE缓冲液,通过金属浴加热后离心的方式获得菌液DNA,操作步骤简洁,耗时短,一次性可以处理大批量的样品。综合考虑,本研究抽样检验的餐饮食品样品主要采取热裂解法提取DNA。
本文以蜡样芽孢杆菌基因组中的 基因为靶序列,设计并合成特异性的引物与探针,PCR特异性实验结果显示,所设计引物探针仅针对蜡样芽孢杆菌DNA有扩增曲线,针对其他菌株DNA未见扩增曲线,充分说明了引物探针的特异性良好。本文通过试验不断筛选和优化适宜的引物探针浓度与退火温度等条件,从而保证蜡样芽孢杆菌PCR检测方法的稳定性和结果的可重复性。
本文将DNA热裂解提取法与实时荧光PCR检测技术相结合,应用于餐饮食品中蜡样芽孢杆菌的检测中,建立了一整套由样品预增菌到DNA提取到实时荧光PCR检测的方法,所建立方法简便快捷,在18 h内即可完成所有检测工作,检出限可达到0.01 ng/μL菌液DNA,特别适用于大批量样品中蜡样芽孢杆菌的快速筛查检测,具有较好的推广应用前景。同时,针对餐饮食品及相关食品如面米制品、乳制品等中蜡样芽孢杆菌的筛查检测,本方法也具有较高的实用和推广价值。
