各国口罩告急,出口需哪些资质?如何快速找到
2020-04-17腾道
中国目前未限制口罩出口,并且鼓励防护服的出口。
全球都在等待 Made in China!
出口中国制造的口罩需要什么资料?国外进口需要有什么资质?有什么标准吗?如何查询口罩是否合格?下面资料供大家参考。
口罩出口,需要提供这些资料信息:⑴ 营业执照;⑵ 企业生产许可证;⑶ 产品检验报告;⑷ 医疗器械注册证;⑸产品说明书、标签;⑹ 产品批次/号;⑺ 产品质量安全书;⑻ 产品样品图片及外包装图片。
国内出口的有关问题
1.目前国内口罩等疫情物资是否可以出口?
答:商务部已对外说明,口罩等疫情物资可正常出口。
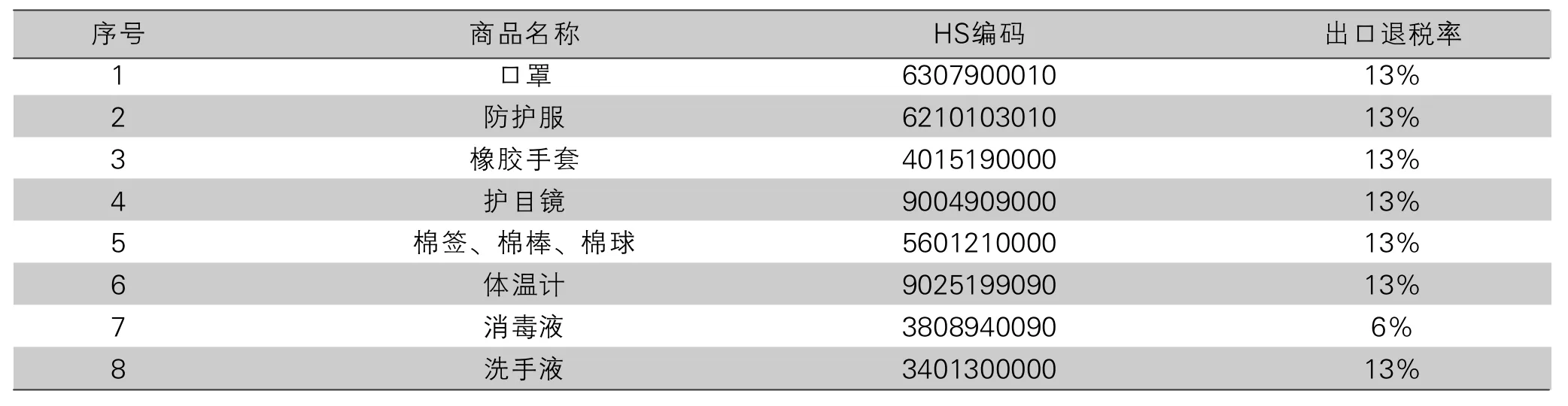
口罩及防护服等防护物资的HS编码表
2.出口疫情物资的企业需要有什么资质?
答:普通口罩等非医疗器械管理的疫情物资,没有监管条件,有进出口权的企业,就可以直接出口。涉证的口罩等疫情物资,需要产品三证:A.营业执照(经营范围包含有医疗器械相关);B.产品备案证或者注册证;C.厂家检测报告,然后由进出口经营权的企业,再行出口。另外,如果是企业想赠送或者代替海外关联公司采购,需要提供情况说明。
3.在我们的公司想要出口一批涉证口罩,不过没有出口资质,想问一下还能进行出口吗?
答:如果是具备三证的工厂的产品,可以通过外贸代理进行出口销售,如果没有三证的话,那就不能出口了。
4.普通口罩和医用口罩出口分别需要什么资质,需要办理哪些证呢?
答:普通和医用,是指用途。而药监局管理是按照产品品质和标准来管理的。二类和三类的医疗器械的口罩,需要备案证或者注册证,才能出口。涉证的三证,见第2个问题的答案。
5.贸易公司没有医疗器械的资质,可以出口口罩吗?厂家可以提供三证,退税有问题吗?
答:可以的,厂家提供三证是完全可以出口的。当然外贸公司的营业范围最好包括劳防用品等内容。这样,出口退税都更安全了。
6.我想个人快递200个口罩到美国可以寄出吗?
答:个人行邮目前也是不禁止出口的。一般快递美国,可以考虑FEDEX、UPS、DHL、EMS、SF等快递公司。不过有人反映,DHL会要求寄件人提供美国的FDA认证,也有的DHL干脆拒收,也有小伙伴被FEDEX拒收过。那可以先尝试邮局邮寄试一下,或者在邮寄前,先电话咨询各个快递公司。但是,目前我们得到的消息是口罩没有美国FDA证,美国海关是会拒绝进境的。
7.我们生产熔喷布的,想问下熔喷布出口需要医疗器械证吗?
答:熔喷布并不属于医疗器械,因此不需要医疗器械证明。关于是否为医疗器械,可以前往国家食药监局官网查询。(网址:http://samr.cfda.gov.cn/WS01/CL1026/)
8.如何查询口罩是否合格?
答:登录“国家药品监督管理局”(www.nmpa.gov.cn)的官网,然后点击“医疗器械”-“国产器械”的栏目。根据页面指示,输入该款口罩的医疗器械注册证号或企业名称等,就可以知道与产品相关的企业生产信息,批准文号信息,即可知道是否合格。
9.请问如果口罩要出口伊朗的话,需要申请什么认证吗?
答:出口伊朗还是比较复杂的,需要在伊朗申请COI认证,中文为符合性核查,是伊朗进口强制发件要求的相关检查。目前伊朗N95口罩和普通三层口罩、呼吸器、手术服、核酸检测试剂盒、个人防护用品、防护面罩和防护服等物资告急。为鼓励进口,2月26日伊朗《经济在线》报道,伊朗市场口罩的进口关税从55%降到了5%。
国外进口有关要求
欧盟
必要资料及资质:
提单,装箱单,发票。
口罩要求:
在欧盟,口罩属于PPE个人防护用品,“危及健康的物质和混合物”。2019年起,欧盟新法规PPE Regulation (EU) 2016/425强制执行,所有出口欧盟的口罩必须在新法规的要求下获得CE认证证书。CE认证是欧盟实行的强制性产品安全认证制度,目的是为了保障欧盟国家人民的生命财产安全。
美国
必要资料及资质:
提单,装箱单,发票。美国进口的口罩,若需要销售,必须要拿到FDA认证才可以在美国本土市场进行销售活动。
对于自用和赠送的口罩,大家在出口的时候最好先问一下美国接收方面,是否也需要FDA认证,或者采购原本就通过FDA认证的口罩进行出口。
口罩要求:
根据HHS(美国卫生及公共服务部)法规,NIOSH(美国国家职业安全卫生研究所)将其认证的防颗粒物口罩分为9类。具体的认证则由NIOSH下属的NPPTL实验室操作。
在美国,按过滤网材质的最低过滤效率,可将口罩分为三种等级——N ,R ,P。
N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。
R口罩只适合过滤油性颗粒物及非油性颗粒物,但用于油性颗粒物时限制使用时间不得超过8小时。
P类口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。根据过滤效率的不同,又有90,95,100 的差别,分别指在标准规定的测试条件下最低过滤效率为90%,95%,99.97%。
N95不是特定的产品名称。只要符合N95标准,并且通过NIOSH审查的产品就可以称为“N95型口罩”。
澳大利亚
必要资料及资质:
提单,装箱单,发票。
口罩要求:
AS/NZS 1716:2012是澳大利亚和新西兰的呼吸保护装置标准,相关产品制造流程和测试必须符合本规范。该标准规定了防颗粒口罩制造过程中必须使用的程序和材料,以及确定的测试和性能结果,以确保其使用安全。
日本
必要资料及资质:
提单、装箱单、发票。
出口日本的PMDA注册医疗器械公司希望把产品投放到日本市场则必须要满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向PMDA注册制造商信息。
口罩要求:
包装上印有ウィルスカット99%的字样都是超过国内过滤效率95%(N95口罩)标准的医用口罩!
PFE:0.1um微粒子?颗?粒过?滤?效率
BFE:细菌过滤率
VFE:病毒过滤?率?ウィルスカット:病毒拦截
1.医用防护口罩:符合中国GB 19083—2010 强制性标准,过滤效率≥95%(使用非油性颗粒物测试)。
2.N95口罩:美国NIOSH认证,非油性颗粒物过滤效率≥95%。
3.KN95口罩:符合中国GB 2626 强制性标准,非油性颗粒物过滤效率≥95%。
韩国
必要资料及资质:
提单、装箱单、发票。
韩国进口商营业执照,韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association.提前备案进口资质(没有不行,网址:www.kpta.or.kr)。
企业自用又是受赠的情况,可以自行进口,不需要有相关资质。
口罩要求:
口罩还需要有详细的原产地标识,如果是中国制造务必有标签,含:Made in China,生产厂家信息,保质期,还要准备成分含量说明,制造工艺流程。除了以上这些文件,货物到了韩国以后还需要进行送样检验,送交样品到实验室,化验合格后方可进入韩国市场销售流通。(腾道)
