基于液质联用技术的环二核苷酸cGAMP定量检测方法的建立与评估
2020-04-16郭增林韩秋影毛劼王娜周涛陈媛
郭增林,韩秋影,毛劼,王娜,周涛,陈媛
国家生物医学分析中心,北京 100850
病毒感染是人类面临的重大健康威胁之一。近年来重大疫情的产生多与病毒感染相关,如SARS 病毒、寨卡病毒、诺如病毒等。目前,对大多数病毒的感染,仍缺乏有效治疗手段,难以应对病毒感染所导致的严重后果。因此,从病毒感染的共性机制入手,寻找有效的抗病毒策略,将可能为预防病毒感染、治疗相关疾病提供新的思路。
病毒感染细胞后,在胞内释放其核酸物质(DNA 或RNA)。正常生理条件下,机体可以快速识别并清除这些外来核酸物质。研究表明,环鸟苷酸-腺苷酸(cyclic GMP-AMP,cGAMP)合成酶(cGAMP synthase,cGAS)是细胞质内核酸物质DNA 的感受器。cGAS 与胞质中的DNA 结合后,催化腺嘌呤核苷三磷酸(ATP)和鸟嘌呤核苷三磷酸(GTP)合成环二核苷酸 cGAMP[1-2],cGAMP 作为第二信使结合接头蛋白质STING 后[3-4],磷酸化TBK1 和 IRF3[5-6],促进β干扰素(IFN-β)产生,并激活NF-κB 信号通路,从而发挥清除病毒感染、维持机体稳态的作用[7-8]。cGAMP 作为cGAS 的直接产物,其表达量可以指征cGAS 的激活情况。目前,仍缺乏行之有效的检测细胞中cGAMP 的手段,因此需要建立快速准确的定量检测方法。
液相色谱串联质谱联用技术近年来进展较大。该技术是高效液相色谱和质谱技术的结合,具有选择性强、灵敏度高、准确性好等特点[9-10],是目前公认最好的复杂样品分析技术之一,已广泛应用于生物医药、食品安全、环境科学、临床等众多领域[11-12],成为现代分析方法中必不可少的组成成分。
本研究基于液相色谱-质谱多反应监测技术(liquid chromatography-mass spectrometry/multiple reaction monitoring,LC-MS/MRM),建立了 cGAMP的定量分析方法,为进一步探讨cGAS 的功能调控机制提供有力的技术支撑。
1 材料与方法
1.1 材料
组织细胞淋巴瘤细胞U937 来自本实验室细胞库;RPMI1640 培养基(迈晨公司);optiMEM 培养基(Gibco 公司);鲱鱼精DNA(HT-DNA)、佛波醇12-十四酸酯13-乙酸酯(PMA)(Sigma 公司);逆转录试剂盒(TaKaRa 公司);IRF3、p-IRF3、βactin 单克隆抗体(Abcam 公司);转染试剂 Li⁃po2000(Invitrogen 公司);SYBR Green 荧光定量试剂盒(ABI 公司);TRIzol Reagent、乙腈(Thermo⁃Fisher 公司);Qtrap6500 三重四极杆质谱仪;Ther⁃mo Ultimate 3000 双三元液相色谱仪。
1.2 细胞培养
U937 细胞系在含10%胎牛血清的RPMI1640培养基中培养,恒温培养箱设定参数为37℃、5%CO2。根据细胞状态和密度,进行细胞传代或其他实验。
1.3 脂质体转染
取对数生长期细胞,设定对照组(仅转染试剂)和HT-DNA 刺激组(转染试剂和HT-DNA),按3×105/孔的密度接种于 24 孔板,加 PMA 后于恒温培养箱中培养36 h 使细胞分化。分化后,根据转染试剂使用说明书推荐的体系进行HT-DNA 转染,刺激6 h 后收样。
1.4 RNA提取及荧光实时定量PCR实验
TRIzol 法提取细胞总RNA,根据逆转录试剂盒说明书进行逆转录反应。将荧光实时定量PCR(qRT-PCR)反应体系在96 孔板中混匀,每个样本和待测目的基因设3 个复孔,800 r/min 离心5 min,于荧光实时定量PCR 仪中反应(反应条件:95℃预变性 5 min,95℃变性 15 s,60℃退火30 s,72℃延伸 1 min,共 40 个循环)。2-ΔΔCt表示目的基因在对照组和实验组中表达的倍比关系。引物信息见表1。
1.5 蛋白质提取及蛋白质免疫印迹实验
吸去24 孔板中的培养基,用PBS 缓冲液洗涤2 次,加入细胞裂解液后,4℃混旋 30 min,4℃、15 000 r/min 离心20 min,收集上清,加入上样缓冲液,沸水煮样后进行SDS-PAGE,采用湿转方式进行转印,室温封闭1 h,在4℃条件下用一抗(1∶1000)孵育过夜,次日从4℃条件下取出膜,TBST缓冲液洗膜3 次,每次5 min,室温孵育二抗(1∶5000)1 h,再 用 TBST 缓冲液 洗 膜 3 次 ,每 次 5 min,显影。β-actin 作为内参。

表1 定量PCR引物信息
1.6 液相色谱-质谱联用技术检测cGAMP含量
吸去24 孔板中的培养基,PBS 缓冲液洗涤2次,加入萃取液(甲醇∶乙腈∶水按体积比4∶4∶2配制),用细胞刮刀轻轻将黏附在孔板上的细胞刮下来,收集至1.5 mL 离心管中,做好标记,并于-20℃条件下静置 30 min,4℃、15 000 r/min 离心20 min,收集上清液,于真空干燥仪中干燥。用终浓度为10 mmol/L 的醋酸铵溶液稀释商品化的cGAMP,作为标准样品;用同样浓度的醋酸铵溶解干燥的样品,4℃、15 000 r/min 离心 10 min,收集上清,通过液质联用技术进行定量分析。
色谱仪为Thermo Ultimate 3000;色谱柱为EC 150/2.0 NUCLEODUR C18 Pyramid(3 μm);流动相A 相为0.2%甲酸-水溶液,B 相为乙腈;流速0.4 mL/min,柱温35℃,进样量5 μL。在该流动相条件下,每个样品在8 min 内分析完成。
质谱离子源为电喷雾离子源(ESI),检测方式为多反应监测(MRM),离子化方式为正离子扫描。离子源参数:气帘气20 psi,喷雾电压5500 V,雾化温度 550℃,雾化气 65 psi,辅助气 65 psi,去簇电压90 V,摄入电压7 V,定量离子对母离子/子离子为675/524,定性离子对母离子/子离子为675/506、675/136。
1.7 统计学分析
采用SPSS16.0 统计学软件进行统计分析,2组间数据的比较采用Studentt检验,当P<0.05 时认为差异有统计学意义。
2 结果
2.1 cGAMP定量标准曲线方程的建立
首先,我们对商品化的标准品进行定量检测,建立标准曲线方程。用终浓度为10 mmol/L的醋酸铵溶液稀释商品化的cGAMP 后上机检测。如图1 所示,横轴为cGAMP 保留时间,纵轴表示离子强度(counts per seconds,cps),标准品cGAMP 浓度分别为 1、5、10、25、50、100 ppb(part per billion),1 ppb=1 μg/L。图中 cGAMP 标准品滞留时间为4 min 且无明显杂峰干扰,表明该方法可以对1~100 ppb 的cGAMP 进行定量检测。根据标准品浓度、谱峰面积等数据,计算得到标准曲线y=2977.9x-1050.9,相关系数为1(图2)。
2.2 细胞中cGAMP的定量检测
cGAMP 是细胞应对外源DNA 入侵时由cGAS合成的小分子。正常生理条件下,细胞内不会产生cGAMP。因此,检测活细胞产生的cGAMP,首先需要通过转染外源DNA(HT-DNA)激活cGAS;再通过甲醇-乙腈萃取法,提取细胞中的cGAMP分子;将样品干燥后,用终浓度为10 mmol/L 的醋酸铵溶液溶解样品,上机检测。结果显示,与对照组相比,HT-DNA 处理组出现cGAMP 谱峰(图3),根据标准曲线定量计算,得到cGAMP 的含量为400 pg/3×105细胞,即0.0013 pg/细胞(图4)。
2.3 生物学效应评估
为进一步评价该化学检测方法的可靠性,我们对细胞中cGAMP 产生后的常规生物学效应指标进行了检测。干扰素调节因子3(IRF3)的磷酸化和IFN-β 的表达是cGAMP 产生后的下游事件。通过脂质体转染,将HT-DNA 转入U937 细胞,分别采用Western 印迹和实时荧光定量PCR(qRT-PCR)检测IRF3 的磷酸化和IFN-β1 mRNA的表达。结果显示,与转染试剂对照组相比,HTDNA 诱导了 IRF3 的大量磷酸化(p-IRF3);同时HT-DNA 刺激组 IFN-β1 的 mRNA 表达水平明显升高(P<0.0001)(图5),这表明在 HT-DNA 刺激条件下,细胞内合成了大量cGAMP 分子。
以上结果表明,上述化学检测方法可以有效地对细胞内合成的cGAMP 进行快速、准确定量,并且通过检测下游生物学效应,进一步验证了该方法的可靠性。
3 讨论
液相色谱质谱联用技术在混合物分析上具有较高的灵敏度和选择性及广泛的适用性,并且应用此技术检测细胞内cGAMP 的含量时,前期样品的提取、纯化和浓缩等过程较为简便,便于掌握实验操作。同时我们在建立该体系方法时,不断优化各项条件参数[12],比如采取合适的样品处理方法,优化实验参数得到最佳色谱分析条件和质谱分析条件,尽可能消除基质效应对样品定量测定的影响;选择多反应检测模式,提高信噪比,即使复杂的样品仍可达到很高的灵敏度。由此,不仅得到了可靠性高的结果,而且检测时间也较短,每个样品的分析时间可以控制在8 min 以内,快速简便。在建立检测方法的同时,我们也对细胞中cGAMP 产生后的常规生物学效应指标进行了检测,如IRF3 的磷酸化、β干扰素的产生等,利用生物学效应与化学检测方法相互验证,证明了该方法的可靠性。cGAMP 的表达量可以特异性指征cGAS 的活性,因此基于液质联用技术对cGAMP 进行定量检测方法的建立,为后续深入研究cGAS 活性调控机制提供了重要手段。
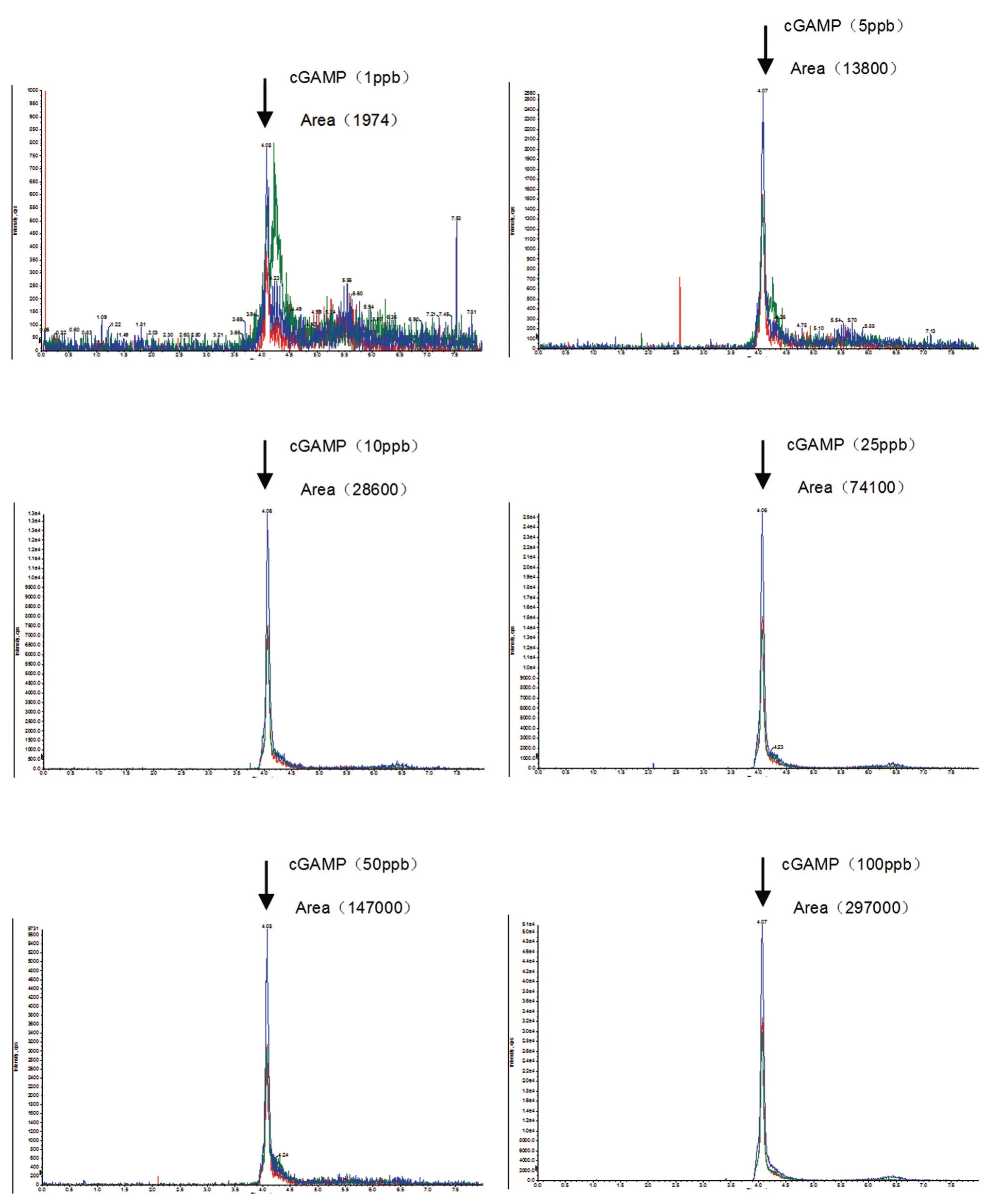
图1 cGAMP 标准品质谱峰图
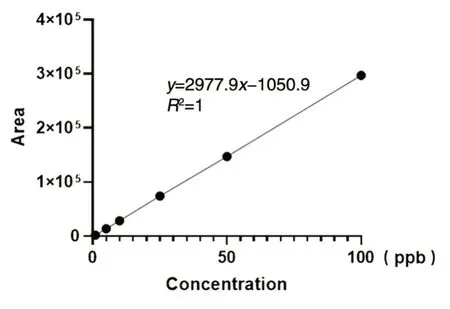
图2 cGAMP 定量标准曲线
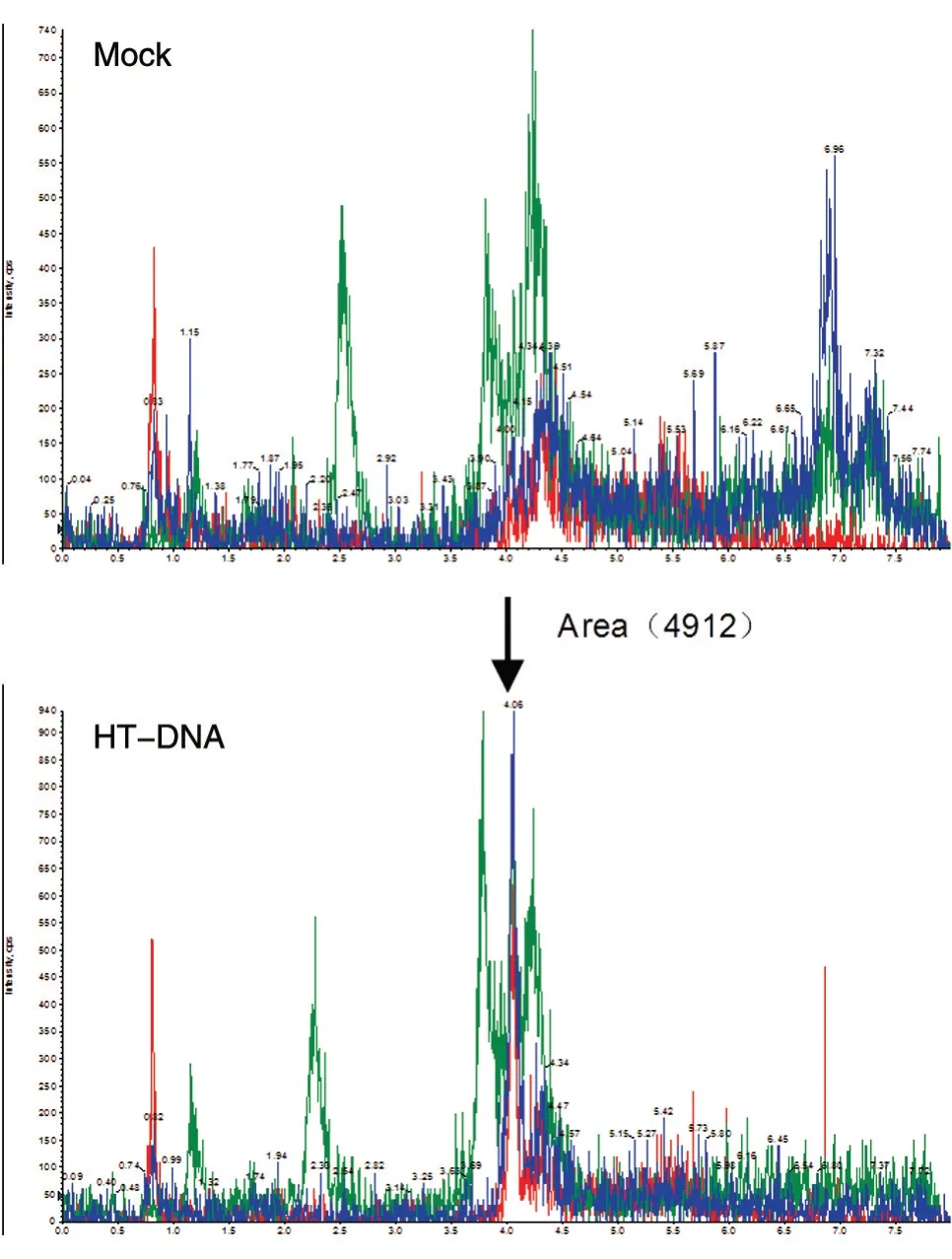
图3 cGAMP 质谱鉴定峰图
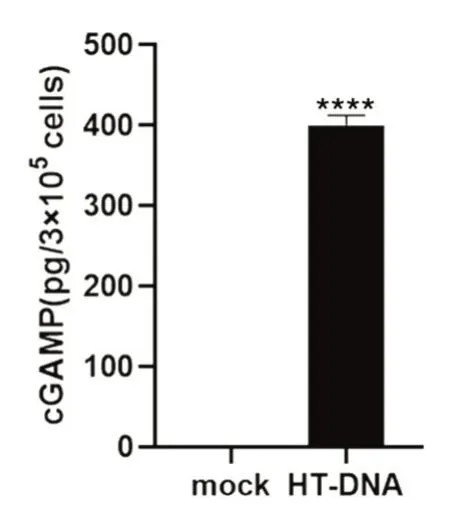
图4 cGAMP 定量计算(****P<0.0001)
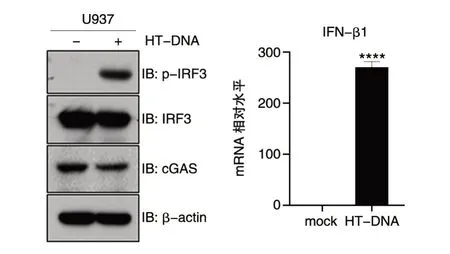
图5 IRF3 磷酸化与IFN-β1 mRNA 的表达(****P<0.0001)
目前,针对cGAMP 的作用和功能的研究还非常有限,尚有许多问题亟待解决。比如cGAMP 除参与天然免疫信号通路外是否在其他通路发挥作用?细菌中的第二信使c-di-GMP 和c-di-AMP是否在哺乳动物细胞中具有相似的作用?该技术方法可实现更加快速、灵敏和可靠的cGAMP 检测,为科学研究和实际应用提供更多依据。
