不同光源条件下多肉植物生长发育的研究
2020-04-16丁晓浩金继良
丁晓浩 金继良 蔡 健 曹 慧
(阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037)
多肉植物又称多浆植物、肉质植物,园艺上也称之为多肉花卉[1]。多肉植物因种类繁多、玲珑可爱、容易成活,是目前比较受欢迎的盆栽植物。当前,已知的多肉植物品种数目约为1万种以上,多肉爱好者也在逐年增多[2]。本文通过研究不同光源对多肉生长的影响,即控制光源和光照时间等,培育出颜色鲜艳、植株矮小耐看的几种多肉植物,进而分析出不同光源对多种多肉植物的形态和色彩的影响,并将这种培养模式推广到大量的多肉植物的养护中,从而得到更具市场价值、色彩丰富的多肉植物。
1 研究内容
本文以蓝苹果(Echeveria 'Blue Apple')、冬美人(Pachyphytum pachyphytoides)、果冻乙女心(Sedum pachyphyllum)、卡罗拉(Echeveria Colorata)、红稚莲(Echeveria macdougallii)和火焰蒂亚(Sedeveria 'Letizia')6种长势良好的多肉植物为材料,设置两个实验组,一个对照组,每组10个样本。实验组分别采用蓝光和红光照射,对照组不补光。每天照射固定时间,连续照光一个月后,测定6种多肉在不同光源下的的各项生理指标。从实验数据中分析出不同光源对不同多肉植物的呈色、花序及长势的影响。
2 材料与方法
2.1 实验材料及器材
2.1.1 实验材料
多肉植物材料采购于阜阳市花博园,选取生长形态大小相同的6种多肉各30盆。生长状态优良,株龄为2年,经温室大棚栽培控型后形成形态良好的成株。
2.1.2 实验器材
LED红光、蓝光补光灯,分光光度计、离心机、电子天平、恒温箱、烧杯、试管、离心管、比色皿、试管架、剪刀、研钵、漏斗、移液管、游标卡尺。
2.1.3 实验试剂
丙酮、蒸馏水、石英砂、CaCO3粉末、0.1mol/L HCl。
2.2 实验方法
2.2.1 栽培环境和光照处理
将6种多肉植物分成3组,每个品种每组10株,放置于黑色塑料托盘上,共180盆,分别置于温室大棚的三排培养架上的中心位置。大棚具有挡光、降温、保湿等功能,白天温度平均为25℃,土温为18.6℃,湿度为38%。采用LED红蓝组合灯对实验组多肉进行光照处理:对第一排进行蓝光照射处理,第二排进行红光照射处理,第三排利用大棚散射光即无补光设备为对照。设置LED红蓝组合灯的光补偿点为50umol·m-2·s-1,下午6点开,第二天早上8点关,实验组多肉植物每日的光照时间为14h,连续培养30日 。平均每5天浇水一次,浇水时从花盆边缘浇入,以土壤干透浇透为准则,不能使其积水。
2.2.2 多肉植物形态指标的测定
进行不同光源照射实验组的第一天,分别选取蓝光实验组、红光实验组和对照组的6种长势良好的多肉植物各5个样本。用皮尺和直尺测量90个样本的冠幅,即多肉叶子展开后的最大直径,记录在观察本上;再测量样本连盆高度及最大叶长和叶宽,记录数据;观察多肉叶片颜色,记录其颜色的变化,每隔10日记录一次。
2.2.3 叶绿素a、叶绿素b含量的测定
在不同光源条件下光照30日后,分别从三组试验材料中,挑选出6种多肉植物各3株,共54个样本。从样本中采集健壮、无病虫害且饱满成熟的叶片,将多肉叶片表面污物清洗干净,用滤纸吸干水分。用干净的剪刀将样本的叶片剪成0.3mm左右大小的碎片,用电子天平称量0.5g放入研钵中,用移液器加5ml纯丙酮、少许的CaCO3和石英砂,将多肉研磨至匀浆,加80%丙酮5ml,混匀后转入离心管中,再加80%丙酮2ml洗涤研钵,一并转移到离心管中,4 000r/min 离心10min,取上清弃去沉淀。上清液用80%丙酮定容至20ml,即得到色素提取液。
测定吸光值:取上述色素提取液1ml,加入80%丙酮4ml,混匀后转入到比色皿中,再以80%丙酮作为对照调零,测定其在645nm、663nm处的吸光值[3]。
按照以下公式计算叶绿素a、叶绿素b和总叶绿素的浓度:
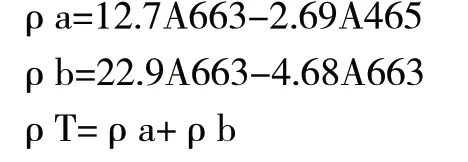
式中: ρa为叶绿素a的质量浓度,单位是mg/L;
ρb为叶绿素b的质量浓度,单位是mg/L;
ρT为总叶绿素质量浓度,单位是mg/L;
A663为在波长663(即叶绿素a的最大吸收峰长)时,混合液的OD值;
A645为在波长645(即叶绿素b的最大吸收峰长)时,混合液的OD值。
再根据稀释倍数分别计算每克鲜重多肉叶片中色素的含量。
2.2.4 花青素生理指数的测定
选取6种多肉在不同光源处理下的样本各3株,即在蓝光组分别选取6种多肉,每种3个样本,红光组和对照组同理,共48个样本,采摘健康饱满的叶片,称量1g,切成2mm左右的碎片,倒入试管中。量取质量分数36%—38%的盐酸4.1ml配制成浓度为0.1mol/L的 HCL溶液500ml,向每个试管中加入现配的0.1mol/L HCL溶液5ml,浸没多肉碎片。试管口用封口膜封住,防止HCL挥发。将试管放入32℃恒温箱中,浸泡5个小时。用滤纸过滤后得到色素提取液,将提取液倒入比色皿中,以0.1mol/LHCL作为调零管,测定其在530nm下的吸光值。求取平行实验的平均值。
将A530的值记为0.1个单位花青素浓度,从而获得花青素的相对含量。将测得的A530乘以10,用来表示该实验中多肉花青素的相对浓度单位。
3 结果与分析
3.1 不同光源对多肉形态指标的影响
3.1.1 对多肉呈色的影响
6种多肉植物在补光灯照射30天后,不同光源对多肉植物着色度的影响,颜色对比如表1所示。

表1 不同光源处理对多肉植物颜色状态的影响

表1 (续)
从整体上来看,蓝光照射下的多肉颜色最鲜艳,红光照射下的多肉颜色次之,自然光条件下的多肉颜色最黯淡,可以推测蓝光、红光对景天科多肉均有增色效果,蓝光处理比红光处理效果好。其中红稚莲、卡罗拉、乙女心三个品种的多肉蓝光组颜色较对照组差距最大,可以推测这三个品种对蓝光处理更敏感,蓝苹果、冬美人这两个品种蓝光组和红光组较对照组均有增色,但两者差距并不明显,可以推测这两个品种对红光、蓝光都有敏感,且敏感度相差不大。蒂亚这个品种虽然蓝光组较红光组植株整体颜色更亮,但红光组蒂亚边缘呈深红色,实验结果还需进一步进行实验。综上红光、蓝光对多肉植物显色度均有提升,蓝光处理较红光处理有效。
3.1.2 对多肉花序的影响
植物的光周期由红光—远红光感受器和蓝光—近紫外光感受器控制,受体接收不同波长的光,从而使植物开花[4]。由表2可知,在不同光源下,一些多肉植物的花序数目有明显差异。蓝苹果在红光下的花序数目较多,蓝光次之,在散射光下最少;果冻乙女心和火焰蒂亚在蓝光下开花数目最多,红光次之,散射光下最少;冬美人、卡罗拉和红稚莲基本未开花。因此,可判断蓝光和红光对蓝苹果、果冻乙女心和火焰蒂亚三种多肉植物的花序数目有不同影响。

表2 不同光源下的多肉花序数数目
3.1.3 对多肉生长发育的影响
记录6种多肉植物的冠幅、连盆高度、最长叶长和最长叶宽,求取平均数,如表3所示。
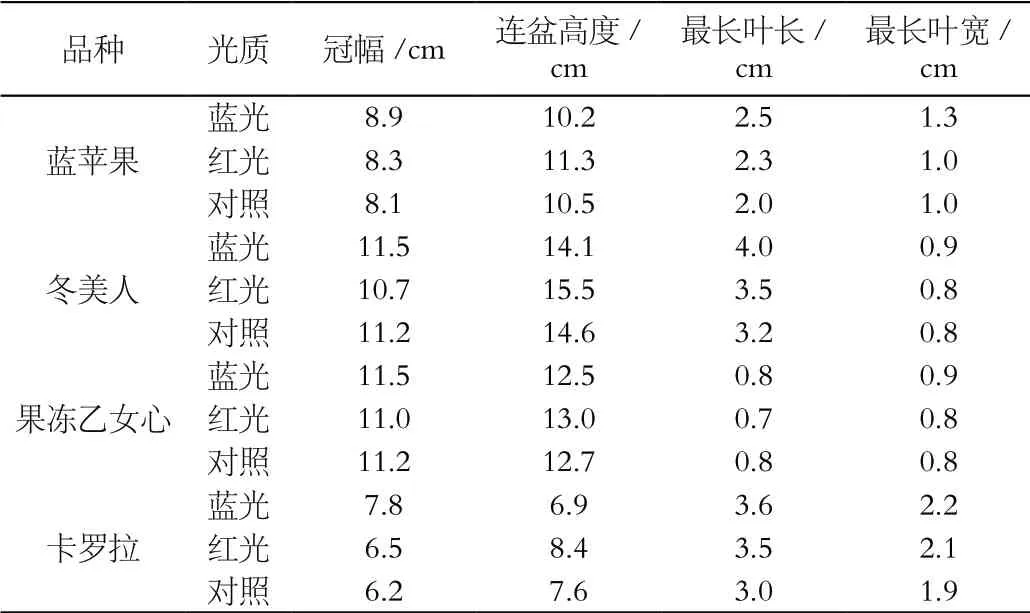
表3 不同光源处理对多肉形态指标的影响
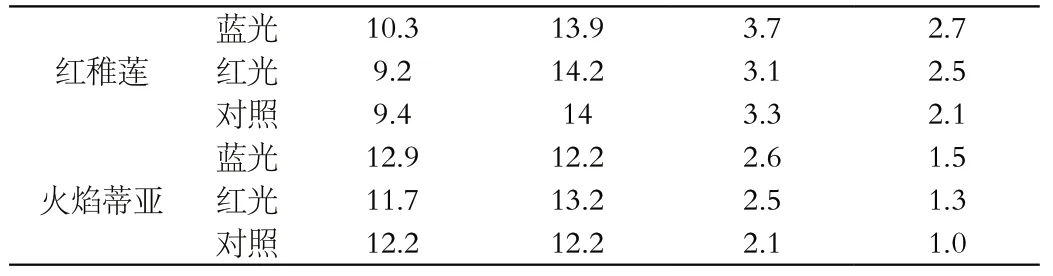
表3 (续)
不同光质对多肉的处理中,蓝光和红光对以上多肉植物生长具有一定的调控作用[5]。蓝光处理的多肉冠幅最大,说明蓝光能促进多肉的冠幅生长,但蓝光处理的多肉连盆高度最小,红光处理的连盆高度最高,说明单一的红光引起这几种多肉徒长,茎变得细长,从而植株高度增加。蓝光处理的最长叶长和最长叶宽也普遍比红光组和对照组要大,说明蓝光对多肉叶片的生长有促进作用[6]。
3.2 不同光源处理对多肉生理指标的影响
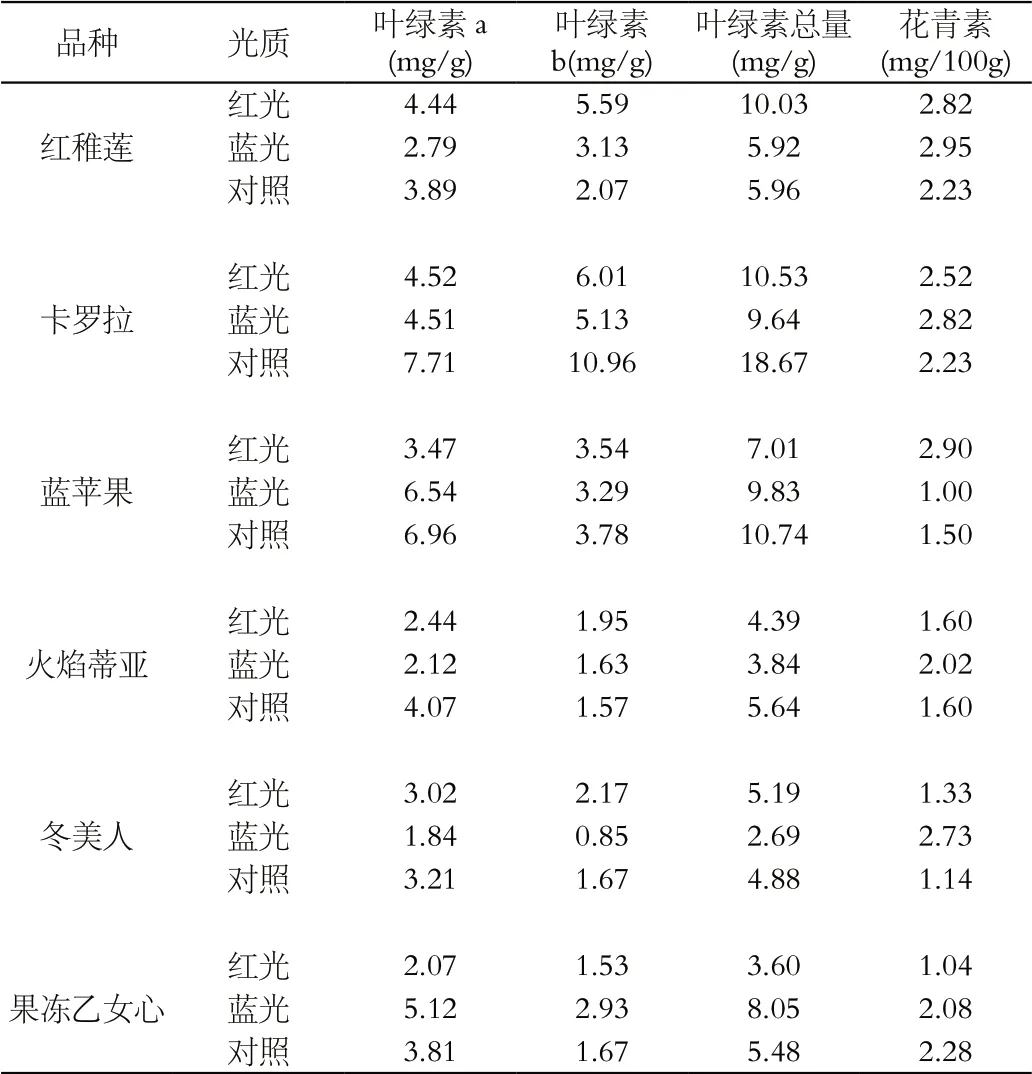
表4 不同光源处理对6种多肉色素含量的影响
由表4可以看出,蓝光处理条件下多肉的叶绿素a、叶绿素b及叶绿素总含量最低,实验对象叶绿素的总含量均呈蓝光〈红光〈自然光的趋势;同时,蓝光处理条件下花青素含量最高,花青素含量呈蓝光〉红光〉自然光的趋势。乙女心和蓝苹果这两个品种不符合这种趋势,可能是因为品种不同而对光敏感程度较低,还需进一步的实验探究。
4 结论
6个品种的多肉植物经过30天的光照处理后,实验组的颜色和状态都优于对照组,补光对于多肉植物的颜色和状态的有明显促进作用。
蓝光组大部分多肉品种的叶绿素含量低于红光和对照组,同时花青素含量高于红光和对照组,颜色丰富且较鲜艳,植株茎干粗壮、株形紧凑、叶片饱满。其中蓝苹果、冬美人这两个品种蓝光组和红光组较对照组虽均有增色,但红光组与蓝光组差距并不明显,可以推测这两个品种对蓝光都有反应,但敏感度可能较低,处理效果不够明显。
红光组大部分多肉的叶绿素含量也是低于对照组的,但高于蓝光组,颜色也是没有蓝光组鲜艳,同时比对照组颜色丰富。红光组多肉株高(含盆)大于蓝光组和对照组,植株茎干较细、株形较为分散、叶片颜色没有蓝光组丰富,整体观赏效果不如蓝光组多肉。实验的6个品种全部都是红光组的株高最大,说明红光对这6个品种的多肉都有影响,能够促进茎干的伸长。
