花生幼苗对酸胁迫的生理响应及品种间差异
2020-04-16王春晓王丽丽于天一郑永美吴正锋王才斌
路 亚,王春晓,王丽丽,于天一,郑永美,吴正锋,李 林,王才斌
(1.湖南农业大学,湖南 长沙 410128;2.山东省花生研究所,山东 青岛 266100;3.山东省烟台市农业科学院,山东 烟台 265500;4.山东省威海市文登区农业技术推广中心,山东 威海 264400;5.国家花生工程技术研究中心,湖南省花生工程技术研究中心,湖南 长沙 410128)
酸化土壤是我国重要的农业土壤之一,约占全国耕地面积的22.7%[1]。花生是我国重要经济及油料作物之一,在国民经济中占有重要地位。目前,我国有相当一部分面积花生分布在酸性或微酸性土壤上[2-3],酸化土壤结构较差,氮磷有效性较低[4-5],盐基离子大量淋失[6-7],交换性酸及重金属含量高[8-10],严重抑制了花生植株生长发育和养分吸收,导致减产[11-13]。缓解土壤酸胁迫及提高花生产量至少有两条措施。一是农艺措施,即施用钙肥及调理剂等[14-18]。二是生物措施,即种植耐酸花生品种。以往报道主要集中在农艺措施,而生物措施的报道较少。
同一作物不同品种(系)间耐酸性差异较大[19-21]。当土壤由pH值6.13下降至3.5时,水稻产量显著降低,其中不同品种早稻产量降低22.67%~33.83%,晚稻产量降低15.60%~23.36%[22]。李智燕等[23]研究表明,酸胁迫下,耐酸型苜蓿品种根瘤菌能够保持较高的超氧化物歧化酶活性来减轻伤害,而酸敏感型品种根瘤菌保护酶活性均大幅降低,活性氧清除能力下降。不同玉米品种开花期耐酸指数(酸性土上植株干质量/对照土上植株干质量)最高相差0.48个单位,酸胁迫下耐酸型品种的根系更为发达,对氮、磷、钾养分的吸收能力更强[24]。上述研究为揭示作物耐酸机制及耐酸品种筛选发挥了重要作用,但目前缺少花生耐土壤酸化方面的研究。因此,本研究开展酸胁迫对不同花生品种幼苗根系形态、叶片光合特性及干物质累积特性的影响,以期为耐酸花生品种选育及酸化土壤花生高产栽培提供依据。
1 材料和方法
1.1 试验设计
盆栽试验在山东省花生研究所进行,供试土壤为棕壤,取自花生所莱西试验站大田耕层(0~20 cm),pH值6.0。试验用塑料盆的上直径为20 cm、下直径16 cm,高15 cm,盆底打一直径2 cm的孔,防积水涝害,装土量为2 kg/盆。采用两因素试验设计,因素一为2个不同土壤pH值水平,分别为pH值3.5(酸胁迫)和pH值6(对照),通过向原始土中加入50 mL/L硫酸溶液调节土壤pH值至3.5,加酸量为110 mL/盆。因素二为不同花生品种,供试品种包括山东、河南、河北及广东等省份近年来审定或育成的15个品种,分别为白沙1016、花育28、花育33、花育36、花育39、冀花6号、冀花8号、山花10、山花8号、山花9号、汕油523、禹花1号、豫花14、豫花9719及仲恺花10。共30个处理,重复12次。
选取饱满且大小一致的种子经0.3%高锰酸钾消毒后催芽、播种,每盆播3粒种子,三叶期间苗1棵,保留2棵长势一致的花生幼苗。定期浇水,下雨天用防雨棚保护,使盆栽试验免受雨水影响,整个试验过程适时除草及防治病虫害。待50%的植株第一朵开放时收获(播种后35 d),并进行相关指标测定。
1.2 测定项目及方法
在花生收获期,选取有代表性的3盆花生植株,于晴朗无风的上午9:00-11:00,测定功能叶(倒二叶)光合速率及SPAD值。其中使用便携式光合测定仪(CIRAS-2,PPSystems,英国)测定净光合速率,测定时使用红蓝光源叶室,光强1 200 μmol/(m2·s),大气温度26 ℃,CO2浓度为400 μmol/mol。用叶绿素仪(SPAD502,KONICA,日本)测定SPAD值。
同时期另取有代表性的3盆植株,将盆中根系和土全部取出,并捡拾散落根系,然后用流水缓缓冲洗干净,其下方放置一个孔径0.15 mm的筛子以防止脱落的根系被水冲走。用吸水纸吸干根系表面水分,用Epson 7500双面光源扫描仪(爱普生(中国)有限公司)扫描根系,扫描后保存图像;再用WinRHIZO根系分析系统(Regent 公司,加拿大)分析图像,并计算花生直径0~1 mm,1~2 mm及>2 mm根长、根体积及根表面积。
同时期另取有代表性的3盆植株。将茎、叶及根分开,用台式叶面积仪(Li-3100C,LI-COR,美国)测定叶面积,将不同器官装入牛皮纸袋中,105 ℃杀青,80 ℃烘干至恒质量后称质量。
1.3 数据处理
用Microsoft Excel 2007软件整理数据及作图,用SPSS 13.0统计软件进行方差分析(LSD)。
2 结果与分析
2.1 酸胁迫对根系形态特性的影响
2.1.1 根长 酸胁迫降低了所有品种总根长,胁迫处理平均较对照降低34.28%。不同直径范围根系,直径0~1 mm根长的降低幅度大于1~2 mm和>2 mm直径根长,降幅分别为35.38%,7.79%,20.20%,说明酸胁迫对细根根长影响最大。酸胁迫下,冀花8号、汕油523和仲恺花10这3个品种的总根长较高,显著高于其他品种,而花育33的总根长则显著低于其他品种。与对照相比,酸胁迫下花育39和花育28 2个品种总根长降幅较大,分别降低58.65%和60.46%,山花8号和山花9号降幅较小,比对照分别降低10.33%和12.92%(表1)。

表1 酸胁迫对花生幼苗根长的影响
注: 同列不同小写字母表示不同品种间差异达显著水平(P<0. 05)。AS.酸胁迫;CK.对照。BS1016.白沙1016;HY28.花育28;HY33.花育33;HY36.花育36;HY39.花育39;JH6.冀花6号;JH8.冀花8号;SH10.山花10;SH8.山花8号;SH9.山花9号;SY523.汕油523;YH1.禹花1号;YH14.豫花14;YH9719.豫花9719;ZKH10.仲恺花10。表2-5,图1同。
Note: Different small letters in the same line mean significant difference among different varieties(lines)at 0.05 level. AS. Acid stress; CK.Control.BS1016.Baisha 1016;HY28.Huayu 28;HY33.Huayu 33;HY36.Huayu 36;HY39.Huayu 39;JH6.Jihua 6;JH8.Jihua 8;SH10.Shanhua 10;SH8.Shanhua 8;SH9.Shanhua 9;SY523.Shanyou 523;YH1.Yuhua 1;YH14.Yuhua 14;YH9719.Yuhua 9719;ZKH10.Zhongkaihua 10.The same as Tab.2-5,Fig.1.
2.1.2 根体积 不同花生品种根体积对酸胁迫的响应存在较大差异。酸胁迫下,山花9号的总根体积最高,显著高于除汕油523和冀花8号外的其他品种;白沙1016、花育28、花育33和冀花6号的总根体积则显著低于其他品种。花育28、花育33、花育36、花育39、山花10、豫花14和仲恺花10等7个品种胁迫处理总根体积低于对照,其中花育33受酸胁迫的影响最大,总根体积较对照降低38.62%;剩余品种中除豫花9719外的7个品种根体积高于对照,其中山花8号、汕油523及禹花1号提高幅度较大,较对照分别增加27.50%,28.23%和31.33%。但胁迫处理各品种总根体积平均值与对照差异较小(表2)。
2.1.3 根表面积 酸胁迫降低了多数品种根表面积,胁迫处理总根表面积平均较对照降低15.17%。不同直径范围根系,直径0~1 mm和1~2 mm根表面积降低幅度大于>2 mm直径根表面积,降幅分别为15.73%,16.14%,9.44%,表明酸胁迫对细根及中等粗度根表面积影响更大。酸胁迫下,冀花8号和汕油523的总根表面积较高,显著高于除山花9号外的其他品种,而花育33的总根表面积显著低于其他品种。酸胁迫降低了白沙1016、花育28、花育33、花育36、花育39、冀花8号、山花10、豫花14、豫花9717和仲恺花10等10个品种的总根表面积,其中花育28、花育33和花育39降幅较大,较对照分别降低45.66%,40.19%和39.92%。酸胁迫提高了山花9号等其他5个品种的根表面积,其中山花9号增幅最大,较对照增加41.36%(表3)。
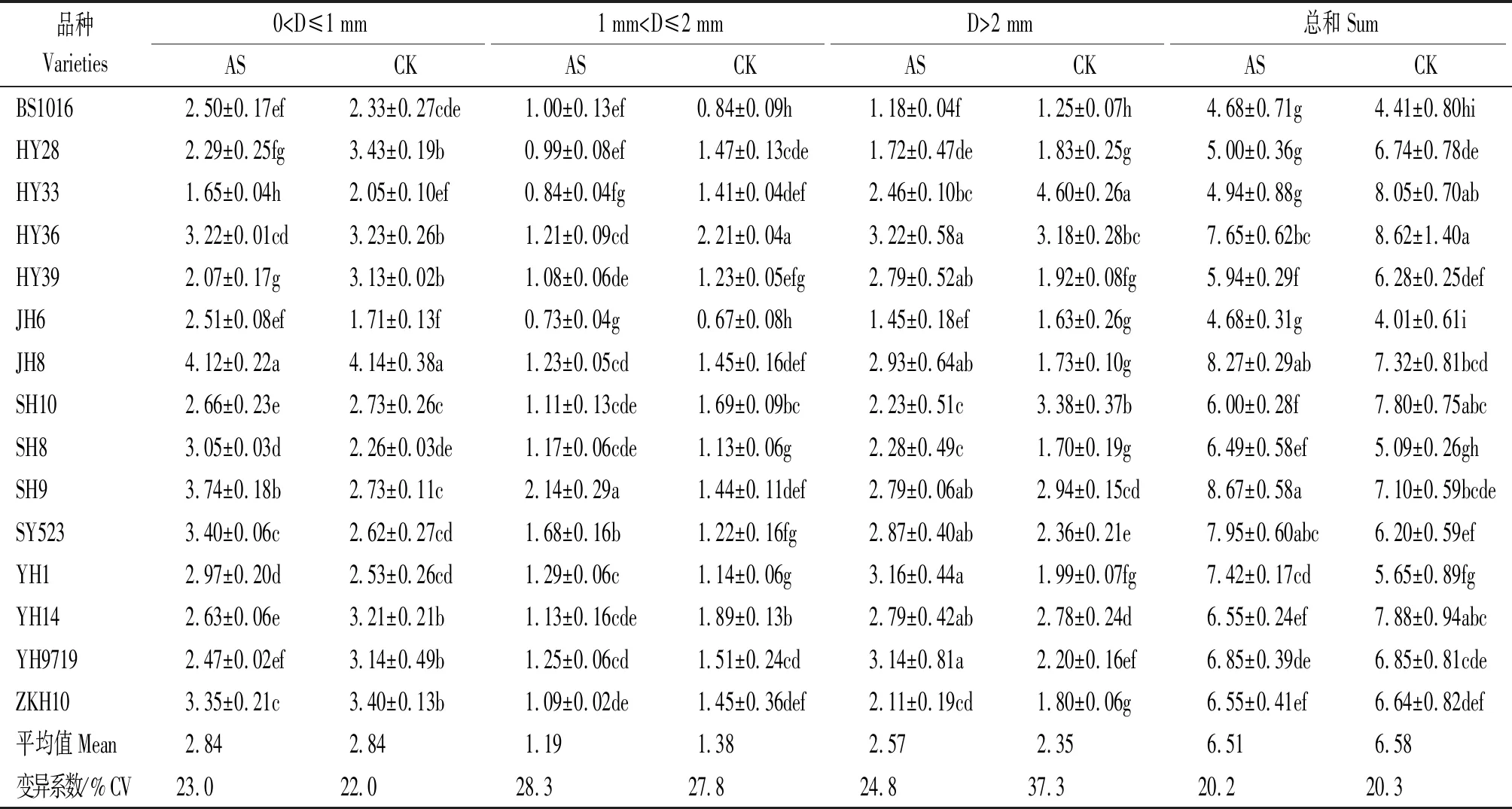
表2 酸胁迫对花生幼苗根体积的影响
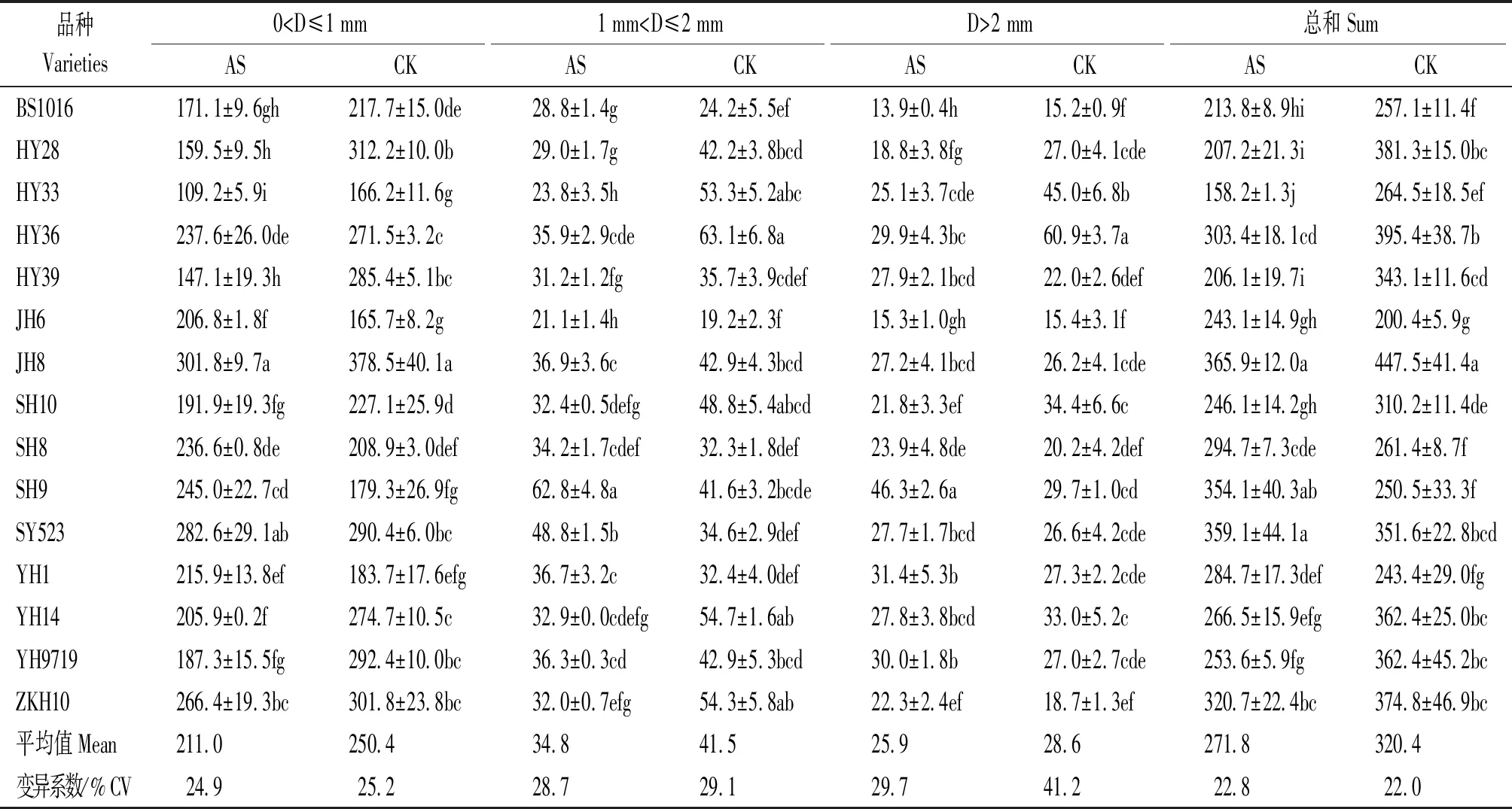
表3 酸胁迫对花生幼苗根表面积的影响
2.2 对花生叶片光合特性的影响
酸胁迫降低了所有品种单株叶面积,胁迫处理平均较对照降低45.92%。酸胁迫下,豫花9719的叶面积显著高于除花育36外的其他品种,而花育33的叶面积最低,显著低于除花育39外的其他品种。与对照相比,酸胁迫下花育28和花育33叶面积降幅较大,分别为60.03%和70.20%;仲恺花10降幅最小,为26.39%。同时,酸胁迫增加了单株叶面积的变异幅度,较对照增加了8.3百分点。各品种叶片净光合速率和SPAD对酸胁迫的响应有所差异。酸胁迫降低了白沙1016、花育28、花育36、花育39、冀花8号、山花8号、山花9号、禹花1号和仲恺花10等9个品种的净光合速率,各品种最大降幅为13.08%,提高了冀花6号等其他6个品种的净光合速率,最大增幅为14.18%。花育28号、山花10、禹花1号、豫花14和仲恺花10等5个品种酸胁迫处理的SPAD值低于对照,最大降幅为6.49%,其余10个品种酸胁迫处理的SPAD值低高于对照,最大增幅为17.65%。但胁迫处理各品种净光合速率及SPAD平均值与对照差异均较小。综上,酸胁迫降低了单株叶面积,增加了叶面积的变异幅度,但对叶片叶绿素含量和净光合速率影响较小(表4)。
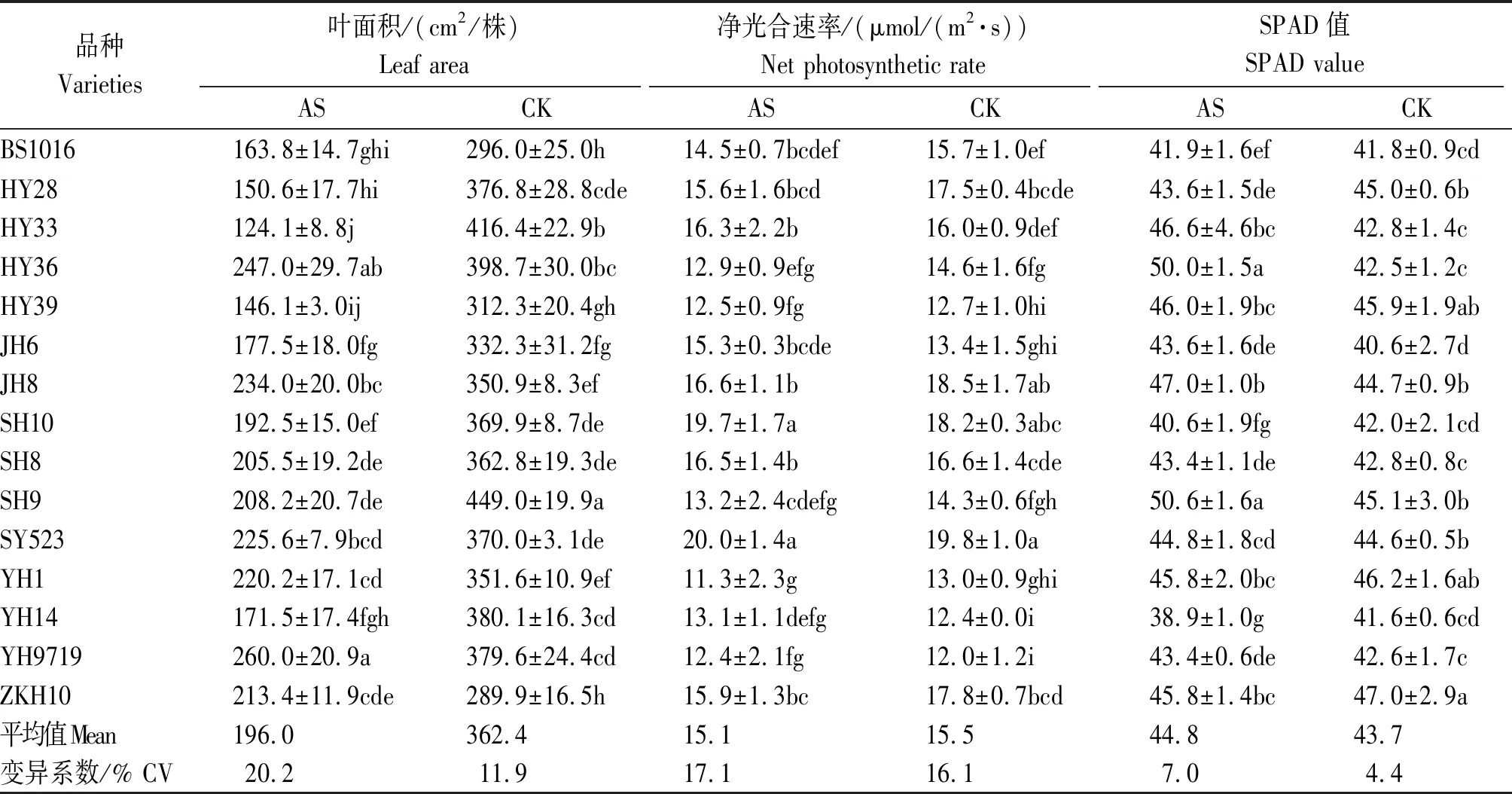
表4 酸胁迫对花生幼苗叶片光合速率的影响
2.3 对花生干物质积累的影响
酸胁迫下花生不同器官干物质质量均有所降低。酸胁迫处理叶、茎和根干质量较对照分别降低37.43%,28.74%和20.75%。酸胁迫导致品种间变异幅度增大,酸胁迫下叶、茎及根变异系数较对照分别增加7.10,13.02和11.30百分点。酸胁迫下,花育36的整株干物质质量显著高于其他品种,而花育28则显著低于其他品种。与对照相比,花育28和花育33 2个品种整株干物质质量降幅较大,较对照分别降低64.66%和53.46%;而冀花8号和仲恺花10降幅较小,分别较对照降低9.33%和10.80%(表5)。
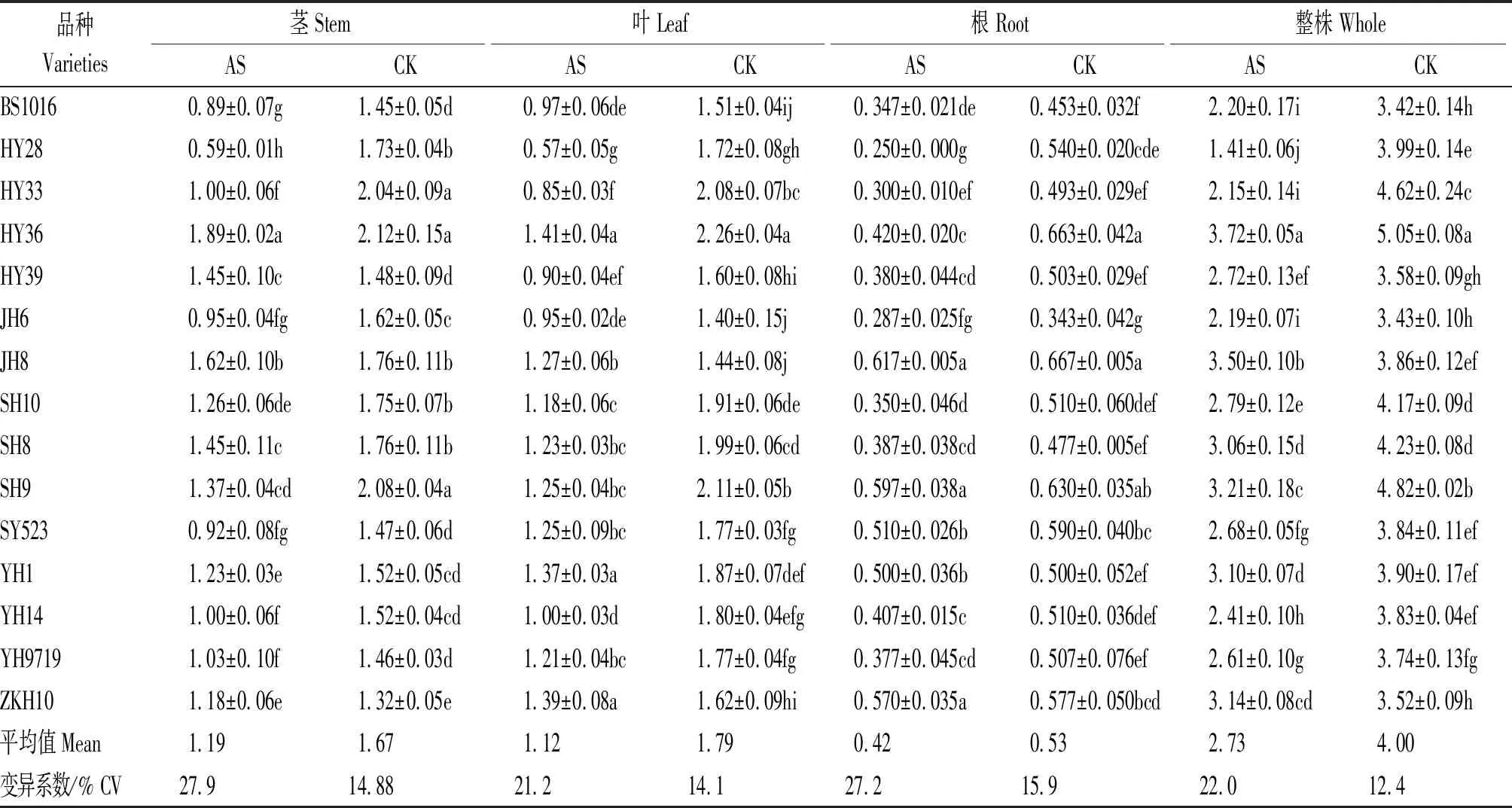
表5 酸胁迫对花生幼苗干物质质量的影响
2.4 不同花生品种耐酸系数
耐酸系数(酸胁迫下整株干物质质量/对照条件下整株干物质质量)是反映品种对酸胁迫耐受程度的一个重要指标。不同品种耐酸系数差异较大,变幅为0.353~0.908,耐酸系数最高相差0.555,耐酸系数最高相差0.555。其中冀花8号和仲恺花10 2个品种耐酸系数分别为0.908和0.891,显著高于其他品种,为耐酸型;花育28和花育33 2个品种耐酸系数较低,分别为0.353和0.465,二者差异显著,且均显著低于其他品种,两者均属于酸敏感型,禹花1号等其他11个品种耐酸系数为0.628~0.797,属于中间型(图1)。
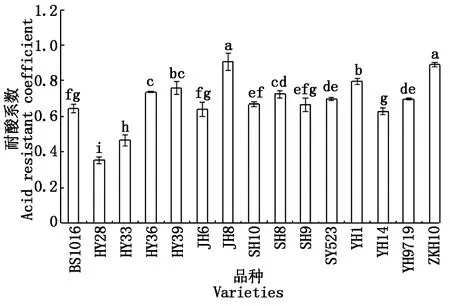
不同小写字表示处理间0.05 水平上差异显著。
3 讨论与结论
酸胁迫对作物的毒害作用主要体现在根系上。刘鹏等[25]研究认为,酸胁迫下大豆总根长及总根体积显著降低,根系直径显著增加。鲍学敏等[26]研究表明,铝胁迫主要降低了不同水稻品种根长、根表面积对根体积及根干质量的影响较小。而本研究表明,酸胁迫主要降低了不同品种花生总根长及总根表面积,其中对直径0~1 mm根长影响最大,对根体积影响相对较小。可能是因为根系变短、根表面积减少与根系变粗相互抵消,导致根体积变化较小,这与鲍学敏等[26]的研究结果类似,表明酸胁迫主要抑制了花生细根生长,增加了根系直径,减少了花生幼苗根系与土壤直接接触面积,影响根系吸收和传导水分、养分。
作物产量主要来源于光合产物,而光合产物的多少取决于光合面积、光合速率和光合时间。王一鸣等[27]研究表明,景天三七的叶片净光合速率及叶绿素含量随土壤pH值降低显著降低。童贯和等[28]在小麦上也得到了类似的结论。而本研究认为酸胁迫降低了所有品种花生单株叶面积,而对叶绿素含量和净光合速率影响不大,说明酸胁迫主要通过减少植株光合同化面积来抑制花生光合作用,这与供试作物及土壤酸化程度等因素有关,具体原因还有待进一步分析。
同一作物不同品种对酸胁迫的响应有所差异。章爱群等[24]研究表明,与对照相比,酸胁迫下不同玉米品种干物质质量降低幅度为2.00%~50.00%。在水稻上的研究表明,酸胁迫下不同早稻品种产量较对照降低22.67%~33.83%和晚稻品种降低15.60%~23.36%[22]。本研究表明,酸胁迫下不同花生品种整株干物质质量下降幅度为9.33%~64.66%,品种间变异幅度高于前人研究结果[22,24],可能与品种数量及试验条件等因素有关。
耐酸系数反映了作物对酸胁迫的响应程度,是品种耐酸性鉴定的可靠指标。以往研究中多以花生荚果产量相对值作为耐酸系数,而本研究未涉及荚果产量,因此,以整株干质量的相对值作为耐酸系数评价花生幼苗耐酸性。本研究中耐酸品种与酸敏感型品种耐酸系数最高相差0.555。表明通过筛选、种植具有耐酸潜力的花生品种,可作为酸化土壤上花生增产增效的有效途径。
酸胁迫降低了多数品种总根长及根表面积,主要是因为抑制了细根(直径0~1 mm)生长。酸胁迫导致不同品种植株叶面积降低,品种间变异增加,进而影响花生光合特性,抑制了花生幼苗不同器官干物质累积。按照耐酸系数,将供试品种分为耐酸型、中间型及敏感型3类,其中冀花8号和仲恺花10 2个品种为耐酸型。下一步将着重从根系分泌物及根尖细胞结构等方面深入研究花生耐酸机制。
