胃肠胰神经内分泌瘤超声内镜下特点及诊疗
2020-04-15陶文鹏郭长青曹新广张芳宾李冠华刘虹彦王文佳段义龙
陶文鹏,郭长青,曹新广,张芳宾,李冠华,刘虹彦,王文佳,段义龙
郑州大学第一附属医院消化内科 郑州 450052
神经内分泌肿瘤(neuroendocrine tumors,NETs)是起源于神经内分泌细胞的肿瘤;神经内分泌细胞是机体内具有神经内分泌表型,可以产生多种激素的一大类细胞[1]。神经内分泌细胞遍布全身各处,因此NETs可以发生在体内任何部位,但最常见的是胃、肠、胰腺等消化系统脏器[2],约占所有NETs的2/3。胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors,GEP-NETs)虽然具有共同的病理特征,但由于解剖部位及肿瘤类型的不同,临床表现千差万别,其术前确诊困难,极易被误诊。因此,加强对GEP-NETs的认识显得尤为重要。近年来,随着人们对GEP-NETs认识和诊疗手段的提高,尤其随着超声内镜(endoscopic ultrasonography,EUS)及超声内镜引导下细针穿刺吸取术(endoscopic ultrasonography guided fine needle aspiration,EUS-FNA)等多种诊疗技术的发展[3],GEP-NETs的确诊率在过去30年内增加了5倍[4]。有研究[5]报道,一旦肿瘤出现分化,发生远处转移,GEP-NETs患者的5 a生存率明显降低,因此其早期诊断显得尤为重要。本研究通过对198例GEP-NETs患者的临床资料、EUS特点及EUS指导下的内镜治疗及手术治疗的情况进行回顾性总结,旨在探讨EUS在GEP-NETs诊治过程中的应用价值。
1 对象与方法
1.1临床资料回顾性分析2017年5月至2019年5月郑州大学第一附属医院消化内科确诊为GEP-NETs 198例患者的信息。所有病例根据2019年第5版WHO NETs命名及分类标准分为G1(核分裂数<2/10HPF、Ki-67增殖指数≤2%)、G2(核分裂数2~20/10HPF、Ki-67增殖指数3%~20%)、G3(核分裂数>20/10HPF、Ki-67增殖指数>20%)和混合型腺神经内分泌癌[6](每种成分不少于30%)。据此,GEP-NETs被分类为神经内分泌瘤(NET G1和G2)、神经内分泌癌(NEC G3)和混合型腺神经内分泌癌(该研究中未见此型)。
1.2诊治方法采用EUS及EUS-FNA观察病灶的声像图特征,包括其部位、形态、大小、起源层次、边界等,获得病灶处组织并行病理学诊断,探及病灶是否存在肌层及周围血管和淋巴结浸润,根据病灶分期分级选择EUS指导下内镜治疗、手术治疗、药物治疗及放化疗。
2 结果
2.1GEP-NETs患者性别、发病部位及分级见表1。
2.2患者EUS下病灶的特征表现见图1。198例患者中,EUS下病灶直径<1 cm、1~2 cm及>2 cm的分别有68例、72例和58例。其中,胃肠神经内分泌瘤(gastrointestinal neuroendocrine tumors,GI-NETs)共161例,其EUS下表现见表2;胰腺神经内分泌瘤(pancreatic neuroendocrine tumors, p-NETs)
EUS下病灶直径<1 cm、1~2 cm及>2 cm的分别有21例、8例和8例,因其解剖结构特殊性,其EUS下形态层次与GI-NETs差异较大,多结合其他影像学及EUS-FNA取得病理学结果后得以诊断,在此处不计入表2中描述。
表1 198例GEP-NETs患者性别、发病部位及分级例
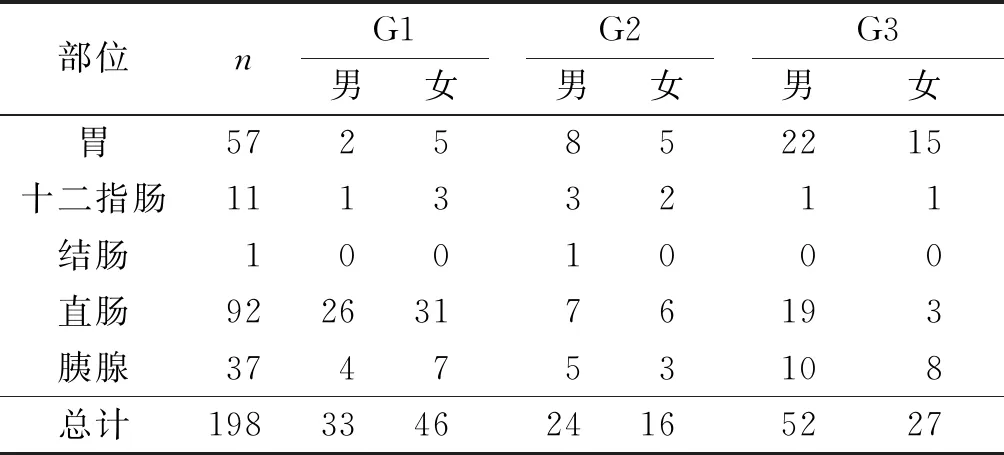
部位nG1男女G2男女G3男女胃5725852215十二指肠11133211结肠1001000直肠92263176193胰腺374753108总计198334624165227

A:胃底NET(G2期)内镜图;B:胃底NET(G2期)超声内镜,全层病变,低回声,边界不清;C:十二指肠球部NET (G2期)内镜图;D:十二指肠球部NET (G2期)超声内镜图,黏膜下层,偏高回声,回声欠均匀;E:直肠NET(G1期)内镜图;F:直肠NET(G1期)超声内镜图,固有肌层,低回声,回声均匀
图1胃肠胰神经内分泌瘤内镜及超声内镜图

表2 162例GI-NETs患者超声内镜下表现 例
2.3EUS下评估病灶侵犯情况及治疗方案198例患者中共有37例p-NETs患者,由于病灶侵犯范围多累计周围淋巴结及远端脏器,因此较难利用EUS对其进行病灶侵犯情况的评估及进行内镜下治疗。对于p-NETs患者,多为因其并发症而偶然发现,发现时大多已伴有周围组织脏器侵及,共26(70.3%)例;对未侵及的11例患者来说,手术是其主要治疗手段,该研究中有9例选择根治性手术,2例选择药物治疗。对侵及的患者来说,根治性手术效果虽然较差,但仍可减轻症状(共3例);余多采用介入栓塞手术、药物治疗和放化疗治疗(分别为20例、2例和1例)。在余下的161例GI-NETs患者中,未侵及的患者多采用内镜下治疗,仅有4(3.8%)例肿物直径较大的患者采用根治性手术治疗、1例要求药物治疗;而在存在周围组织脏器侵及的患者中,有部分患者选择内镜下治疗,大多数患者选择根治性手术治疗或行介入栓塞化疗,少数患者选择放化疗或生长抑素类似物、多肽受体放射性核素等药物保守治疗(此类患者恶性程度较高,预后较差)。详见表3。

表3 EUS下评估GI-NETs患者病灶侵犯情况及治疗方案选择 例
3 讨论
GEP-NETs是一组神经内分泌表型肿瘤,常分布于胃肠道,也可见于全身多处器官,分为功能性和非功能性。对于GEP-NETs而言,其功能性肿瘤通常为有显著症状的胃泌素瘤或胰岛素瘤等,而非功能性肿瘤经常会是偶然发现或症状相关肿瘤及其转移的结果[7]。近年来,NETs的确诊率有所上升,这通常被认为是由于检测方法的改进所导致[8]。
本文回顾性分析在郑州大学第一附属医院确诊为NETs患者的EUS表现及治疗方法等特点,旨在帮助其诊断及治疗方式的选择。本研究中共有男性患者109(55.1%)例,女性患者89(44.9%)例,其性别差异可能与机体激素代谢水平及生活方式有关[9]。其中,发病率最高的部位是直肠,其次为胃,再次是胰腺、十二指肠,结肠均只发生1例,这与Dasari等[4]的关于GEP-NETs大规模研究结果相符。
随着内窥镜检查技术的进展,胃、十二指肠和直肠中的GI-NETs在内窥镜检查中偶然检出的频率越来越高[10],包括EUS-FNA对胰腺NETs的诊断,EUS内镜探头可进入体腔对胰腺进行近距离探查,在胰腺占位性病变评估方面具有较高的准确性,特别适合于胰腺微小病变的识别,可以检测到小至2~5 mm的病变[11]。EUS尤其能够定位胃泌素瘤和胰岛素瘤,其对胰头部的灵敏度较高,胰尾部的灵敏度较低[12]。在198例病例中,直肠NETs在EUS下大多表现为息肉型或隆起型,其中62.0%为G1级,82.6%的肿瘤直径小于2 cm,且大多不伴有淋巴结转移。而对于胃NETs,有64.9%为G3级,有56.1%的肿瘤直径大于2 cm。由此看出,直肠NETs大多为低度恶性肿瘤,而胃NETs可见潜在恶性或转移可能[13]。多项研究表明,肿瘤是否存在周围脏器侵犯及淋巴结转移与瘤体大小密切相关,随着瘤体增大,其转移率不断增高,直径小于1 cm的GEP-NETs很少发生脏器侵犯和转移(<5%),而直径大于2 cm的GEP-NETs时常伴有脏器侵犯(45%)和淋巴结转移(64%)[14]。随着内镜治疗技术(EMR、ESD、EFTR)的不断发展与完善,GI-NETs的治疗也趋向于多元化选择,但盲目的内镜下肿瘤切除不能保证病灶切除完整性,因此,在内镜下切除前,内镜医生经常进行EUS分期以确定内镜切除的可行性,尤其是在GI-NETs的治疗上体现的更为明显[15]。
内镜下治疗,本研究主要指内镜下黏膜下剥离术(endoscopic submucosal dissection,ESD),其被认为是早期消化道肿瘤内镜治疗的一种方法,同时也被认为是GI-NETs内镜下切除的主要方式。研究[16]表明,在GI-NETs中,EUS对病灶深度的评估趋近于100%准确,而对于内镜下合适的切除对象,有过9成的病灶能够完全切除。虽然ESD在技术上比EMR更难实施,但其可以提供一个更完整的治疗,该手术所增加的实际效用还需在进一步的研究中进行评估。对于本研究中的GI-NETs而言,共有114例(70.8%)患者选择了内镜下治疗,其中大部分为未侵及周围组织脏器病例,而在21例根治性手术患者中,有81.0%存在侵犯及转移,而对于此类患者,因其手术治疗创伤大、预后差、复发风险高,手术收益有限,建议其配合药物(生长抑素类似物、多肽受体放射性核素等)治疗或放化疗辅助治疗[17-19]。总的来说,在内镜下治疗前对病灶进行EUS检查以评估,对于其术前分期及治疗方式选择,是十分必要且不可或缺的[20]。
综上所述,随着超声内镜的普及,GEP-NETs的诊断和治疗逐渐成熟,同时,EUS是对GEP-NETs具有极高价值的检查手段,其治疗方案有赖于术前EUS的评估判断,识别GEP-NETs在其下的特征性表现,对于治疗方案的选择尤为重要。
总之,EUS是评估和治疗GEP-NETs的有效工具,进一步发展EUS并联合其他影像学检查,对其局限性进行改善,将有利于提高GEP-NETs的规范化诊疗与个体化治疗水平,改善患者预后生活质量。
