人胃腺癌组织中COX-2、iNOS和NF-κBp65蛋白的表达
2020-04-15李晓丽李继昌
李晓丽,林 锐,李继昌,符 洋
1)郑州大学第一附属医院老年病科;河南省高等学校临床医学重点学科开放实验室 郑州 450052 2)郑州大学第一附属医院消化内科 郑州 450052 3)郑州大学第一附属医院胃肠外科 郑州 450052
环氧合酶-2(cyclooxygenase-2, COX-2)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)为两种诱生型酶,且两者启动子区域含有核转录因子-κB(nuclear factor-κB, NF-κB)结合位点。NF-κB作为一种重要的核转录因子,调节着多种基因的表达,并参与炎症、免疫反应、肿瘤发生等多种生物学进程[1-3]。三者在胃腺癌组织中的表达及作用如何,目前少有报道。本研究采用免疫组化法对人胃腺癌组织中COX-2、iNOS及NF-κBp65蛋白的表达情况进行检测,分析三者在胃腺癌发生发展中的作用,现将结果报道如下。
1 材料与方法
1.1标本与试剂胃腺癌及其癌旁正常胃黏膜组织标本各85例均来源于我院病理科,为2016年3月至2017年12月手术切除标本。85例胃腺癌患者中,男49例,女36例;年龄33~78岁,≤60岁36例,>60岁49例;肿瘤直径≤5 cm 39例,>5 cm 46例;分化程度:高、中分化52例,低分化33例;浸润深度:浸润浅肌层35例,浸润深肌层50例;淋巴结转移情况:无淋巴结转移37例,有淋巴结转移48例。所有患者均无长期服用糖皮质激素及非甾体抗炎药物史,术前均未行化疗或放疗,病理证实均为腺癌。本研究经医院伦理委员会批准,受试者均签署知情同意书。兔抗人COX-2、iNOS多克隆抗体和鼠抗人NF-κBp65单克隆抗体及SABC即用型试剂盒均购于北京中杉金桥生物技术有限公司,DAB显色试剂购自武汉博士德生物技术有限公司。
1.2 2种组织中COX-2、iNOS及NF-κBp65蛋白的检测采用免疫组化SABC法。常规组织切片脱蜡至水;体积分数3%H2O2封闭内源性过氧化物酶15 min;高压抗原修复5 min;血清封闭剂封闭非特异性抗原,37 ℃20 min;分别滴加COX-2、iNOS、NF-κBp65一抗,稀释度分别为1∶200、1∶100、1∶200,4 ℃孵育过夜(>12 h);滴加生物素标记的二抗(按1∶100稀释)37 ℃30 min;滴加SABC,37 ℃孵育30 min;DAB显色后自来水冲洗;苏木精复染,分化,脱水透明,封片。应用PBS代替一抗作为阴性对照,用已知胃癌组织阳性染色切片作为阳性对照。综合染色强度及阳性细胞计数对染色结果进行半定量分析[4]。COX-2、iNOS、NF-κBp65蛋白阳性表达呈棕黄色。高倍镜下观察并判定染色强度:无染色为0分,染色弱但明显强于阴性对照为1分,染色清晰为2分,染色强为3分。每例观察5个高倍视野,每个视野计数100个细胞,阳性细胞比例<10%为0分,10%~为1分,25%~为2分,50%~为3分。结果取两项评分之和,0~1分为阴性,≥2分为阳性。
1.3统计学处理采用SPSS 24.0进行统计学处理。胃腺癌和癌旁正常胃黏膜组织中COX-2、iNOS与NF-κBp65蛋白表达情况的比较采用配对资料的χ2检验;三者在胃腺癌组织中的表达与临床病理学特征的关系采用χ2检验进行分析,三者间的关系采用Pearson等级相关进行分析。检验水准α=0.05。
2 结果
2.1胃腺癌及癌旁正常胃黏膜组织中COX-2、iNOS与NF-κBp65蛋白的表达情况COX-2主要表达于胃腺癌细胞胞质和(或)胞膜中,呈弥漫状分布。iNOS主要表达于胃腺癌细胞胞质和(或)胞膜中,呈颗粒状分布。NF-κBp65主要表达于胃腺癌细胞胞质和(或)胞核中,呈弥漫状分布。胃腺癌组织中COX-2、iNOS及NF-κBp65蛋白的阳性表达率均高于癌旁正常胃黏膜组织,见图1、表1~3。

1:癌旁正常胃黏膜组织(×200);2:胃腺癌组织(×400);A:COX-2;B:iNOS;C:NF-κBp65

表1 胃腺癌及癌旁正常胃黏膜组织中COX-2蛋白的表达情况 例

表2 胃腺癌及癌旁正常胃黏膜组织中iNOS蛋白的表达情况 例
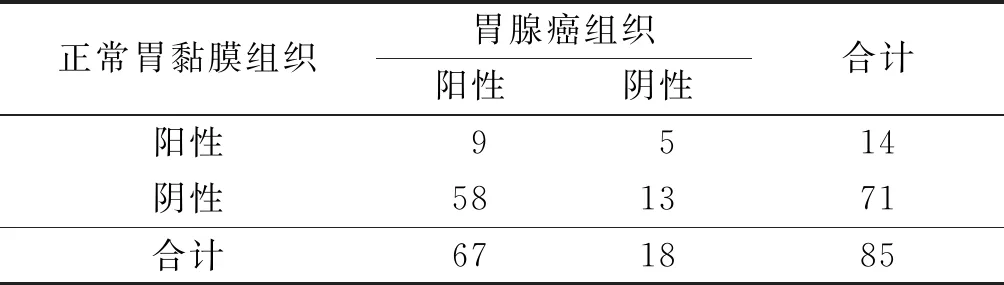
表3 胃腺癌及癌旁正常胃黏膜组织中NF-κBp65蛋白的表达情况 例
2.2胃腺癌组织中COX-2、iNOS、NF-κBp65蛋白的表达与临床病理学特征的关系胃腺癌组织中COX-2、iNOS及NF-κBp65蛋白的表达与患者的性别、年龄和肿瘤直径无关;而三者与胃腺癌的组织浸润深度和有无淋巴结转移有关,浸润深肌层组阳性表达率高于浸润浅肌层组,有淋巴结转移组高于无淋巴结转移组;COX-2蛋白在高、中分化胃腺癌组表达高于低分化组,而iNOS及NF-κBp65蛋白表达与胃腺癌分化程度无关。见表4。

表4 胃腺癌组织中COX-2、iNOS、NF-κBp65蛋白的表达与临床病理学特征的关系 例
2.3胃腺癌组织中COX-2、iNOS、NF-κBp65蛋白表达的关系COX-2与NF-κBp65表达呈正相关(rP=0.359,P<0.001);iNOS与NF-κBp65表达呈正相关(rP=0.405,P<0.001),见表5。COX-2与iNOS表达呈正相关(rP=0.366,P<0.001),见表6。
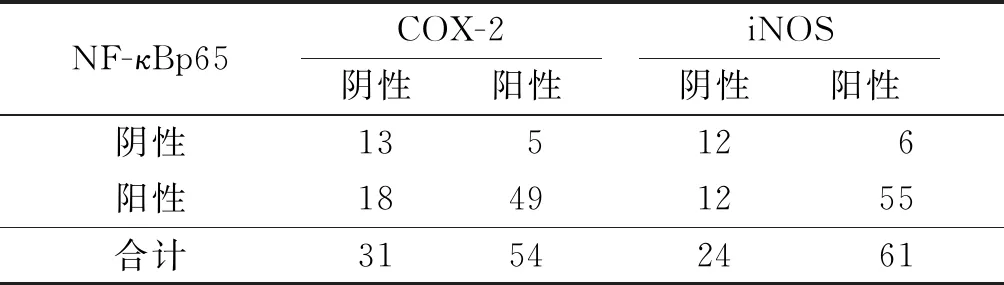
表5 胃腺癌组织中COX-2、iNOS与NF-κBp65蛋白表达的关系 例
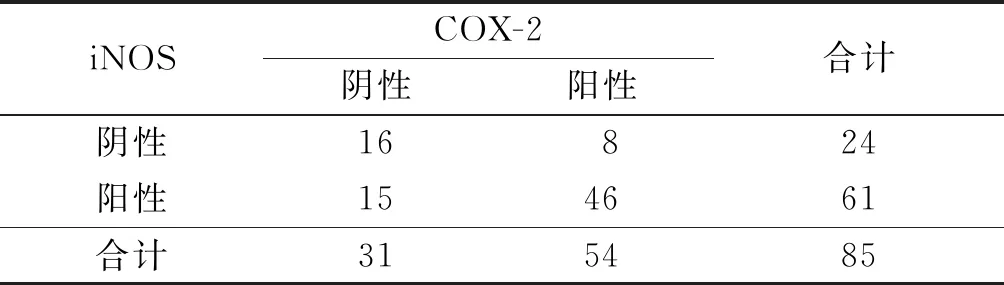
表6 胃腺癌组织中COX-2与iNOS蛋白表达的关系 例
3 讨论
胃癌是世界上最常见的恶性肿瘤之一,其发病率与病死率均较高[5]。早发现与早诊治是降低胃癌病死率的重要措施。因胃癌中95%以上为胃腺癌,故本实验选取胃腺癌组织进行检测,并初步探讨COX-2、iNOS及NF-κBp65与胃腺癌发生发展的关系。
COX是花生四烯酸转化为前列腺素过程中的关键性限速酶。COX 存在两种同工酶,即COX-1和COX-2,COX-2呈诱导型表达,当出现组织损伤、炎症或肿瘤时其表达增强[6-8]。COX-2主要分布在核膜,故其产物更容易进入核内而调节靶基因的转录,它可被迅速诱导,且诱导生成的COX-2量随细胞类型的不同而改变。本研究结果显示,COX-2蛋白的阳性表达主要定位于胃腺癌细胞的胞质和(或)胞膜中,呈弥漫状分布。胃腺癌组织中COX-2的表达高于癌旁正常组织,且COX-2蛋白在高中分化、浸润深肌层及有淋巴结转移的胃腺癌组织中的阳性表达率更高。提示COX-2与胃腺癌的发生发展有关,且可能为其早期事件,COX-2在分化较好的胃腺癌组织中的异常高表达可能与其他旁分泌途径有关。
一氧化氮(NO)是一种重要的内源性调节因子,在哺乳动物体内由一氧化氮合酶进行催化,利用L-精氨酸-NO途径生成。NO在生物体内的功能依据部位及NOS的种类不同而存在差异,NOS的3种同工酶包括神经型一氧化氮合酶、内皮型一氧化氮合酶和iNOS。iNOS 在正常生理状态不表达,但在病理条件下通过催化NO因子来实现其病理性生物学过程,其中iNOS诱导生成的过量NO是其产生病理作用的基础,且与炎症及肿瘤形成等密切相关[9]。另有研究[10]证明,NO既能提高血管内皮生长因子的生物学功能,又能激活COX-2而促进前列腺素的生成,这两种因子又可加速肿瘤新生血管及肿瘤的生长。本研究结果显示,iNOS蛋白阳性表达主要位于胃腺癌细胞胞质和(或)胞膜中,呈颗粒状分布。胃腺癌组织中iNOS的表达高于癌旁组织,且浸润深肌层及有淋巴结转移的表达更高。提示iNOS通过诱导生成NO而参与胃腺癌早期的形成,同时作为一种重要促侵袭转移因子可加速胃腺癌的进展。所以,其对胃腺癌的早期诊断及晚期预后判断具有一定的临床意义。
NF-κB为一种重要的多向性细胞核转录因子,NF-κB被激活后进入细胞核内发挥其重要作用,并参与炎症、免疫、肿瘤生成等过程。目前,NF-κB靶基因仍不十分清楚,但已知有炎症性细胞因子(IL-6、TNF-α等)、趋化因子(IL-8、MCP-1等)、MCH-1、COX-2、iNOS等,它们均为其诱生物,其中COX-2、iNOS是启动子含有NF-κB结合位点的两种诱生酶,而在细胞核内激活的NF-κBp65 又可促进COX-2和iNOS的合成[11-12]。本研究结果显示,NF-κBp65蛋白的阳性表达主要定位于胃腺癌细胞胞质和(或)胞核中,呈弥漫状分布。胃腺癌组织中NF-κBp65蛋白的表达高于癌旁组织,且浸润深肌层及有淋巴结转移的更高。另外,COX-2、iNOS与NF-κBp65蛋白在胃腺癌组织中呈高表达状态,且三者间存在正相关关系。提示NF-κBp65在刺激因素作用下被激活,从细胞质转移至细胞核内,然后与COX-2、iNOS启动子区域的NF-κB结合位点结合,启动COX-2和iNOS基因转录并促进其生成,两者再通过不同途径共同参与胃腺癌的发生、发展和转移的全过程。
综上所述,COX-2、iNOS与NF-κBp65在胃腺癌细胞中的表达和分布具有相似性,且COX-2、iNOS与NF-κBp65表达存在正相关关系,COX-2和iNOS的表达调控可能与NF-κBp65有关。COX-2、iNOS与NF-κBp65共同参与了胃腺癌的形成,且与晚期胃腺癌的侵袭、转移有关,影响预后。
