碳热还原法制备的碳载零价铁对水中U(VI)的去除研究
2020-04-14王佳琦庞宏伟唐昊于淑君朱洪涛王祥学
王佳琦, 庞宏伟, 唐昊, 于淑君, 朱洪涛, 王祥学,,3
碳热还原法制备的碳载零价铁对水中U(VI)的去除研究
王佳琦1, 庞宏伟2, 唐昊2, 于淑君2, 朱洪涛1, 王祥学1,2,3
(1. 华北电力大学 环境科学与工程系, 燃煤电站烟气多污染物协同控制实验室, 保定 071003; 2. 华北电力大学环境科学与工程学院, 资源环境系统优化教育部重点实验室, 北京 102206; 3. 西南科技大学 核废物与环境安全国防重点学科实验室, 绵阳 621010)
随着核电的发展, 放射性污染物流入环境, 污染水土资源。纳米零价铁(nZVI)材料因还原性强、去除效率高等优势, 被广泛应用于水资源污染修复。本研究以海藻酸钠(SA)为碳源, 采用一步碳热还原法制备碳载零价铁(Fe-CB)材料, 并将其用于水溶液中放射性核素U(VI)的去除。采用微观光谱和宏观实验研究Fe-CB对U(VI)的吸附性能和作用机理。研究发现Fe-CB具有丰富的官能团(如–OH和–COOH)及较高的比表面积, 弥补了纳米零价铁(nZVI)分散性差和去除效果低的不足。在298 K时, Fe-CB对U(VI)的吸附去除在3 h内达到平衡, 最大吸附量为77.3 mg·g–1, 是能够自发进行的化学吸附。X射线光电子能谱分析仪(XPS)分析发现Fe-CB对U(VI)的去除主要是通过吸附和还原的协同作用来实现的, 吸附过程是U(VI)与Fe-CB发生表面络合, 还原过程是通过零价铁的还原性将U(VI)还原成U(IV)。研究结果表明Fe-CB材料可作为优良的吸附剂, 在环境污染治理领域具有良好的应用前景。
零价铁; 碳材料; 铀; 吸附; 还原
核电发展缓解了能源短缺的问题, 铀作为核电的主要燃料, 其开采和利用引起了广泛研究[1-2]。随着铀矿开采力度的加大, 产生的废渣及废水随之增加, 伴随雨水冲刷及风化等自然条件, 铀进入环境, 污染水土资源, 最终对人体健康造成危害。在水溶液中, 高毒性的U(Ⅵ)通常以稳定的UO22+存在, 是当前最常见的放射性污染物之一。因此, 治理铀污染水体问题刻不容缓[3-5]。在近几十年的研究中, 传统的去除方法如吸附法、膜分离技术和离子交换法等已被成功运用, 其中吸附法绿色高效, 在污水修复中有很大的发展潜力[3,6]。近年来, 将溶解度高的U(Ⅵ)转化为毒性低更易被去除的U(Ⅳ)的还原材料也开始被重视, 研发去除效率高、具有还原性的新型材料成为国内外学者关注的重点。
纳米零价铁材料(nZVI)由于反应活性高, 能够高效地去除放射性核素, 而被广泛应用于水体污染修复。例如: Li等[7]通过液相还原法制备的纯nZVI能够快速去除U(Ⅵ), 反应2.5 h后对U(Ⅵ)的去除率高达98.98%, 吸附量为27.2 mg·g–1。Pang等[8]研究了nZVI和零价铁ZVI对U(Ⅵ)的去除, 发现nZVI能够提供更多的活性位点, nZVI的去除率(~41%)远高于ZVI(~17%)。随着对nZVI去除过程的深入研究, 发现nZVI具有较强的磁性, 在反应过程中易发生团聚, 严重阻碍其吸附与还原能力, 使得nZVI对于放射性核素的去除效果不佳[9-11]。为了解决这个问题, 研究者采用多孔材料如膨润土、水滑石、沸石等, 与nZVI形成复合材料, 通过这种方式提高nZVI分散性[12-14]。由于这些负载材料不具备还原性或还原性低, 在制备过程中需要添加其他还原剂, 制备成本较高, 在一定程度上限制了负载零价铁材料的应用。因此, 理想的复合材料应具备不易被氧化、工艺简单、价格低廉等特点。
海藻酸钠(SA)是一种无毒、可生物降解的天然聚合物, 在医学和食品领域被广泛研究[15-16]。研究发现, 海藻酸盐可作为一种强生物吸附剂用于去除Pb(Ⅱ)、Cu(Ⅱ)和Cd(Ⅱ)等重金属离子和放射性核素[17-20]。HU等[20]采用同轴电子注入法制备了海藻酸钠复合材料, 用于Cu(Ⅱ)和U(Ⅵ)的去除, 研究发现海藻酸钠中羧基和羟基参与了反应, 对Cu(Ⅱ)和U(Ⅵ)的去除量可达到52.5和138.9 mg·g–1。SA也常被用作增强剂或载体形成复合材料, 如Choe等[21]通过SA负载的黑曲霉对Th(Ⅳ)的去除量高达303.9 mg·g–1, 是纯黑曲霉去除量的2倍。Eunbee等[22]利用SA复合普鲁士蓝, 阻止普鲁士蓝聚集, 加强了对Cs(I)的去除效果。此外, SA具有丰富的羧基, Fe3+可以直接与其羧基配位固定, 形成稳定的交联体, 为碳载零价铁的制备提供良好的前驱物[23]。目前, SA作为碳源还原负载零价铁对核素去除机理的研究鲜有报道。
本研究以SA作为碳源, 与Fe3+交联形成前驱体, 通过一步碳热还原法制备碳负载零价铁颗粒(Fe-CB), 研究其在不同条件下对水溶液中U(Ⅵ)的去除效果, 并探究Fe-CB对U(Ⅵ)的去除机理。
1 实验方法
1.1 实验材料
试剂: 海藻酸钠, FeCl3·6H2O、NaBH4、FeSO4·7H2O、偶氮胂III、NaNO3、KBr等购自上海阿拉丁生化科技股份有限公司; UO2(NO3)2·6H2O购自湖北楚盛威集团; HNO3和NaOH购自北京化工厂。以上药品等级均为分析纯, 无需纯化可直接使用, 实验用水为去离子水。
1.2 Fe-CB的制备
采用一步碳热还原法合成Fe-CB。取2.5 g海藻酸钠和20 g的FeCl3·6H2O分别溶于247.5和480 mL的去离子水中, 使用12号针头吸取海藻酸钠溶液并快速注入FeCl3溶液中, 使Fe3+与海藻酸钠发生共价交联。待凝胶与溶液分离后使用尼龙网过滤, 并用去离子水对凝胶反复冲洗。采用冷冻干燥机对凝胶干燥48 h后, 放至管式炉中, 在N2保护下以2 ℃/min的速度升温至700 ℃并保温2 h, 自然冷却得到碳负载零价铁材料即Fe-CB。
1.3 吸附试验
称取0.632 g UO2(NO3)2·6H2O溶于1 L去离子水中, 配置成300 mg·L–1的U(VI)储备液。以10 mL的聚乙烯离心管作为反应器, 0.01 mol·L–1的NaNO3作为背景电解质, 加入浓度为0.1 g·L–1的吸附剂和初始浓度为10 mg·L–1的U(Ⅵ)溶液, 使用微量NaOH或HNO3调节pH至5.0±0.05, 放置于恒温摇床反应24 h确保吸附达到平衡(温度为25 ℃, 100 r/min)。反应结束后使用滤膜过滤, 采用偶氮胂Ⅲ显色法测定滤液中U(Ⅵ)的浓度。所有实验均进行3次以上并取平均值以减少误差。U(Ⅵ)在Fe-CB中的吸附量(e, mg·g–1)和吸附率(Sorption, %)可用式(1, 2)计算得到:

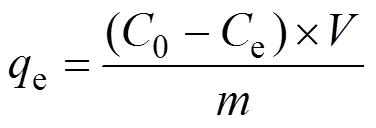
式中,0为污染物初始浓度(mg·L–1);e为反应平衡时U(Ⅵ)的浓度(mg·L–1);为溶液的体积(mL);为Fe-CB的质量(g)。
1.4 材料表征
使用X射线衍射仪(XRD, Rigaku Ultima), 在2为15°~80°的扫描范围对SA、nZVI和Fe-CB结构进行分析; 经过光谱级KBr对材料压片处理, 利用红外光谱仪(FT-IR, Tensor Bruker)获取Fe-CB表面官能团信息, 扫描范围为400~4000 cm–1; 使用扫描电子显微镜(SEM S4800, Hitachi)和X射线能谱仪(EDS JEOL JEMARF200F)分析材料的形貌和结构; 利用氮气吸附–脱附曲线(N2-BET, TriStar II 3020)对nZVI和Fe-CB进行比表面积和孔径的计算; 采用XPS(ESCALAB-250)分析吸附前后Fe-CB表面组成。
2 结果与讨论
2.1 材料的表征与性质
通过SEM和EDS对Fe-CB的微观面貌进行研究, 如图1(a)所示, 制备的零价铁粒径约为100 nm, 为纳米零价铁, 呈球均匀分布在碳表面。通过元素分布图(图1(b))可以看出nZVI均匀地分布在碳表面,表明Fe0在Fe-CB材料中具有良好的分散性。Fe-CB的EDS能谱如图1(c)所示, 材料中存在Fe、C和O元素, 其中C、O元素是由碳化后的SA提供。综上说明实验成功制备了Fe-CB。
图2(a)为SA、nZVI和Fe-CB的XRD图谱。通过碳热还原后, Fe-CB在2=44.7°和65.2°处出现了零价铁的衍射尖峰, 表明交联体中的Fe3+在700 ℃高温下被还原成零价铁。纯nZVI在2=35.6°处存在较弱的Fe2O3的特征峰[13], 说明nZVI外层包裹了一层氧化铁薄膜, 造成nZVI活性低、稳定性差; 而经过高温碳化处理的Fe-CB没有出现Fe2O3特征峰, 说明其稳定性比纯nZVI更好。
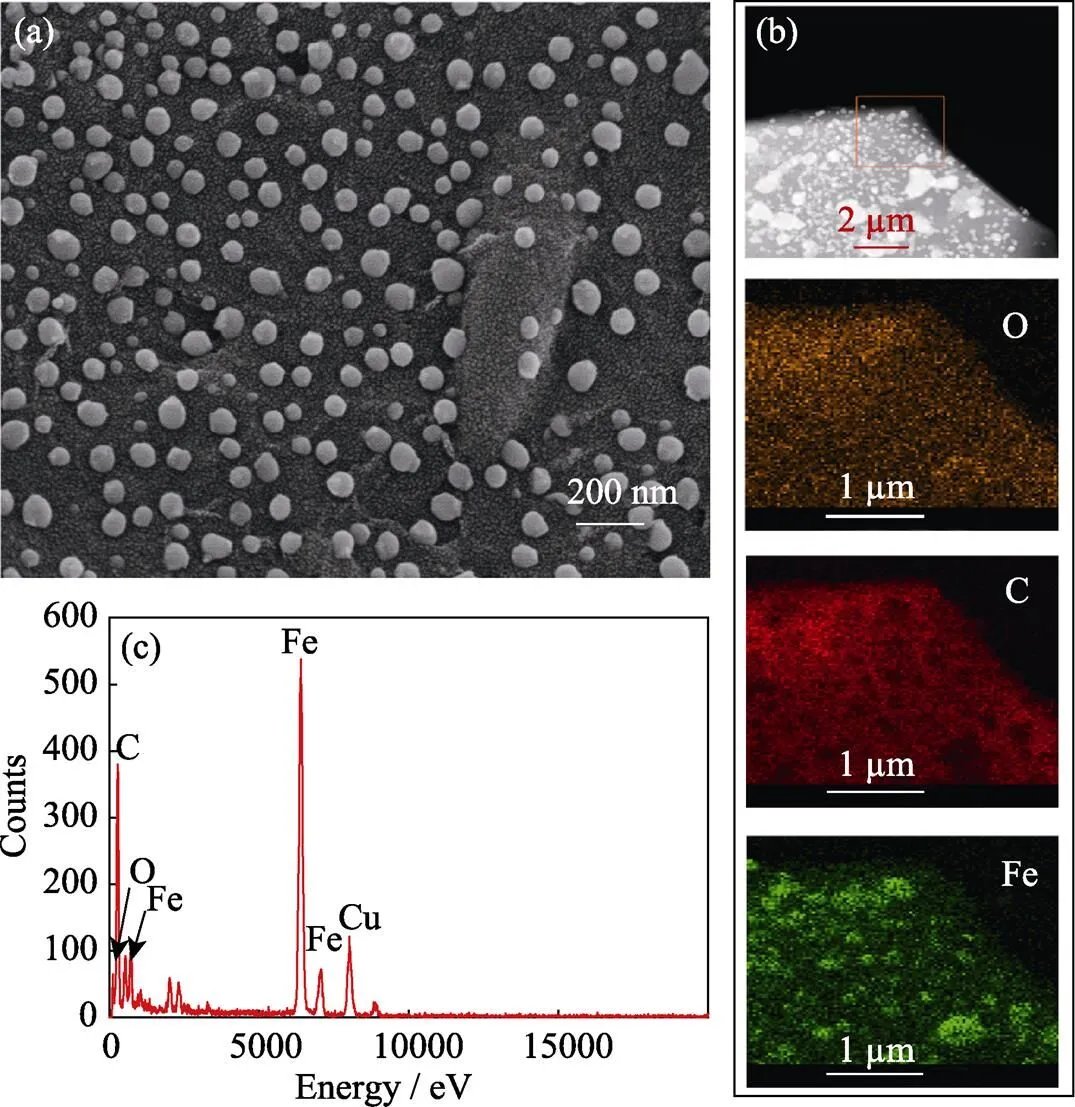
图1 Fe-CB的SEM照片(a), 元素分布图(b)与EDS能谱分析(c)
图2(b)为样品的N2吸附–脱附等温线, 显示其为Ⅳ型吸附–脱附等温线[24], 材料主要为介孔材料, 而介孔的存在对离子级别的污染物具有很强的去除效果。此外, 通过BET测得纯nZVI与Fe-CB的比表面积分别为4.1和346.6 m2·g–1。表1为各材料的BET结果, 经过973 K碳化后, 比表面积增加, 这是因为煅烧后前驱体凝胶被碳化, 材料脱水, 起到了扩孔的作用, 从而确保材料对U(Ⅵ)的去除具有一定的优势。
采用FT-IR对SA和Fe-CB的表面官能团进行表征, 如图2(c)所示。负载前后的FT-IR光谱基本一致, 在3420 cm–1处有一个大而宽的特征峰, 对应SA和Fe-CB表面的O–H伸缩振动峰[25]; 1550和1470 cm–1处的峰对应–COOH和C–OH的振动峰, 在负载后明显减小[26], 这是由于在高温处理过程中, 部分H3O+发生转化而流失。另外, 在608和564 cm–1处出现了Fe–O的特征峰, 这是在烘干过程中nZVI被氧化形成的。

表1 nZVI、SA和Fe-CB的BET结果
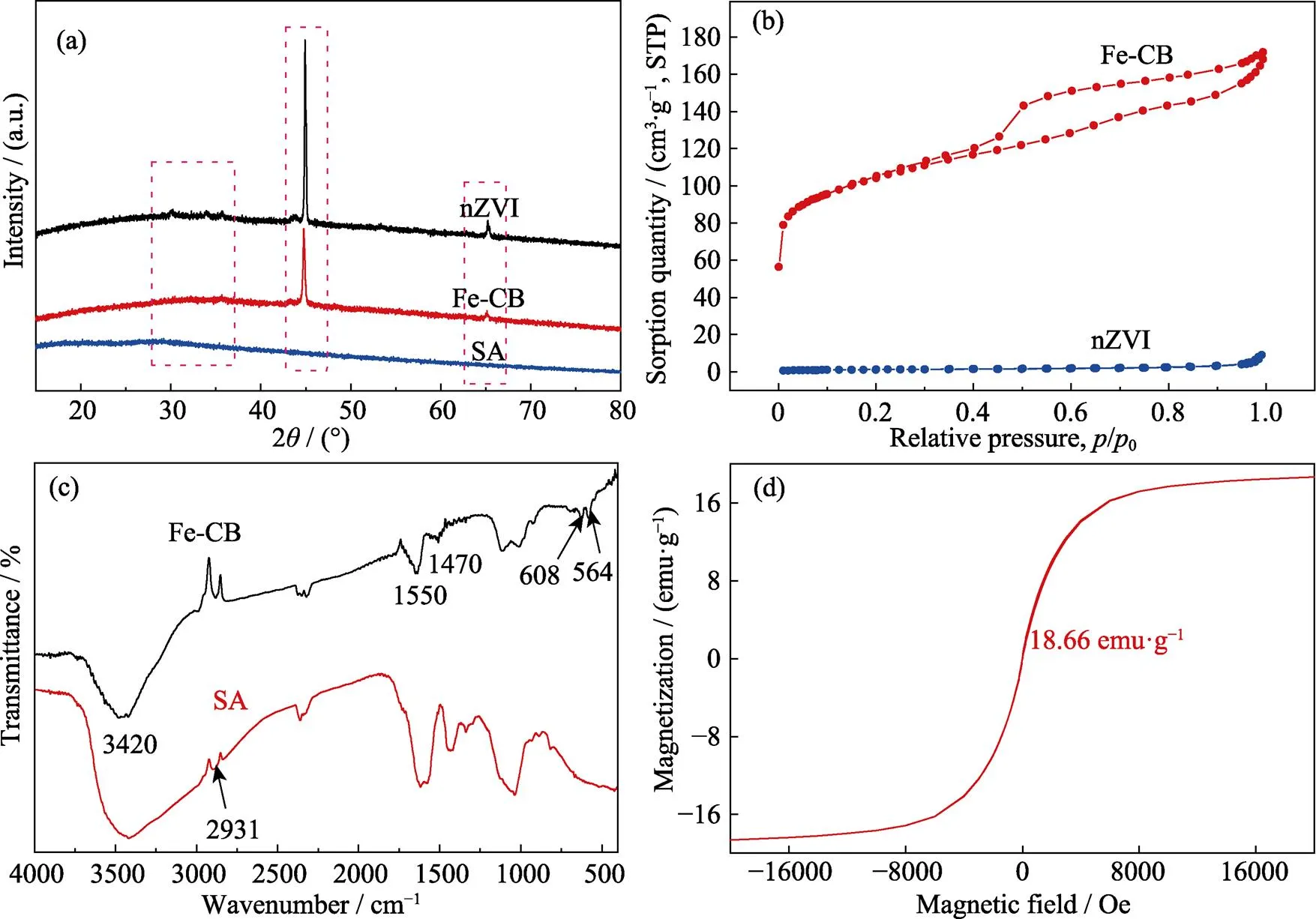
图2 SA、nZVI与Fe-CB的XRD图谱(a)和N2吸附脱附等温线(b); SA与Fe-CB的红外光谱图(c)和Fe-CB的磁滞回线(d)
Fe-CB的磁滞回线如图2(d)所示, 材料的饱和磁化强度为18.66 emu·g–1(1 emu/g=1 Am2/kg, 1 Oe= 79.6 A/m)。Fe-CB的矫顽力可以忽略不计并且磁滞现象表现微弱, 表明材料具有超强的顺磁性[27]。
2.2 吸附动力学
Fe-CB对U(Ⅵ)的吸附量随时间的变化曲线如图3所示。从图3(a)中可以看出, 随着时间的延长, Fe-CB对U(Ⅵ)的吸附量逐渐增加。在开始接触60 min内吸附量迅速增加, 说明在吸附开始阶段, Fe-CB上的吸附位点被不断占据; 经过3 h接触后表面的吸附位点趋于饱和, 导致反应逐渐平衡。为进一步探讨Fe-CB对U(Ⅵ)的去除过程, 常用准一阶和准二阶动力模型描述Fe-CB对U(Ⅵ)的吸附过程, 如式(3, 4)所示:
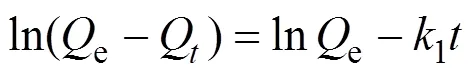

式中,1(min–1)和2(g·mg–1·min–1)分别为两种动力学反应常数,e和Q分别为吸附平衡时和时刻的吸附量(mg·g–1)。
分析准一阶动力学拟合(图3(b))、准二阶动力学拟合(图3(c))和动力学各参数拟合结果(表2), 发现22>12, 且准二阶平衡吸附量为64.3 mg·g–1, 表明Fe-CB对U(Ⅵ)的吸附更符合准二阶动力学模型, 说明Fe-CB对U(Ⅵ)的吸附去除过程主要由化学吸附控制[28]。
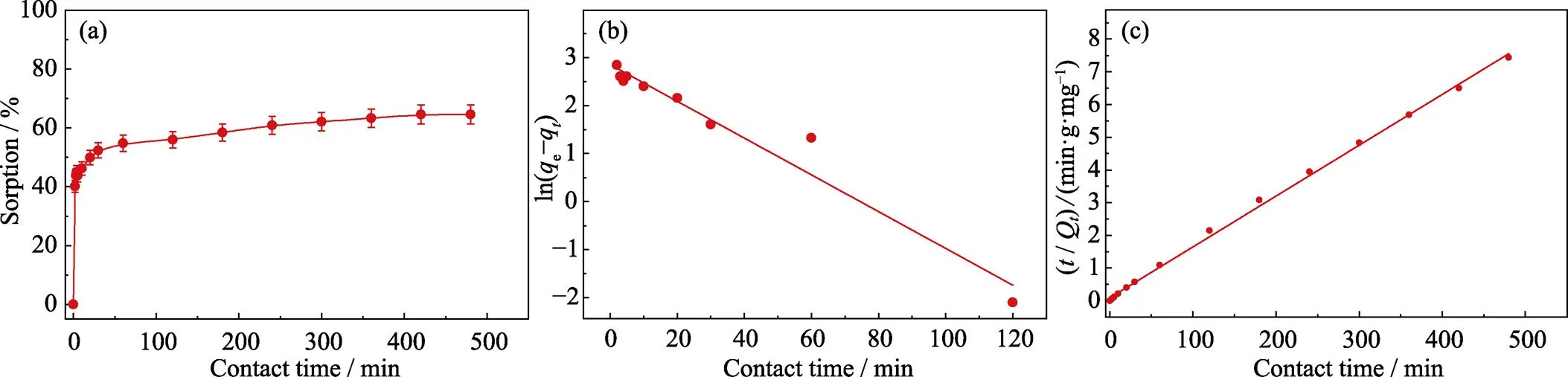
图3 不同接触时间对Fe-CB吸附U(Ⅵ)的影响(a)、准一阶动力学拟合模型(b)和准二阶动力学拟合模型(c)

表2 Fe-CB对U(Ⅵ)吸附动力学的拟合参数
2.3 等温线与吸附热力学
为探究反应温度对去除效果的影响, 在反应温度分别为298、313和328 K下, 对初始浓度为5~ 70 mg·L–1的U(Ⅵ)进行吸附去除, 得到的等温线如图4(a)所示。从图中可以看出, 材料对U(Ⅵ)的吸附量随着温度升高而增加, 这是由于温度的上升加快了溶液中分子的运动速度, 促进U(Ⅵ)与Fe-CB上的不饱和离子进行交换。同时, 采用Langmuir[29]和Freundlich[30]等温线模型对数据进行非线性拟合探究材料的吸附机理, 相关数据可通过式(5, 6)计算。


式中,L和F分别为Langmuir常数和Freundlich常数;e和m(mg·g–1)分别代表平衡吸附量和最大吸附量;e(mg·L–1)为U(Ⅵ)吸附平衡后的质量浓度,为无量纲数。
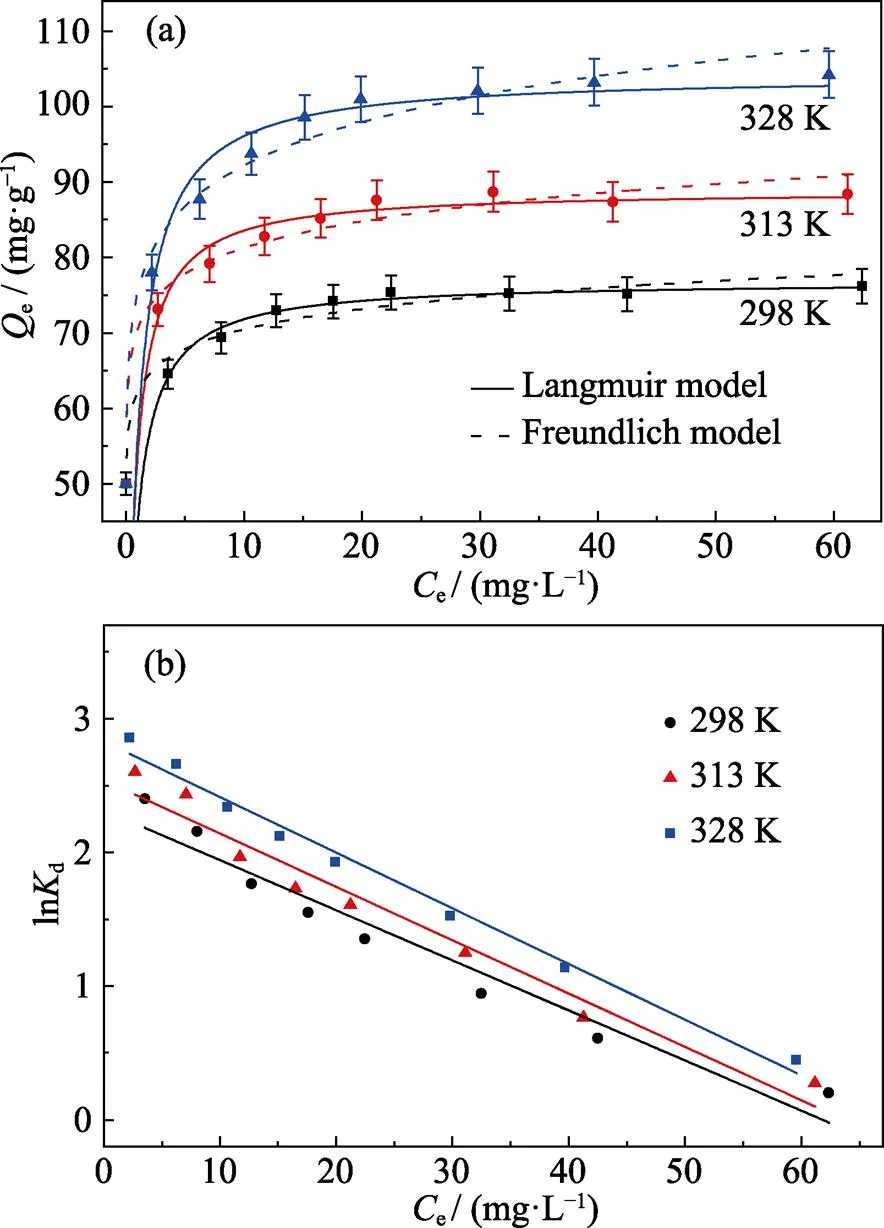
图4 Fe-CB对U(Ⅵ)的吸附等温线(a)和lnKd-Ce的线性图(b)
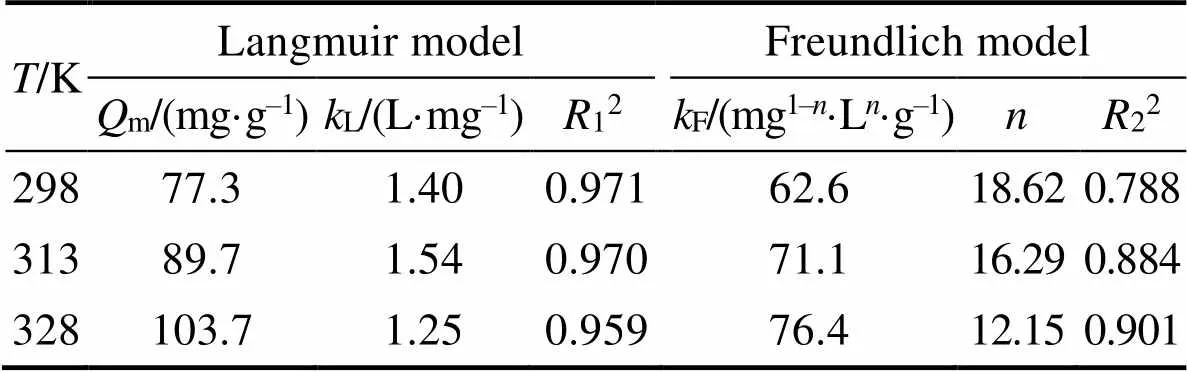
表3 Fe-CB对U(Ⅵ)吸附等温线的拟合参数
拟合结果如表3所示(12>22), 说明Langmuir模型能够更好地描述材料对U(Ⅵ)的吸附去除过程, 说明水溶液中均匀分散的Fe-CB能与U(Ⅵ)更全面地接触, 并且是单层吸附, 其在298、313和328 K时理论最大吸附量分别为77.3、89.7和103.7 mg·g–1。
利用热力学计算探究材料的热力学性质。由热力学公式(7, 8)计算不同温度下的热力学数据, 其拟合结果如表4所示:

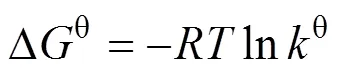

2.4 p0048和离子强度的影响
pH作为反映材料吸附性能的重要参数, 吸附性能与U(Ⅵ)在水中的溶解度和吸附剂的电性密切相关。图5(a~b)显示了pH和NaNO3浓度对Fe-CB去除U(Ⅵ)的影响, 结果表明, Fe-CB对U(Ⅵ)的吸附行为不受离子强度变化的影响, 为内层表面络合。说明水溶性的U(Ⅵ)与Fe-CB表面水化层的官能团通过化学键的形式结合, 形成稳定的化合物。
图5(c, d)分别为Fe-CB的Zeta电势分布图和不同pH下U(Ⅵ)离子的分布形态。当pH<4时, U(Ⅵ)主要以UO22+和UO2OH+的形式存在, 而Fe-CB表面的官能团质子化, 使Fe-CB带正电荷, 两者之间存在强大的静电斥力, 减弱材料的吸附力。在pH增至7的过程中, U(Ⅵ)会发生水解, 形成UO2(OH)+和(UO2)3(OH)5+, 且Fe-CB表面的正电荷开始减少, 此时U(VI)与材料表面的官能团发生络合反应[32]。当溶液pH>9时, 溶液中开始出现UO2(OH)3–和(UO2)3(OH)7–, 这是由于Fe-CB呈负电性, 静电斥力增强, 难以吸附在材料上, 从而减缓了对U(Ⅵ)的去除。

表4 不同温度下的热力学拟合数据
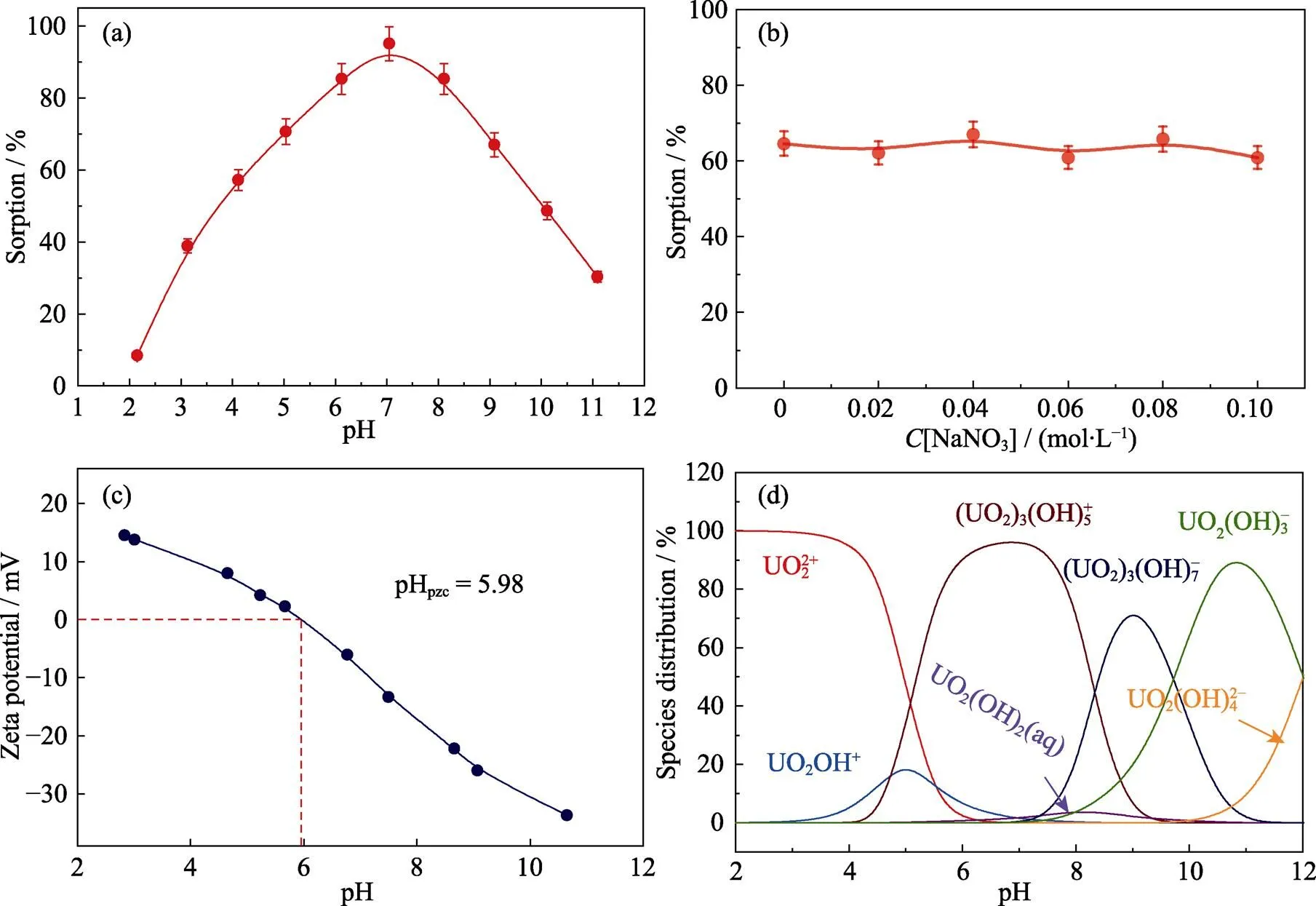
图5 pH(a)与离子强度(b)对Fe-CB吸附能力的影响; pH对Fe-CB表面电势的影响(c), 以及U(Ⅵ)在不同pH水溶液中的物种分布(d)
2.5 XPS分析
通过对Fe-CB吸附U(VI)前后的XPS光谱进行机理研究, 结果如图6所示。如图6(a)所示, C1s、O1s、Fe2p特征峰的出现表明实验成功制备了Fe-CB材料。吸附后的图谱中出现了U4f峰, 说明Fe-CB对U(Ⅵ)进行了吸附。在U4f高分辨XPS光谱(图6(b))中, 293和382 eV处分别出现了U4f5/2和U4f7/2的特征峰[33], 进一步分析发现在384.88、393.38和392.88、382.38 eV处的峰分别归属于U(Ⅵ)和U(Ⅳ), 说明该反应不仅有吸附过程, 还存在还原反应, U(VI)被Fe0还原成毒性低、更易被去除的U(IV)。图6(c)显示了Fe2p高分辨XPS光谱, 713.2和725.0 eV的特征峰归属于Fe2+和Fe3+, 如Fe2O3、Fe3O4。Fe0出现在706.4 eV处, 材料吸附U(Ⅵ)后, Fe0的峰值降低和铁氧化物峰值增加,表明Fe0与U(Ⅵ)发生反应, 被氧化为Fe(II)或Fe(III), 这与U 4f图谱相吻合[34]。
在O 1s高分辨XPS光谱中(图6(d)), 530.4和532.9 eV分别对应Fe–O和羧基(–COOH), 吸附后Fe–O的相对含量增加和–COOH的相对含量降低, 表明材料的吸附机理可能是–COOH与U(Ⅵ)形成了表面配合物; 531.3 eV处的C=O相对含量的变化也表明其对U(Ⅵ)的吸附有一定的作用。
XPS光谱分析结果表明, Fe-CB对U(Ⅵ)的去除过程主要是由吸附和还原的协同作用实现的: U(Ⅵ)被吸附至Fe-CB形成表面络合物, 部分U(Ⅵ)会被Fe0还原为溶解性较小更易被去除的U(Ⅳ)。
3 结论
以海藻酸钠作为碳源, 通过碳热还原法制备了碳载零价铁, 并应用于U(Ⅵ)的高效去除。研究结果表明: 零价铁均匀地负载在碳基材料表面, 弥补了零价铁易团聚的特点, 使得材料可在3 h内达到反应平衡, 298 K时的最大吸附量为77.3 mg·g–1, 对U(Ⅵ)具有较高的去除效率。通过光谱分析发现, Fe-CB主要由吸附和还原的协同作用达到较好的去除效果。本研究为负载零价铁的制备和U(Ⅵ)的去除机理提供了新的认识, Fe-CB材料在放射性污水净化方面具有广阔的应用前景。
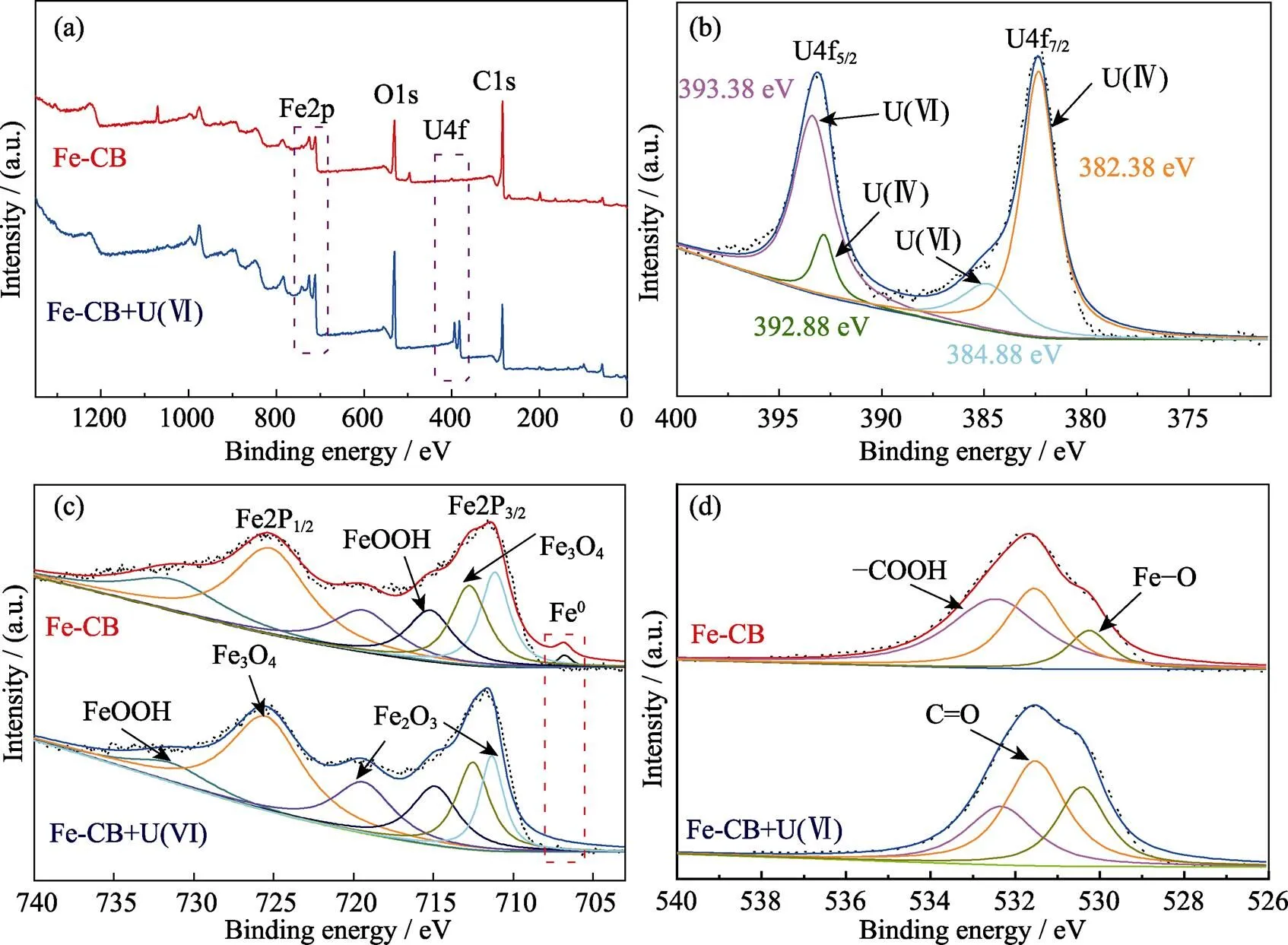
图6 Fe-CB吸附U(Ⅵ)前后的XPS图谱 (a), U4f (b), Fe2p (c), O1s (d)高分辨XPS图谱
[1] WU YI-HAN, PANG HONG-WEI, YAO WEN,Synthesis of rod-like metal-organic framework (MOF-5) nanomaterial for efficient removal of U(VI): batch experiments and spectroscopy study.2018, 63(13): 831–839.
[2] WANG XIANG-XUE, YU SHU-JUN, WANG XIANG-KE. Removal of radionuclides by metal-organic framework-based materials., 2019, 34(1): 17–26.
[3] PANG HONG-WEI, DIAO ZHUO-FAN, WANG XIANG-XUE,Adsorptive and reductive removal of U(VI) by dictyophora indusiate-derived biochar supported sulfide NZVI from wastewater., 2019, 366: 368–377.
[4] WANG XIANG-XUE, CHEN LONG, WANG LIN,Synthesis of novel nanomaterials and their application in efficient removal of radionuclides., 2019, 62(8): 933–967.
[5] CHEN ZHONG-SHAN, WANG JIAN, PU ZENG-XIN,Synthesis of magnetic Fe3O4/CFA composites for the efficient removal of U(VI) from wastewater.., 2017, 320: 448–457.
[6] YU SHU-JUN, WANG XIANG-XUE, YANG SHI-TONG,Interaction of radionuclides with natural and manmade materials using XAFS technique., 2016, 60(2): 170–187.
[7] LI XIAO-YAN, LIU YI-BAO, HUA MING,Removal of U(VI) from aqueous solution by nanoscale zero-valent iron., 2013, 34(2): 160–163.
[8] PANG HONG-WEI, WU YI-HAN, HUANG SHU-YI,Macroscopic and microscopic investigation of uranium elimination by Ca-Mg-Al-layered double hydroxide supported nanoscale zero valent iron.,2018, 5(10): 2657–2665.
[9] LIU DA-QIAN, LIU ZHI-RONG, WANG CHANG-FU,Removal of uranium(VI) from aqueous solution using nanoscale zero- valent iron supported on activated charcoal..,2016, 310(3): 1131–1137.
[10] ZHANG SI-HAI, WU MEI-FENG, TANG TING-TING,Mechanism investigation of anoxic Cr(VI) removal by nano zero- valent iron based on XPS analysis in time scale.2018, 335: 945–953.
[11] TANG LIN, FENG HAO-PENG, TANG JING,Treatment of arsenic in acid wastewater and river sediment by Fe@Fe2O3nanobunches: the effect of environmental conditions and reaction mechanism., 2017, 117: 175–186.
[12] CAO ZHEN, LIU XUE, XU JIANG,Removal of antibiotic florfenicol by sulfide-modified nanoscale zero-valent iron.., 2017, 51(19): 11269–11277.
[13] XU CONG-BIN, YANG WEN-JIE, SUN HONG-LIANG,Performance and mechanism of Pb(II) removal by expanded graphite loaded with zero-valent iron., 2018, 33(1): 41–47.
[14] YANG XIAO-DAN, WANG YU-RU, LI MIN-RUI. Preparation, modification of nanoscale zero valent iron and its application for the removal of heavy metals and organic pollutants from wastewater., 2019, 38(7): 3412–3424.
[15] MAHDAVINA GHOLAM-REZA, RAHMANI ZEINAB, KARAMIN SHIVA,Magnetic/pH-sensitive kappa-carrageenan/sodium alginate hydrogel nanocomposite beads: preparation, swelling behavior, and drug delivery.., 2014, 25(17):1891–1906.
[16] LI DA-HAO, LÜ CHUN-XIAO, LIU LONG,Egg-box structure in cobalt alginate: a new approach to multifunctional hierarchical mesoporous N-doped carbon nanofibers for efficient catalysis and energy storage., 2015, 1(5): 261–269.
[17] BERTAGNOLLI CAROLINE, CARLOS DA-SILVA, GUIBAL ERIC. Chromium biosorption using the residue of alginate extraction from sargassum filipendula., 2014, 237: 362–371.
[18] PAPAGEORGIOU S K, KOUVELOS E P, KATSAROS F K. Calcium alginate beads from Laminaria digitata for the removal of Cu2+and Cd2+from dilute aqueous metal solutions., 2008, 224(1/2/3): 293–306.
[19] YI XIAO-FENG, SUN FU-LIANG, HAN FU-HAO,Graphene oxide encapsulated polyvinyl alcohol/sodium alginate hydrogel microspheres for Cu(II) and U(VI) removal., 2018, 158: 309–318.
[20] HU SHU-HONG, LIN XIAO-YAN, ZHAO WEN-HUI,Efficient simultaneous removal of U(VI) and Cu(II) from aqueous solution using core-shell nZVI@SA/CMC-Ca beads., 2018, 315(2): 223–235.
[21] CHOE SANG-RAK, HALDORAI YUVARAJ, JANG SUNG- CHAN,Fabrication of alginate/humic acid/Fe-aminoclay hydrogel composed of a grafted-network for the efficient removal of strontium ions from aqueous solution.,2018, 9: 285–293.
[22] CHO EUNBEE, KIM JONGHO, PARK CHAN-WOO,Chemically bound Prussian blue in sodium alginate hydrogel for enhanced removal of Cs ions.., 2018, 360: 243–249.
[23] AGBOVI HENRY-K, WILSON LEE-D. Flocculation optimization of orthophosphate with FeCl3and alginate using the Box–behnken response surface methodology., 2017, 56(12): 3145–3155.
[24] LIU XIN, CHEN CHANG-FENG, YE HONG-WU,One-step hydrothermal growth of carbon nanofibers and insitu assembly of Ag nanowire@carbon nanofiber@Ag nanoparticles ternary composites for efficient photocatalytic removal of organic pollutants., 2018, 131: 213–222.
[25] PANG HONG-WEI, HUANG SHU-YI, WU YI-HAN,Efficient elimination of U(VI) by polyethyleneimine-decorated fly ash.., 2018, 5(10): 2399–2407.
[26] HU TAO, LIU QIN-ZE, GAO TING-TING,Facile preparation of tannic acid-poly(vinyl alcohol)/sodium alginate hydrogel beads for methylene blue removal from simulated solution., 2018, 3(7): 7523–7531.
[27] MAHDAVINA GHOLAM-REZA, MOUSANEZHAD SEDIGHEH, HOSSEINZADEH HAMED,Magnetic hydrogel beads based on PVA/sodium alginate/laponite RD and studying their BSA adsorption., 2016, 147: 379–391.
[28] WU YI-HAN, LI BI-YUN, WANG XIANG-XUE,Magnetic metal-organic frameworks (Fe3O4@ZIF-8) composites for U(VI) and Eu(III) elimination: simultaneously achieve favorable stability and functionality., 2019, 378: 122105–122117.
[29] LIU XIA, WANG XIANG-XUE, LI JIA-XING,Ozonated graphene oxides as high efficient sorbents for Sr(II) and U(VI) removal from aqueous solutions., 2016, 59(7): 869–877.
[30] ZHU HONG-SHAN, YUAN JIN-YUN, TAN XIAO-LI,Efficient removal of Pb2+by Tb-MOFs: identifying the adsorption mechanism through experimental and theoretical investigations.,2019, 6(1): 261–272.
[31] WU YI-HAN, LI BI-YUN, WANG XIANG-XUE,Determination of practical application potential of highly stable UiO-66- AO in Eu(III) elimination investigated by macroscopic and spectroscopic techniques.., 2019, 365: 249–258.
[32] YU SHU-JUN, YIN LING, PANG HONG-WEI,Constructing sphere-like cobalt-molybdenum-nickel ternary hydroxide and calcined ternary oxide nanocomposites for efficient removal of U(VI) from aqueous solutions., 2018, 352: 360–370.
[33] XIA WEI, CHEN XING-XING, KUNDU SHANKHAMALA,Chemical vapor synthesis of secondary carbon nanotubes catalyzed by iron nanoparticles electrodeposited on primary carbon nanotubes., 2007, 201(22/23): 9232–9237.
[34] SHENG GUO-DONG, YANG PENG-JIE, TANG YAN-NA,New insights into the primary roles of diatomite in the enhanced sequestration of UO22+by zerovalent iron nanoparticles: an advanced approach utilizing XPS and EXAFS., 2016, 193: 189–197.
Carbothermic Synthesis of Carbon-supported Zero-valent Iron Material for Removal of U(VI) from Aqueous Solution
WANG Jiaqi1, PANG Hongwei2, TANG Hao2, YU Shujun2, ZHU Hongtao1, WANG Xiangxue1,2,3
(1. Hebei Key Lab of Power Plant Flue Gas Multi-Pollutants Control, Department of Environmental Science and Engineering, North China Electric Power University, Baoding 071003, China; 2. MOE Key Laboratory of Resources and Environmental Systems Optimization, College of Environmental Science and Engineering, North China Electric Power University, Beijing 102206, China; 3. Fundamental Science on Nuclear Wastes and Environmental Safety Laboratory, Southwest University of Science and Technology, Mianyang 621010, China)
With the development of nuclear power, radioactive pollutants discharge into the environment and then contaminate soil and water resources. Nanoscale zero-valent iron (nZVI) materials are widely used in water remediation due to their strong reducibility and high removal efficiency. A carbon-based zero-valent iron material (Fe-CB) was prepared in this work. Fe-CB was fabricated using sodium alginate (SA) as a carbon sourceone-step carbothermic method and then applied to eliminate U(VI) from aqueous solution. Its mechanism and adsorption properties of Fe-CB and U(VI) were studied by spectroscopic analyses and macroscopic experiments. The results illustrated that Fe-CB possessed of ample functional groups (such as –OH and –COOH) and high BET surface area, which made up for the dispersibility and low removal efficiency of nanoscale zero-valent iron (nZVI). The removal of U(VI) by Fe-CB achieved equilibrium in 3 h and the maximum sorption capacity was 77.3 mg·g–1at 298 K. XPS analyses indicated that the U(VI) removal by Fe-CB was a synergistic effect of reductive adsorptive processes. Adsorption process resulted from surface complexation and the reduction process was dominated by U(VI) reduction to U(IV) by nZVI. The results show that Fe-CB can be used as an inexpensive and highly efficient pollutant scavenger, which has great potential for environment pollution management.
zero-valent iron; carbon material; uranium; adsorption; reduction
X591
A
1000-324X(2020)03-0373-08
10.15541/jim20190378
2019-07-23;
2019-09-05
国家自然科学基金(21876048, 21906052, 21836001); 中央高校基本科研业务费专项资金(2018ZD11, 2018MS114); 核废物与环境安全国防重点学科实验室开放基金(17kfhk01)
National Natural Science Foundation of China (21876048, 201906052, 21836001); The Fundamental Research Funds for the Central Universities (2018ZD11, 2018MS114); The Open Foundation of Fundamental Science on Nuclear Waste and Environmental Security Laboratory (17kfhk01)
王佳琦(1996–), 男, 硕士研究生. E-mail: wjqncepu@163.com
WANG Jiaqi(1996–), male, Master candidate. E-mail: wjqcepu@163.com
王祥学(1976–), 讲师. E-mail: xxwang@ncepu.edu.cn
WANG Xiangxue, lecturer. E-mail: xxwang@ncepu.edu.cn
