应用SS-PCR技术设计种特异性引物快速鉴定瓜实蝇
2020-04-13黄振郭琼霞陈韶萍
黄振 郭琼霞 陈韶萍
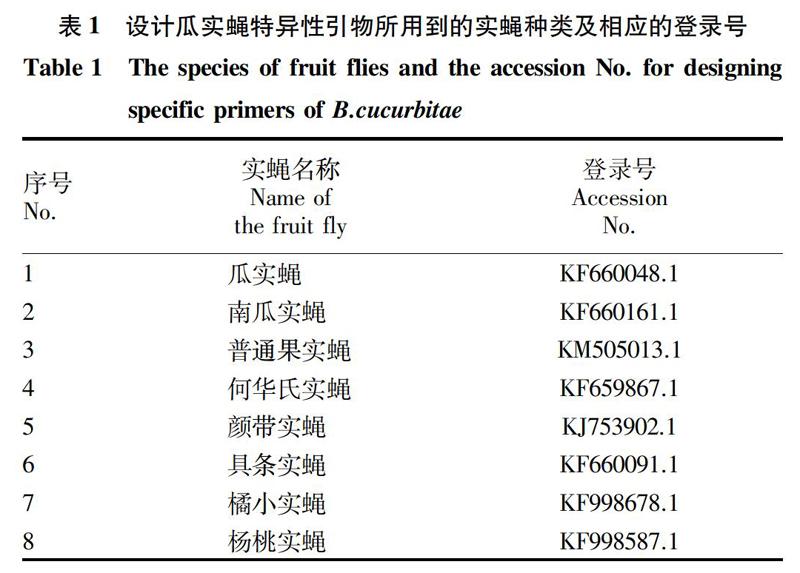


摘要 [目的]为了促进果蔬进出口贸易和快速通关,防止瓜实蝇[Bactrocera cucurbitae(Coquillett)]进一步传入扩散,迫切需要开展适合实蝇快速鉴定技术的研究。[方法]应用SS-PCR技术,基于mtDNA COⅠ序列,设计了1对能够准确鉴定瓜实蝇的种特异性引物GF85和GR531。选用瓜实蝇作为阳性对照,南瓜实蝇[B.tau(Walker)]、具条实蝇[B.scutellata(Hendel)]等其他19种待测实蝇作为阴性对照,提取供试虫样基因组DNA,并进行PCR扩增和电泳检测。[结果]仅虫样瓜实蝇能在约447 bp位置扩增出一条清晰且单一的条带,其余的虫样未出现条带。[结论]将该试验建立的SS-PCR鉴定方法应用于实际进出境果蔬截获和疫情监测的虫样的鉴定,并得到验证,表明该方法具特异性、稳定性强,可在实际的实蝇鉴定工作中应用。
关键词 瓜实蝇,mtDNA COⅠ,种特异性引物,SS-PCR,快速鉴定
中图分类号 S433文献标识码 A
文章编号 0517-6611(2020)06-0083-04
Abstract [Objective]In order to promote the import and export trade of fruits and vegetables and rapid customs clearance,prevent further damage from Bactrocera cucurbitae(Coquillett),there is an urgent need to develop a rapid identification technology suitable for the fly.[Method]A pair of primers, GF85 and GR531, was designed and synthesized based on the mtDNA CO I sequence.B.cucurbitae(Coquillett) was chosen as the positive control and other 19 species of fruit flies including B.tau (Walker),B.scutellata (Hendel) and so on were used as the negative controls, for the PCR amplification and gel electrophoresis.[Result]Clear and single 447 bp band was amplified only in B.cucurbitae(Coquillett),but not in the other 19 fruit flies.[Conclusion]The SSPCR identification method established in this experiment has been applied and verified in inspection and quarantine, indicating that this method has high species specificity and can be applied in infestation monitoring and quarantine surveillance of fruit flies in ports.
Key words Bactrocera cucurbitae(Coquillett),mtDNA COI,Speciesspecific primers,Speciesspecific PCR (SSPCR),Rapid identification
瓜實蝇[Bactrocera cucurbitae(Coquillett)]是我国进境果蔬中的重要检疫性害虫,隶属于双翅目(Diptera)实蝇科(Tephritidae)果实蝇属(Bactrocera)。1913年,瓜实蝇在印度被 Bezzi 首次报道,目前分布于亚洲的巴基斯坦、尼泊尔、斯里兰卡、菲律宾、中国以及其他东南亚国家和地区,非洲的喀麦隆、埃及、肯尼亚、毛里求斯、坦桑尼亚等国家,大洋洲的澳大利亚、新几内亚、马里亚纳群岛和夏威夷群岛、所罗门群岛、罗塔、关岛群岛、瑙鲁以及南太平洋岛屿和美国南部[1]。在中国,主要分布在西南、华南、华东的部分地区以及台湾、香港等地区[2]。瓜实蝇寄主范围很广,主要有番石榴、桃、无花果、甜瓜、西瓜、辣椒、菜豆、苦瓜、南瓜和番茄等葫芦科和茄科等植物,为害种类超过120种[3]。
近年来,由于国际贸易日渐频繁,合作领域不断拓宽,进境果蔬种类、数量不断增加,给瓜实蝇的进一步传入带来了潜在危险[4~5],而在进境果蔬中截获到的实蝇均为幼虫、卵或蛹,从外观形态往往难以对其进行正确的种类识别。为了促进果蔬进出境贸易,加快口岸通关速度,以及疫情监测中实蝇虫样的快速鉴定,亟需开展实蝇的快速鉴定识别技术。
应用SS-PCR分子生物学技术快速鉴定害虫种类,不仅能解决传统的形态学分类方法难以解决的问题,而且不受卵、幼虫、蛹等不同虫态和虫体组织的影响。近年来,分子生物学技术被广泛运用于昆虫的鉴定中[6-7]。目前,线粒体DNA mtDNA CO Ⅰ 被越来越多地应用于实蝇近缘种的系统发育研究中[8-9]。
为了实现对口岸截获的疑似瓜实蝇的卵、蛹、幼虫、成虫及虫体组织的准确鉴定,笔者基于SS-PCR(speciesspecific PCR)技术,拟筛选设计种特异引物快速鉴定瓜实蝇的方法,应用于口岸的实际检疫和疫情监测。
将GF85和GR531利用NCBI数据库提供的Primer-BLAST程序检查同源序列,最终将正向引物GF85的第8个碱基A颠换成T,第11个碱基A转换成G,第17个碱基T颠换成A,反向引物GR531的第2个碱基T转换成C,第3、4个碱基C转换成T,确定出引物GF85和GR531(图2)。
2.3 引物种特异性与灵敏度
2.3.1 引物种特异性。
通过对选择的GF85和GR531种特异性引物进行扩增,结果表明只有阳性对照瓜实蝇在约447 bp的位置扩增出了一条清晰且明显透明的条带,其余19种供试的实蝇均未见任何目标条带,试验重复3次结果一致,结果表明设计的GF85和GR531种特异性引物有较强的特异性和稳定性(图3)。
将试验所获得的PCR产物通过英潍捷基(上海)贸易有限公司测序,将结果提交NCBI数据库进行BLAST比对,试验表明该段序列与数据库中的瓜实蝇序列完全一致。
2.3.2 引物灵敏度。
采用核酸蛋白分析仪对提取的瓜实蝇DNA模板的浓度进行测试,浓度为21.62 ng/μL。取DNA模板的不同浓度测定最低检出阈值,结果表明模板浓度降低,扩增出的条带呈逐渐变淡的趋势,稀释至10-1倍后,仍可见有明显条带,表明该方法具有较高的灵敏度(图4)。
2.4 方法与验证
采用SS-PCR快速鉴定瓜实蝇的方法,鉴定从福建口岸进境的水果中截获的瓜实蝇虫样21份,均能扩增出目标条带(图5),结果表明该试验鉴定结果与形态学的鉴定结果一致,所以应用SS-PCR技术设计种特异性引物快速鉴定瓜实蝇方法具有较好的稳定性,能够在检疫鉴定工作中准确鉴定出瓜实蝇,并可作为口岸进出境果蔬检疫和实蝇疫情监测鉴定工作的重要依据。
3 讨论
3.1 实蝇的快速鉴定是困扰口岸检疫人员的突出问题
实蝇类害虫种类的快速鉴定是检验检疫的重要工作,也是困扰口岸检疫人员的突出问题。实蝇类害虫是果蔬的重要害虫,在口岸进境的果蔬中经常被截获到的多为其卵、幼虫、蛹。目前传统果实蝇属昆虫的识别主要以成虫的形态特征为重要鉴定依据,成虫前各个时期的虫态(卵、幼虫、蛹)的鉴定特征不稳定或不明显,无法进行快速鉴定,直接影响果蔬进出口贸易和快速通关。
3.2 引物的特异性是快速准确鉴定种类的关键
以分子生物学技术进行检疫性害虫种类鉴定的研究开发不受昆虫发育时期、残体的影响。昆虫分子的快速鉴定研究、发展与应用为检疫害虫的及时鉴定提供了快捷而准确的途径,有效促进果蔬贸易快速通关,防止检疫性实蝇传入以及进一步传播扩散的前提。张长禹[9]利用3种分子标记对瓜实蝇、柑橘大实蝇、南瓜实蝇、橘小实蝇、具条实蝇这5种实蝇的分子系统发育进行分析与分子快速鉴定研究,但因为分子标记技术对环境因子变化较为敏感,扩增产物的可重复性相对较差,结果的可靠性低,因此目前已较少使用。该试验建立的SS-PCR技术由CO I 标记技术转化而来,具有重现性强、谱带单一等优点,适宜于大规模快速检测分析。该试验选用mtDNA CO Ⅰ作为标记基因[10],选择与瓜实蝇序列较为一致的8种实蝇的同源序列,设计了能快速鉴定出瓜实蝇的特异性引物。采用该试验设计的引物GF85和GR531对供试的20种实蝇进行PCR扩增,仅瓜实蝇能扩增出一条长度约447 bp的单一且清晰的目标条带,其余的实蝇种类均无一条带出现,同时,通过对截获的瓜实蝇的幼虫、蛹和饲养的成虫以及部分虫样的验证,其均与成虫形态分类结果一致,GF85和GR531引物能特异地鉴定出瓜实蝇。该试验所设计的引物的特异性试验表明尽管截获的是卵、幼虫、蛹或是残体,只要能提取到微量DNA,就能快速准确地鉴定到种。所以,SS-PCR检测鉴定方法的灵敏度至关重要。
3.3 SS-PCR方法可用于瓜实蝇的特异鉴定 试验所建立的SS-PCR鉴定瓜实蝇的方法具有快速简便、特异性高、灵敏度高等优点,能检测到的DNA模板浓度可低至2.162 ng/L。同时,该SS-PCR检测鉴定方法在实际检疫工作中也得到应用和验证。此外,SS-PCR分析技术操作简便快捷,缩短了通关时间,提高了工作效率。因此,该技术方法可用于瓜实蝇的特异鉴定,并在害虫检疫与检测监测中具有重要应用价值。
参考文献
[1] PRABHAKAR C S,MEHTA P K,SOOD P,et al.Population genetic structure of the melon fly, Bactrocera cucurbitae (Coquillett)(Diptera: Tephritidae) based on mitochondrial cytochrome oxidase (COI) gene sequences[J].Genetica, 2012, 140(1/2/3): 83-91.
[2] 梁广勤,杨国海,梁帆,等.亚太地区寡毛实蝇[M].广州:广东科技出版社,1996:222-223.
[3] 歐剑峰,黄鸿,吴华,等.瓜实蝇国内研究概况[J].长江蔬菜,2008(13):33-37.
[4] 黄振,黄可辉.检疫性害虫——瓜实蝇在中国的适生性研究[J].武夷科学,2013,29(1):177-181.
[5] 黄振.果实蝇属重要种的鉴定、人工饲料筛选、适生性预测和风险分析[D].海口:海南大学,2010.
[6] 陈韶萍,黄振,郭琼霞,等.实蝇类害虫分子鉴定研究进展 [J].生物安全学报,2014,23(3):151-155.
[7] 黄可辉, 郭琼霞, 虞赟, 等.分子标记法在昆虫学研究中的应用[J].华东昆虫学报, 2005, 14(2): 109-114.
[8] JAMNONGLUK W, BAIMAI V,KITTAYAPONG P.Molecular evolution of tephritid fruit flies in the genus Bactrocera based on the cytochrome oxidase I gene[J].Genetica,2003,119:19-25.
[9] 张长禹.五种实蝇的分子系统发育分析与分子快速鉴定研究[D].武汉:华中农业大学,2007.
[10] 黄振,陈韶萍,谢婧,等.应用种特异性PCR技术快速鉴定辣椒实蝇[J].昆虫学报,2015,58(4):460-466.
