深圳地区血红蛋白G的分子特征与血液学表型*
2020-04-13李育敏金潇张宇英张力军陈亚琼覃俊龙张秀明
李育敏,金潇,张宇英,张力军,陈亚琼,覃俊龙,张秀明
(深圳市罗湖区人民医院a.医学检验科,b.感染管理科,广东深圳518001)
异常血红蛋白病是由于珠蛋白基因缺陷导致珠蛋白分子的一级结构发生改变引起的一组遗传性血红蛋白病[1]。血红蛋白G(HbG)病于 1954 年由 Edington等[2]首次报道。我国流行病学调查显示,在中国人群中发现的HbG种类有Hb G-Honolulu(Hb G-Chinese)、Hb G-Taipei、Hb G-Coushatta、Hb G-Waimanalo、Hb G-San José、Hb G-Siriraj和Hb G-Makassar等,南方地区以Hb G-Honolulu和Hb G-Taipei为主,北方以Hb G-Coushatta和Hb G-Taipei为主[3-10]。目前报道中国人群HbG病个别类型的临床表型的案例较少[7,10]。鉴于不同类型的HbG可位于同一毛细管电泳分区内,并可由α珠蛋白基因或是β珠蛋白基因缺陷所致,需通过DNA测序才能鉴定其类型,本研究通过筛查72 397例毛细管电泳样本,对所检出的异常血红蛋白进行珠蛋白基因序列分析,总结和分析鉴定出的HbG的分子特征和血液学表型,为血红蛋白疾病的筛查和遗传咨询提供参考。
1 对象和方法
1.1研究对象 连续选择2016年6月至2019年5月来我院门诊和住院且检测血红蛋白电泳者共72 397例。
1.2标本采集 采集各研究对象就诊时的外周静脉血2 mL,EDTA-K2抗凝,2~8 ℃保存,用于红细胞参数,血红蛋白电泳分析,地贫基因和DNA测序检测。
1.3仪器与试剂 Capillarys2全自动毛细管电泳仪及其配套试剂 (法国Sebia公司);XN-1000血细胞分析仪及其配套试剂(日本Sysmex公司);T960扩增仪(中国黑马公司);ChemiDocTMMP全自动凝胶成像分析仪(美国Bio-Rad公司);DYY-6C型电泳仪(北京六一仪器厂);YN-H16恒温杂交仪及其配套试剂(深圳亚能公司);3730XL遗传分析仪(美国ABI公司)。
1.4血液学分析 采用毛细管电泳法进行血红蛋白分析,电泳图分为Z1~Z15区,分区鉴别Hb条带的类型,并分析各条带所占相对比例的含量。对毛细管电泳检出的异常血红蛋白样本采用全自动血液分析仪进行各项红细胞参数分析,检测指标为Hb、MCV和MCH。以上检测均按照仪器及试剂盒说明书进行。MCV参考区间为82~100 fL,MCH参考区间为27~34 pg,Hb参考区间为成年男性:130~175 g/L;成年女性:115~150 g/L[11]。
1.5地贫基因检测 对毛细管电泳检出的异常血红蛋白样本采用Gap-PCR法检测3种中国人群常见的缺失型α地贫基因(--SEA、-α3.7和-α4.2);采用PCR-RDB法检测常见的3种非缺失α地贫基因(αQS、αCS、αWS)和17种β地贫基因点突变类型(-28、-29、CD17、CD41-42、CD43、βE、CD71-72、IVS-Ⅱ-654、-32、-30、CAP、Initiation condon、CD14-15、CD27-28、IVS-Ⅰ-1、IVS-Ⅰ-5、CD31)。以上检测操作及结果判读均按照仪器及试剂盒说明书进行。
1.6珠蛋白基因序列分析 珠蛋白基因测序由深圳亚能公司检测。对毛细管电泳检出的异常血红蛋白样本采用PCR法扩增α1、α2和β珠蛋白基因[12-13];采用Sanger双脱氧链终止法进行珠蛋白基因序列测定;采用Vector NET 8.0软件进行测序结果比对,于人类异常血红蛋白和地中海贫血数据库(http://globin.bx.psu.edu)查找突变位点。
1.7统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料用均数±标准差表示。以P<0.05为差异有统计学意义。
2 结果
2.1HbG的分子特征 经珠蛋白基因序列分析,共鉴定出6种异常HbG(图1),发生率为0.047%(34/72 397),发生于α链的为Hb G-Honolulu(15例)和Hb G-Waimanalo(2例),发生于β链的为Hb G-Taipei(9例)、Hb G-Coushatta(5例)、Hb G-San José(2例)和Hb G-Siriraj(1例),其中3例为新生儿(2例Hb G-Taipei和1例Hb G-Coushatta),其余均为成人。除1例Hb G-Honolulu合并βIVS-Ⅱ-654及αIVS-Ⅱ-55(G→T)突变杂合子(图2A),2例Hb G-Honolulu合并βIVS-Ⅱ-81(C→T)突变杂合子(图2B)和1例Hb G-Honolulu合并αCD118(+TCA)突变杂合子(图2C)外,其余均为单纯HbG杂合子。

注:A,Hb G-Honolulu;B,Hb G-Waimanalo;C,Hb G-Taipei;D,Hb G-Coushatta;E,G-San José;F,Hb G-Siriraj;↓,突变位点。
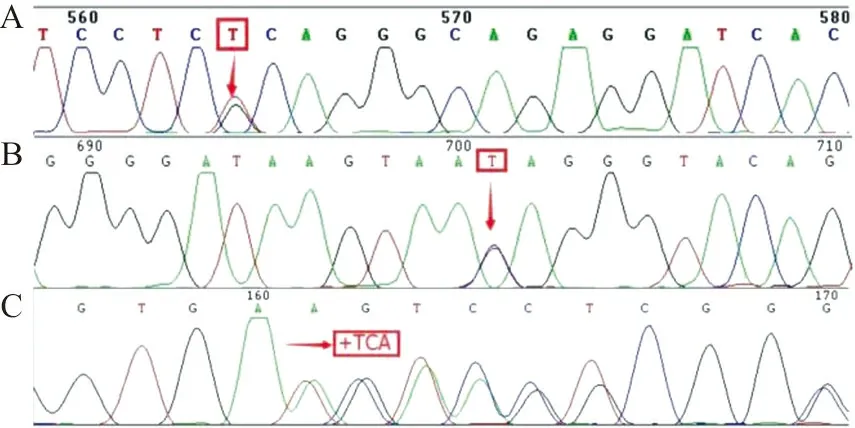
注:A,IVS-Ⅱ-55;B,IVS-Ⅱ-81;C,CD118;↓,突变位点。
图2 IVS-Ⅱ-55、IVS-Ⅱ-81和CD118突变的DNA测序结果
2.2血液学表型分析 成人各类型单纯HbG杂合子、Hb G-Honolulu合并βIVS-Ⅱ-81突变杂合子和Hb G-Honolulu合并αCD118突变杂合子的Hb、MCV、MCH和HbA2均正常;Hb G-Honolulu合并βIVS-Ⅱ-654及αIVS-Ⅱ-55突变杂合子的MCV和MCH均降低,HbA2升高,以上各类型的HbG含量见表1。毛细管电泳分析示新生儿Hb G-Taipei的含量为(2.3±0.6)%;Hb G-Coushatta的含量为4.1%,其余见表2。
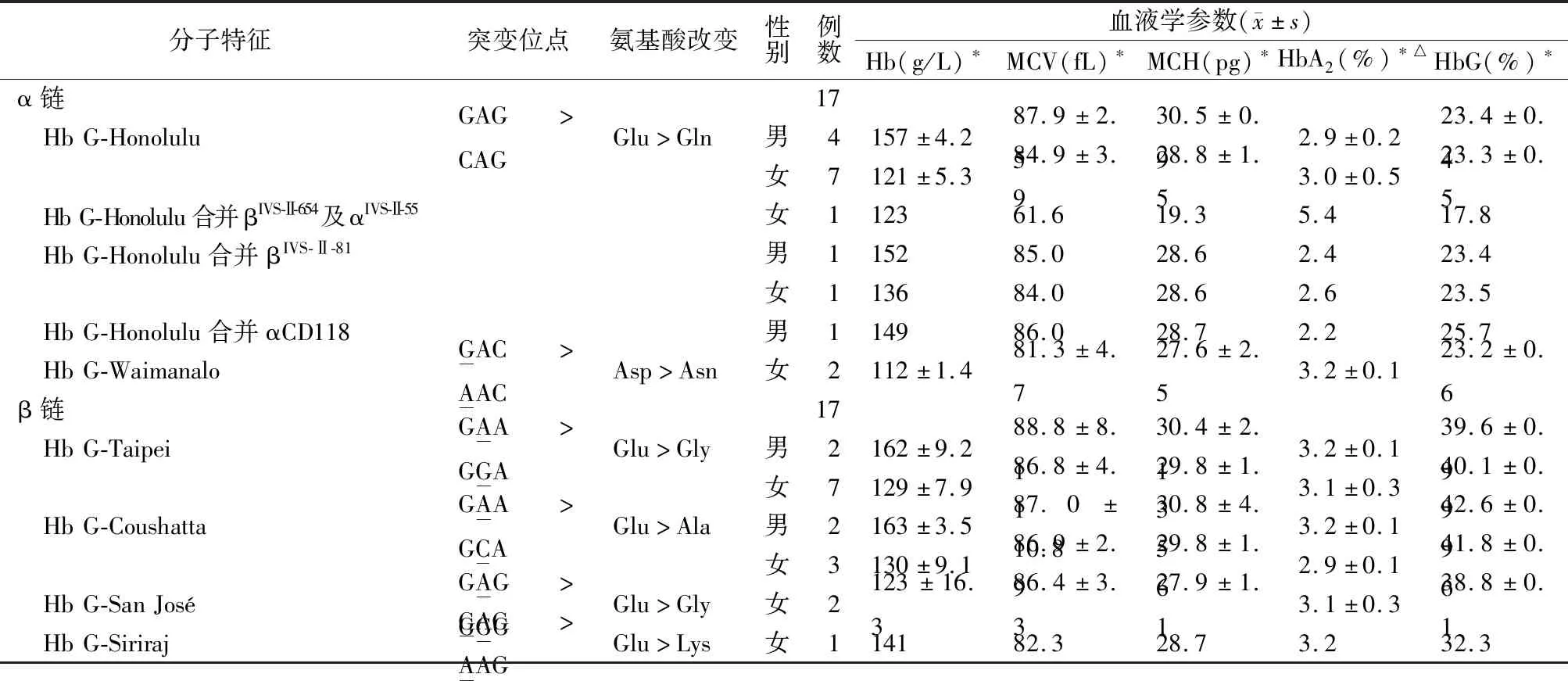
表1 成人不同HbG类型的血液学表型
注:*,以上指标在本院检验科检测;△,α链HbG的HbA2为HbA2+变异体,β链为HbA2。

表2 3例新生儿HbG杂合子的毛细管电泳分析
注:*,以上指标在本院检验科检测。
3 讨论
本次研究共纳入深圳地区72 397例样本进行大规模的群体异常血红蛋白病筛查,结果显示HbG的发生率为0.047%,共发现了6种HbG类型,与我国南方地区HbG的种类分布相符合[3-7]。本次调查发现2种位于α链的HbG,分别为G-Honolulu和Hb G-Waimanalo,均为杂合子,以Hb G-Honolulu为主,占44.1%,发生率为0.021%。Hb G-Honolulu(Hb G Chinese)于1958年由Vella等[14]在新加坡华人中首次发现。笔者曾报道Hb G-Honolulu在深圳地区α链异常血红蛋白中分布最高[7]。Hb G-Waimanalo于1971年由Blackwell等[15]首先在美国夏威夷具有菲律宾血统的人群中发现。两者均广泛分布于我国南方地区[3-7]。本研究显示两者的单纯杂合子临床表型均正常,HbG的含量均在23%左右,与HbVar记录相符合。另外,本研究发现了1例Hb G-Honolulu合并βIVS-Ⅱ-654和αIVS-Ⅱ-55杂合突变,1例Hb G-Honolulu合并βIVS-Ⅱ-81杂合突变,以及1例Hb G-Honolulu合并αCD118杂合突变。βIVS-Ⅱ-654、αIVS-Ⅱ-55和βIVS-Ⅱ-81突变位点均发生于内含子上。内含子由于不形成翻译产物,不受自然选择的压力,可能比外显子累积更多的突变。而发生于珠蛋白基因非编码内含子区域的突变通常是影响mRNA剪切使珠蛋白链合成受限,因此,目前在HbVar 数据库上记录的影响血红蛋白功能的大部分内含子突变也位于剪接位点。IVS-Ⅱ-654(C>T)突变即是由于内含子序列发生改变影响了转录后的正常剪切,产生异常剪接产物使β链合成减少,属于β+地贫。IVS-Ⅱ-81突变(HBB:c.315+81C>T)在HbVar记录发生于印度人群,可能为中性多态性位点。笔者[7]也曾报道1例Hb Queens合并βIVS-Ⅱ-81杂合突变,其表型正常。IVS-Ⅱ-55(G>T)突变尚未在HbVar记录,但其突变发生于内含子的非剪接位点。笔者[16]曾报道单纯αIVS-Ⅱ-55杂合突变的临床表型正常。以上研究提示αIVS-Ⅱ-55和βIVS-Ⅱ-81均可能为中性多态性位点,不影响珠蛋白基因的表达,其合并单纯Hb G-Honolulu杂合子的临床表型正常。因此,本例Hb G-Honolulu合并βIVS-Ⅱ-654和αIVS-Ⅱ-55携带者符合轻型β地贫特征,表现为MCV、MCH降低和HbA2升高,但其Hb G-Honolulu含量较单纯Hb G-Honolulu杂合子降低,这可能与βIVS-Ⅱ-654杂合突变导致β珠蛋白基因表达减少有关。由于未进行家系调查,尚不清楚其Hb G-Honolulu和IVS-Ⅱ-55是否发生于同一条α链。同样,本例Hb G-Honolulu合并βIVS-Ⅱ-81杂合突变的临床表型正常。CD118突变(HBA1:c.357_358insTCA)发生于α1基因,在HbVar上未见记录,但在中国人群中有报道,属于α+地贫[1]。笔者[7]曾报道Hb Ube-2合并αCD118杂合突变的表型正常,表明CD118突变对珠蛋白基因的功能影响较小,其合并同样不影响血红蛋白功能的异常血红蛋白的临床表型正常。因此,本研究中的Hb G-Honolulu合并αCD118携带者的表型正常。
本研究发现位于β链的HbG有4种,分别为Hb G-Taipei、Hb G-Coushatta、Hb G-San José和Hb G-Siriraj,均为杂合子,以前两者为主,各占26.5%和14.7%,发生率分别为0.012%和0.007%。Hb G-Taibei由Blackwell等[17]于1967年首先在中国台湾汉族人群中发现;Hb G-Coushatta由Vella等[18]于1958年首先在美国印第安人群中发现;两者广泛分布于我国南方和北方地区[4-10]。本研究显示Hb G-Taipei、Hb G-Coushatta、Hb G-San José和Hb G-Siriraj单纯杂合子的临床表型均正常,前三者HbG的含量均在40%左右,Hb G-Siriraj的含量相对较低,为32.3%,与HbVar记录及王妍等[8]报道相符合。
本研究还发现了2例新生儿Hb G-Taipei杂合子,其HbG的含量为(2.3±0.6)%;以及1例新生儿Hb G-Coushatta杂合子,其HbG的含量为4.1%。新生儿地贫筛查是地贫防控的重要环节之一,本研究提供的临床资料对新生儿血红蛋白疾病的筛查具有参考价值:第一,不同年龄段的血液学参数不同,新生儿与成人的血红蛋白条带存在明显差异;第二,脐带血血红蛋白电泳分析在新生儿地贫筛查中较传统的红细胞脆性试验及血细胞分析筛查效果更佳[19];第三,本研究显示新生儿的以上两种HbG的含量均较低,在(1.8~4.1)%之间,提示临床应注意鉴别新生儿HbG的毛细管电泳特征,必要时可做DNA测序鉴定其类型,并与其他异常血红蛋白进行区别。
