CuZnTiO2/SAPO-34双功能催化剂的设计、制备及其用于CO2加氢制烯烃性能
2020-04-11陈静宇张建红盛浩吴大凯高新华马清祥张建利范素兵赵天生
陈静宇,张建红,盛浩,吴大凯,高新华,马清祥,张建利,范素兵,赵天生
(省部共建煤炭高效利用与绿色化工国家重点实验室(宁夏大学),宁夏银川750021)
低碳烯烃(C2~C4烯烃)是重要的有机化工原料,主要由石脑油[1]裂解和轻质烷烃脱氢[2-3]路线制得。为缓解对石油资源的依赖,以煤炭、天然气、生物质等非石油资源为原料,直接或间接制备烯烃技术发展迅速[4]。CO2作为一种廉价的碳源,通过加氢反应制备烯烃不但可以将CO2充分利用,减少对环境造成的污染,也可推动C1化学的发展[5-6]。该过程可由两条路线实现:①CO2经逆水煤气变换与费托合成制烯烃路线,受Anderson-Schulz-Flory(ASF)分布制约,C2~C4烃选择性低于60%[7-8],如式(1)、式(2);②CO2在双功能催化剂上经甲醇合成与甲醇脱水(MTO 反应)制烯烃路线,可打破ASF 分布限制,大幅度提高目标产物选择性[9],如式(3)、式(4)。
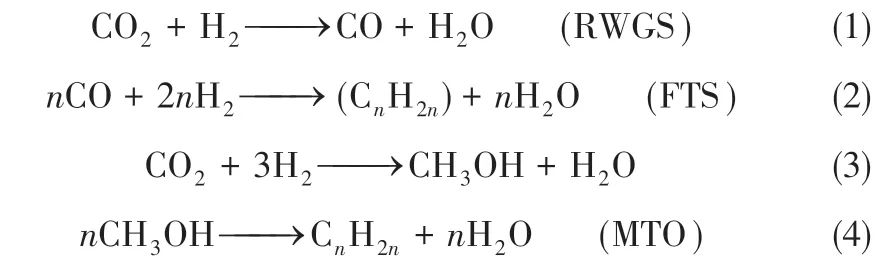
CO2加氢双功能催化剂设计路线中,第一步成醇反应所用材料集中于非Cu 基催化剂,如Zr-Zn[10]、In-Zr[11]等作为成醇催化剂。该类催化剂与分子筛耦合(OX-ZEO),实现串联反应高选择性地制取低碳烯烃,且显著降低副产物CH4选择性。在Cu 基复合催化剂如Cu-Zn-Cr/HY[12]、Cu-Zn-Zr/Zeolite[13]上,产物分布多以烷烃为主。目前在Cu基催化剂上实现两步反应的耦合高选择性制取低碳烯烃的相关报道较少。基于两步反应机理,在加氢能力较强的Cu 基双功能催化剂上,通过探究CO2活化成醇与固体酸催化剂的耦合机制、酸性调控,也可实现目标产物的高选择性。因此,探究Cu 基双功能催化剂上影响两步反应耦合的影响因素和作用机理,对于指导高效催化剂的设计具有重要意义。
传统甲醇合成Cu-Zn基催化剂的研究多以助剂载体的改性为主[14-15]。Nomura 等[16-17]提出CO2加氢制甲醇反应中,在Cu-Zn基催化剂中两性助剂的添加可提高反应活性和甲醇选择性。两性助剂有Al2O3、ZrO2和等。在CO加氢反应中,Cu-ZnO/Al2O3具有较高的催化活性。但在CO2加氢反应中,由于Al2O3载体亲水性强,Cu-ZnO/Al2O3催化性能低于Cu-ZnO/ZrO2催化剂[19]。ZrO2助剂在CO2加氢制甲醇反应中研究较多,有较好的反应活性和甲醇选择性[20-21]。TiO2助剂在两性载体中效果最好,可抑制副产物CO的生成[22]。TiO2与ZrO2同为ⅣB族的氧化物,物理化学性质较为相似,在CO2加氢制烯烃两步反应中,有望通过调变催化剂的酸性以及水煤气变换活性,实现产物分布的有效调控。
因此,本研究在传统甲醇合成Cu-Zn 催化剂研究基础上,通过助剂TiO2改性增大助剂与活性组分的协同作用,避免活性中心毒害,提高催化剂的稳定性,从而提高中间产物甲醇的选择性,降低副产物CO产量。然后,进一步复合SAPO-34催化剂,SAPO-34 催化剂对低碳烯烃的活性和选择性最好,可以实现100%的甲醇转化率和90%的轻烯烃选择性,同时没有烃类的生成,催化剂在乙烯和丙烯工业生产中具有广阔的应用前景[23]。因此成醇-脱水路线制取低碳烯烃,固体酸催化剂选用SAPO-34 最佳。实现两步反应的耦合,提高烯烃选择性。金红石型TiO2具有吸水性弱、化学性质和热稳定性好等优点[24]。实验采用金红石型TiO2作为第一步成醇Cu-Zn基催化剂载体,通过机械混合的耦合方式与固体酸催化剂SAPO-34混合,调变两类活性中心的含量以及固体酸酸性的强弱,探究了CuZnTiO2/SAPO-34 复合催化剂对CO2加氢制低碳烯烃反应性能的影响。同时,通过对两种活性中心颗粒混合、分层填装等混合方式的研究,探究了两类活性组分接触距离对反应产物分布的影响。
1 实验材料和方法
1.1 材料
硝酸铜[Cu(NO3)2·3H2O]、硝酸锌[Zn(NO3)2·6H2O]、金红石型TiO2、CTAB[C16H33(CH3)3NBr]均为分析纯。异丙醇铝(C9H21AlO3),阿拉丁试剂;四乙基氢氧化铵25%水溶液C8H21NO,麦克林试剂;磷酸(H3PO4),含量≥85%;硅溶胶(质量分数40%);去离子水H2O(超纯水机及预处理系统,艾柯)。
1.2 制备方法
1.2.1 CuZnTiO2催化剂的制备
催化剂制备采用浆态并流共沉淀法[24],称取2g金红石型TiO2粉末分散在去离子水中,加入用乙醇溶解后的0.4g CTAB。在50℃恒温水浴条件下,搅拌0.5h,使其充分混合均匀。将总浓度为1.0mol/L的Cu(NO3)2·3H2O、Zn(NO3)2·6H2O混合溶液(Cu/Zn摩尔比为2∶1)与浓度为1.0mol/L的Na2CO3溶液,通过蠕动泵逐滴滴加到已分散均匀的TiO2溶液中,保持溶液pH 在8 左右。混合溶液滴加结束后继续搅拌1h。搅拌结束后,在室温下老化过夜,经洗涤,干燥,400℃下焙烧5h,催化剂命名为CZT。
1.2.2 SAPO-34催化剂的制备
SAPO-34 原料为铝源、磷源、硅源和结构导向剂(SDA)。元素摩尔组成为1.0Al2O3∶1.0P2O5∶0.6SiO2∶2.0TEAOH∶60H2O。将异丙醇铝、磷酸、去离子水在室温下混合搅拌2h,然后加入TEAOH和硅溶胶的混合溶液。滴加结束后,将混合溶液在水浴温度为80℃中搅拌4h,直到得到均匀的凝胶。将这种凝胶在室温下老化24h,然后转入聚四氟乙烯内衬的不锈钢反应釜中,在200℃下晶化48h。晶化结束后,骤冷,用去离子水进行离心、洗涤。在120℃下干燥,550℃中煅烧6h。原位金属改性的Zn-SAPO-34 分子筛,按Zn/Al 摩尔比为0.1,加入到混有异丙醇铝、磷酸、去离子水的混合溶液中进行搅拌,其余制备过程重复SAPO-34的制备过程。
1.2.3 复合催化剂的制备
(1)机械混合 将CZT 与SAPO-34 的粉末以不同比例充分研磨在一起,再压片至20~40 目,命名为CZT/(Zn-)SAPO-34。
(2)颗粒混合 分别将CZT 与SAPO-34 压至20~40目,质量比为1∶1,然后均匀混合。
(3) 分 层 填 装 将20~40 目 颗 粒CZT 与SAPO-34用石英棉隔开,石英棉上层为CZT颗粒,下层为SAPO-34颗粒,质量比为1∶1装入反应管中。
1.3 催化剂表征
各类催化剂物相表征在Bruker D/MAX2200PC型X射线衍射仪(XRD)上进行,Cu靶,Kα射线,λ=0.154Å 的光源波长,管电压40kV,管电流40mA,3°~85°扫 描,扫描速度2°/min,步宽0.01°。催化剂形貌通过电子扫描显微镜(SEM),型号ZEISSEVO18 在30kV 工作电压下观察其形貌。傅里叶变换红外FTIR 用于测定样品中的官能团,该实验在德国布鲁克TENSOR27 红外光谱上进行。将KBr与待测样品混合,在研钵中充分研磨,其中KBr与样品的质量比为100∶1,扫描范围为4000~400cm-1,扫描速率32/s,分辨率2/cm。催化剂比表面积、孔容测定在Quantachrome,Autosorb-iQ型N2吸附仪中-196℃下进行测量,将样品在He 气流中处理,然后在300℃下脱气3h。比表面积通过多点Brunauer-Emmett-Teller (BET) 方程计算。通过BJH (Barrett-Joyher-Halenda) 模型计算中孔。根据Horvath-Kawazoe(HK)模型计算微孔。
CO2程 序 升 温 脱 附(CO2-TPD) 实 验 在MicromeriticsAutoChemII2920 上进行。50mg 样品在400℃,10%H2/Ar 气氛中,流速30mL/min 预处理1h。然后在He 气氛中降温至50℃,开始吸附CO2直至饱和。脱附条件为50~500℃,载气He升温速率为10℃/min。程序升温脱附(NH3-TPD)在TP-5080吸附仪上进行酸量分析,样品量为100mg。样品在550℃He 气中预处理1h(He 气流速40mL/min)。然后,在常温下用NH3吸附样品,使其饱和。在120℃He 流速下吹扫样品1h,去除物理吸附的NH3,此时从120℃下进行升温,速率为20℃/min 时,记录NH3从120℃到650℃的脱附曲线。在AutoChem Ⅱ2920 仪器上分析催化剂还原性能(H2-TPR)。将50mg 样 品 用He (30mL/min) 在350℃下处理1h,然后冷却至50℃。样品通过10%H2/Ar 混合气体以30mL/min 的流速处理。然后,样品以10℃/min的升温速率从50℃线性增加至600℃,同步记录还原曲线。
1.4 催化剂性能评价
CO2加氢催化活性评价在小型固定床反应器上进行,装填示意图如图1所示。催化剂装填在不锈钢反应管中(内径8mm,长度400mm,催化剂体积1mL),底部装有适量石英棉,催化剂置于加热炉恒温区,热电偶固定在催化剂的床层中心位置,催化剂上方填有适量海砂,以达到稳定气流的目的。
反应前,通入还原气(30%H2+70%N2)将样品常压还原6h(GHSV=1000h-1,T=350℃)。待达到指定温度后开始反应,反应条件:H2/CO2=3(摩尔比),GHSV=3000h-1,T=380℃,P=2MPa。

图1 催化剂装填示意图
在线产物分析采用气相色谱(GC9160-I):TCD检测器(TDX-01填充柱)、FID检测器(Al2O3毛细管柱)。液相产物经离线分析,在具有2m GDX-401 填充柱的气相色谱仪(GC9160-Ⅱ)上分析。所述柱连接TCD 检测器用于水相产物分析。采用校正面积归一化法计算各组分的含量,TCD与FID结果用甲烷关联做归一化处理。
2 实验结果与讨论
2.1 催化剂物相结构
图2(a)为Zn 改性前后SAPO-34 的XRD 谱图。图2(a)中曲线a 在2θ=9°、21°和31°附近均出现了SAPO-34的衍射特征峰。图2(b)中曲线b,经Zn改性的SAPO-34 催化剂与未改性的SAPO-34 特征衍射峰位置一致[25],且没有杂峰出现,表明改性后的催化剂仍保持了SAPO-34分子筛的结构。
图2(b)为Zn 改性前后SAPO-34 的FTIR 光谱,用于测定分子筛的骨架结构。由图可知,在波数4000~400cm-1范 围 内,分 子 筛Zn-SAPO-34 与SAPO-34 具有基本相同的骨架振动吸收谱带,说明金属改性并没有破坏SAPO-34 的基本骨架。与XRD 表征[图2(a)]分析结果一致。在497cm-1、620cm-1处的峰为SiO4四面体和D-6 元环的T O 弯曲振动;730cm-1和1109cm-1处的峰为P O(或Al O)的对称伸缩振动以及O P O的非对称伸缩振动;其中,D-6 元环为对应于CHA 型骨架,说明成功合成了SAPO-34分子筛[26]。在1400cm-1处的峰可归因为煅烧后残留模板剂中 CH3的弯曲振动[27],而在1640cm-1处的峰为物理吸附在SAPO-34表面上的水[28]。在羟基基团范围内(3000~4000cm-1),在3200~3600cm-1较宽的振动带为桥羟基Si OH Al,并且在该基团上产生SAPO-34的Brønsted酸位点[29-30]。Zn-SAPO-34 分子筛在730cm-1处的峰明显向高波数方向偏移,Xu等[31]认为该处峰的变化可视为金属离子进入骨架证据之一。

图2 (Zn-)SAPO-34的XRD谱图和FTIR谱图,CZT、TiO2以及复合催化剂的XRD谱图
图2(c)为金属氧化物、复合样品的XRD 谱图。曲线c 是纯TiO2的特征衍射峰,2θ=27°、36°和55°处为金红石型TiO2特征衍射峰[31];曲线d 为CZT 的XRD 谱图,具有明显的金红石型TiO2特征衍射峰,在2θ=36°、39°、49°、61°和68°出现的峰归属于CuO 的特征衍射峰,在2θ=32°、34°、36°、57°和63°出现的峰归属于ZnO的特征衍射峰。曲线e、曲线f 表明,机械混合后(Zn-)SAPO-34、CZT 催化剂物相结构并未发生改变。
2.2 催化剂表面吸附行为
图3 为不同CZT/SAPO-34 配比催化剂的CO2-TPD 谱图。由图可知,样品均在50~500℃范围内出现三个CO2脱附峰。其中,α 峰位可归为催化剂表面的弱碱性位(50~200℃),β 为中强碱性位(225~325℃),γ为强碱性位(350~500℃)。不同CZT/SAPO-34 配比催化剂上α 峰脱附温度几乎相同,随CZT 含量增加,α 峰脱附峰面积增加,而β峰脱附峰面积减小,且峰位向高温偏移;单一CZT在γ 位出现较强的CO2脱附峰,复合催化剂的强碱位脱附峰向高温偏移,表明CZT/SAPO-34 复合催化剂的碱性增强。
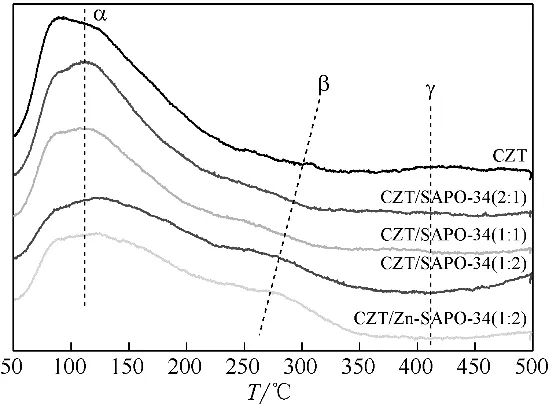
图3 不同CZT/SAPO-34比例催化剂的CO2-TPD谱图
图4 为催化剂的NH3-TPD 谱图。由图4 可知,CZT表面无强酸、弱酸位点;SAPO-34分子筛具有弱酸与强酸峰,对应峰温分别为172℃、389℃。结合酸量分析(表1)可知,Zn 改性的Zn-SAPO-34样品强酸量明显降低,弱酸、总酸量增加。弱酸量的增加,有利于低碳烯烃选择性的提高以及催化剂反应寿命的延长[32]。CZT 与Zn-SAPO-34 复合后均出现弱酸与强酸峰,随SAPO-34 含量增加,弱酸量、强酸量均增加。当中间产物甲醇生成时,一定酸性有利于催化甲醇向低碳烯烃的转化[33-34]。

图4 催化剂的NH3-TPD谱图
2.3 催化剂还原行为
催化剂的还原行为(H2-TPR)如图5 所示,有效检测铜基催化剂的还原能力。所有样品均在200~350℃范围内有一个H2消耗峰,均为催化剂CuO 中Cu2+→Cu+、Cu+→Cu0过程的还原[35],同时说明在350℃的还原处理条件下均可实现催化剂的完全还原。CZT 样品还原峰温在234℃左右;与SAPO-34 复合后,耗氢峰明显向低温方向移动,表明复合催化剂促进了CuO的还原。
2.4 织构性质

图5 催化剂的H2-TPR还原曲线

表1 不同样品的NH3-TPD酸量
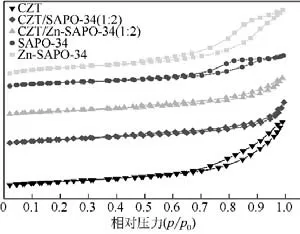
图6 催化剂N2等温吸附-脱附曲线
图6为催化剂的N2等温吸附-脱附曲线。CZT、CZT/SAPO-34、CZT/Zn-SAPO-34 样品在相对压力p/p0值为0~0.4 时,N2吸附量均较为缓慢,变化不明显。当相对压力p/p0值在0.4~1.0 时,吸附量逐渐增加,由于毛细管凝聚现象,与脱附曲线形成滞后环,等温吸附线为IV 型[36],表明样品均存在一定量的介孔。SAPO-34和Zn-SAPO-34样品等温吸附-脱附曲线均为IV型[37]。在相对压力p/p0较低时,吸附量较大,为微孔典型特征[38]。当p/p0值在0.4~1.0时,出现滞后环,样品均存在介孔。
表2为催化剂样品的比表面积、孔容、孔径相关参数。CZT比表面积为36m2/g,SAPO-34分子筛比表面积为493m2/g。经Zn改性后,分子筛的比表面积有所降低,为416m2/g,孔容有所增加。当CZT 与SAPO-34 机械混合后,比表面积均高于CZT。高表面积有利于在两步串联反应中暴露更多活性位点并促进反应传质,提高催化性能[39]。催化剂CZT 孔径为2.86nm,属于介孔范围,且与N2等温吸附-脱附曲线类型相符合。SAPO-34孔径为微孔,约0.45nm。
2.5 形貌
图7 为催化剂的SEM 照片。由图7 可知,CZT呈圆球颗粒状,为20~50nm,粒子之间存在聚集现象[图7(a)];SAPO-34 为立方体晶粒形貌,尺寸大小较为均一,为2~3µm[图7(b)];Zn-SAPO-34也具有与SAPO-34相同的立方体形貌,为2~3µm。CZT 与SAPO-34 机械混合[图7(d)]后均保持各自的形貌结构,CZT 纳米颗粒分散于SAPO-34 表面,与文献报道一致[10,40]。

表2 催化剂结构性质

图7 催化剂的SEM照片
2.6 催化活性对比
催化剂CO2加氢制低碳烯烃性能如表3(TOS=24h)和图8所示。CZT 催化剂在380℃下,逆水煤气反应严重,且加氢能力较强,导致反应产物以CO、CH4为主。其中,CO 主要由逆水煤气变换(reverse water gas shift,RWGS)反应产生;CH4的产生是由于CuO 加氢能力较强,甲醇(或CH2*物种)在CuO 活性位点上直接加氢产生的,见式(5)或式(6)[41-43]。
表3 催化剂催化活性数据
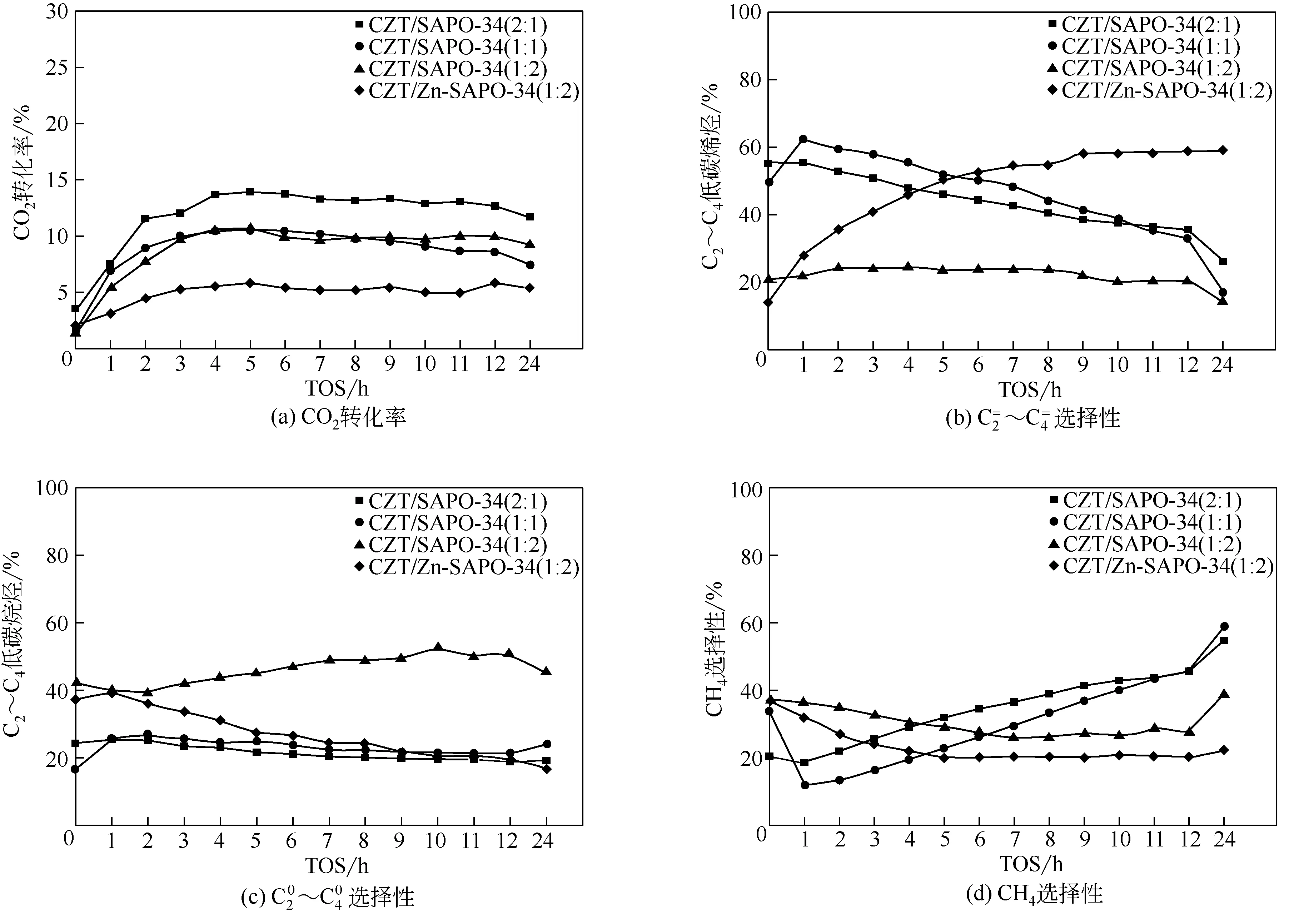
图8 复合催化剂CZT/SAPO-34质量比(2∶1)、(1∶1)、(1∶2)以及CZT/Zn-SAPO-34(1∶2)反应随时间变化性能谱图

与单一CZT 相比,复合CZT/SAPO-34 催化活性下降,见表3 和图8(a);产物中CO、CH4选择性均降低。其中CH4选择性明显下降,由95%降至39%,说明串联反应促进了两步反应的协同发生,抑制了甲醇在CZT 上的直接加氢反应。C+2烃的生成明显增加,C2~C4烯烃选择性从3%增加到26%。CZT/SAPO-34 比例不同,对烃分布的影响显著。随SAPO-34含量增加,C2~C4烯烃选择性随反应时间的进行均表现出下降趋势[图8(b)];CH4选择性下降[图8(d)]。当CZT/SAPO-34=1∶2时,C2~C4烯烃选择性变化趋于平稳。Zn 改性后的复合CZT/Zn-SAPO-34催化剂具有较低的CH4选择性,随着反应的进行,C2~C4烯烃选择性逐渐升高,最高达60%,C2~C4烷烃和CH4选择性逐渐降低,反应8h后趋于稳定。所有催化剂液相产物均未检测到甲醇。
对比CZT/SAPO-34(2∶1)、(1∶1)、(1∶2)催化剂,CZT含量较高时,反应初始C2~C4烯烃选择性较高,但产物不稳定,C2~C4烯烃、C2~C4烷烃都呈下降的趋势,CH4逐渐上升。当CZT含量降低时,C2~C4烯烃选择性趋于稳定,但C2~C4烷烃选择性升高。这与文献报道的Zr-Zn[10]、In-Zr[11]等催化剂产物分布有很大的不同,文献中金属氧化物含量较高时,产物选择性较好,较为稳定。此外,这也与前期实验中CuZnZrO2/SAPO-34[20]催化剂产物分布截然不同,当金属氧化物在一定范围内含量较多时,产物中C2~C4烯烃选择性最佳。分析造成产物分布差异性的原因可能是:高温下,CZT催化剂各组分间存在较强的相互作用,加氢能力也较强,生成的甲醇浓度较低,当CZT 与SAPO-34 机械混合后,初级产物甲醇主要在CZT 上直接加氢,生成甲烷,少量酸不足以促进反应的正向进行,如图8(d)所示。当酸量增大时,抑制了甲醇继续加氢,促进MTO 反应的进行,即两步反应存在竞争关系。
在传统MTO 反应中,甲醇进料体积分数在45%~99%。但在CO2加氢双功能催化剂上,甲醇生成的催化活性较低,且高温下逆水煤气变换反应较强,导致中间产物甲醇体积分数低于6%,因此,酸性的控制对低浓度甲醇脱水反应至关重要。表3中当SAPO-34 经Zn 改性后,强酸量显著降低,弱酸量增加,C2~C4烯烃选择性从14%增至59%,O/P值从0.3提高至3.5。酸量较多和酸性太强,均可加剧烯烃二次反应,产物以C2~C4烷烃为主。因此,在该反应中,适宜的酸量、较弱的酸性可促进反应向MTO方向进行,获得较高的低碳烯烃选择性。
文献研究表明,双功能催化剂上两种活性中心复合方式对产物分布影响较大[11,44]。因此,本实验进一步探究了活性组分复合方式对其催化性能的影响,图9 为催化剂反应24h催化活性数据。粉末机械混合[图9(a)],导致较高的CH4选择性,约59%,C2~C4烯烃选择性17%,O/P 值小于1;颗粒混合[图9(b)],CH4选择性明显下降,C2~C4烯烃选择性43%,O/P值约为1;颗粒分层填装[图9(c)],CH4选择性约为35%,较机械混合也明显下降,C2~C4烯烃选择性39%,O/P 值大于1。可见,两种活性中心之间距离逐渐增大,CH4选择性先降低、后升高,C2~C4烯烃选择性呈先增大后降低的趋势。这与文献报道的Zn-ZrO2/SSZ-13 催化剂产物选择性差异较大,文中认为活性组分间的距离越近,促进中间体进行第二步MTO 反应,C2~C4烯烃选择性越高[45]。
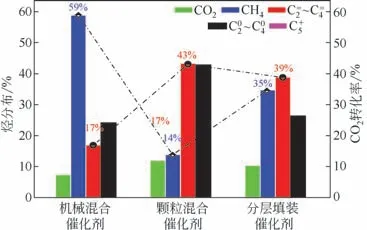
图9 活性组分的复合方式对催化性能的影响
进一步研究发现,在Cu 基复合催化剂上,两种活性中心距离越近,副产物选择性(CH4、C2~C4烷烃)越高。原因为:①Cu 基催化剂较其他类型催化剂相比,加氢能力较强,当两种活性中心距离较近或较远时,导致生成的甲醇中间体反复接触金属氧化物活性位点的可能性增加,造成甲醇继续加氢,CH4的选择性较高,当两种活性中心距离在适当范围内,可有效推动反应正向进行,抑制甲烷产生;②由于Cu的存在会加速烯烃的二次反应[42],因此两种活性中心距离太近,易造成初级烯烃二次加氢反应,导致大量烷烃生成,两者距离逐渐增大,烯烃选择性提高,如图9所示,三种不同方式混合后的O/P 值由0.7 增大到1 再继续增大到1.5,当初级烯烃与Cu 活性位点距离较远时,可大大降低二次反应,烯烃选择性显著提高。
3 结论
采用机械混合法制备的CZT/SAPO-34 复合催化剂,在CO2加氢两步路线制低碳烯烃反应中,促进了反应串联发生,产物分布中,甲烷、CO 选择性降低,低碳烯烃选择性提高。研究表明,以加氢能力较强的传统甲醇合成Cu 基为成醇活性中心,与SAPO-34耦合制备的双功能催化剂,实现了CO2加氢反应高选择性制取低碳烯烃。
(1)CZT/SAPO-34 以不同质量比机械混合,质量比为2∶1、1∶1 时,C2~C4烯烃选择性较高;但由于CZT较强的加氢能力,导致中间产物甲醇继续加氢,CH4选择性随反应延长逐渐升高,产物选择性变化较大。
(2)复合CZT/SAPO-34 催化剂酸量对产物分布影响显著。适宜的酸量可促进协同反应的发生,抑制副产物CH4的生成。当CZT/SAPO-34质量比为1∶2时,产物分布趋于稳定,C2~C4烯烃选择性约为14%。
(3)SAPO-34 经Zn 改性后,强酸量降低,弱酸量增加。CZT/Zn-SAPO-34 催化剂上C2~C4烯烃选择性可达60%;表明通过调控催化剂的酸量、酸性,可促进反应正向进行,显著提高C2~C4烯烃选择性。
(4)两种活性中心的复合方式研究表明,Cu基催化剂较强的加氢能力,采用机械混合法制备的催化剂发生显著的二次反应,导致大量烷烃的生成。通过两种活性中心距离的控制可抑制二次反应的发生、提高烯烃选择性。
