MALDI-TOF MS检测非小细胞肺癌基因突变研究进展
2020-04-11宋御繁王娜娜张婷陈英剑胡成进
宋御繁,王娜娜,张婷,陈英剑,胡成进
(1.中国人民解放军联勤保障部队第960医院检验科,济南 250031;2.山东第一医科大学&山东省医学科学院公共卫生学院,山东泰安 271016)
肺癌是全球范围内癌症死亡的主要原因之一[1]。肺癌患者中约85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。手术是早期NSCLC患者首选的治疗手段,但由于发病隐匿,约75%的患者就诊时已为晚期或出现局部转移[3],丧失最佳手术治疗时机。铂类双联的化疗方式可延长患者生存期,但晚期NSCLC患者预后极差,5年生存率低于17%[4]。随着基因分析与分子诊断技术的不断发展,越来越多的基因突变体成为癌症靶向治疗和预后评估的重要标志物,基于基因组变化的个体化治疗比传统治疗手段更有针对性[5]。迅速发展的基因检测技术让有限的肿瘤样本能够获得更广泛的分子分析,促使NSCLC患者个体化治疗的实施,基因突变筛查对提高NSCLC患者生存率、改善患者生活质量具有重要意义[6]。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)技术具有高通量、高灵敏度、高特异性及操作简便等特点,广泛应用于肿瘤分子研究,是对已知突变基因分型的有力方法[7]。
1 MALDI-TOF MS技术基本原理及特点
MALDI-TOF MS是一种新型软电离生物质谱分析技术,目前该技术可应用于基因突变检测、基因多态性研究、微生物鉴定、肿瘤生物学标志物检测以及筛查、微小残留病变预后风险评估、药物研发及监测等方面。其基本原理是将样品分散在基质分子中形成晶体,当用激光照射晶体时,基质从激光中吸收能量传递给生物分子,样品解吸附使生物分子电离,离子在电场作用下加速飞过真空飞行管道,通过飞行时间(TOF)质量分析器进行质谱分析。在固定的动能下,质量小的离子“飞行”速度较快,可先到达检测器,质量大的离子“飞行”速度较慢,到达检测器的时间长,根据到达检测器的飞行时间不同来测定离子的质荷比(m/z),进一步确定分子量。最终通过相关专用软件分析,绘制出特异性指纹图谱。
相较于其他质谱技术,MALDI-TOF MS有其独特的优点:(1)灵敏度高,可为亚微克级样本提供信息;(2)准确度高,测量相对分子质量(Mr)为1 000~3 000 Da的分子时,准确度可达99.9%[8];(3)可识别并量化与特定基因突变相关的疾病或病理状况[9];(4)兼容性强,可与其他质谱技术相结合,如液相色谱技术、双向电泳及磁珠技术等[10];(5)可检测血清、血浆、尿液、支气管洗脱液、脑脊液、细胞裂解液等各种分泌物,并可直接分析组织切片;(6)高通量检测,速度快;(7)无标记检测,成本消耗低。MALDI-TOF MS的高特异性和准确性使其有可能克服其他生物化学技术和免疫分析局限性[11-12],准确反映被测样本中的分子情况,为临床实验室的常规检测和患者个体化治疗提供了新的策略,对临床实践十分有吸引力。
2 MALDI-TOF MS检测非小细胞肺癌常见基因突变
从根本上说,癌症是由基因变异或表观遗传改变引起的遗传性疾病。然而,由于肿瘤异质性,即使是相同病理类型的肿瘤患者对治疗反应也可能不同[13],因此,癌症基因组学中的分子诊断对于制定针对性治疗决策必不可少。NSCLC是实体恶性肿瘤在精准医学个体化治疗方面的代表性实例[14]。在NSCLC中,相当高比例的患者呈现广泛的基因组不稳定性,这种不稳定性发生在不同水平时,可成为肿瘤发生的主要驱动力[15-16]。其中,表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)和鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)等是NSCLC重要的驱动基因,在非小细胞肺癌靶向治疗中起着重要作用[17-18]。目前可通过不同的分子方法来检测非小细胞肺癌基因突变,如Sanger测序、扩增阻滞突变系统PCR(ARMS-PCR)[19]、实时荧光定量PCR、焦磷酸测序、新一代测序(NGS)和MALDI-TOF MS技术等,各自具体的特点见表1。其中Sanger测序作为基因检测金标准,在检测基因突变时对至少20%的等位基因突变敏感性较低[20]。其他方法灵敏度较高,但大多受限于样本质量,对样本肿瘤细胞含量有较高要求。而MALDI-TOF质谱系统是一种有效的体细胞突变分析方法,能够在有限的肿瘤组织样本中实现分子谱分析,对DNA质量要求低,能够进行多重基因检测及突变频率的定量,同时可以将高灵敏度和高特异性的优势与简便的样本处理相结合,显示出作为临床分子诊断工具的极大潜力。
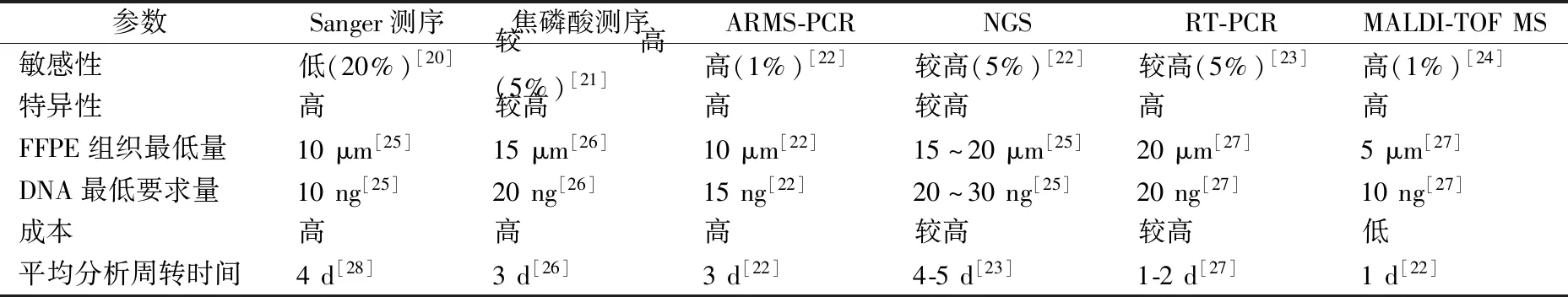
表1 各种基因突变检测方法特点比较
2.1MALDI-TOF MS检测EGFR基因突变EGFR基因突变作为NSCLC发现的第一个治疗靶点,是目前研究最深入、最成功的治疗靶点。最新研究表明,EGFR是亚太地区和俄罗斯地区NSCLC中最常见的驱动基因,发生率为49.3%[29]。EGFR基因突变主要发生在18、19、20和21号外显子上,其中21号外显子p.L858R位点突变和19号外显子p.E746_A750del缺失突变约占90%[30]。研究证实,EGFR基因突变是NSCLC患者选择接受EGFR-TKIs的治疗依据,21号外显子L858R位点突变及19号外显子缺失患者对EGFR-TKIs治疗反应良好,而20号外显子T790M点突变患者对EGFR-TKIs存在耐药性[31]。NSCLCEGFR突变检测已成为临床常规检测项目之一,对改善患者预后及个体化治疗具有重要意义。Min等[32]使用3种不同方法检测107例NSCLC患者经福尔马林固定石蜡包埋(FFPE)组织样本EGFR突变状态,结果发现MassARRAY MALDI-TOF MS技术、焦磷酸测序和肽核酸钳制法(PNAc)的EGFR突变检出率分别为56.1%、48.6%和45.8%。MALDI-TOF MS技术灵敏度为85.7%,明显高于焦磷酸测序和肽核酸钳制法(PNAc)的74.3%和70%,对NSCLC患者中是否存在EGFR突变具有较强的鉴别能力。Shepherd等[33]将经过RT-PCREGFR突变检测的532例NSCLC患者肿瘤DNA通过MassArray MALDI-TOF MS技术重复检测,结果显示,两种方法检测样本EGFR突变的总体符合率为93.2%,其中14例患者通过MassArray MALDI-TOF MS检测到EGFR突变阳性,均为常见的19、20、21号外显子突变,而RT-PCR方法未检测到EGFR基因突变。Giannini等[34]通过传统的Sanger测序和MALDI-TOF MS技术平行评估2 387例NSCLC患者EGFR突变率,结果显示,Sanger测序检测DNA含量低或受损的样本的灵敏度较低,与之相比,MALDI-TOF MS检测样本突变成功率则明显升高。采用多靶基因检测技术检测后,MALDI-TOF MS检测EGFRL858R突变的检出率提高了约1倍。Su等[35]采用类似方法对45例NSCLC患者FFPE组织样本进行EGFR突变检测,结果发现MALDI-TOF MS和Sanger测序结果一致,具有100%的分析灵敏度和特异性,其失败率低至0.1%,且MALDI-TOF MS分析平均周转时间(TAT)为3 d,能够有效缩短整体治疗决策时间,适用于临床管理。
2.2MALDI-TOF MS检测ALK基因突变 间变性淋巴瘤激酶(ALK)融合是NSCLC独特的分子亚群,约3%~7%的NSCLC具有ALK染色体重排,是继EGFR基因之后发现的又一重要驱动基因。最常见的融合基因是棘皮动物微管相关蛋白样4(echinodermmicro tubule associated proteinlike 4,EML4)[36]。EML4与ALK均位于2号染色体短臂上,两基因通过逆位融合形成1个新的EML4-ALK基因。一项PROFILE系列的临床研究证实[37],EML4-ALK融合患者对酪氨酸激酶抑制剂克唑替尼的反应率和疾病控制时间均明显好于化疗。ALK融合阳性患者对克唑替尼的反应率可达60%~80%,而对化疗药物的反应率仅为30%~40%。《中国表皮生长因子受体基因突变和间变淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南》建议:病理诊断为NSCLC中肺腺癌或含有腺癌成分的患者均应进行ALK融合基因检测[38]。Sakai等[39]使用MassARRAY iPLEX MALDI-TOF MS分析NSCLC患者的FFPE样本,检测到EML4-ALK变体1的清晰质量峰,并通过PCR产物亚克隆和测序证实了每个样本阳性结果的准确性。MALDI-TOF MS技术能够以高灵敏度检测9种不同的EML4-ALK变异类型。目前免疫荧光原位杂交(FISH)是临床ALK融合基因检测的标准方法,但其不能区分ALK基因变异的类型,且操作复杂,价格昂贵。与FISH相比,MALDI-TOF MS分析能够在少量NSCLC FFPE组织中区分不同的EML4-ALK变体,是检测EML4-ALK变异类型的有力工具。
2.3MALDI-TOF MS检测KRAS基因突变KRAS基因突变是NSCLC中重要的新兴标志物,在全球肺癌驱动基因分布中,KRAS突变排例位居前列。最常见的是2号外显子第12或13位发生突变,约占KRAS突变类型的85%~90%。Sherwood等[40]使用基于MassARRAY iPLEX MALDI-TOF MS技术分析238个非小细胞肺癌患者FFPE肿瘤样本,并将结果与ARMS-PCR检测到的数据进行比较,两种方法检测样本KRAS突变率的总体一致性百分比为99.1%,此外,MALDI-TOF MS技术还检测到19%存在KRAS突变的患者同时伴有其他突变,并证实其中最常见的是肿瘤抑制基因TP53、PIK3CA和CDNK2A。Giannini等[41]通过检测NSCLC患者的KRAS突变,发现MALDI-TOF MS和焦磷酸测序检测KRAS突变率分别为31.7%和28.7%,且在手术样本、小组织活检、细胞学样本中,MALDI-TOF MS技术检测的KRAS突变率分别为37.9%、31.7%和32.7%,而焦磷酸测序检测的突变率分别为34.2%、28.8%和29.0%,由此看出,MALDI-TOF MS技术检测肿瘤样本突变率明显提高。
2.4MALDI-TOF MS检测其他基因突变EGFR和ALK酪氨酸激酶抑制剂在EGFR突变和ALK融合患者中的成功应用,将晚期NSCLC引入了靶向治疗的时代。近年来,NSCLC的基因组研究发现了其他潜在的治疗靶点,包括ROS1重排、RET融合、MET扩增,以及BRAF、HER2、PIK3CA、ERBB2、NRAS、KIT突变等。携带这些基因组变化的NSCLC可能作为其他适应症或临床开发药物的靶点,具有潜在的临床治疗意义。Wen等[42]采用Sequenom MALDI-TOF MS检测NSCLC患者19个基因238个热点突变,结果发现携带KIT基因突变的患者均存在其他突变,如BRAF、EGFR、PIK3CA、HRAS和AKT等,其中最常见的共存突变基因是EGFR。存在PIK3CA突变的患者也通常伴有EGFR或KRAS突变。有学者通过RT-PCR验证了MALDI-TOF MS多基因突变检测结果,发现在RT-PCR所检测的热点突变中,MALDI-TOF MS与传统的RT-PCR检测结果几乎一致。另有研究发现,组织DNA量会影响分析结果:当10%以上的等位基因出现突变,使用5 ng DNA即可检测到突变;但当等位基因突变频率低于10%时,使用至少10 ng DNA才会检测到突变。Bonaparte等[43]进一步验证了DNA量对检测结果的影响。为了确定能检测到的突变频率低的基因所需的最小DNA量,参照HORIZON参考标准,使用分别含EGFRG719A、EGFRL861Q、EGFRT790M、KRASQ61L、BRAFV600E突变的50 ng DNA进行连续稀释(50%、10%、5%和2.5%),发现MALDI-TOF MS敏感性因检测的特定基因突变而异。检测EGFRG719A和T790M突变使用1.25 ng DNA即可,而EGFRL861Q、KRASQ61L和BRAFV600E突变需要5 ng DNA才可被检测到。Magliacane等[44]研发了一种基于MALDI-TOF MS多重基因分型平台PentaPanel,用于评估5个临床相关癌症基因(EGFR、KRAS、NRAS、BRAF、PIK3CA)的56个突变热点的单核苷酸多态性,结果显示,PentaPanel是一种强大的高通量平台,只需低至8 ng的DNA模板就能同时评估多种基因状态,可在一次运行中对10例选择靶向治疗的患者进行基因分型,实际周转时间仅为2个工作日。为了验证PentaPanel平台的准确性,该学者对所有研究样本进行Sanger测序。结果显示,两种方法总体一致率为97.8%,所有1 025个样本中经Sanger测序的不可分析样本数量为28个,成功率为97.3%,MALDI-TOF MS PentaPanel平台不可分析样本数量为5个,成功率高达99.5%,且PentaPanel MALDI-TOF MS平台的特异性为100%。MALDI-TOF MS技术可以为NSCLC相关基因突变分析提供即时、准确的多重检测方法。此外,其极高的灵活性可用于靶向治疗选择快速进行,具有发掘新的生物学标志物的潜力。
4 小结及展望
以上研究显示了MALDI-TOF MS的强大功能,但也面临着一系列挑战。首先,MALDI-TOF MS目前只能检测已知的基因突变;其次,当前基因突变研究分析的样本仍是以组织样本为主,液体活检作为驱动基因检测替代品的研究主要集中于EGFR检测方面,且样本量较少。然而对晚期NSCLC患者来说获取组织样本是一种侵入性操作,可能增加意外并发症的风险,无创的基因检测能够指导更为精准的个体化治疗。因此,作为一种非侵入性技术,MALDI-TOF MS检测外周血基因突变是一种新的策略,能够补充传统方法的不足之处,以增强MALDI-TOF MS作为高通量基因分型技术在基础应用和临床诊断中的地位,是肿瘤驱动基因检测新的发展方向,在NSCLC基因突变靶点精准检测中拥有广阔前景。
