一种绢纺原料除油微生物菌株的获得及除油性能研究
2020-04-10陈祥平程明丹方佳李乔兰肖露
陈祥平 程明丹 方佳 李乔兰 肖露


摘要: 从茧丝腐化液中筛选获得了一株脱油效率较高的菌株,经16S rDNA分子鉴定,命名为Enterobacter sp. TY4。对脱油菌株脱油条件进行了优化,获得了最适碳源为蔗糖、最适氮源为蛋白胨,最适C/N为0.25︰1,培养基最适pH 7.0,最适浴比和接种量分别为2︰125和1%。将脱油菌株TY4与一株脱胶菌株Aeromonas sp. TJ5进行共培养,对比了脱胶菌和除油菌同时接种与次序接种对重油茧丝脱胶除油效率的影响。结果表明,采用共培养方式和次序接种明显提高了脱胶脱油效率,残油率和脱胶率分别达0.48%和24.1%。
关键词: 重油茧丝;脱油;微生物群落;产气肠杆菌;脱胶脱油菌共培
中图分类号: TS195.2文献标志码: A文章编号: 10017003(2020)01001406
引用页码: 011103DOI: 10.3969/j.issn.10017003.2020.01.003
Study on the acquisition and deoiling performance of an oilremoving microbial
strain for raw materials of silk spinning
CHEN Xiangping1, CHENG Ming1, ZHENG Dan1, FANG Jia2, LI Qiaolan2, XIAO Lu2
Abstract: A bacterial strain with high deoiling efficiency was obtained from bave corrosive liquid, and was named Enterobacter sp. TY4 based on 16S rDNA molecular identification. The oilremoving conditions of TY4 were optimized, and the optimal carbon source, nitrogen source, C/N, pH, liquor ratio and inoculum size were sucrose, peptone, 0.25︰1, 7.0, 2︰125, and 1%, respectively. The oilremoving Enterobacter sp. TY4 and degumming Aeromonas sp. TJ5 were cocultured, and the effect of coinoculation and sequential inoculation of TY4 and TJ5 on oilremoving and degumming efficiencies was investigated. The results show that coculture and sequential inoculation greatly enhance the oilremoving and degumming efficiencies, with the rates of 0.48% and 24.1%, respectively.
Key words: heavy oil bave; deoiling; microbial community; enterobacter aerogenes; coculture of oilremoving and degumming bacteria
绢纺原料来自于丝绸工程剔除或产生的各类下茧、滞头、废丝、缫丝脚渣等。这些下脚原料含有程度不同且差异较大的丝胶、油脂、污染物和杂质,必须通过精炼整理去除油脂、大部分丝胶、蜡质等。除油问题(尤其是重油茧丝)一直都是绢绵制备的主要难题之一,目前常用的除油方法主要是化学法和生物法两种[13]。化学法主要包括利用有机溶剂除油、酸法除油及皂碱法除油等,但除油效果不理想,且污染环境。生物法(主要指腐化法)是一种传统的绢纺原料除油方法,属自然发酵法。它利用腐化液中多种微生物并存的混菌发酵体系,依靠微生物代谢分泌的酶达到除油的目的。该方法除油效果显著,但由于是混菌發酵,微生物培育条件及脱油过程控制困难,产品质量不稳定,而且生产周期长,劳动强度大,生产环境气味恶劣[47]。因此,筛选具有高效除油功能的微生物,将其应用于绢纺原料脱油处理,对于进一步改善精炼工艺、提高脱油效率、稳定产品品质具有重要意义。近年来,已有研究者分离筛选到高效脱油菌株,并利用脱油菌株或者产生的酶进行脱油,取得了良好的效果[89]。本文从茧丝腐化液中筛选获得了一株具有较高脱油效率的菌株,对其脱油条件进行了优化,并将其与脱胶菌株Aeromonas sp. TJ5共培养[10],探讨其脱胶除油效果。
1材料与方法
1.1材料
重油茧丝及腐化液(四川省南充银海丝绸有限公司)。
1.2试剂和仪器
细菌基因组DNA提取试剂盒(上海生工生物工程有限公司),2×PCR Master Mix、琼脂糖(北京天根生化科技有限公司),其余试剂均为国产分析纯。
BioRad S1000 PCR仪、GEL Doc+凝胶成像仪、OLYMPUS BH2光学显微镜(美国BioRad公司),NU6382E超低温冰箱(美国天美公司),DHP9082电热恒温培养箱(上海一恒实验仪器有限公司),CS501恒温培养摇床(上海富玛实验设备有限公司)。
1.3微生物及培养基
1)脱胶菌Aeromonas sp. TJ-5:从茧丝腐化液中筛选获得,经16S rDNA鉴定,保藏于中国典型培养物保藏中心[10]。
2)牛肉膏蛋白胨培养基:牛肉膏3g/L;蛋白胨10g/L;NaCl 5g/L;pH 7.0;121℃灭菌20min。
3)选择培养基:硝酸铵1g/L;磷酸二氢钾0.5g/L;磷酸氢二钠1.5g/L;氯化钠1g/L;七水硫酸镁02g/L;三丁酸甘油酯5mL;121℃灭菌20min。
4)种子培养基:牛肉膏蛋白胨培养基。
5)脱油基础培养基:牛肉膏蛋白胨培养基。
6)脱油脱胶共同培养基:蛋白胨20g/L;蔗糖25g/L;NaCl 5g/L;SDS 0.5g/L;pH 7.0;蔗糖于112℃灭菌15min;其余121℃灭菌20min,然后无菌操作下混合。
Study on the acquisition and deoiling performance of an oilremoving microbial strain for raw materials of silk spinning一种绢纺原料除油微生物菌株的获得及除油性能研究1.4方法
1.4.1脱油微生物的筛选
取100mL茧丝腐化液,离心(1000r/min,4℃)10min,收集上清液。上清液离心(10000r/min,4℃)10min后收集沉淀,沉淀用磷酸缓冲液(PBS,pH 8.0)离心(10000r/min,4℃)洗涤沉淀3次,将沉淀重悬于相同的PBS缓冲液中。取重悬液10mL加入牛肉膏蛋白胨培养基中富集培养12h。
初筛:取1mL富集培养液,经梯度稀释,均匀涂布于以三丁酸甘油酯为唯一碳源的选择培养基固体平板上,置于37℃培养箱中培养48h。根据菌落周围的透明圈直径(D)与菌落直径(d)之比(D/d),挑选比值较大的菌株进行下一步筛选[10]。
复筛:挑取初筛获得的菌株,接种至种子培养基中,于30℃培养箱中培养12h,作为活化的种子培养液。以1%的接种量将培养好的种子液接种至脱油基础培养基中,加入2g未脱油茧丝样品,置于30℃摇床中培养48h。脱油完成后,测定残油率。
1.4.2菌株16S-rDNA鉴定
离心收集培养至对数生长后期的菌体,采用细菌基因组DNA试剂盒提取菌株总DNA。采用细菌通用引物27f(5AGAGTTTGATCCTGGCTCAG3)和1492r(5TACGGCTAC CTTGTTACGACTT3)对总DNA进行PCR扩增,PCR扩增条件如下:变性94℃,1min,退火52℃,1min,延伸72℃,2min,循环30次[11]。扩增产物送至上海生工生物工程股份有限公司进行测序,将测序得到的16S rDNA序列用BLAST软件与GenBank数据库做相似性分析。
1.4.3菌株脱油条件的优化
分别考察了培养基碳源、氮源、C/N比、培养基pH值、接种量及装液量对脱油效果的影响。以1%的接种量接种菌株TY10至脱油基础培养基中,并加入2g茧丝样品,置于30℃摇床150r/min培养48h,测定茧丝残油率,分别考察不同的培养基及脱油条件对菌株脱油效果的影响。
1.4.4脱油菌与脱胶菌共培养对茧丝脱胶除油效果的影响
分别取在种子培养基中培养12h的脱胶菌TJ-5和脱油菌TY-4种子液,以1%的接种量接种至优化后的脱油培养基中,加入2g含油率为14%的重油茧丝样品中,并置于30℃摇床内培养48h。分别测定茧丝处理后的残油率及脱胶率。
1.4.5残油率的测定
将脱胶脱油处理后的茧丝取出,用水洗净,晾干后用滤纸包裹,放在索式抽提器中。加入75~100mL乙醚到150mL圆底烧瓶中,在恒温水浴中保持圆底烧瓶43℃温度,将冷凝管从索式抽提器的上端插入,通入冷凝水。回流后,取出样品,等待乙醚完全挥发,放入烘箱,在105℃烘3h,取出放入干燥器中,冷却至室温称重,即得脱油后样品的干重。提取的油和圆底烧瓶放入烘箱中3h后取出。在干燥器内冷却至室温后称重,减去球形瓶重即为油脂的质量[12]。
残油率的计算公式:残油率/%=烧瓶变化质量/(烧瓶变化质量+茧丝脱油后干重)×100。
1.4.6脱胶率的测定
取出脱胶脱油处理后的茧丝,冲洗、烘干;按照1.4.5的步骤将茧丝中剩余的油脂提取干净,取出茧丝,烘干,恒重。在烧杯中加入6g/L的碳酸氢钠溶液,同时加入恒重后的茧丝,在100℃条件下脱胶30min,期間不断搅拌,反应结束后取出,先用温水,再用冷水冲洗茧丝。重复上述步骤一次,将茧丝烘干后恒重,计算残胶率。根据脱胶处理前后损失的质量计算脱胶效率[13]。
2结果与分析
2.1脱油功能菌的筛选鉴定
以茧丝腐化液为研究对象,利用三丁酸甘油酯为唯一碳源,筛选脱油功能微生物。通过测定透明圈大小,选取透明圈直径与菌落直径之比较大的菌株,共计200余株,从中筛选20株进行进一步脱油实验(表1),其中菌株TY-4脱油效果最好,茧丝残油率达到0.71%,因此选择TY4进行后续实验。
菌株TY-4经活化后,提取基因组DNA,扩增获得其16S-rDNA核酸序列,将该序列与NCBI中的DNA序列进行比对,构建菌株系统发育树(图1),菌株TY4与Enterobacter aerogenes EA1509E属于同一分支,确定该菌株为产气肠杆菌(Enterobacter),命名为Enterobacter sp. TY-4。
2.2菌株TY-4脱油条件的优化
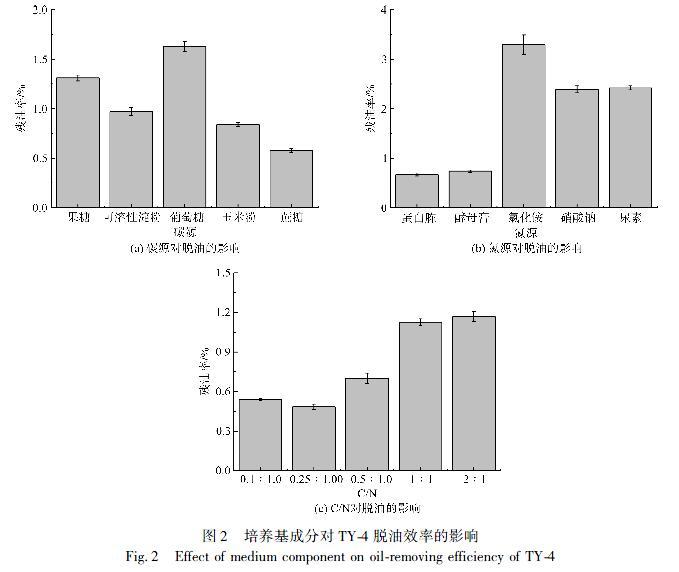
2.2.1培养基对脱油效果的影响
实验考察了培养基碳源、氮源和C/N对脱油效果的影响,如图2所示。图2(a)共选择了果糖、可溶性淀粉、葡萄糖、玉米粉、蔗糖5种碳源,TY4菌株对茧丝的脱油率与碳源的种类有很大关系。当葡萄糖为碳源时,脱油效果最差,说明速效碳源虽然比较容易利用,但是却不利于油脂的脱除。蔗糖作为碳源时,其残油率最低,为0.58%。同时,蔗糖价格便宜,来源广泛。因此,选择蔗糖作为碳源进行后续实验。
图2(b)分别使用蛋白胨、酵母膏、氯化铵、硝酸钠、尿素作为基本培养基的氮源,茧丝的残油率有较大差异,硝酸钠、氯化铵和尿素作为氮源时残油率较高,而蛋白胨和酵母膏作为氮源时残油率较低,说明菌株利用有机氮源脱油效果较好,这与郭磊[9]的研究结果一致。因此,选择蛋白胨作为氮源进行后续实验。
从图2(c)可以看出,茧丝的残油率随着碳氮比的增加先降低后增加,碳氮比在0.25︰1时残油率最低(0.49%)。因此,选择0.25︰1作为最适碳氮比。
2.2.2pH值对TY4脱油的影响
微生物的生长繁殖需要在合适的pH值条件下进行,本文考察了pH值对菌株脱油效率的影响,如图3所示。从图3(a)可以看出,随着培养基pH值的增加,残油率逐渐减小,在pH 9.0时残油率最低,达到0.27%。从图3(b)可以看出,在pH 7.0时菌体浓度最高,增加或者降低pH值细胞生物量显著下降。因此,在碱性条件下,残油率降低主要是由于茧丝里的蛹油会在碱性条件下发生水解,属于化学除油过程。陈慧[14]研究了一株红球菌属细菌X8的脱油工艺,在pH7.0时除油效果最优,残油率达到了126%。综合考虑,本文选择pH7.0为最适pH值。
2.2.3浴比和接种量对脱油的影响
浴比和接种量对菌株脱油效率的影响如图4所示。从图4(a)可以看出,残油率随着浴比的增加逐渐降低,而浴比为2︰125以后,残油率又有所增加。浴比对菌株脱油的影响可能与溶氧等有关,浴比过小,由于2g茧丝在摇瓶中所占空间较大,培养液可能不能没过茧丝,因此残油率会比较高。选择2︰125作为最佳的浴比,此时的残油率为0.44%。从图4(b)可以看出,当接种量为1%时,茧丝样品的残油率最小,为043%。因此,选择最适接种量为1%。
综上所述,通过对菌株TY4脱油条件进行优化,获得了最适的脱油条件为:最适碳源为蔗糖、最适氮源为蛋白胨、最适C/N为0.25︰1,培养基最适pH 7.0,最适浴比和接种量分别为2︰125和1%。在最适培养条件下进行脱油,重油茧丝残油率最低可达0.33%。
2.3脱胶菌和脱油菌共培养对茧丝脱胶除油的影响
为了进一步考察功能微生物在絹纺原料精炼工艺中的应用,将筛选获得的脱油菌TY4与脱胶菌TJ5进行共培养,考察两株菌共同作用对原料脱胶除油效率的影响。选用重油茧丝为研究对象,分别考察了菌株单独培养和共培养对茧丝脱胶率和残油率的影响,结果如图5所示。未接种菌株,茧丝脱油脱胶效果很差;单独接种菌株TY4或TJ5,茧丝或残油率高,或脱胶率低,前者脱胶率为12.8%,后者残油率为862%;共培养后,由于两种菌株的共同作用脱胶率和残油率都达较好水平,分别为22.53%和0.64%。因此,通过将脱油菌和脱胶菌共培养对含胶较高的重油茧丝进行脱胶除油能够取得较好的效果。
为了更好地提高重油茧丝脱胶除油效率,考察了脱油菌株和脱胶菌株同时接种共培养48h(TY+TJ48)和顺序接种(先接种TY4,发酵24h后,接种TJ5)再共培养24h(TYTJ24)两种工艺对茧丝脱胶和除油效果的影响,其结果见图6。从图6可以看出,与同时接种相比,采用顺序接种,残油率从072%降至0.5%,但脱胶率从18.3%降至14.0%,主要原因是脱胶时间减少。因此,将顺序接种后共培养时间增加至48h,残油率和脱胶率分别达到048%和24.1%。
3结论
1)利用透明圈法从茧丝腐化液中筛选获得了一株脱油效果较好的菌株TY4,通过16S rDNA测序对菌株进行了鉴定,确定该菌株为产气肠杆菌(Enterobacter),命名为Enterobacter sp. TY4。
2)通过对脱油菌株的脱油条件优化,获得了最适的碳源为蔗糖、最适氮源为蛋白胨、最适C/N为0.25︰1,培养基最适pH7.0,最适浴比和接种量分别为2︰125和1%。在最适培养条件下进行脱油,重油茧丝残油率最低可达0.33%。
3)通过脱油菌株TY4与脱胶菌株Aeromonas sp. TJ5的共培养实验及两种菌株不同接种方式的对比,结果显示共培养法对绢纺重油原料的脱胶和除油效果明显好于菌株单独作用,且次序接种更有利提高脱胶脱油效率,其最适共培养时间为48h,残油率和脱胶率分别达0.48%和24.1%。本实验为重油原料除油、脱胶、环保、精炼工艺研究奠定了基础。
参考文献:
[1]冯洁, 劳继红. 绢纺原料的除油方法[J]. 丝绸, 1999(5): 2830.
FENG Jie, LAO Jihong. Deoiling method of silk raw material [J]. Journal of Silk, 1999(5): 2830.
[2]封宝山, 林海涛, 蒋芳, 等. 不同脱胶除油工艺对丝绵性能影响的研究[J]. 丝绸, 2014, 51(9): 14.
FENG Baoshan, LIN Haitao, JIANG Fang, et al. An analysis on influence of different degumming and oil removal processes on silk floss properties [J]. Journal of Silk, 2014, 51(9): 14.
[3]SARMA Indrani. Degumming of muga cocoon with mycogenic extracellular protease and lipase enzymean alternative method for efficient reeling of silk [J]. Advances in Applied Science Research, 2015, 6(9): 716.
[4]劳继红, 叶圣于. 碱性脂肪酶对重油滞头原料的除油研究[J]. 丝绸, 2002(9): 2324.
LAO Jihong, YE Shengyu. Study on degrease of heavy oil bisu with basic lipase [J]. Journal of Silk, 2002(9): 2324.
[5]SARMA Indrani. Degumming of muga cocoon with mycogenic extracellular protease and lipase enzyme: an alternative method for efficient reeling of silk [J]. Advances in Applied Science Research, 2015, 6(9): 716.
[6]LIN Haitao, XU Yanlong, LI Long, et al. The study on the degreasing technology of silk floss treated with leaching method [J]. Applied Mechanics and Materials. 2014, 496: 114117.
[7]徐艳龙, 李龙, 林海涛, 等. 丝绵除油工艺的探讨及其生产自动化[J]. 轻纺工业与技术, 2013,42(6): 3940.
XU Yanlong, LI Long, LIN Haitao, et al. Silk floss oil removal process and its production automation [J]. Light Industry and Technology, 2013,42(6): 3940.
[8]杨雪霞, 何兆军, 劳继红, 等. 表面活性剂对绢纺原料细菌除油的影响[J]. 纺织学报, 2007, 28(4): 811.
YANG Xuexia, HE Zhaojun, LAO Jixhong, et al. Effect of surfactants on deoiling of waste silk by bacteria[J]. Journal of Textile Research,2007, 28(4): 811.
[9]郭磊. 絹纺原料腐化液中除油细菌筛选及工艺初探[D]. 上海: 东华大学, 2005.
GUO Lei. Screen of Waste Silk OilRemoving Bacteria and Primary Research on OilRemoving Technology [D]. Shanghai: Donghua University , 2005.
[10]李丹, 程明, 方佳, 等. 茧丝腐化液微生物群落分析及脱胶功能菌的筛选[J]. 丝绸, 2018, 55(4): 16.
LI Dan, CHENG Ming, FANG Jia, et al. Analysis of microbial community structure for silk natural fermentation liquid and screening of degumming microorganisms [J] .Journal of Silk, 2018, 55(4): 16.
[11]ZHONG W H, CAI Z C, YIN L C, et al. Effects of the longterm application of inorganic fertilizarson microbial community diversity in riceplanting red soil as studied by using PCRDGGE [J]. Acta Ecologica Sinica, 2007, 27(10): 40114018.
[12]郑小坚, 张雨清. 昆虫蛹油的索氏抽提法[J].生物学通报, 2001, 36(1): 3637.
ZHENG Xiaojian, ZHANG Yuqing. Soxhlet extraction of insect pupa oil [J]. Bulletin of Biology, 2001, 36(1): 3637.
[13]GULRAJANI M L, RITU Agarwal, SUBBHASH Chand. Degumming of silk with a fungal protease [J]. Indian Journal of Fibre & Textile Research, 2000, 25(7): 138142.
[14]陈慧. 绢纺原料除油用细菌的分离鉴定及除油工艺研究[D]. 上海: 东华大学, 2007.
CHEN Hui. Screening and Identification of Waste Silk Degreasing Bacteria and Studying on Degreasing Technology by Bacteria [D]. Shanghai: Donghua University, 2007.
收稿日期: 20190610; 修回日期: 20201127
基金项目: 四川省科技计划项目(18ZDYF3037)
作者简介: 陈祥平(1955),男,教授级高级工程师,主要从事茧丝绸纺织材料及工程技术研究。
