流式细胞术在兰科植物中的应用
2020-04-10李春楠傅巧娟沈国正赵福康张晓莹阮若昕
李春楠 傅巧娟 沈国正 赵福康 张晓莹 阮若昕
(杭州市农业科学研究院,浙江 杭州 310024)
兰科(Orchidaceae)是显花植物中最大的科,全世界至少有800个属,25 000~30 000个原生种,分布于各大洲(包括南极岛),具有很高的观赏、药用及生态价值[1-2]。兰科植物历史悠久,经过长期的进化和演变,加之上世纪80年代兰花产业的大规模兴起,种属间杂交育种得以迅速发展,育种体系庞大而繁杂,种质间细胞染色体数目、倍性等遗传信息发生了复杂的变化[3]。研究兰科种质资源遗传背景已成为育种的一项重要的基础工作,对于亲本合理选配、后代倍性预测、提高杂交成功率、掌握育种主动性具有重要意义。
流式细胞术(flow cytometry,FCM)是20世纪70年代发展起来的一种对悬浮的单细胞进行高速分析和分选的技术,在动植物细胞、微生物、细菌和病毒等生物体分选及其DNA、蛋白质或其他分子的快速分析中广泛应用,是现代生物学、医学常用的细胞分选技术[4]。在植物学研究中,流式细胞术常用于倍性分析、核型分析、细胞计数、DNA和RNA含量测定、转基因检测等方面,具有分析速度快、灵敏度高、可靠性好等优点[5]。本文在简要介绍流式细胞术基本原理和关键技术的基础上,对其在兰科植物中的应用现状进行综述,旨在为全面了解细胞群体的流式快速分析方法,挖掘兰科遗传信息,拓展染色体结构、系统进化、多组学联合应用等领域提供基础资料。
1 FCM的原理及关键技术
1.1 FCM的原理
流式细胞仪的工作原理:在一定压力下,待测样品经特异性荧光染色制备而成的细胞悬液进入流动室与鞘液在喷嘴处汇合,加速进入照射室,细胞精确排成单列依次通过激光束,激光照射细胞发生散射和折射,发射出前向散射光(forward scatter,FSC)和侧向散射光(side scatter,SSC),前者与细胞的大小和体积有关,后者与细胞表面、内部结构如胞质、胞膜、核膜及其大小和形状有关;同时,激光激发细胞所携带的荧光素发射出荧光。检测器把散射光和荧光转换为电信号,信号放大后再经数据化处理,进行细胞分析和分选[4]。
1.2 FCM关键技术
在植物学研究中,FCM的基本操作流程包括单细胞悬液的制备、细胞核荧光染色、流式细胞仪分析和荧光数据收集和整理等[6]。由于不同物种组织和细胞代谢产物的差异,流式细胞检测的成败和准确性很大程度上取决于细胞核悬液制备及荧光染色2个步骤,因此,细胞缓冲液和荧光染料的制备和选择至关重要。
1.2.1 单细胞悬液的制备 对于细胞核分离缓冲液的基本要求是抑制核酸酶、维持细胞核的完整性并能提供核酸染料染色最佳条件[7]。组织破碎不充分则单细胞得率较低,研究认为组培苗幼嫩叶片组织是流式分析的合适材料[8],但若组织过于幼嫩,破碎过程中易产生细胞碎片,会影响检测结果。此外,一些细胞次级代谢产物如花青素、草酸钙等会对单细胞悬液质量产生较大影响,因此,有效识别和去除这些特殊的细胞次级代谢产物,根据组织特点和细胞代谢产物类别等筛选适宜的缓冲液,有利于提高检测精度,获取更美观的流式峰图。植物中常用的缓冲液有Galbraith’ s buffer[9]、LB01 buffer[10]、Otto’ s buffers[11]、MgSO4buffer[12]、Tris-MgCl2buffer[13]、Marie’ s buffer[14]、GPB(general purpose buffer)和WPB (woody plant buffer)[15]等。兰科属生育期较长的多年生草本,成熟叶片组织质地坚硬且富含多种细胞代谢产物,如蝴蝶兰(Phalaenopsis)细胞中含有大量的草酸钙,极大地影响了完整细胞核的得率。Lee 等[16]在研究蝴蝶兰的FCM 检测系统时提出一种适用于坚硬叶片组织且富含多糖类、草酸钙和其他代谢物的细胞悬液制备方法,可供借鉴和参考。
1.2.2 荧光染料的选择 目前兰科植物中使用最多的荧光染料是4,6-联脒-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)和碘化丙啶(propidium iodide,PI)染液。一般在分析植物倍性水平时,DAPI和PI 染液均能获得良好的分离效果,但由于DAPI 特异性结合在腺嘌呤和胸腺嘧啶上[17],所以在细胞核总DNA含量精确度要求较高时常用PI 染液。表1列举了部分兰科不同种属所采用的FCM 缓冲液成分和荧光染料。
1.3 兰科基因组大小和C值测定方法
基因组大小是物种遗传信息的重要参数,在基因序列分析、种群基因组多样性和进化演变等研究中占有重要地位。物种基因组大小常通过C值反映,C值是指生物体不复制的单倍体细胞核(无论倍性水平)所含DNA的含量[42]。通常C值以基因组的碱基对来表示,一般认为1 pg DNA的量相当于978 Mb 碱基对[43]。由于C值反映的是单倍体细胞核总DNA含量,因此,二倍体(2n=2x)的基因组大小与C值相同,而多倍体的C值大于基因组大小[7]。基因组和C值的测定方法主要有Feulgen 分光光度法和FCM[44],后者因其分辨率、灵敏度高,操作简便而被广泛应用。一般以已知基因组大小的标准品作为参照进行DNA 总量分析来计算目标基因组大小,根据标准品与待测物混合上样与否,又可分为内标法和外标法。通常先采用外标法,估测未知基因组的大小范围,确定合适的参考基因组,再将内参加入待测物同时检测,通过DNA含量峰值计算目标基因组大小。计算公式如下[45]:

适宜的参考标准是获得准确基因组大小和C值数据的关键。通常选择能较好区分待测样品、二者之间基因组相差不大又不会重叠的物种作为参照,通过上述公式计算目标C值。表2列举了兰科植物中常用的参考标准。此外,也可以植物DNA C值数据库(https:/ /cvalues.science.kew.org/)中已公布基因组大小信息的物种作为参照样本[46]。
2 FCM 在兰科植物鉴定中的应用研究
2.1 基因组大小和C值鉴定
早在1975年,Capesius 等[52]报道估测了第一个兰科植物(一个兰属杂交种)的基因组大小,之后在FCM不断发展和完善的背景下,越来越多的兰科植物基因组大小和C值被测定。Jones 等[53]利用FCM 检测了兰科26个属共70个种的基因组大小,2C 核DNA含量值介于1.91~15.19 pg之间(不包含石斛属),C值最小的为Cadetia taylori,最大的是Vanilla phaeantha;其中,石斛属的2C值介于1.53(Dendrobium cruentum)~ 4.23 pg (Dendrobium spectabile)之间;汪琛颖等[19]以铁皮石斛(Dendrobium officinale)为外参测定兰属蕙兰的基因组大小为4.39±0.12 Gb,即2C DNA含量为8.98 pg;Ahmadian 等[27]测定头蕊兰属3个种的基因组大小(2C)分别为27.49、35.39和36.33 pg;原沼兰属药用植物Malaxis wallichii的2C DNA含量约为2.76 ± 0.02 pg,即1C=1 349.64 Mb[41];Rewicz 等[34]估测了2个居群火烧兰的基因组2C值平均为27.71和27.49 pg。此外,利用FCM 还测定了兜兰[3,49]、树兰属[28]和扇叶兰属[25]等兰科的基因组大小和C值。
基因组是一个物种的基本特性,每个物种的C值通常是恒定的,然而,Leitch 等[54]在以327个兰科植物为对象分析基因组多样性时发现,尽管它们中不存在自然界中最大和最小的基因组,但在被子植物家族中却是变异性最大、多样性最丰富的,从C值最小1C=0.33 pg (Trichocentrum maduroi)跨度到最大1C=55.4 pg (Pogonia ophioglossoides);尽管基因组大小变异范围较大,但多数品种表现出集中分布的特点,且核DNA含量较小(平均1C=8.5 pg,图1);在所分析的4个亚科中,树兰亚科(Epidendroideae)的基因组变异最大,基因组偏小,而杓兰亚科(Cypripedioideae)和香荚兰亚科(Vanilloideae)的基因组最大。

表1 部分兰科植物流式细胞分析缓冲液和荧光染料Table1 List of nuclear isolation buffers and fluorescence dyes used in flow cytometry of some Orchidaceae
随着FCM 更加广泛地用于植物基因组大小和C值测定,兰科家族基因组信息不断被补充,这将有助于开展兰科植物种属特征分析、种质资源鉴定、进化关系研究、种群结构和遗传多样性分析等研究工作。
2.2 DNA倍性分析
在植物育种中,倍性是种质资源的重要评价指标。植物倍性鉴定主要有2种方式,一是直接鉴定法,在细胞水平上确定染色体数目,即染色体计数;二是间接鉴定法,从表型特征、气孔大小、保卫细胞数目、核DNA含量等方面间接鉴定倍性。二者相比,染色体计数法准确、可靠,但对细胞学操作技术要求较高,且费时费工,而传统的间接鉴定法从表型和生理指标上反应倍性变化,但准确性不高,很难区分非整倍体和嵌合体。随着流式细胞术的发展,其能够对大量处于分裂期间的染色体核DNA含量进行检测间接分析植物DNA倍性,已成为快速、高通量鉴定种质资源和多(单)倍体倍性的主流方法[55-56]。
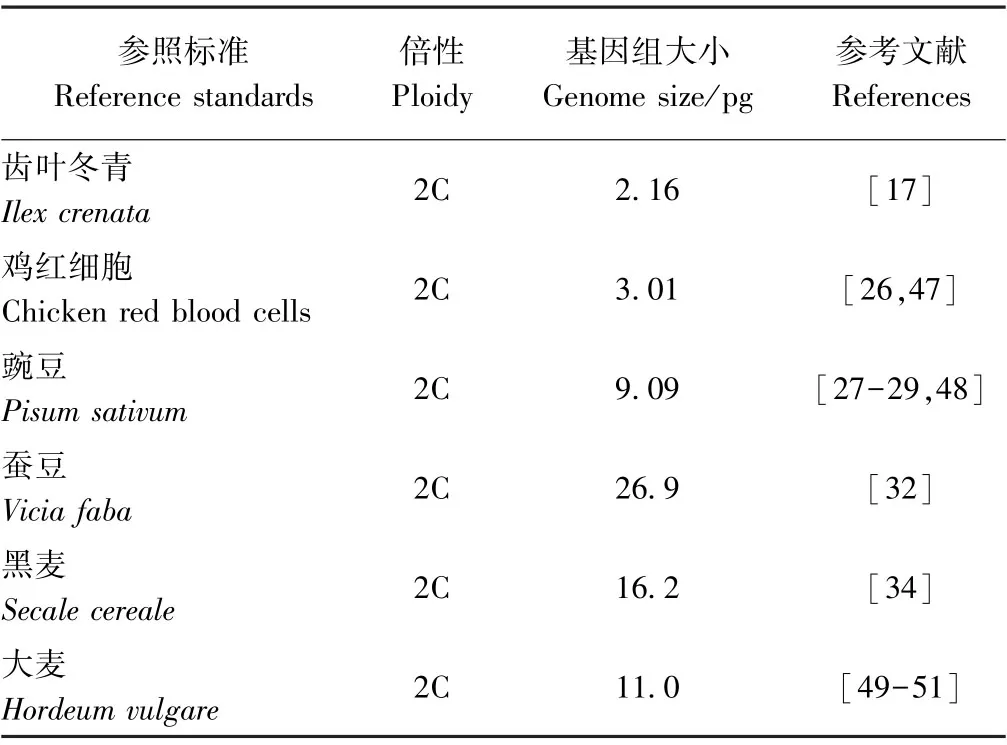
表2 兰科植物中常用的参照标准Table2 List of common reference standards used in Orchidaceae
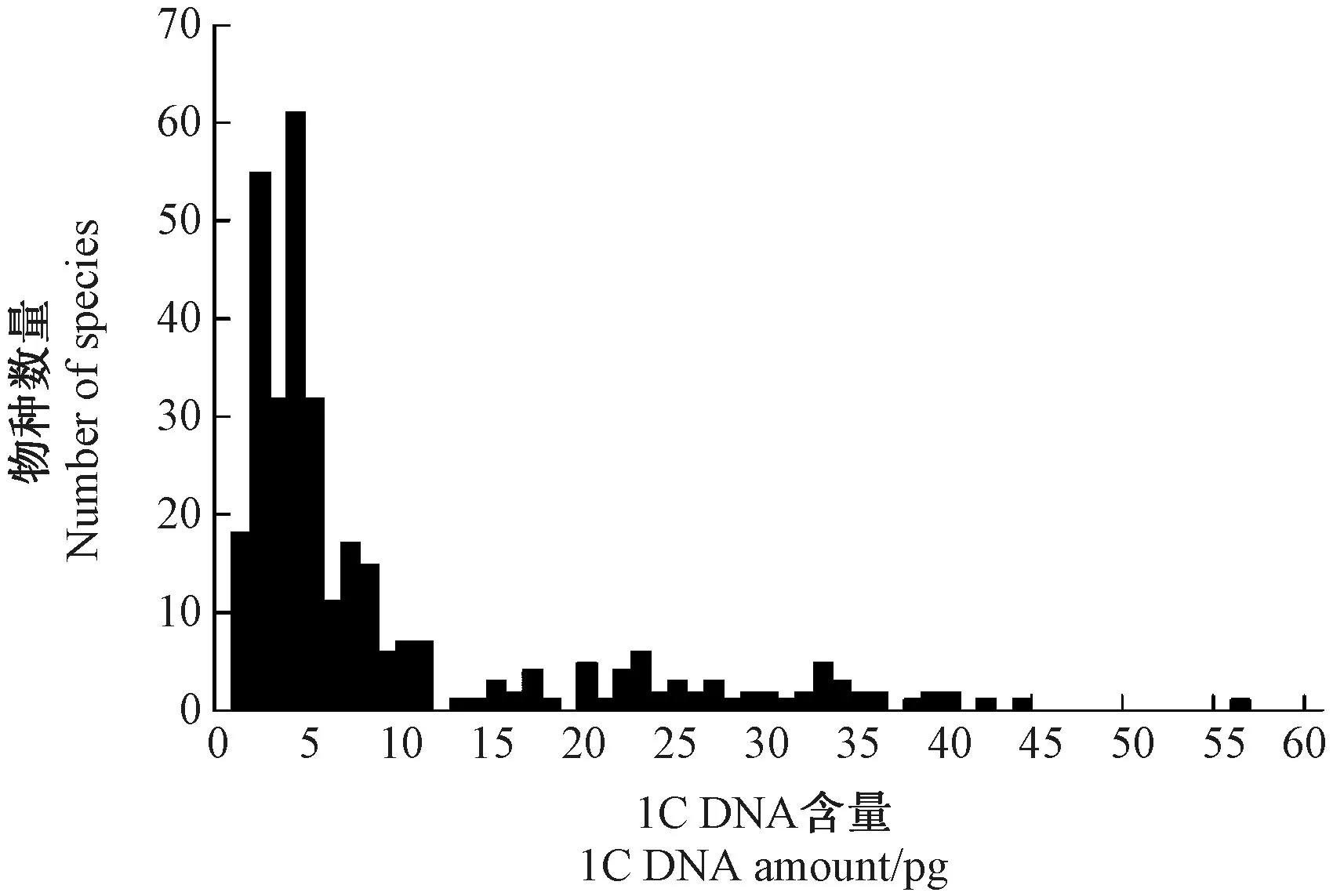
图1327 个兰科植物的基因组大小分布[54]Fig.1 Distribution of genome sizes (1C-values)for 327 species of Orchidaceae[54]
2.2.1 种子低温贮藏后成苗倍性鉴定为了保护濒危兰科植物,通常将种胚玻璃化后离体储藏于低温干燥的环境,并利用FCM 鉴定种胚在低温贮藏后成苗的遗传稳定性。Hirano 等[21]对比不同成熟度(授粉后2~4月)白及种胚在不同低温保存方式下离体成苗的倍性变化,发现种胚低温贮藏后发育而成的植株能够正常生长,DNA倍性水平未发生改变;类似的,石斛属[2]、文心兰属[24]种子在低温贮藏后萌发成苗仍能保持遗传上的稳定,未改变DNA倍性。
2.2.2 组织培养中遗传稳定性鉴定种苗在组培扩繁过程中可能发生变异,因此,确保育种材料的遗传稳定性,或将变异率控制在合理范围是兰花育种和生产中的重要环节,FCM 已成为高通量评估兰科植物组培成苗遗传稳定性的主要手段,在药用兰科美冠兰属[20]、皇后兰[26]、贝母兰属[36]、石斛属[53,57-58]、兰属[59]及文心兰属[60]等兰花中均有应用。
2.2.3 多倍体和单倍体识别 利用化学诱变剂处理兰花类原球茎(protocorm like body,PLB)是获得多倍体的有效手段。Chen 等[39]用已知倍性的对照作参照,利用FCM 鉴定加倍后的蝴蝶兰倍性;Chung 等[40]分别采用不同浓度的秋水仙素和氨磺乐灵诱导虾脊兰杂交种子(Calanthe discolor×Calanthe sieboldii),FCM鉴定种子成苗倍性,确定四倍体诱导率最高的是0.003%氨磺乐灵处理1~2 d;Han 等[23]利用FCM 检测秋水仙素处理白及原球茎成苗后二倍体和同源四倍体倍性;Chen 等[61]提出了一种水平分割原球茎或类原球茎诱导蝴蝶兰多倍体的方法,无需药剂处理,通过FCM 验证了该方法是获得多倍体的有效途径;Grosso等[62]用秋水仙素和甲基胺草磷处理石斛属(Dendrobium)杂交种子形成的PLB,FCM 鉴定处理后的PLBs和幼苗倍性,根据前人的研究[63-64](略作修改)采用一种综合指数Cycle Value 作为倍性评价指标,证明Cycle Value 与倍性呈正相关,可有效用于多倍体的筛选。同时提出,当Cycle Value ≥1 ± 0.1时能够高效诱导四倍体的产生(Cycle Value=0×np1+1×np2+2×np3+3×np4…/np1+np2+np3+np4…,式中np1、np2、np3和np4代表流式细胞图相应峰值的细胞核数量);FCM 亦可鉴别单性结实产生的单倍体,从白及柱头注入萘乙酸钠使其单性生殖,蒴果种胚播种后即可形成单倍体植株[22]。
此外,FCM 还用于兰科其他种属的倍性分析,如掌裂兰属[17,65]、手参属[18,66]和香荚兰属(Vanilla)[67]等。
2.3 内多倍化水平检测
内多倍性(endopolyploidy)是指同一个体、组织或器官相邻体细胞中多种倍性细胞核同时存在的现象,是细胞核进行正常的DNA 复制却不发生细胞分裂引起的[68-69],最早由Levan[70]在洋葱(Allium cepa)根部成熟区报道,这种核内再复制现象在高等植物中广泛存在,普遍发生在被子植物和藓纲中[7,63,71],在特定细胞或组织中能够观察到。FCM是基于细胞核DNA含量差异来区分不同倍体细胞,可以准确地识别内多倍体的存在和内多倍化水平。兰科的核内再复制现象普遍发生,如掌裂兰属和蜂兰属[29]、万代兰属[30,72]、紫苞舌兰[31]、原沼兰属[41]、蝴蝶兰属和五唇兰属(Doritis pulcherrima)[48]、石斛属[73]、兰属[8]、兜兰属[74]、文心兰属[75]等均存在内多倍化现象。
植物体内多倍化水平因组织器官和发育阶段而异,这在芸薹属(Brassica)[76-77]、紫薇(Lagerstroemia indicaL.)[78]、大麦和小麦(Triticum)[79]等中已有报道。在兰科植物中,FCM 可检测到万代兰叶片、根和柱头中的多倍性细胞,但在花被、花梗等部位并未发现。同时,随着体胚的不断发育,内多倍性水平也在不断升高,激素[如萘乙酸(naphthalene acetic acid,NAA)]处理可以提高体胚的多倍化进程[30];在热带兰科植物紫苞舌兰(Spathoglottis plicata)中也发现了类似的现象,不同器官的内多倍化水平不一,其中,处于发育阶段的花梗在流式DNA含量直方图显示出2C、4C、8C和16C 4个峰值,内多倍化水平较高,但在花萼、花瓣、子房中未发现内多倍化现象[31];小兰屿蝴蝶兰(Phalaenopsis equestris)不同组织内多倍性细胞存在2C、4C、8C、16C和32C 水平,多倍化程度在叶、花、根中呈极显著差异[48]。此外,内多倍化现象在兰科植物赖以繁殖的类PLB和根状茎中依然存在。Fukai 等[8]利用FCM 分析了兰属中以PLB 繁殖的附生兰和以根状茎繁殖的地生兰(Cymbidium kanran)的体细胞多倍性,发现PLB 上产生的芽存在2C和4C 两个峰值,而PLB 本身则检测到2C、4C、8C和16C的多倍性细胞,花器官(不包括子房)、根、根状茎中均呈现出高度多倍性,之后,在对不同PLB 内部结构及幼苗细胞倍性的研究表明,尽管不同途径产生的PLB 内多倍性水平存在差异,但在成苗后细胞倍性将趋于稳定[50-51]。
研究证明,细胞内多倍性在兰科不同组织器官中有一定的差异,这种差异可能与形态建成及增强植物逆境胁迫的适应性有关[63]。内多倍性可在多种类型细胞中存在,尤其是那些正处于分化和增殖的细胞[69],在调节植物组织、器官生长发育和增强对环境胁迫的适应性方面具有积极作用。早期在对玉米内多倍化现象的研究中也发现,核内再复制能够增强玉米幼苗的耐冷性[80],提高玉米胚乳细胞的活性,快速积累储藏物质[81]。此外,植物的内多倍性还与一些形态发育相关,生物体通过核内再复制方式使细胞增大来影响其表型性状,如蝴蝶兰属花的大小和发育与内多倍性水平呈紧密的正相关关系[38,82];细胞再复制能力及内多倍性水平不仅与细胞周期、倍性水平、所处器官和细胞发育状态有关[51],而且还受温度[83]、光质[84]、声波处理[85]等外界条件的影响。因此,深入了解内多倍性的特点和发生规律,在兰花选育种中,可能通过调整内多倍性水平来调控植物抗逆性和表型特征,从而辅助育种研究。
3 结论与展望
FCM 以其分析简便、快速,灵敏度高等优点,在植物基因组大小测定、DNA倍性分析、碱基组成分析、植物性别鉴定、细胞周期、细胞计数等方面有着明显的优势[7,86-87]。基于核DNA 总量分析,FCM 能获取物种基础遗传信息,为基因组测序、分子生物学等相关研究奠定基础,还能进一步了解植物的分布规律、进化演变和基因组多样性对物种产生的影响,在细胞分类学和进化研究中具有重要地位[54]。此外,FCM 还可分析不同基因型的同源关系和减数分裂行为[25]、区分具有相同染色体数的不同种[88-90]、分析杂合子的基因构成[91-92]以及评估植物细胞的胁迫损伤程度[93-95]等。随着FCM技术的不断发展和新型流式细胞仪的开发研制,FCM技术将在兰科基因组学、分类进化、染色体结构等相关领域具有更加广泛的应用潜力。
