星状神经节阻滞对心力衰竭大鼠心肌细胞凋亡及PI3K/Akt信号通路的影响*
2020-04-09郑建滨黄娟珍吴加富冯小玲陈鹭
郑建滨,黄娟珍,吴加富,冯小玲,陈鹭
(1.福建医科大学附属宁德市医院 麻醉科,福建 宁德 352100;2.福建医科大学附属 第一医院 麻醉科,福建 福州 350000)
心力衰竭是由于心脏结构或功能异常导致心室充盈或射血能力受损的临床综合征,属于心血管疾病的终末阶段。随着中国居民平均寿命增加,心力衰竭发病率也逐年提高,统计资料显示,我国心力衰竭患病率为0.9%,患者已达1 000万,居世界首位[1]。几乎所有的心血管疾病最终都会导致心力衰竭,心肌梗死、心肌病、血流动力学负荷过重及炎症等原因引起的心肌损伤,均可造成心肌结构和功能的变化,最后导致心室泵血和/或充盈功能低下[2]。细胞凋亡是基因调控下的一种自发性程序化细胞死亡,细胞凋亡可能是心力衰竭发病机制的重要环节之一。心力衰竭患者存在明显的心肌细胞凋亡过度,伴微血管稀少,小血管平滑肌重塑,血管细胞凋亡现象[3]。如何终止或扭转心力衰竭细胞凋亡进程已成为改善患者预后的关键。星状神经节阻滞(stellate ganglion block, SGB)是将局部麻醉药物注射在星状神经节组织内从而阻滞交感神经,进而维持机体内环境的稳定,纠正植物神经失调[4]。本研究探索SGB对心力衰竭大鼠心肌细胞凋亡及PI3K/Akt信号通路的影响,旨在研究SGB对心力衰竭细胞凋亡的影响及其作用机制,为临床治疗提供参考依据。
1 材料与方法
1.1 实验动物
SPF级SD雄性大鼠18只,8周龄,体重200~ 250 g,动物许可证号:SCXK(沪)2008-0016,购自上海斯莱克实验动物技术有限公司,60只大鼠分为SGB组、假手术组和对照组,每组6只。
1.2 试剂与仪器
酶联免疫吸附试验(ELISA)试剂盒、TUNEL细胞凋亡检测试剂盒和蛋白提取试剂盒均购自南京凯基生物科技有限公司,兔抗大鼠多克隆PI3K、Akt及Caspase-3抗体均购自英国Abcom公司,辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗兔IgG购自美国Sigma公司,兔抗大鼠β-actin单克隆抗体购自美国Santa Cruz公司,ELISA检测试剂盒购自南京凯基生物科技发展有限公司,蛋白电泳仪购自美国Bio-Rad公司。
1.3 心力衰竭大鼠模型复制
参考国外文献[5],采用腹主动脉狭窄法复制心力衰竭大鼠模型。腹腔内注射50 mg/kg戊巴比妥钠麻醉成功后,取正中切口逐层开腹,打开后腹膜,探及腹主动脉,取右肾动脉上方的腹主动脉一段,钝性分离后与7号针头合并结扎,取出针头,制造0.7 mm直径的残腔,逐层缝合关闭切口,继续饲养。腹主动脉结扎可造成心脏后负荷过重,从而导致慢性心力衰竭,实验至少需8周才能观察到心室重构。
1.4 实验动物分组
心力衰竭大鼠模型复制成功后,SGB组腹腔内注射戊巴比妥50 mg/kg以麻醉大鼠,选择右侧食管旁入路,消毒,切开皮肤组织暴露右侧颈动脉鞘,探及颈总动脉、迷走神经和伴行的交感神经,沿食管向下游离,于锁骨下动脉及椎动脉起始部,可见淡黄色星状神经节,约1~2 mm大小,呈梭形或星形分布。植入硬膜外穿刺针至星状神经节分布处,牵引硬膜外导管的另一端自颈前向后引出,逐层关闭切口,固定硬膜外导管至皮肤,处理3 d后经硬膜外导管注入1%利多卡因0.2 ml,2次/d,连续2周;假手术组仅切开皮肤暴露至星状神经节,然后直接缝合切口;对照组未予以任何处理。
1.5 ELISA检测心肌组织内TNF-α和IL-1β的表达
连续给药2周后,处死动物,取出各组心肌组织,组织匀浆,稀释待测样品和标准品至合适浓度,按100μl/孔加入到酶标板中,4℃过夜。TNF-α和IL-1β抗体用稀释液稀释至工作浓度后,加入每孔中,100μl/孔,于37℃环境下放置于湿盒45 min。洗板3次。加入亲和素过氧化物酶复合物工作液100μl,37℃反应30 min,依次加入TMB显色液,37℃避光反应30 min,加入50μl终止液,用ELISA检测仪于450 nm波长处测定吸光度值。
1.6 Western blotting检测凋亡蛋白PI3K、Akt及Caspase-3的表达
SGB处理2周后,获取大鼠心肌组织,蛋白提取试剂盒收集细胞蛋白,测定蛋白浓度,取样品蛋白对靶蛋白PI3K、Akt及Caspase-3表达水平进行检测。每个样品蛋白提取物为20μg,120 V恒流电源下利用10% SDS-PAGE分离胶分离样品蛋白1 h,80 V直流电转硝酸纤维素膜2 h,2%牛血清蛋白封闭1 h,剪膜,于4℃环境下加入1∶100~1∶500稀释兔抗大鼠PI3K、Akt、Bcl-2、Bax及Caspase-9多克隆抗体孵育过夜,加入1∶1 000稀释HRP标记羊抗兔IgG抗体,室温孵育30 min,显色系统中显色定影,分析杂交条带。
1.7 心肌组织学观察
获取大鼠心肌组织行HE染色。95%乙醇固定20 min,PBS洗涤2次,1 min/次。苏木精染色2 min,自来水洗涤。镜下观察,若细胞核染色过深,用1%盐酸酒精溶液分色数秒,自来水洗涤。浸入伊红染液染色1 min,自来水洗涤。自然晾干细胞爬片后,中性树胶封片,放置显微镜下观察。
1.8 TUNEL检测心肌细胞凋亡
连续给药2周后,处死大鼠,取出各组心脏组织,4%多聚甲醛固定、包埋,石蜡切片脱蜡,含0.2% Triton X-100的PBS缓冲液破膜10 min,生理盐水清洗3次,加入50μl TUNEL检测液,室温避光孵育1 h,PBS清洗3次,1% DAPI染核60 s,PBS清洗3次。 基因组DNA断裂时,在脱氧核苷酸转移酶催化下,将荧光素标记的脱氧三磷酸尿苷标记到3'-OH末端,从而可通过荧光显微镜或流式细胞仪进行检测,本研究使用异硫氰酸荧光素对阳性凋亡细胞进行标记,荧光显微镜下观察。
1.9 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步的两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组心肌组织内炎症因子水平比较
各组TNF-α、IL-1β水平比较,经方差分析,差异有统计学意义(P<0.05),SGB组较对照组和假手术组低(P<0.05)。见表1。
表1 各组TNF-α、IL-1β水平比较 (n =6,pg/ml,±s)

表1 各组TNF-α、IL-1β水平比较 (n =6,pg/ml,±s)
组别 TNF-α IL-1β SGB组 73.1±9.75 55.8±13.07对照组 189.2±21.38 142.8±36.55假手术组 178.6±19.54 155.4±30.47 F值 40.001 11.250 P值 0.000 0.009
2.2 各组PI3K、Akt及Caspase-3蛋白相对表达量比较
各组PI3K、Akt及Caspase-3蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),SGB组PI3K、Akt蛋白相对表达量较对照组和假手术组高(P<0.05),Caspase-3蛋白相对表达量较对照组和假手术组低(P<0.05)。见图1和表2。
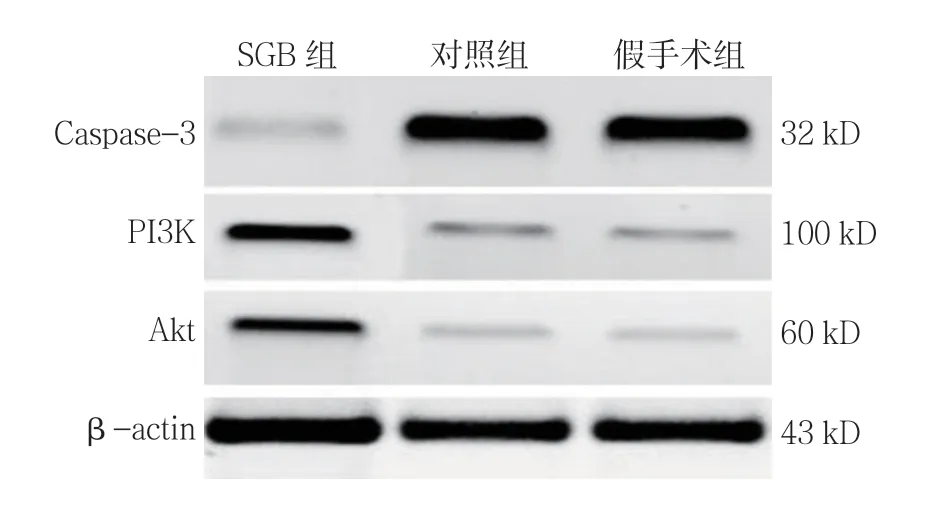
图1 各组PI3K、Akt及Caspase-3蛋白的表达
表2 各组PI3K、Akt及Caspase-3蛋白相对表达量 比较 (n =6,±s)
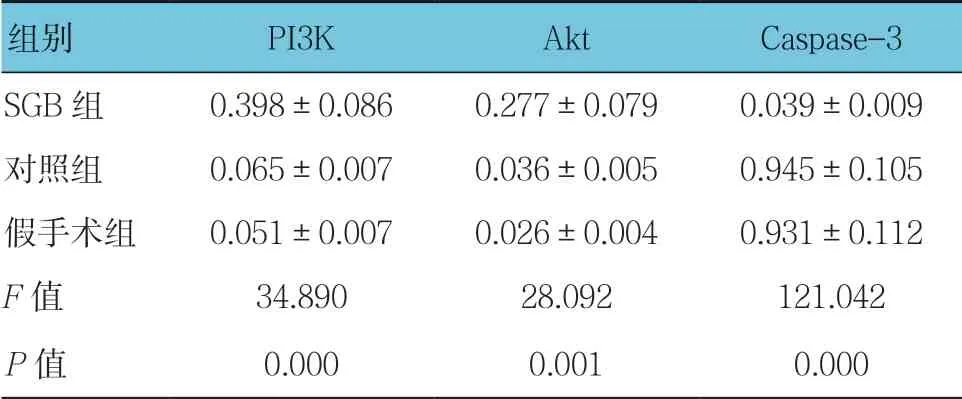
表2 各组PI3K、Akt及Caspase-3蛋白相对表达量 比较 (n =6,±s)
组别 PI3K Akt Caspase-3 SGB组 0.398±0.086 0.277±0.079 0.039±0.009对照组 0.065±0.007 0.036±0.005 0.945±0.105假手术组 0.051±0.007 0.026±0.004 0.931±0.112 F值 34.890 28.092 121.042 P值 0.000 0.001 0.000
2.3 各组心肌细胞形态及凋亡细胞比较
各组HE染色结果显示,SGB组心肌细胞排列规则整齐,而对照组和假手术组心肌细胞空泡化,细胞间隙明显,部分细胞溶解。见图2。
在荧光显微镜下凋亡细胞呈绿色荧光散在分布,连续给药2周后,SGB组、对照组和假手术组高倍镜视野下TUNEL染色平均阳性数分别为(17±2)、(65±5)和(63±4)个,经方差分析,差异有统计学意义(F=147.467,P=0.000),SGB组较对照组和假手术组少(P<0.05)。见图2。

图2 各组心肌组织HE和TUNEL染色病理切片 (×100)
3 讨论
人星状神经节主要由第6、7颈部节与第1胸神经节融合而成,形状不规则,呈卵圆形,长约2 cm,宽约1 cm。而本研究采用SD大鼠,其星状神经节相对人类小得多,大小1~2 mm。节后纤维广泛分布于C3~T12节段的皮肤区域,在功能上属于交感神经节。SGB涉及植物神经系统、内分泌系统和免疫系统,SBG有助于维持机体内环境的稳定性,改善机体植物神经失调状态。值得注意的是,心力衰竭患者交感神经兴奋性升高,而星状神经节组织能显著降低心血管交感神经反射,调节心血管系统植物神经功能,从而降低心脏前后负荷,保护心肌细胞。
心力衰竭属于心功能不全的失代偿阶段,炎症反应和细胞凋亡是心肌细胞功能障碍的病理基础[6]。有研究表明心力衰竭时,心肌细胞固缩,形成凋亡小体,凋亡指数可达35.5%[7]。本研究通过对SGB治疗后心肌组织学观察和相关凋亡蛋白的分析,探讨SGB诱导的心肌细胞保护机制。在众多炎症细胞因子中,起主要作用的是TNF-α、IL-1β、IL-6及IL-8等。TNF-α主要由巨噬细胞和单核细胞产生,具有强大促炎作用,能刺激中性粒细胞、T淋巴细胞和嗜酸性粒细胞的趋化,造成器官功能损伤[8]。IL-1β是一种致炎细胞因子,广泛参与人体组织破坏、水肿形成等多个病理损伤过程[9-10]。本研究结果证实,与假手术组和对照组相比,SGB组心肌组织内炎症因子水平显著降低,表明SGB具有强烈的抑制炎症反应作用,从而有效保护心肌细胞。
心力衰竭发生、发展过程中出现的一些病理因素,如氧化应激、负荷过重、细胞因子、钙稳态失衡及线粒体功能失常等,都可诱导心肌细胞凋亡[11]。凋亡包括内源性线粒体细胞色素释放途径和外源性死亡受体途径,Caspase-3是凋亡信号通路传导的最终凋亡执行分子,而Caspase-8是外源性凋亡途径的执行者,Caspase-9是内源性凋亡途径的执行者[12]。鉴于Caspase-3蛋白在凋亡信号通路中守门人的角色,笔者检测SGB干扰后心力衰竭心肌组织中Caspase-3蛋白的表达,SGB组Caspase-3蛋白相对表达量较对照组和假手术组显著降低,这表明SGB组细胞凋亡活性被明显抑制。PI3K/Akt信号通路是目前研究较为透彻的一种经典细胞信号传导路径,其功能失调常见于心血管疾病等。PI3K是细胞内重要的信号传导分子,PI3K可被生长因子、细胞因子和激素等细胞外信号刺激激活[13]。PI3K激活可使膜磷酸肌醇磷酸化,催化激活下游信号分子Akt。Akt是细胞存活的主要调节因子,通过直接抑制促凋亡蛋白或抑制转录因子产生的促凋亡信号实现调节作用[14]。与假手术组和对照组相比,SGB组可诱导心力衰竭心肌组织中PI3K和Akt蛋白表达升高,表明SGB主要通过影响PI3K/Akt通路,导致下游凋亡信号传递受阻,从而发挥抗凋亡作用。因此,笔者推测SGB抗炎症反应和抗细胞凋亡作用可能是心力衰竭大鼠心肌细胞保护作用的关键 因素。
