废旧锂电池中锂的回收
2020-04-09,
,
(先进储能材料国家工程研究中心有限责任公司,湖南 长沙 410205)
0 引言
新能源汽车近些年取得了较大的发展,许多企业和国家都十分关注新能源汽车及其相关配套系统的研究进展,国家甚至提出了一些帮助新能源汽车应用推广的政策,将发展新能源汽车放到了战略地位。相应地,动力锂电池被应用到新能源汽车中[1]。由于锂电池的消耗量巨大,因而对不可再生的金属资源的消耗是相当大的。因此,回收锂电池中经济价值高的锂,对于实现节能减排、可持续发展具有重要意义[2]。
废旧锂离子电池中含钴、锂、镍的质量分数分别为5%~15%,2%~7%,0.5%~2.0%,此外还含有Cu、Al、Fe等金属元素[3]。随着我国锂离子电池原料矿产的日益减少及对环境保护的需要,若将废旧材料中的资源加以回收和循环利用,不仅可带来显著的环境效益,且具有一定的经济效益与社会效益,这是现代社会中最有发展前途的废旧材料处置方案之一[4]。如何回收分离废旧锂电池中的有价金属,采用经济便捷的方法开发和提取废旧锂电池中的锂尤为重要。
目前,对于废旧锂电池的再生处理大多采用湿法冶金技术。锂的回收方法有溶剂萃取法、沉淀法、电解法、离子交换法、盐析法等。其中,溶剂萃取法是目前锂电池金属元素分离回收应用最广泛的工艺,按照萃取体系的不同,可分为单组分萃取体系,如P2O4、P5O7等;以及混合协同萃取体系,如皂化P5O7微乳体系等[5]。
随着锂离子电池技术的不断成熟,氟化锂作为一种重要的锂基基础材料,越来越受到人们的重视,工业上,氟化锂的生产主要有中和法和复分解法两种[6]。在废旧锂电池回收领域中,氟化沉锂法比溶剂萃取法的工艺流程短,更便捷高效。为了分离废旧锂电池活性物质粉浸出除杂液中的各有价金属,本实验重点研究了用氟化钠溶液对其进行沉锂的方法及其主要影响因素,确定了氟化钠沉锂方法的最佳工艺条件,以期为废旧锂电池中锂的回收利用提供理论参考。
1 实验材料和方法
1.1 技术方案
本实验的技术方案见图1。
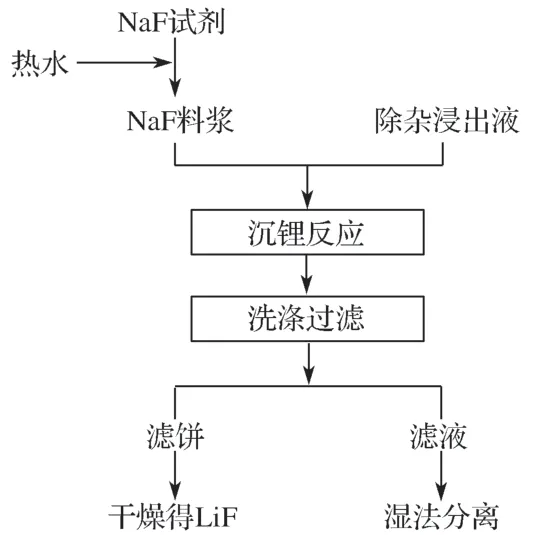
图1 实验流程图Fig.1 Experiment flow chart
氟化钠沉锂分离法[7]是利用氟化锂的溶解度(为0.16 g/100 g水,20 ℃)远小于硫酸锂的溶解度(为34.8 g/100 g水,20 ℃)的特性,通过向溶液中加入一定量的氟离子,使得锂离子形成沉淀从而与其他金属离子分离的方法,溶液中锂离子与沉淀剂发生如下化学反应:
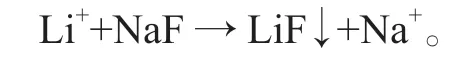
1.2 仪器与试剂
本实验所用的仪器与试剂见表1。
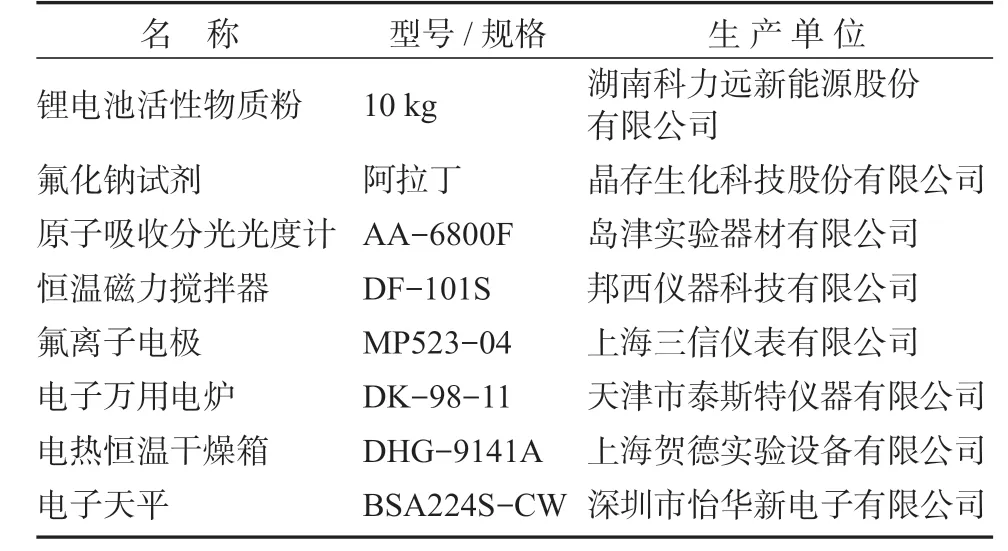
表1 实验仪器与试剂Table 1 Laboratory instruments and reagents
1.3 实验内容
将锂电池破碎分选出的活性物质粉10 kg进行湿法硫酸浸出[8],通过添加还原剂,调控浸出液酸的浓度、反应温度、反应时间、搅拌速度等参数,过滤获取浸出液,浸出液中的铜、铁、铝等杂质离子经过加铁粉置换除铜、黄钠铁钒法除铁铝等工序除去。对于除杂后的浸出液,采用原子吸收分光光度计[9]分析其化学成分,确定锂、镍、钴、锰及杂质元素的质量浓度,如表2所示。
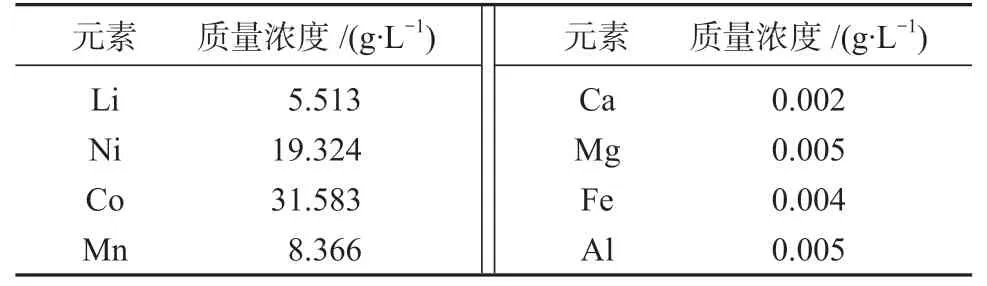
表2 除杂浸出液各元素的质量浓度Table 2 Mass concentration of elements in impurity removal leaching solution
由表2可以得知,除杂浸出液中,锂元素的质量浓度为5.513 g/L,镍、钴、锰元素的质量浓度分别为19.324,31.583,8.366 g/L,此外,还有少量钙、镁、铁等。
本实验以除杂浸出液为原料,n(F)/n(Li)过量比、反应温度、搅拌速率、反应时间、洗涤水温为参考因素,考察各因素对锂的回收率和镍、钴、锰(统称M)损失率的影响。
1)氟锂过量比单因素实验。沉淀剂氟化钠根据除杂液中锂离子的含量进行添加,氟锂过量比选取n(F)/n(Li)=1.0,1.1,1.2,1.3,1.4,1.5,共进行6组实验。取6个2 000 mL的烧杯,按1~6顺序进行编号,并置于恒温磁力搅拌器中。量取500 mL除杂浸出液置于烧杯内,开启搅拌及加热开关。按过量比计算所需氟化钠的质量,用分析天平称取氟化钠固体并置于1 000 mL的烧杯中。由于90 ℃条件下氟化钠的溶解度为5 g/100 g水,为保证其全部溶解,故1 000 mL烧杯中均加入适量比例的去离子水,并将烧杯置于万用电炉上,边搅拌边加热至90 ℃至氟化钠全部溶解。然后,将溶解后的氟化钠料液倒入2 000 mL烧杯中,控制一定温度和搅拌速率,待其沉淀锂一段时间后取出。将反应后的混合物趁热抽滤,按液固比为10:1,用去离子水分5次洗涤沉淀,并将洗涤后的沉淀置于60 ℃电热恒温干燥箱中烘干。
2)反应温度单因素实验。在氟锂过量比选择n(F)/n(Li)=1.2的条件下,反应温度分别选择50,60,70,80,90,100 ℃进行6组实验,其余实验步骤及参数均与实验1保持一致。
3)搅拌速率单因素实验。在氟锂过量比选择n(F)/n(Li)=1.2、反应温度选择90 ℃的条件下,搅拌速率分别选择50,100,200,300,400 r/min,进行5组实验,其余的实验步骤及参数均与实验1保持一致。
4)反应时间单因素实验。在氟锂过量比选择n(F)/n(Li)=1.2、反应温度选择90 ℃、搅拌速率选择300 r/min的条件下,反应时间分别选择2,4,6,8,10 h,进行5组实验,其余的实验步骤及参数均与实验1保持一致。
5)洗涤水温单因素实验。在氟锂过量比选择n(F)/n(Li)=1.2、反应温度选择90 ℃、搅拌速率选择300 r/min、反应时间选择8 h的条件下,洗涤水温度分别选择50,60,70,80,90,100 ℃,进行6组实验,实验步骤与实验1保持一致。
各实验烘干得到的氟化锂沉淀质量记为MLiF,将氟化锂沉淀研磨,取样,用王水溶解并定容,稀释到一定的倍数后进行元素分析,测出氟化锂中锂的质量分数MLi和镍钴锰的质量分数MM,以此计算锂的回收率和镍钴锰的损失率。
1.4 分析测试方法
利用氟离子选择性电极测定氟化锂中的锂质量分数[10],实验所得氟化锂中锂的质量与除杂浸出液中锂质量的比值就是锂的回收率,即

式中:Y为氟化锂的回收率,以锂计;
MLiF为所得产品氟化锂的质量;
WLi为产品中锂元素的质量分数。
利用火焰原子吸收光谱法测定氟化锂中的镍、钴、锰含量,实验所得氟化锂中镍、钴、锰M质量与除杂浸出液中镍、钴、锰质量的比值就是镍、钴、锰M的损失率,即
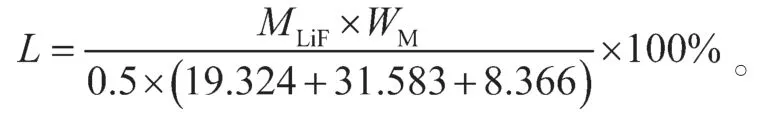
式中:L为镍钴锰M元素的损失率;
WM为产品中镍钴锰M元素的质量分数。
2 结果与讨论
2.1 n(F)/n(Li)过量比对锂的回收率和M损失率的影响
实验反应温度为90 ℃,反应时间为10 h,搅拌速率为300 r/min,洗水温度为90℃,干燥温度为60 ℃,干燥时间为10 h。实验所得n(F)/n(Li)过量比对锂的回收率和M损失率的影响结果见图2。
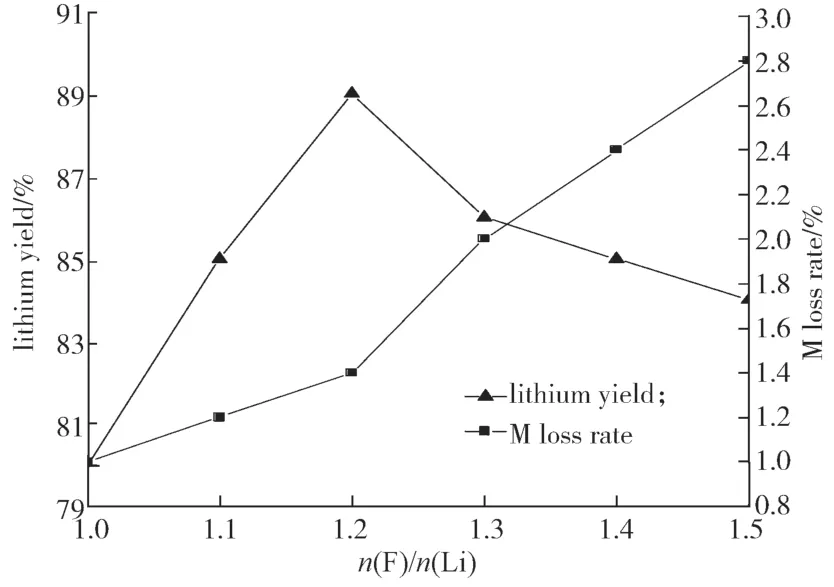
图2 n(F)/n(Li)过量比对锂的回收率和M损失率的影响Fig.2 Effect of n(F)/n(Li) excess ratio on the recovery of lithium and M loss rate
由图2可知,随着氟离子加入量的增大,反应动力增大,金属锂的回收率迅速增大。当n(F)/n(Li)为1.2时,锂的回收率达最大值,为89.01%;但是当n(F)/n(Li)>1.2后,锂的回收率反而下降,但下降幅度较小。此时,由于溶液中F离子的浓度过大,反应过于彻底,使得镍钴锰M的沉淀损失率也随之增加,故选择n(F)/n(Li)=1.2为最佳实验条件之一。
2.2 反应温度对锂的回收率和M损失率的影响
实验条件如下:反应时间为10 h,搅拌速率为300 r/min,n(F)/n(Li)过量比为1.2,洗水温度为90 ℃,干燥温度为60℃,干燥时间为10 h。所得反应温度对锂的回收率和M损失率的影响结果如图3所示。
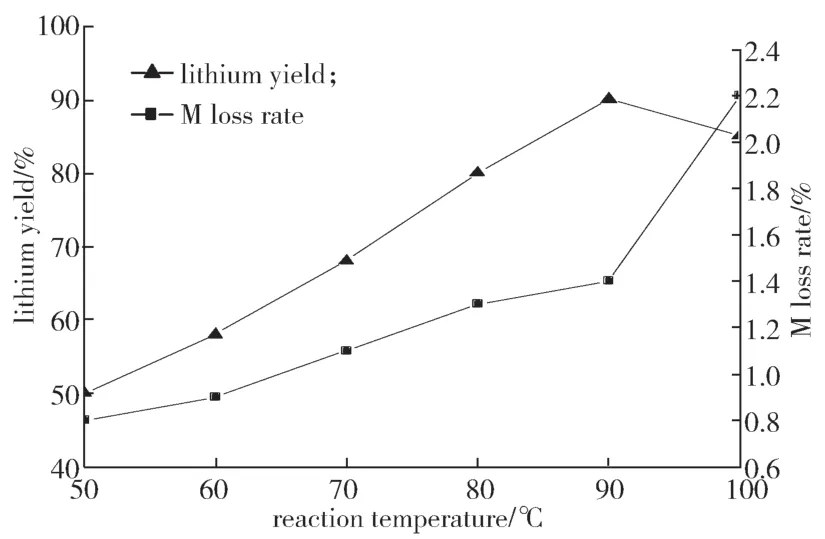
图3 反应温度对锂的回收率和M损失率的影响Fig.3 Effect of reaction temperature on the recovery of lithium and M loss rate
由图3可知反应为吸热反应,升高温度有利于反应进行。随着反应温度升高,氟化钠在水中的溶解度增大,同时因产物氟化锂在水中的溶解度随温度的升高而降低,升高温度也避免了氟化锂在形成过程中被大量溶解。当温度T>90 ℃时,锂的回收率有所减少,这可能是因为反应溶液中黏度过低,离子运动加快,不利于氟化锂形成,同时M的沉淀损失率快速增加。故选择T=90 ℃为最佳实验条件之一。
2.3 搅拌速率对锂的回收率和M损失率的影响
实验条件如下:反应温度为90 ℃,反应时间为10 h,n(F)/n(Li)过量比为1.2,洗水温度为90 ℃,干燥温度为60 ℃,干燥时间为10 h。所得搅拌速率对锂的回收率和M损失率的影响结果如图4所示。

图4 搅拌速率对锂的回收率和M损失率的影响Fig.4 Effect of stirring rate on the recovery of lithium and M loss rate
由图4可知,当搅拌速率不高于300 r/min时,增大搅拌速率,氟化钠和锂元素的反应速率和传质率增大,氟化锂转化率变大,锂回收率增大。当搅拌速率不低于300 r/min时,正在形成的氟化锂会被大的切削力打碎,产生大量小颗粒氟化锂。从M沉淀损失率的速率增大同样可看出,增大搅拌速率,会增加表面缺陷吸附杂质元素,导致产物锂的纯度下降,故选择300 r/min的搅拌速率为最佳实验条件之一。
2.4 反应时间对锂的回收率和M损失率的影响
实验条件如下:反应温度为90 ℃,搅拌速率为300 r/min,n(F)/n(Li)过量比为1.2,洗水温度为90 ℃,干燥温度为60 ℃,干燥时间为10 h。所得反应时间对锂的回收率和M损失率的影响结果如图5所示。
由图5可以看出,反应的初始阶段,由于氟离子浓度较高,反应速率较快,氟化锂的回收率迅速增加;随着反应的进行,氟离子浓度下降,反应速率减慢,至8 h时,锂的沉淀率达最高值,随后变化不大。当反应时间较短时,反应不完全,过量的氟化钠剩余会导致氟化锂产品纯度的降低以及后续提纯困难;反应时间过长,会使得LiF的生产时间延长,从能耗、产品质量和镍、钴、锰M的损失出发,综合考虑,选择8 h为最佳实验条件之一。
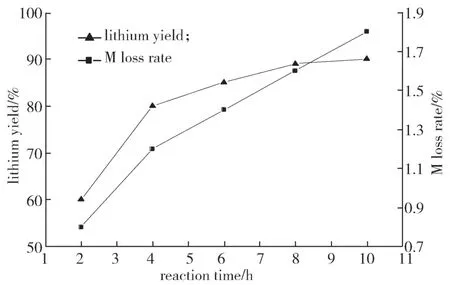
图5 反应时间对锂的回收率和M损失率的影响Fig.5 Effect of reaction time on the recovery of lithium and M loss rate
2.5 洗涤水温对锂的回收率和M损失率的影响
实验条件如下:反应温度为90 ℃,反应时间为8 h,搅拌速率为300 r/min,n(F)/n(Li)过量比为1.2,洗水温度为90 ℃,干燥温度为60 ℃,干燥时间为10 h。所得洗涤水温对锂的回收率和M损失率的影响结果如图6所示。

图6 洗涤水温对锂的回收率和M损失率的影响Fig.6 Effect of washing water temperature on the recovery of lithium and M loss rate
洗涤过程中可以除去沉淀中的NaF以及少量的镍钴锰杂质,但同时也会带走一部分LiF,造成损失。由图6可以看出,洗涤水温对锂的回收率的影响是随着洗涤水温度的升高而增大的。这是因为,氟化锂在水中的溶解度是随着温度的增加而减小的,可见,较高的水温对于减少氟化锂的损失是有利的。但水温升至90℃后,锂的回收率增幅变缓,考虑节能因素,故而在洗涤滤饼时,选取的温度应为90 ℃附近。
3 优化实验结果分析
根据上述实验结果,优化后的实验条件如下:n(F)/n(Li)过量比为1.2,反应温度为90 ℃,搅拌速率为300 r/min,反应时间为8 h,洗涤水温为90 ℃。按上述条件进行重复验证实验,证明了该方法的可行性及准确性。优化后的实验产品中各元素的质量分数见表3。经计算,优化后锂的回收率达90.31%,镍钴锰的损失率小于1.5%。
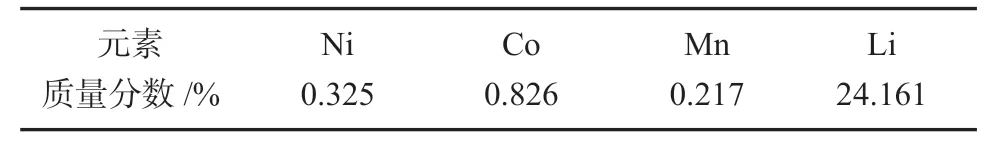
表3 优化实验所得产品各元素质量分数Table 3 Element contents of products obtained from optimized experiments
4 结论与展望
废旧锂电池经过破碎,分选出活性物质粉,再经过浸出除杂后,用氟化钠水溶液进行沉锂,考察了n(F)/n(Li)过量比、反应温度、搅拌速率、反应时间、洗涤水温对锂的回收率的影响。得出的最优条件如下:n(F)/n(Li)过量比为1.2,反应温度为90 ℃,搅拌速率为300 r/min,反应时间为8 h,洗涤水温为90 ℃。此条件下,锂的回收率达90.31%,而镍钴锰损失率小于1.5%。该方法若被应用于废旧电池回收工业生产中,可以节约成本,实现锂资源的高效循环及综合利用。此外:
1)本实验由氟化钠提供氟源,氟化钠在水中的溶解度较低,限制了反应的进行。后续研究可考虑选择更多的氟源进行探索,为更高效率地制备氟化锂提供可能。
2)本实验的最佳反应时间为8 h,反应时间较长,后续工业生产中可通过加压等方式缩短反应时间,以提高生产效率。
3)本实验对氟化钠沉锂的反应机理,如动力学、热力学等方面,并未进行深入研究和探讨,建议之后对这一反应进行深入研究,以便指导后续的生产实践。
4)本实验为寻求较高的锂的回收率,导致最优实验条件下所获得的氟化锂纯度离行业标准暂有一段距离,后续操作应考虑是否进行提纯或是否将其作为原料制备其他锂产品。
