利用网络药理学整合分子对接技术研究人参抗心力衰竭的潜在药效物质基础及作用机制*
2020-04-09李昊楠孔浩天李晓彬张姗姗张轩铭韩利文许海玉刘可春屠鹏飞
李昊楠,孔浩天,李晓彬,张姗姗,张轩铭,韩利文,2**,许海玉,刘可春,屠鹏飞
(1. 齐鲁工业大学(山东省科学院)山东省科学院生物研究所/山东省人类疾病斑马鱼模型与药物筛选工程技术研究中心 济南 250103;2. 山东省医学科学院药物研究所/山东第一医科大学 济南 256200;3. 中国中医研究院中药研究所 北京 100700;4. 北京大学药学院 北京 100700)
心力衰竭(Heart failure,简称心衰)是指心室充盈或射血能力受损的一组复杂临床综合征,它是由任何心脏结构或功能异常所引起的,是各种心脏疾病的重症和晚期阶段,发病率很高,是现今最严重的心血管疾病之一,它的主要临床表现为呼吸困难、乏力、肺瘀血和外周水肿[1]。欧美流行病学数据显示,发达国家成年人心衰的患病率为1%-2%,而70 岁以上的老年人心衰的患病率则超过10%,患病率随年龄增加[2,3]。根据近年来的实际观察,我国的心力衰竭患病率与欧美国家相差无几[4]。《中国心血管病报告2014》指出:我国心血管病的流行处于持续上升的阶段,据估计,目前全国有2.9亿心血管病患者,其中450万患有心衰[5]。心力衰竭已成为我国心血管疾病领域的重要公共卫生问题。
人参(Ginseng radix et rhizoma)微苦,性甘,含有糖类、人参皂苷、有机酸、挥发油、维生素、微量元素、氨基酸等成分[6]。作为最著名的中草药之一,人参在我国已被广泛应用了几千年。《神农本草经》记载:人参能够“定魂魄,安精神,补五脏,除邪气,止惊悸,开心益智”[7]。现代研究人参具有明显的正性肌力作用,可以显著增强心肌收缩力,改善心室重构,使心衰患者的血流动力学达到稳定状态,并有助于心脏功能及结构改善[8]。然而,人参从整体网络层次综合调节改善心衰的整体药效物质及作用机制研究尚不明确。
中药的现代化研究的基本问题是对中药多成分多靶点复杂体系的进行解析。网络药理学由英国药理学家Hopkins 率先提出,其基于整体观的研究思路与中药系统作用、网络调控的特点不谋而合[9]。“中药网络药理学”这一全新领域的研究旨在从系统水平和分子水平揭示中药处方的奥秘,并以“网络靶标,多成分药物”的新模式为目标,促进中药研究的发展[10]。国内学者在网络药理学基础上进一步提出整合药理学观点,进一步关注“中药成分群—体内过程—药效活性”的关联性,在传统中药复杂体系的解析方面也都取得可喜的进展[11]。中药复方的现代研究需要加强整合,包括整体与部分的整合,宏观与微观的整合,体内ADME(Absorption,distribution,metabolism,excretion)过程与体内活性评估的整合,计算与代谢的实验的整合,也就是进行研究整合药理学[12]。过去基于吸收、分布、代谢、排泄(ADME)过程的药代动力学过程结合网络药理学研究思路被广泛应用于中药药效物质基础与作用机理的研究中,但是,该方法基于化合物的二维结构来预测是它的不足之处[11]。如今,基于化合物的三维(3D)结构及其在分子领域中的相互作用,预测化合物的理化性质和药代动力学性质已成为一种崭新的方法[13]。许海玉[14]通过开发ETCM 数据库为了解中药成分、靶点、相关通路和与疾病之间的相关关系或建立网络提供了便利。因此,本研究以网络药理学为方法,从整体生物效应网络角度探讨分析人参治疗心衰的作用机制,以期为传统中药人参的临床科学应用提供理论依据。
1 方法
1.1 筛选人参的活性成分
通过中药系统药理学分析平台TCMSP(http://lsp.nwsuaf.edu.cn/tcmsp.php)[15],人参为关键词,检索人参中的全部化学成分。
中药或中药配方中所有成分的目标基因被认为是中药或中药配方的目标基因,与这些目标基因相关的疾病也被认为是可以通过中药或中药配方治愈的疾病[16]。口服生物利用度(oral bioavailability,OB)是药物ADME 中最重要的药物代谢动力学的参数之一,它表示口服的药物到达血液循环中所占口服剂量的比例,作用比例高的口服生物利用度一般是决定生物活性分子类药性的关键指标[17]。因此,本研究以OB ≥15%和DL ≥0.13 作为活性成分的筛选条件,筛选TCMSP中具有较高活性的化合物。
1.2 人参的活性成分潜在靶点的收集
将筛选好的候选活性成分在TCMSP 数据库[14]、SymMAP 数 据 库(http://www.symmap.org/)[18]和Swis⁃sTargetPrediction 数 据 库(http://swisstargetprediction.ch/)[19]中收集蛋白靶点,其中SwissTargetPrediction 数据库以score ≥0.5 为标准,并进一步通过Uniprot 数据库进行转化,获取与活性成分作用的相关蛋白靶点(人源)。
1.3 疾病靶点的收集
利 用DISGENET 数 据 库(http://www. disgenet.org/)[20]和Genecard数据库(https://www.genecards.org/),以心力衰竭(heart failure)为关键词,收集疾病靶点。Genecard 数据库建立基因与疾病的相关度排序,提供GIFTS 算法,依据Relevance score 可在特定疾病对应的众多靶点中进一步筛选更高相关度的靶点,以减少重复[21]。
1.4 人参活性成分-潜在靶点网络和人参活性成分-心衰疾病靶点网络构建和分析
通过 TCMSP 数据库、SymMAP 数据库和SwissTargetPrediction 数据库搜索与人参候选活性成分有关的潜在靶点,并将候选活性成分与其潜在靶蛋白导入Cytoscape 3.6.0 软件(http://www.cytoscape.org/)[22]生成人参活性成分-潜在靶点相互作用的网络图,进一步比对人参潜在靶点和心衰疾病靶点,生成人参活性成分-心衰疾病靶点关联网络图,并使用Cytoscape3.6.0 软件的插件Netweek analysis 分析网络特征,探究人参的药理机理。
1.5 蛋白质-蛋白质相互作用(PPI)网络构建
为了解靶蛋白在系统水平上的作用,在STRING数据库(http://string-dp.org/)中获得蛋白质相互作用信息,选择置信度0.7,并在Cytoscape 3.60 软件上生成人参活性成分靶点PPI图并进行拓扑分析。
1.6 GO功能富集分析
为说明人参的药物靶蛋白在基因功能中的作用,利用DAVID 数据库(https://david.ncifcrf.gov/)对PPI 网络中筛选出的核心靶点进行GO功能富集分析。
1.7 KEGG通路的富集分析
利用DAVID 数据库对PPI 网络中的靶蛋白进行KEGG 通路富集分析,使用Cytoscape 3.6.0软件可视化富集分析结果,分析人参中抗心衰活性成分显著影响的生物途径,探讨人参发挥治疗心衰作用的可能机制。
1.8 分子对接
为了进一步评价靶蛋白和化合物分子之间的相互作用,使用Ledock 分子对接软件在靶蛋白和化合物分子之间进行分子对接。下载蛋白的3D 结构,上传蛋白质的3D 结构和化合物结构信息,然后进行分子对接以获得靶蛋白和化合物分子的对接结果[23]。
2 结果
2.1 人参的活性成分的收集
通过TCMSP 数据及文献找到人参化学成分190个,以DL ≥0.13、0B ≥15%为筛选条件,筛选出符合条件的化学成分共33种,成分基本信息见表1。
2.2 人参活性成分——潜在靶点网络构建
进一步预测了33种化合物,结合uniprot数据库确认并转换,最终获得141个靶点。
使用cytoscape 3.6.0 软件对上述数据集构建化合物—潜在靶点网络图(图1),并对该网络图进行拓扑分析。该网络包括174(33 个化合物和141 个靶点)个节点和241 条边。通过图1 可以看出,经过筛选后的33 种人参活性成分具有多靶点的特点。超过10 个靶点的活性成分有人参皂苷Rb1(Ginsenoside Rb1)、山柰酚(Kaempferol)、人参皂苷Rh1(Ginsenoside-Rh1)、人 参 皂 苷Ro(Ginsenoside Ro)、人 参 皂 苷RG5(Ginsenoside Rg5)、苯代南蛇碱(Celabenzine)、β-谷甾醇(Beta-sitosterol)、盐酸前鸦片碱(Fumarine)、马卡因(Inermin)、马尔肯久纳醇苯酯(Malkangunin)。5 个以上活性成分作用在PTGS2、PTGS1、ADRB2、SLC6A2、SLC6A4、SCN5A、SLC6A3等靶点。也就是说。同一靶点作用于不同的活性成分,而不同的靶点作用于同一活性成分,体现出人参具有多种成分、多种靶点的特点。

表1 化学成分基本信息表

图1 人参化合物—潜在靶点网络图
2.3 人参活性成分—心衰疾病靶点网络构建
在DISGENET 数据库中以socre >0.7 为筛选条件,收集到心衰的疾病靶点64个,在Genecards 数据库初步筛选出9261 个候选基因,取Relevance score 值较高的结果,将两次收集的心衰疾病靶点去除重复项,共336 个疾病靶点,与人参有65 个重叠靶点。通过Cytoscape 3.60软件的Merge插件构建人参活性成分—心衰疾病靶点网络(图2)。该网络包括94 个节点(29个活性成分和65 个靶点)和135 条边。箭头代表人参活性成分,八边形代表心衰疾病靶点,箭头颜色越深代表人参活性成分在该网络中靶点越多,其中山柰酚(Kaempferol)、人参皂苷Rb1(Ginsenoside Rb1)、人参皂 苷 Rh1(Ginsenoside-Rh1)、人 参 皂 苷 Ro(Ginsenoside Ro)、盐酸前鸦片碱(Fumarine)、人参皂苷RG5(Ginsenoside Rg5)、β-谷甾醇(Beta-sitosterol)中有7 个及7 个以上靶点。八边形的颜色越深代表含有该靶点的活性成分越多,其中PTGS2、ADRB2、SCN5A、SLC6A2、SLC6A3、CHRM1、AR 有5 个及以上的活性成分中含有。
2.4 蛋白质-蛋白质相互作用(PPI)网络构建
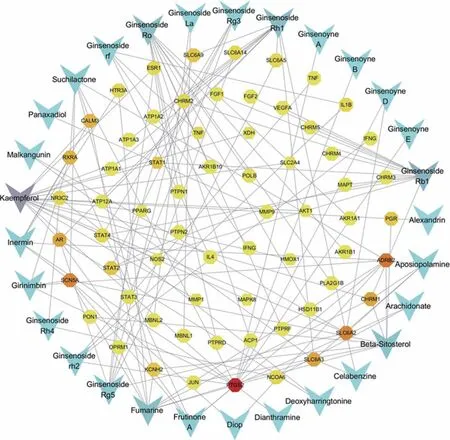
图2 人参活性成分--心衰疾病靶点网络图
为了进一步探讨人参在心衰的治疗机制,基于PPI 的关联,本研究将65 个人参与心衰相关的靶点导入STRING 数据库(http://string-dp.org/)以获得蛋白质相互作用信息,然后在Cytoscape 3.6.0 软件上构建人参参与治疗心衰相关靶点的PPI 网络(图3)。人参疾病靶点的PPI 网络包含50 个节点和180 条交互关系。节点颜色的深浅代表该节点的Degree 值的大小,颜色越深代表Degree 值越大。利用Cytoscape 软件分析了人参PPI 网络拓扑学的特征,发现有20 个节点的度大于平均值(度=7.2),占总节点数的40%。结果显示,人参治疗心衰涉及的关键靶点包括STAT3、JUN、IL1B、TNF、MAPK8、VEGFA、PTGS2、NOS2、MMP9 等,其中度值最高的为STAT3,能与23 个蛋白发生相互作用。
2.5 GO功能富集分析
在DAVID 数据库对人参治疗心衰的50 个关键靶点进行GO 功能富集分析共收集到108 条。根据P 值(P <0.05),列出了65条符合条件的GO条目其中包括生物过程(BP)、分子功能(MF)、细胞组成(CC)(表2)。结果主要涉及一氧化氮生物合成过程(positive regulation of nitric oxide biosynthetic process)、平滑肌细胞增殖(positive regulation of smooth muscle cell proliferation)、类 固 醇 激 素 受 体(steroid hormone receptor activity) 、心 肌 收 缩(cardiac muscle contraction)、血压调节(regulation of blood pressure)、JAK-STAT 级联(JAK-STAT cascade)、心肌细胞收缩的调节(regulation of cardiac muscle cell contraction)等方面功能。

图3 人参治疗心衰靶点的相互作用网络图
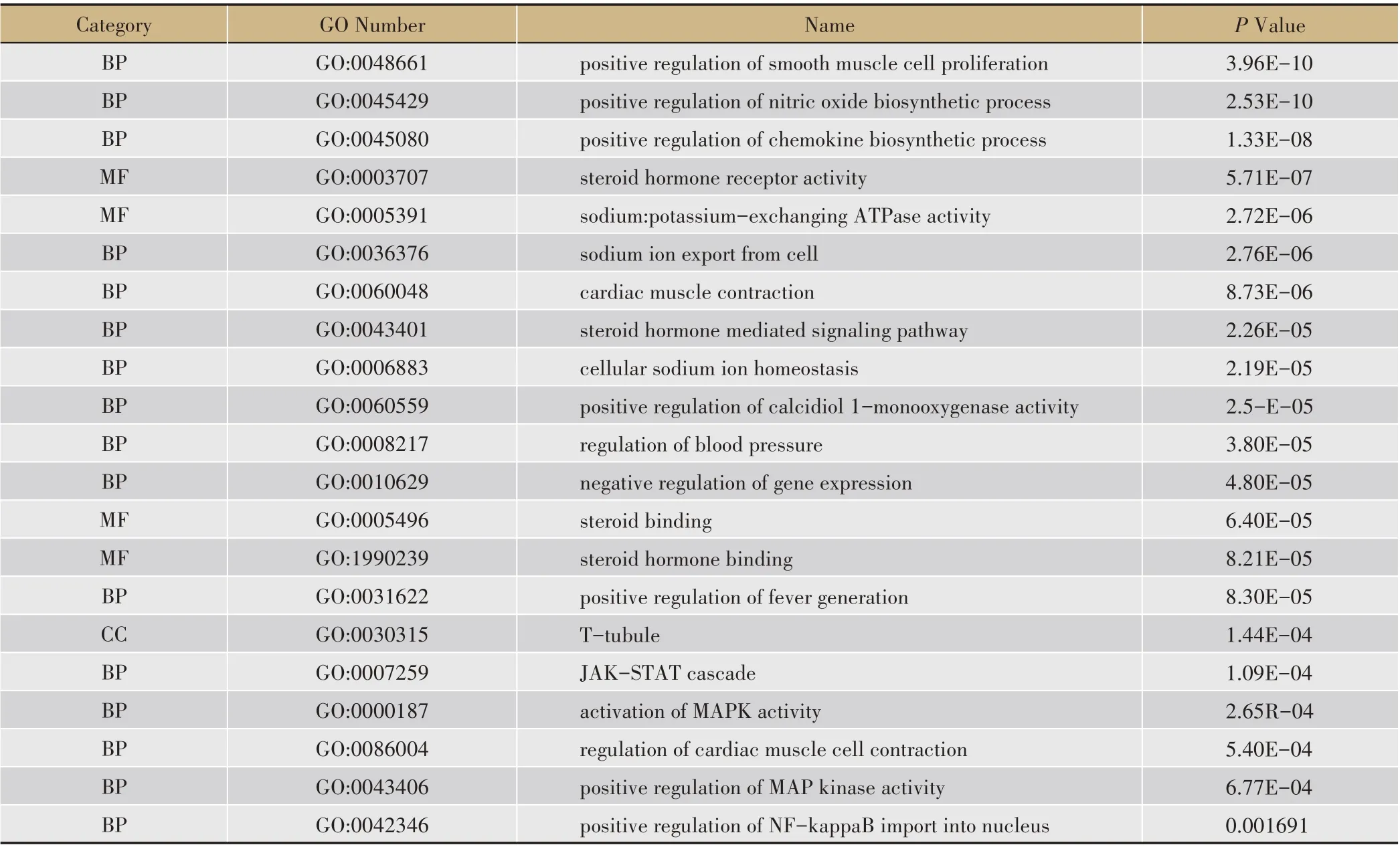
表2 GO富集分析表
2.6 KEGG通路富集分析
生物途径通过它们所构成的不同靶蛋白之间的相互作用来执行其特定的生物学功能,是认识疾病临床表现的生理基础。药物对疾病的干预不仅与靶蛋白有关,还受靶蛋白所处的生物途径的影响,通过相互作用使发生紊乱的机体重新恢复平衡,具有多成分、多靶点、多通路特点,中药更是如此。将50个靶点蛋白导入DAVID 数据库进行KEGG 通路注释分析,共富集出71 条信号通路,其中符合P <0.05 的信号通路有55条,与炎症、细胞分化、生长发育、心肌肥大、调节钙离子吸收等信号通路(表3)。
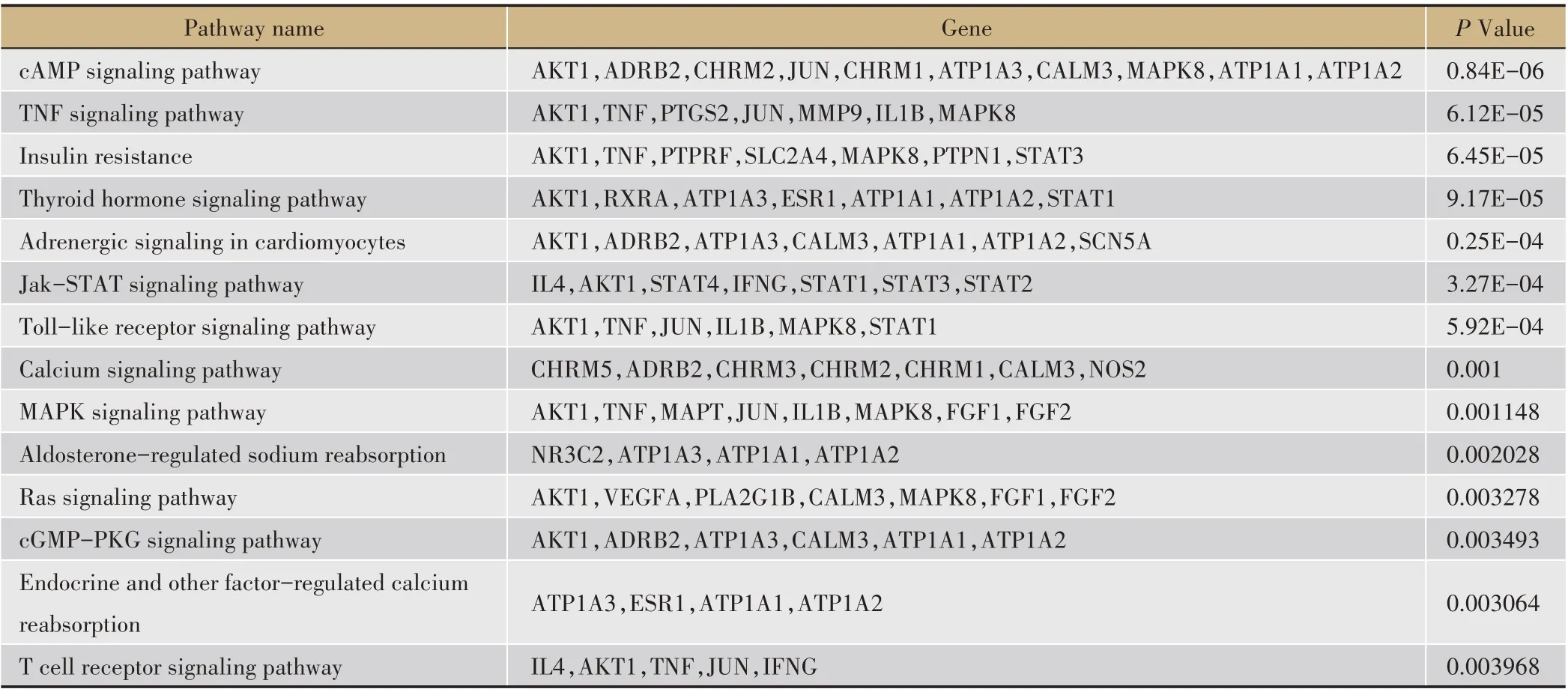
表3 pathway信息表
2.7 人参活性成分-靶点生物通路网络构建
富集分析得到的信号通路对应人参治疗心衰的靶点及成分,构建“人参活性成分—靶点—信号通路”网络(图4)。此网络由74 个节点和178 条边组成,紫色三角表示人参的成分,绿色方块表示潜在靶点,红色箭头表示信号通路。节点的大小表示对心衰的重要 程 度。 其 中cAMP signaling pathway、Thyroid hormone signaling pathway、MAPK signaling pathway、TNF signaling pathway、Ras signaling pathway、Jak-STAT signaling pathway、Calcium signaling pathway 等信号通路对心衰更重要,可能是治疗心衰的重要信号通路。每种活性成分对应于多个靶点,并且每个靶点都与多种成分相关,这反映了人参的多成分和多靶点治疗心力衰竭的作用机理。同时,多个途径通过一个共同的靶点连接而非独立分开的,这表明每条途径之间可以发挥协同作用来治疗心衰。
2.8 分子对接结果
利用Ledock 分子对接软件,将心衰关键靶蛋白与关键化合物进行分子对接。结果如下(表4):可见7种人参成分与5 种心衰关键靶点均有较好的对接结果,其中Ginsenoside Rh1 与STAT3、JUN、MAPK8、IL1β 对接活性最好,Ginsenoside Ro 与PTGS2 的接合活性最好。提示这些成分在人参抗心衰治疗中具有重要作用,可作为未来人参单体成分提取用于治疗心血管疾病的研究对象。
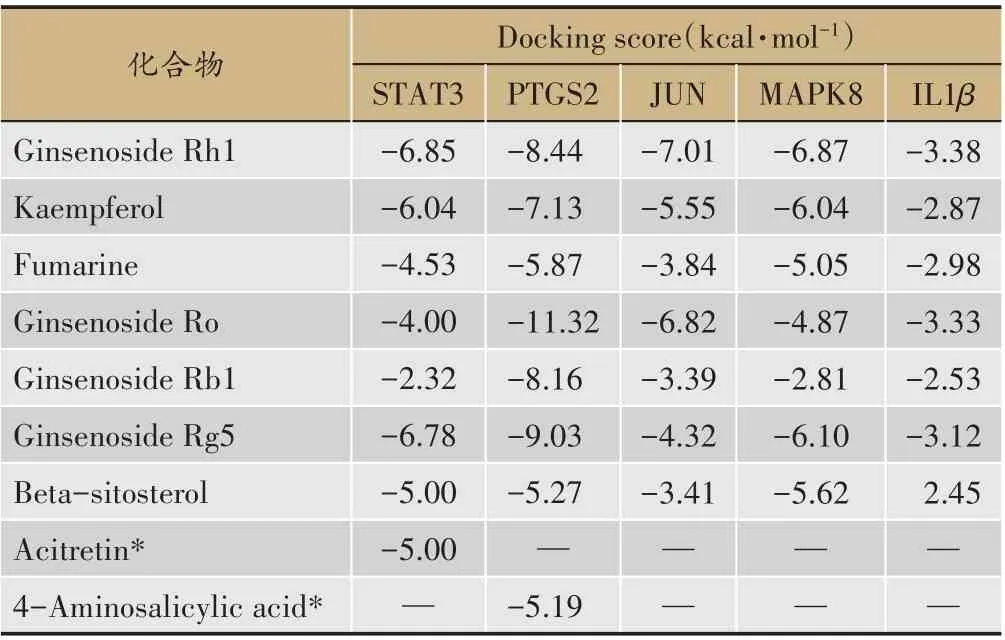
表4 分子对接结果
3 讨论
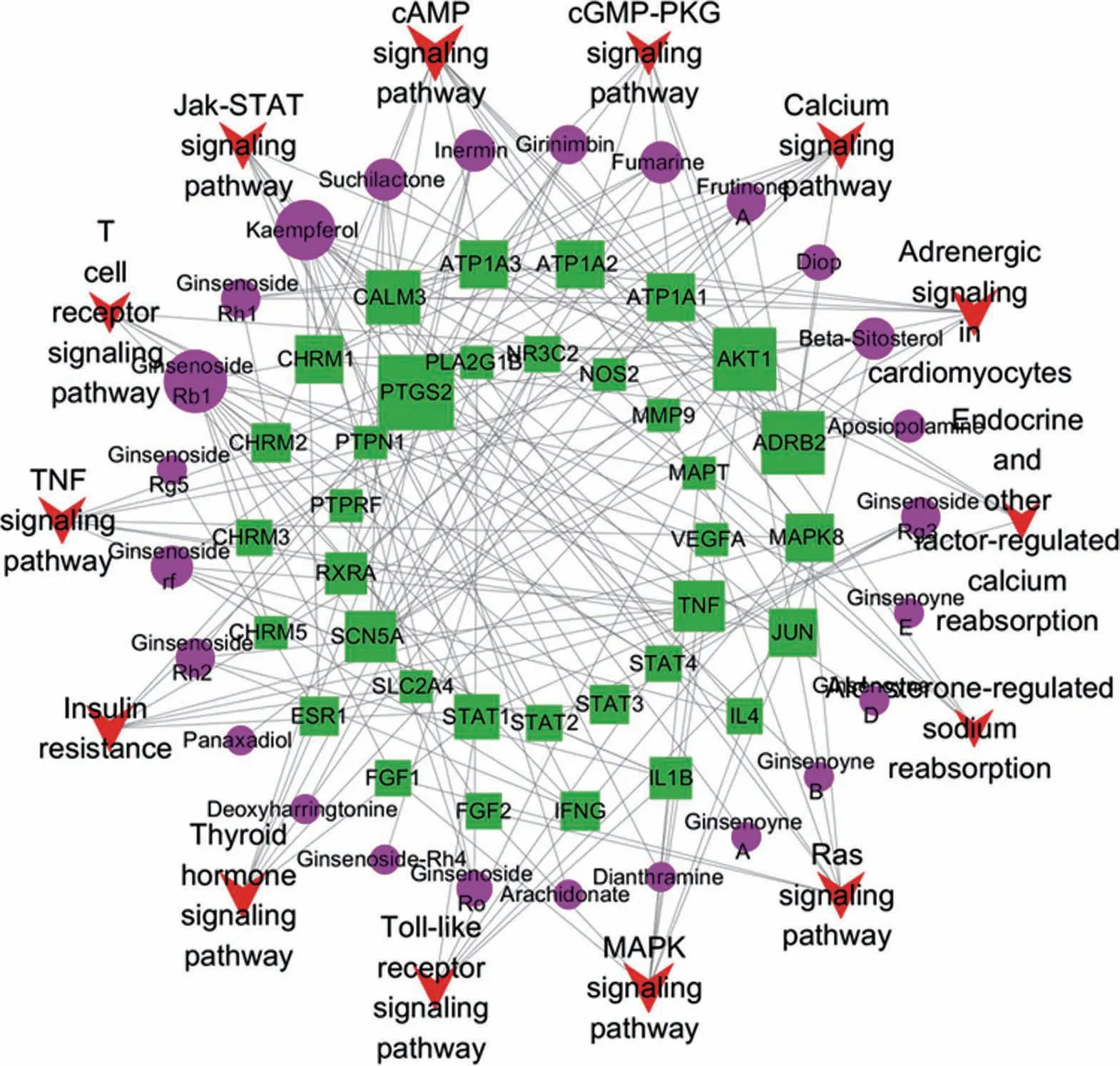
图4 人参活性成分—靶点—信号通路图
人参含有的化学成分有人参皂苷、人参多糖、挥发油(萜类、醇类、脂肪酸类等)和氨基酸等。人参皂苷根据糖苷配基被分为3 类:原人参二醇(Ra1,Ra2,Ra3,Rb1,Rb2,Rb3,Rc,Rd,Rg3,Rh2 等)、原人参三醇(Re,Rg1,Rg2,Rf,Rh1 等)和齐墩果酸(Ro),共有约30 多种[24]。人参多糖包括淀粉样葡聚糖和酸性果胶[25]。人参挥发油主要由倍半萜类物质、醇类、酮类、醛类组成。聚乙炔醇类也是一类重要的成分,此外,人参还含有具有较高活性的其他脂溶性成分比如亚油酸、甾醇、聚炔类等化合物[26]。本研究通过TCMSP数据库和文献共筛选出33种人参的活性成分,经心力衰竭疾病靶点对接得到29 种人参活性成分。其中山柰酚(Kaempferol)、人参皂苷Rb1(Ginsenoside Rb1)、人 参 皂 苷Rh1(Ginsenoside-Rh1)、人 参 皂 苷Ro(Ginsenoside Ro)、盐酸前鸦片碱(Fumarine)、人参皂苷RG5(Ginsenoside Rg5)、β-谷甾醇(Beta-sitosterol)是人参发挥抗心衰作用的关键成分。现代药理学研究已经证实心力衰竭的发病机制与离子缺陷、炎症和重构、心肌肥厚有关[27]。山奈酚在心血管系统具有广泛的活性,如抗氧化、抗动脉粥样硬化、清除自由基等[28,29]。相关研究发现[30-33],人参皂苷Rb1 能够通过影响心肌组织periostin 蛋白的表达,抑制TGF-β 信号通路,从而改善心衰大鼠心室重构,防治心力衰竭。吴巍[34]研究表明,不同剂量的人参皂苷Rh1 均能明显减少结扎冠状动脉所致大鼠急性心肌缺血引起的心肌梗死面积,并可降低由心肌缺血造成的肢体导联心电图J 点的升高,揭示了人参皂苷Rh1 对心肌具有保护作用,能降低缺血引起的心肌损伤。JN C 等人[35]研究发现β-谷甾醇抗炎作用机制是通过减少NO 的合成,抑制巨噬细胞IL-6 活性,减少IL-1、TNF-等炎性因子的分泌。人参皂苷Rf以剂量依赖性方式显著抑制IL-6,IL-1β 和TNF-α 的产生而显示出抗炎作用[36]。此外,本文通过网络分析预测新发现人参皂苷Ro、盐酸前鸦片碱(Fumarine)、人参皂苷Rg5 也与抗心衰作用有关,但目前没有明确的相关文献报道,可能是有待确认的新的药效成分,值得进一步的研究关注。
本研究通过预测发现,STAT3、STAT1、MMP9、PTGS2、JUN、IL1β、MAPK8.等靶点可能为人参治疗心衰的关键靶点。其中信号转导及转录激活因字3(signal transducer and activator of transcription 3,STAT3)是JAK-STATs 信号传导通路的关键蛋白,压力负荷导致的心肌肥大、心力衰竭与这一通路密切相关[37]。ZHANG 等[38]研究发现抑制STAT3 蛋白活化能显著降低心肌细胞肥大,抑制心肌细胞凋亡,阻止心肌纤维化,改善心室重构,从而有效地延缓心力衰竭。心衰心肌组织中MMP9 的表达及活性增加,且MMPs/TIMPs比例失衡,从而导致正常心肌胶原纤维的降解,使胶原网络重构,诱发心室扩张[39,40]。研究发现,心力衰竭病人IL-1 水平较正常人升高,且IL-1 水平越高,心力衰竭程度可能越严重[41],白细胞介素-1β(IL-1β)通过抑制心肌蛋白合成,促进其分解、抑制Na+-K+-ATP 酶活性等多种作用机制对心肌细胞具有负性肌力作用[42];IL-1β 表达持续升高可诱导心肌肥厚,增加心肌重塑[43]。通过分子对接技术,本研究发现的7 种人参关键成分与以上关键靶点的对接结果良好,说明人参关键成分和心衰关键靶点有结合活性。
GO分析和KEGG信号通路分析结果显示,人参治疗心衰涉及到了MAPK 信号通路、TNF 信号通路、Toll样受体信号通路、JAK-STAT 信号通路、cGMP-PKG 信号通路、cAMP 信号通路、心肌肾上腺素信号通路等。MAPK 信号通路与心衰、心梗梗死和心肌肥厚等多种心血管疾病的发生密切相关[44]。NO 的生物利用度的降低会导致cGMP-PKG 信号通路的中断,造成心肌肥厚、重塑,缩舒功能不全和硬化。人参通过促进NO 的生物合成,增加NO 的生物利用度和氧化应激功能,来上调cGMP 信号通路,达到改善HF 的症状及并发症[45]。心肌肾上腺素信号通路与cAMP 信号通路有关,前者含有3 种βARs 亚型,即β1 肾上腺素受体(β 1AR)、β2 肾上腺素受体(β2AR)和β3 肾上腺素受体(β 3AR),β1AR 和β2AR 活化后,可经Gs 蛋白-腺苷酸环化酶(AC)-cAMP-蛋白激酶A(PKA),激活Gs-ACcAMP-PKA 信号通路增强心功能[46],促进细胞质内钙离子增多,增加了钙瞬变及收缩振幅和动力。在心房组织中,β3AR 通过Gs-AC-cAMP-PKA 途径引起类似于β1AR、β2AR 效应;在心室肌细胞中,β3AR 通过GieNOS-NO-cGMP 途径发挥负性变力效应[47]。白介素(IL)激活的Janus 激酶(Janus kinases,JAK)/信号转导及转录激活因子(signal transduction and activator of transcri ption,STAT)也可介导心肌缺血再灌注损伤、心肌肥大、心室重构、心肌炎症等,甚至可影响局部肾素-血管紧张素-醛固酮系统(RAAS)[48-50],因其影响了心力衰竭过程中的各个环节。
综上所述,本研究运用网络药理学的方法研究人参治疗心力衰竭的机制,发现中药人参通过山柰酚、人参皂苷Rb1、人参皂苷Rh1、人参皂苷Ro、人参皂苷RG5、β-谷甾醇等药效成分协同作用于STAT3、STAT1、MMP9、PTGS2、JUN、IL1β、MAPK8.等多个靶点,参与炎症通路、JAK-STAT 信号通路、cGMP-PKG信号通路、cAMP 信号通路、MAPK 信号通路等多信号通路发挥治疗心衰疾病的作用,为人参的药效基础物质基础与机制研究提供了方向,为进一步系统地开展人参治疗心力衰竭的实验研究及临床应用提供理论依据。
