MiR-367通过Wnt/β-catenin通路抑制成骨细胞增殖的研究
2020-04-09马建国高志明靳雷
马建国,高志明,靳雷
(南部战区海军第二医院骨科,海南 三亚 570008)
骨质疏松是以骨超微结构改变、骨量丢失、骨质脆性增加为特征的骨代谢性疾病,近年来随着人口老龄化的加剧,骨质疏松的发生率也呈逐年升高的趋势,相应的骨折风险也明显增加[1]。成骨细胞所介导的骨形成过程在调节骨超微结构、维持骨量中起到重要作用[2-3]。在间充质干细胞向成熟成骨细胞分化及成骨细胞增殖的过程中,成熟的成骨细胞一方面大量分泌骨钙素(osteocalcin,OCN)、I型胶原(Collagen-I,Col-Ⅰ)并参与骨基质的形成,另一方面大量分泌碱性磷酸酶(alkaline phosphatase,ALP)并参与骨矿化的过程,两方面因素共同作用得以使骨组织维持完整的结构[4-5]。在骨质疏松的发生过程中,成骨细胞的分化及增殖均受到抑制,但目前调控成骨细胞分化和增殖的机制仍未完全明确。
微小RNA(microRNA,miR)是具有广泛生物学作用的非编码小分子RNA,虽然本身不具备编码蛋白质的功能,但是与基因mRNA的3’非翻译区结合后能够调节基因表达并通过基因表达的变化来产生相应的生物学活性。近年来关于miR与骨质疏松的研究表明,多种miR与骨质疏松的发生有关[6-7],骨质疏松过程中成骨细胞的分化、增殖受到与miR185、miR-214、miR-367等miR的调控[8-9]。其中miR-367是能够靶向Wnt/β-连环蛋白(β-catenin)通路的miR[10],该通路在成骨细胞的分化及增殖中起到重要作用。基于此,本研究具体分析了MiR-367通过Wnt/β-catenin对成骨细胞分化及增殖的调节作用。
1 材料与方法
1.1 实验设计 细胞培养及分子生物学实验。
1.2 实验时间和地点 于2017年6月至2018年10月在医院中心实验室完成。
1.3 实验材料 骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)购自上海中科院细胞资源中心,新生24 h的SD大鼠购自上海斯莱克实验动物公司,细胞培养所用杜氏改良Eagle培养基(Dulbeeeo’s modified eagle medium,DMEM)、α-低限量Eagle培养基(α-minimal essential medium,α-MEM)、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶购自Gibco公司,地塞米松、β-甘油磷酸钠、维生素C、溴化噻唑蓝四氮唑(thiazolyl blue tetrazolium bromide MTT)、茜素红购自Sigma公司,Lipofectamine2000试剂购自Invitrogen公司,miR-367-3p模拟物(序列3’-AGUGGUAACGAUUUCACGUUAA-5’)、抑制物及阴性对照(negative control,NC)模拟物、抑制剂由上海吉玛公司合成,β-catenin、Runt2相关转录因子2(runt-related transcription factor 2,RUNX2)、ALP、OCN、Col-Ⅰ的引物由上海生工公司合成,β-catenin、RUNX2、ALP、OCN、Col-Ⅰ的第一抗体购自Abcam公司。
1.4 实验方法
1.4.1 BMSCs的转染及诱导分化 BMSCs复苏后用含有10%FBS的DMEM培养,细胞融合至90%后用0.25%的胰酶消化、传代,取第3~5代细胞进行转染及诱导分化。用转染试剂Lipofectamine2000分别将miR-367模拟物、抑制物及NC模拟物、抑制剂转染进入BMSCs。转染24 h后将培养基更换为成骨诱导培养基、诱导BMSCs向成骨分化,具体成骨培养基为含有0.1 μmol/L地塞米松、10mmol/L β-甘油磷酸钠、50 mg/L维生素C、10%胎牛血清的α-MEM。
1.4.2 成骨细胞的培养、转染及处理 取新生SD大鼠5只,无菌条件下解剖颅盖骨后取出骨膜、结缔组织,将组织剪成1 mm3的碎块,用0.25%胰蛋白酶2 mL消化10 min、加入血清终止消化并收集消化液、离心后保留沉淀,加入0.1% Ⅱ型胶原酶继续消化沉淀物100 min,加入血清终止消化后收集消化液、离心后得到细胞沉淀,重悬细胞后用200目滤网过滤并最终得到成骨细胞悬液;成骨细胞用含有5%FBS的DMEM培养、用0.25胰酶传代,取第3代成骨细胞并用转染试剂Lipofectamine2000分别转染miR-367模拟物、抑制物及NC模拟物、抑制剂转染,或联合使用β-catenin抑制剂SKL2001(40 μmol/L)、β-catenin激动剂XAV939(40 μmol/L),持续24 h。
1.4.3 成骨分化的茜素红染色 BMSCs成骨诱导2~4周后,根据细胞形态判断成骨情况后,先用75%乙醇固定细胞30 min,蒸馏水冲洗3次后加入0.1%茜素红(pH8.3)染色、37℃、30 min,染色后拍照记录;加入10%氯化十六烷基吡啶500 μL、溶解骨结节后吸取50 μL液体,加入96孔板并在酶标仪上测定570 nm处的吸光值(OD570)。
1.4.4 细胞增殖的MTT检测 成骨细胞接种在96孔培养板中(每个条件设置5个复孔),转染miR-367或NC的模拟物、抑制物后24 h,向96孔培养板中加入MTT染色液10 μL,37℃培养箱内继续孵育4 h,而后弃去培养孔内的全部液体并加DMSO溶液150 μL,轻微震荡培养板、使结晶充分溶解后在酶标仪上测定490 nm处的吸光值(OD490)。
1.4.5 基因表达的荧光定量PCR检测 成骨细胞不同条件干预后24 h,采用天根公司的试剂盒进行检测,首先细胞/细菌总RNA提取试剂盒分离细胞内的RNA,而后通过FastKing一步法除基因组cDNA第一链合成预混试剂将RNA反转录为cDNA,最后采用Talent荧光定量检测试剂盒配置反应体系如下(每个条件设置3个复孔):cDNA 1~2 μL、10 μmol/L的正向引物和反向引物各0.6 μL、试剂盒中的PCR反应混合液10 μL、去离子水补足至20 μL;反应程序如下:95℃ 5s、60℃ 15s,重复40个循环。在反应曲线上读取循环阈值(Ct),以β-actin为内参、参照公式2-ΔΔCt计算基因的mRNA表达水平。引物序列见表1。

表1 基因的引物序列
1.4.6 基因表达的western-blot检测 成骨细胞不同条件干预后24 h,采用碧云天公司生成的蛋白裂解液提取细胞中的总蛋白,蛋白样本加入预先配置好的SDS-聚丙烯酰胺凝胶的点样槽内,进行电泳、转膜、封闭、第一孵育抗体过夜、第二抗体孵育1 h的操作后,在NC膜上加入显影液、在天能公司生成的显影仪中显影得到β-catenin、RUNX2、ALP、OCN、Col-Ⅰ的蛋白条带,用Image J软件计算蛋白条带的灰度值,而后计算β-catenin/β-actin、RUNX2/β-actin、ALP/β-actin、OCN/β-actin、Col-Ⅰ/β-actin的比值,以此作为基因的蛋白表达量。
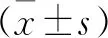
2 结 果
2.1 miR-367模拟物及抑制剂的转染效率 转染miR-367模拟物的细胞中miR-367的表达量为(2.25±0.52),明显高于转染NC模拟物的细胞中miR-367的表达量(0.83±0.15);转染miR-367抑制剂的细胞中miR-367的表达量为(0.41±0.09),明显高于转染NC抑制剂的细胞中miR-367的表达量(0.89±0.16)。
2.2 miR-367对BMSCs成骨分化的调节 转染miR-367的模拟物后,茜素红染色后的OD570值与转染NC的模拟物比较差异无统计学意义(P>0.05);转染miR-367的抑制剂后,茜素红染色后的OD570值与转染NC的抑制剂比较差异无统计学意义(P>0.05)。见图1~4。
2.3 miR-367对新生大鼠成骨细胞增殖活力的调节 转染miR-367的模拟物后,细胞的MTTOD490值明显低于转染NC模拟物的细胞;转染miR-367的抑制剂后,细胞的MTTOD490值明显高于转染NC抑制剂的细胞(P<0.05,见图5~6)。

图1 转染NC及miR-367模拟物后的茜素红染色图 图2 转染NC及miR-367抑制物后的茜素红染色图

注:*与NC模拟物比较,P<0.05 注:*与NC抑制物比较,P<0.05
图3 转染NC及miR-367模拟物后的OD570值 图4 转染NC及miR-367抑制物后的OD570值 图5 转染NC及miR-367模拟物后的OD490值 图6 转染NC及miR-367抑制物后的的OD490值
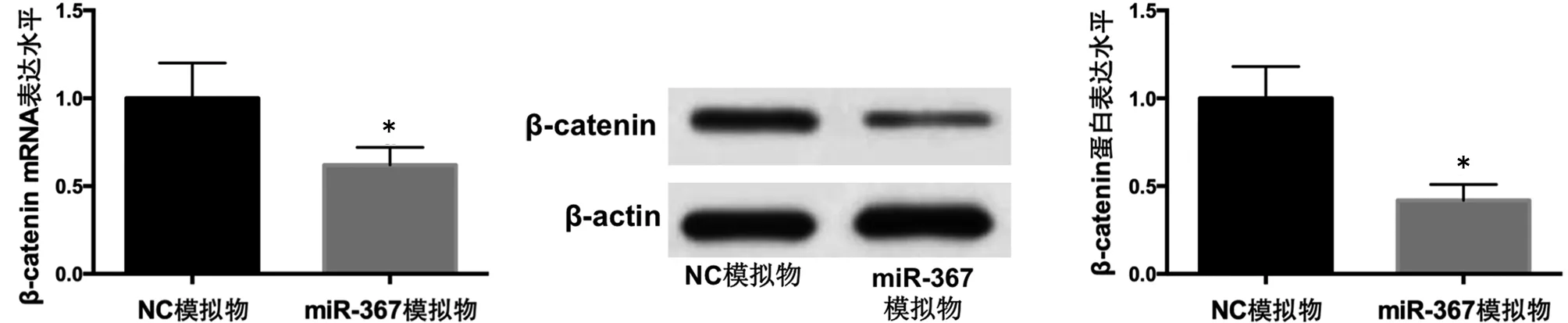
2.4 miR-367对新生大鼠成骨细胞中β-catenin表达的调节 转染miR-367模拟物后,β-catenin的mRNA表达水平及蛋白表达水平明显低于转染NC模拟物的细胞(P<0.05);转染miR-367抑制物后,β-catenin的mRNA表达水平及蛋白表达水平明显高于转染NC抑制物的细胞(P<0.05)。见图7~12。
2.5 miR-367通过Wnt/β-catenin通路调节新生大鼠成骨细胞中成骨标志基因的表达 转染miR-367模拟物后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表达水平及蛋白表达水平明显低于转染NC模拟物的细胞;转染miR-367模拟物并联合β-catenin激动剂SKL2001处理后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表达水平及蛋白表达水平明显高于转染miR-367模拟物的细胞(P<0.05)。见表2,见图13~14。
转染miR-367抑制物后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表达水平及蛋白表达水平明显高于转染NC抑制物的细胞;转染miR-367抑制物并联合β-catenin抑制剂XAV939处理后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表达水平及蛋白表达水平明显低于转染miR-367抑制物的细胞(P<0.05)。见表3,见图15~16。
3 讨 论
骨质疏松是好发于老年人、绝经后女性的骨代谢性疾病,骨超微结构的改变及骨骼脆性的增加会使骨折的风险加大,需要积极进行防治。成骨细胞介导骨形成过程和破骨细胞介导骨吸收过程的平衡在调节骨代谢、维持骨质正常结构中起到关键作用。成熟骨组织是含有丰富骨基质且高度矿化的组装,成骨细胞的分化成熟、增殖能够分泌OCN、Col-Ⅰ等成分并直接参与骨基质的形成,成骨细胞的矿化能够维持骨骼的矿化[11-12];当成骨细胞的分化及增殖受到抑制时,骨基质形成及矿化均会受到影响并参与骨质疏松的发生[13-14]。目前,调节成骨细胞分化、增殖及矿化的机制仍未完全阐明。
MiR是近年来受到越来越多关注的非编码小分子RNA,靶向结合基因mRNA的3’非翻译区、在转录后水平调节基因表达后影响细胞的多种生物学行为、参与体内多个组织脏器中的不同生物学过程。miR-367已被证实能够靶向抑制信号通路Wnt/β-catenin[10],而该信号通路被多项研究证实在成骨细胞分化、增殖中起到重要作用[15-16]。为了明确miR-367在成骨细胞分化、增殖及矿化中所起的作用,本研究分别培养了BMSCs和新生大鼠成骨细胞,通过转染miR-367模拟物及抑制物的方式来增强或拮抗细胞内miR-367的功能。在BMSCs中转染miR-367的模拟物或抑制物后,茜素红染色结果提示细胞的成骨分化过程未受到明显影响,提示miR-367不直接影响BMSCs向成骨细胞分化过程。在新生大鼠成骨细胞中转染miR-367的模拟物或抑制物后,MTT检测结果显示miR-367的模拟物能够使细胞增殖活力下降、而miR-367的抑制物能够使细胞的增殖活力增强。由此提示miR-367在成骨细胞的增殖过程中起抑制作用。
注:*与NC模拟物比较,P<0.05 注:*与NC模拟物比较,P<0.05

注:*与NC抑制物比较,P<0.05 注:*与NC抑制物比较,P<0.05
图10 转染NC及miR-367抑制物后β-catenin的mRNA表达水平 图11 转染NC及miR-367抑制物后β-catenin的蛋白条带 图12 转染NC及miR-367抑制物后β-catenin的蛋白表达水平
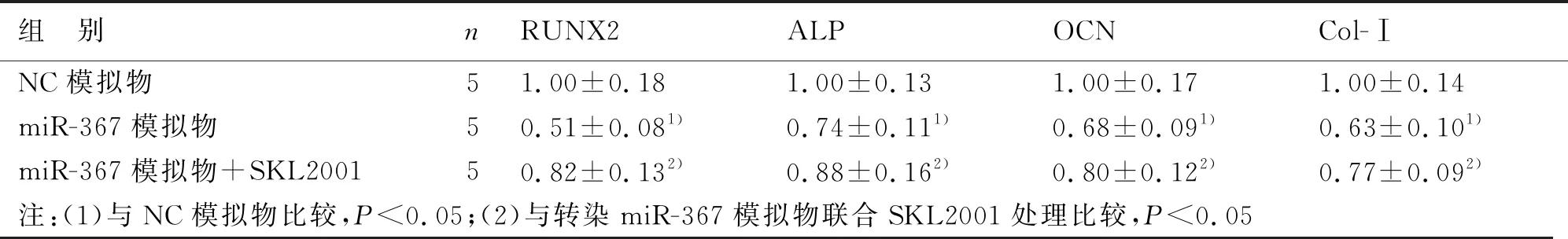
表2 转染miR-367模拟物后成骨标志基因的mRNA表达

表3 转染miR-367的抑制物后成骨标志基因的mRNA表达

图13 转染miR-367模拟物后成骨标志基因的蛋白条带 图15 转染miR-367抑制物后成骨标志基因的蛋白条带
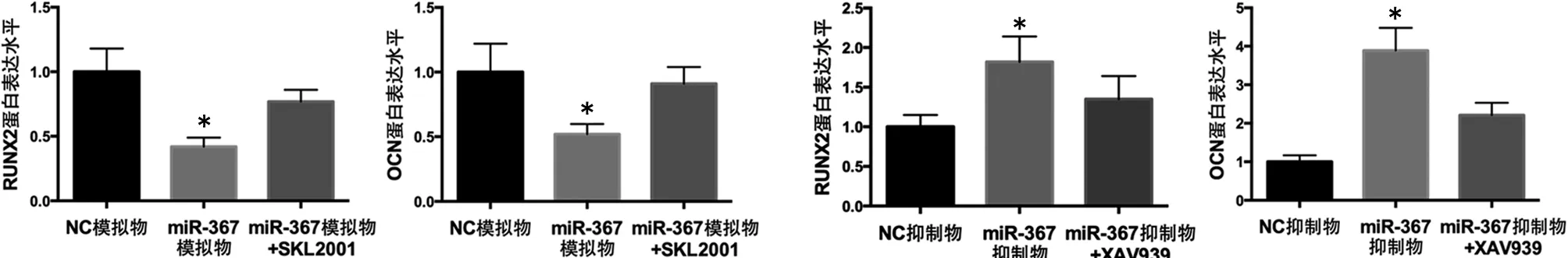
a RUNX2蛋白表达 b OCN蛋白表达 a RUNX2蛋白表达 b OCN蛋白表达

c ALP蛋白表达 d COL-1蛋白表达 c ALP蛋白表达 d COL-1蛋白表达
注:*与NC模拟物、转染miR-367模拟物联合SKL2001处理比较,均P<0.05 注:*与NC抑制物、转染miR-367抑制物联合XAV939处理比较,均P<0.05
图14 转染miR-367模拟物后成骨标志基因的蛋白表达水平 图16 转染miR-367抑制物后成骨标志基因的蛋白表达水平
Wnt/β-catenin通路在成骨细胞分化、增殖的过程中起到重要作用,β-catenin是该通路的核心分子。细胞内由细胞支架蛋白(Axin)、糖原合成激酶3β(glycogen synthesis kinase 3β,GSK-3β)、结肠腺瘤样息肉病基因(adenomatous polyposis coli,APC)组成的复合体能够发挥对β-catenin的降解作用,进而使Wnt/β-catenin通路处于失活或受抑制的状态。当Wnt发生活化时,Wnt与受体LRP5/6结合后能够使Axin/β-catenin/APC复合体发生解离,进而削弱了该复合体对β-catenin的降解作用,最终使β-catenin在细胞内累积并逐步进入细胞核、通过Tcf/Lef来调控下游多种靶基因的表达[17-18]。Target scan生物信息学分析显示,β-catenin的mRNA 3’非翻译区上有miR-367的结合位点,提示miR-367能够靶向抑制β-catenin的表达。本研究在转染miR-367的模拟物或抑制物后,观察了成骨细胞中β-catenin表达的变化,结果如下:miR-367的模拟物能够使成骨细胞中β-catenin的表达水平降低、而miR-367的抑制物能够使成骨细胞中β-catenin的表达水平升高。这一结果表明miR-367能够靶向抑制成骨细胞中Wnt/β-catenin通路的激活,这也可能是miR-367发挥成骨细胞增殖抑制作用的分子机制。
为了验证Wnt/β-catenin通路在miR-367调节成骨细胞增殖中所起的作用及受其靶向调控的基因,本研究对多种成骨标志基因的表达进行了分析。RUNX2的编码产物是调控成骨细胞分化及增殖的转录因子,决定了成骨细胞的分化及增殖活力;ALP的编码产物是参与骨基质矿化的代谢酶,决定了骨矿化程度;OCN和Col-Ⅰ的编码产物分别是骨基质内主要的非胶原成分和胶原成分,决定了骨基质的含量。在转染miR-367的模拟物和抑制物后,成骨细胞中上述成骨标志基因的表达水平分别发生了下调和上调;在转染miR-367模拟物的同时联合使用β-catenin的激活剂能够逆转miR-367模拟物下调成骨标志基因表达的效应,而在转染miR-367抑制物的同时联合使用β-catenin的抑制剂能够逆转miR-367抑制物上调成骨标志基因表达的效应。以上结果表明miR-367抑制成骨细胞增殖、抑制成骨标志基因表达的效应部分由Wnt/β-catenin通路介导。
综上所述,miR-367能够抑制成骨细胞的增殖,但不影响成骨细胞的分化,同时也能抑制成骨细胞中Wnt/β-catenin通路的激活;今后可进一步设计实验、通过过表达β-catenin的方式来逆转miR-367对成骨细胞增殖的调节作用,进而验证miR-367是否直接通过抑制Wnt/β-catenin通路来影响成骨细胞的增殖。
