柑橘AN1 基因(CsAN1)在柠檬酸积累中的作用及不同因素对其表达的影响
2020-04-09杨文萱罗丽娟柳东海刘永忠
杨文萱,罗丽娟,陈 欢,柳东海,刘永忠
华中农业大学 园艺林学学院,湖北 武汉 430070
柠檬酸作为柑橘果实中的主要有机酸,是决定柑橘果实风味的关键因素,在拉动消费者购买力方面具有重要作用,而如今市场上的柑橘柠檬酸含量过高,口感酸涩不佳,加之柑橘种植面积广,群众对柑橘品质要求较高,大量柑橘滞销严重,造成了资源的极大浪费。因此,本试验认为研究柠檬酸积累对调控柑橘果实风味具有非常重要的意义。
PH5是细胞质膜上的一种P 型ATP 酶基因,具有决定液泡pH 的功能[1]。而CsPH8是PH5的同源基因,前期研究认为它极有可能调节柑橘果实液泡中的柠檬酸积累[2]。2016 年Verweij 等[3]提出一个调控PH5的模型:AN11-AN1-PH4形成复合体调控PH3转录,然后PH3 翻译蛋白又与AN11-AN1-PH4复合体结合调控PH5 的转录,本课题组宁东媛[4]分别从柑橘基因组中克隆了调控CsPH8的CsAN1、AN11、PH3和PH4基因,发现红暗柳中的CsAN1在CsPH8低表达中可能起到非常重要的作用。
AN1是bHLH 家族转录因子,参与花青素合成,且可调节花瓣中液泡酸化和种皮细胞的大小及形态[5]。Bianchi,et al[6]发现,AN1等位基因并不稳定,极易受外界各种因素影响,当温度由18°C升高至25°C 时,参与花青素合成的AN1等位基因表达水平大幅下降,矮牵牛花瓣的斑点密度显著增加。但是,关于CsAN1与柠檬酸关系的研究却鲜见报道,对于何种外界各种因素影响CsAN1的表达仍不明确。因此,研究CsAN1在柑橘柠檬酸积累中的作用以及探讨不同因素对该基因表达影响及调控柠檬酸积累具有重要意义。
本课题基于以上背景,以不同品种为材料分析了CsAN1、CsPH8的表达水平和有机酸含量以探讨三者之间的关系,并且在离体与活体两种条件下,分析不同条件对CsAN1表达的影响。通过研究,初步明确CsAN1的表达水平与柠檬酸积累之间的关系,以及不同因素对CsAN1的表达水平的影响。
1 材料与方法
1.1 实验材料的处理与培养基
1.1.1 实验材料的处理 华中农业大学基地果园的暗柳橙(Citrus sinensis cv.Anliu)和红暗柳橙(HL,C.sinesnsiscv.Honganliu)分别于盛花后124、146、165、186、207 d 采收。离体处理的国庆1 号温州蜜柑(C.unshiu cv.GuoqingNo.1)和华柑2 号椪柑(C.reticulata cv.HuaganNO.2)来自华中农业大学园林楼,时期为花后94 d,进行汁胞组织培养。活体处理中矿质元素处理的国庆一号温州蜜柑来自华中农业大学花果山基地,选取三棵温州蜜柑果树,编号为1、2、3。1 号果树施用氮肥,选取枝干A、B。A 枝干作为对照,喷洒0.005 mol/L 的矿物油;B 枝干喷洒0.5%的尿素和0.005 mol/L 矿物油所配溶液。2 号果树施用磷、钾肥,选取枝干A1、B1、C1、D1。A1 喷洒0.003 mol/L 的尿素,B1喷洒0.003 mol/L 的尿素和0.005 mol/L 的钾肥(K2SO4),C1 喷洒0.003 mol/L 的尿素和0.004 mol/L的磷肥(Na2HPO4),D1 喷洒0.003 mol/L 尿素、0.004 mol/L 的磷肥(Na2HPO4)与0.005 mol/L 的钾肥(K2SO4),3 号果树,选取枝干A2、B2、C2、D2。A2 枝干喷洒0.005 mol/L 矿物油枝干作为对照;B2 枝干分别喷洒0.005 mol/L 的Ca(NO3)2·4H2O 和0.005 mol/L 矿物油,C2 喷洒0.005 mol/L 的CaCl2溶液和0.005 mol/L 矿物油,D2 喷洒0.005 mol/L 的CaSO4·2H2O 溶液和矿物油。15 d 喷洒一次,30 d 后采收。活体覆膜处理的实验材料同样是种植于华中农业大学花果山的国庆一号温州蜜柑果树。随机选取一棵果树的三条枝干。一条枝干作为空白对照,第二条枝干覆黑色遮阳网,第三条枝干覆上白色防虫网,7 d 后采收果实。活体ABA 注射处理,一条枝干的果实进行ABA 注射,另外一条枝干的果实作为对照,14 d 进行一次注射,处理30 d。以上实验材料采收后,均分离汁胞混匀,液氮冷冻,-70°C 超低温冰箱保存。
1.1.2 离体培养基配制 大量元素母液配制除矿质元素处理外,其他离体培养处理均为正常取值,配置体系如表1 所示。微量元素母液配制:KI 0.083 g、CuSO4·5H2O 0.0025 g、H3BO30.62 g、CoCl2·6H2O 0.0025 g、ZnSO4·7H2O 0.86 g、Na2MoO4·2H2O 0.025 g、MnSO4·4H2O 2.23 g,1000ml 蒸馏水溶解上述药品,装瓶定容。有机母液配制:肌醇10 g、盐酸硫胺素(VB1)0.01 g、烟酸(VB6)0.05 g、甘氨酸0.2 g、盐酸吡哆醇(VB5)0.05 g,1000 mL 蒸馏水溶解上述药品,装瓶定容。MS 铁盐母液配制:依次称取Na2·EDTA(乙二胺四乙酸二钠)3.73 g、FeSO4·7H2O(七水硫酸亚铁)2.78 g,配成1L 母液。MS 培养基配制:大量元素100 mL、铁盐10 mL、有机母液10 mL、微量元素10 mL、蔗糖30 g、pH 5.85、8 g 琼脂,加热溶解,调节pH,分装后121 ℃高压灭菌15~20 min。

表1 大量元素母液配制体系Table 1 Large amount of element mother liquor preparation system
1.2 实验方法
试验采用离体培养与活体处理相结合的方式进行,活体处理包括覆膜处理、矿质元素(氮肥、磷钾肥、钙肥)处理、ABA 注射处理,均于华中农业大学进行,设置对照组,处理30 d,测定相关生理指标;离体培养采用配制培养基进行汁胞组织培养的方式进行,包括矿质元素处理、温度处理。矿质元素处理为N、P、K、Ga、Mg,各分两组不同质量的处理组,均设置10 d,20 d,30 d 3 个时间阶段,测定相关生理指标;温度处理中,椪柑设置4°C、25°C、35°C 3 个处理组,温州蜜柑设置4°C、15°C、25°C、35°C 4 个处理组,处理时间均为5 d、15 d、30 d 3 个阶段,测定相关生理指标。
1.3 测定项目
1.3.1 可滴定酸含量的测定 利用酸碱滴定法测定可滴定酸含量[7]。
1.3.2 柠檬酸含量的测定 参照胡小梅[8]学位论文绘制柠檬酸定性分析方法和标准曲线(2015),测定柠檬酸含量。
1.3.3 基因CsAN1与CsPH8的qRT-PCR 表达分析 总RNA 的提取按照参照艾德莱TRIpure Reagent总RNA 提取试剂盒方法,进行柑橘果肉汁胞的RNA 提取方法,稍作改动。使用的cDNA 合成试剂盒为TRAN 公司的TransScript One-step g DNA Removal and cDNA Synthesis Super Mix 试剂盒,分两步合成cDNA。编码柑橘的AN1基因CDS 序列在柑橘基因组数据库中挖掘发现,AN1基因的片段引物根据分析结果设计克隆编码,使用Primer 5.0 对所得到的保守序列设计qRT-PCR 的引物,随后在武汉天一辉运有限公司合成,定量反应体系如表1,定量反应条件见表2。Actin 基因为实时定量分析中的内参基因,序列见表3,参考雷顿(2010)的方法。

表2 定量反应体系Table 2 Reaction system of quantitative real-time PCR

表3 定量反应条件Table 3 Reaction conditions of quantitative real-time PCR

表4 定量分析所用引物Table 4 List of primers of quantitative real-time PCR
1.2.4 数据分析 本实验的数据整理和初步分析主要运用WPS Spredsheets 软件进行,绘图软件运用Sigmaplot 12.5 与WPS Spredsheets,SAS Studio 软件进行差异显著分析。
2 结果分析
2.1 柑橘果实发育过程中CsAN1 与CsPH8 的表达、柠檬酸与可滴定酸含量变化
测定了盛花后124、146、165、186、207 d 里暗柳橙和红暗柳橙果实汁胞中的CsAN1与CsPH8的表达水平、柠檬酸及可滴定酸含量,结果如图1 所示。
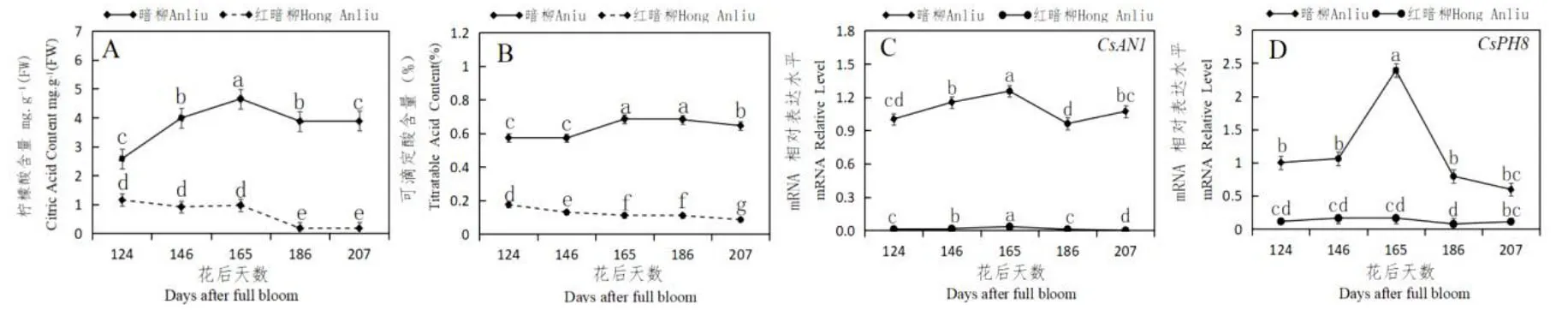
图1 柑橘果实发育过程中CsAN1 与CsPH8 基因表达、柠檬酸与可滴定酸含量变化Fig.1 The changes of CsAN1 and CsPH8 gene expression,citric acid and titratable acid content during citrus fruit development
如图1A 所示,暗柳橙果实汁胞中的柠檬酸含量在这5 个时期分别为2.58 mg.g-1FW,3.99 mg.g-1FW,4,65 mg.g-1FW,3.88 mg.g-1F 和3.89 mg.g-1FW,红暗柳橙果实汁胞中的柠檬酸含量分别为1.15 mg.g-1FW,0.92 mg.g-1FW,0.97 mg.g-1FW,0.18 mg.g-1FW 和0.18 mg.g-1FW。暗柳与红暗柳中,柠檬酸含量均呈现先升高后降低的趋势,并在盛花后165 d 左右达到高峰值,但暗柳中的柠檬酸含量明显远远高于红暗柳。
如图1B 所示,暗柳橙在花后124、146、165、186、207 d 的可滴定酸含量分别为0.57%,0.57%,0.69%,0.68%和0.65%,红暗柳橙果实汁胞中的可滴定酸含量分别为0.18%,0.13%,0.11%,0.11%和0.09%。显然,果实发育过程中,暗柳橙中的可滴定酸含量要远高于红暗柳橙中的可滴定酸含量。
本实验测定了CsAN1与CsPH8在暗柳橙和红暗柳橙汁胞发育过程中的表达情况,如图1C 与1D。结果显示,在暗柳橙与红暗柳橙果实发育期间,CsAN1在这两种柑橘汁胞中的表达水平呈现逐渐上升的趋势,并在花后165 d 时达到高峰。在花后165 至207 d,CsAN1在暗柳中的基因表达水平呈现逐渐下降的趋势,红暗柳橙中的CsAN1表达水平也呈现微弱的先升高后降低的趋势,且暗柳橙中的CsAN1表达水平明显高于红暗柳橙。此外,实验发现CsPH8在暗柳橙与红暗柳橙果实发育期间的表达趋势与CsAN1相似,且CsPH8在红暗柳橙中的表达极低,说明CsAN1与CsPH8可能存在相关性。
2.2 活体处理中矿质元素对CsAN1 表达及可滴定酸含量的影响
实验测定了4 种不同种类的钙肥对温州蜜柑果实中可滴定酸及CsAN1的表达水平。结果如图2A与2B 所示,对照组、氯化钙、硫酸钙及硝酸钙处理组的温州蜜柑果实可滴定酸含量分别为1.68%,1.94%,1.82%,1.66%。可滴定酸含量最高的氯化钙处理的CsAN1的表达水平也最高,可滴定酸含量排第2 位的硫酸钙处理组CsAN1的表达水平与对照组无明显差异,可滴定酸含量排第3 位的对照组与硫酸钙处理组在CsAN1的表达水平上无显著差异,然而可滴定酸含量较低的硝酸钙处理组对照组相比CsAN1的表达水平显著升高,但显著低于氯化钙处理组。
磷钾对照组(P、K 对照)和施加钾肥(0.5%K)、磷肥(0.4%P)、磷钾混合肥(0.5%K+0.4%P)的3 个处理组温州蜜柑果实可滴定酸及CsAN1的表达水平,结果如图2C 与2D 所示,磷钾对照组与0.5%K、0.4%P、0.5%K+0.4%P 处理组的可滴定酸含量分别为2.22%,1.92%,1.90%,1.85%。施加P 或K 均可使果实中可滴定酸含量显著降低,其中可滴定酸含量最高的对照组所对应的CsAN1的表达水平也同样最高,可滴定酸含量排第二位的0.5%K 及0.4%P 处理组的CsAN1的表达水平同样也排第二位,而0.5%K+0.4%P 处理组可显著下调CsAN1的表达水平并降低可滴定酸含量。
实验测定了氮对照组与0.5%N 处理组的温州蜜柑果实可滴定酸含量及CsAN1的表达水平。实验结果如图2E 与2F 所示,氮对照组与0.5%N 处理组的可滴定酸含量分别为1.52%和1.75%。0.5%N处理组中的可滴定酸含量与CsAN1的表达水平均显著高于氮对照组,可滴定酸含量与CsAN1的表达水平成正相关性。
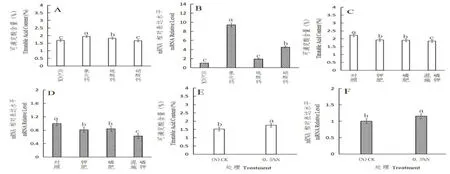
图2 矿质元素对CsAN1 表达及可滴定酸含量的影响Fig.2 The effects of mineral elements on CsAN1 expression and titratable acid content
2.3 覆膜处理中温州蜜柑果实中可滴定酸含量及CsAN1 的表达影响
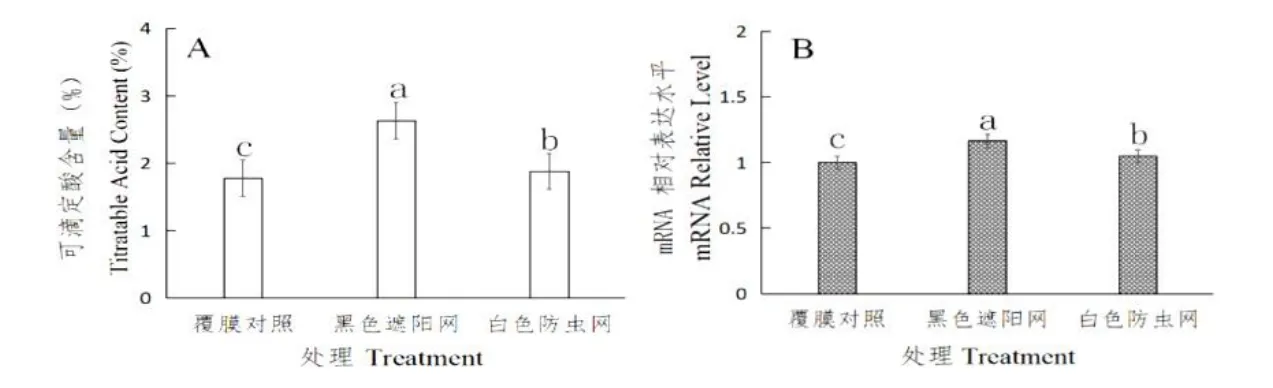
图3 覆膜处理(覆膜对照、白色防虫网、黑色遮阳网)中的CsAN1 的表达水平及可滴定酸含量Fig.3 Relative expression level ofCsAN1and titratable acid in mulching treatment(film control,white insect net,black shade net)
由图3A 与3B 可以看出,可滴定酸含量依次为1.9484%,2.5166%和1.968%,覆膜处理可以提高CsAN1的表达水平和可滴定酸含量,其中黑色遮阳网处理组的可滴定酸含量和CsAN1的表达水平均为最高;白色防虫网处理组可滴定酸含量与基因表达水平排第二,且处理组与对照组之间差异显著。由此推断,覆膜处理的CsAN1表达水平与可滴定酸含量存在相关性。
2.4 ABA 注射对温州蜜柑果实可滴定酸含量及CsAN1 和CsPH8 表达影响
实验测定了ABA 注射后处理组与对照组的温州蜜柑果实汁胞中CsAN1与CsPH8的表达水平、可滴定酸含量。实验结果如图4A、4B、4C 所示,ABA 注射处理组的可滴定酸含量高于对照组,差异显著。就CsAN1与CsPH8的表达量而言,ABA 注射处理组同样明显高于对照组,即CsAN1与CsPH8基因表达水平呈现相似的表达趋势。

图4 ABA 注射处理组及对照组中CsAN1 与CsPH8 的基因表达水平及可滴定酸含量Fig.4 The Gene expression level and titratable acid content ofCsAN1andCsPH8in ABA injection treatment group and control group
2.5 离体处理中温度处理对CsAN1 的表达影响
通过qRT-RCR 技术,实验测定了不同温度处理组中的椪柑与温州蜜柑果实汁胞中CsAN1的表达水平。实验结果如图5A 与5B 所示,总体上,不论是在椪柑还是温州蜜柑果实汁胞中,CsAN1随温度的升高而逐渐下调表达,且趋势明显。在椪柑果实汁胞中,由4°C 升高至25°C 时,CsAN1的表达水平在第10 d 和第15 d 里均显著下调,而由25°C 升高至35°C 时,CsAN1的表达水平在第5 d显著下调,而之后无明显变化;在温州蜜柑果实汁胞中,由4°C 升高至15°C 及15°C 升高至25°C时,CsAN1均持续显著下调表达,而由25°C 升高至35°C 时,CsAN1下调表达不显著。

图5 CsAN1 在不同温度处理组中的基因表达分析Fig.5 The Gene expression analysis of CsAN1 in different temperature treatment groups
2.6 离体处理中矿质元素处理对CsAN1 的表达影响
通过qRT-RCR 技术,实验测定了不同含量矿质元素(2N 与1/2N、2Mg 与1/2Mg、2Ca 与1/2Ca、2P 与1/2P、2K 与1/2K)的温州蜜柑果实汁胞中CsAN1的表达水平。实验结果如图6 所示,总体上,2Mg、2Ca、2N 处理组中的CsAN1的表达水平分别显著高于1/2Mg、1/2Ca、1/2N 处理组(除第20 d的Ca 处理和第30 d 的N 处理中,2Ca、2N 处理与1/2Ca、1/2N 处理相比,CsAN1分别下调表达以外),如图6A、6B 与6F 所示。而2P 处理组中的CsAN1的表达水平显著低于1/2P 处理组,2K 处理组在30 d 时CsAN1的表达水平低于1/2K 处理组,其他时期差异不显著,如图6C 与6D 所示。
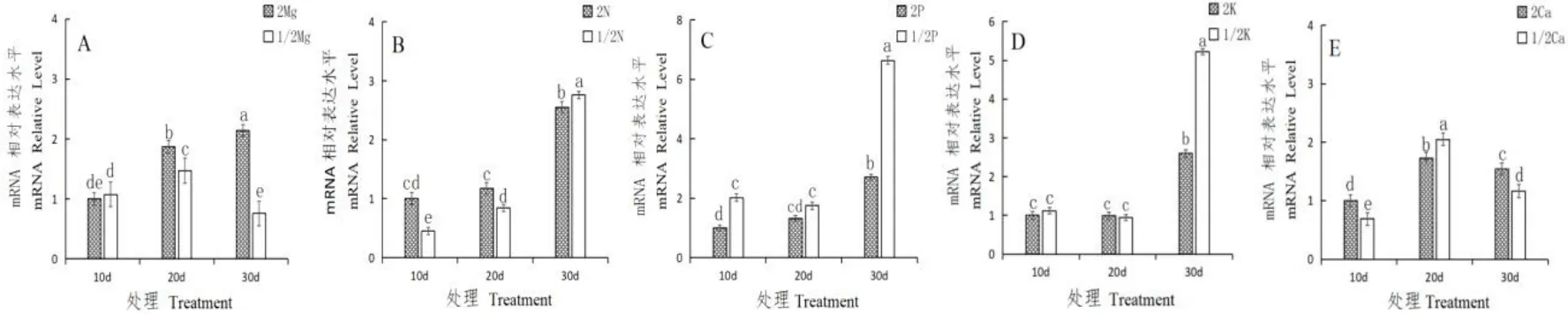
图6 矿质元素处理对温州蜜柑果实CsAN1 的表达影响Fig.6 The effects of mineral element treatment on the expression of CsAN1 in Satsuma Orange
3 结论与讨论
3.1 CsAN1 影响CsPH8 基因调控柠檬酸含量的探讨
CsAN1编码bHLH 蛋白,并参与花青素合成等多种相关代谢途径的调控,其中就包括直接调控矮牵牛PH5的表达,从而酸化花瓣中的液泡。CsPH8作为PH5的同源基因,是细胞质膜上的一种P型ATP 酶基因,具有决定液泡pH 的功能[1]。本试验发现,暗柳橙和红暗柳橙果实发育过程中,柠檬酸含量、CsAN1及CsPH8基因表达水平的动态变化趋势一致;对温州蜜柑果实进行ABA 注射处理,发现汁胞中CsAN1及CsPH8的表达水平同样呈现相似的表达趋势,与本课题组宁东媛[4]的推测相吻合,此外,覆膜处理与矿质元素处理中的CsAN1表达水平与可滴定酸含量普遍呈现近似正比的关系,根据Verweij 等[3]提出的PH5的调控模型,推测其主要原因可能是上游的CsAN1影响了下游CsPH8的表达,进而影响果实细胞液泡内的柠檬酸积累,使得柠檬酸含量、CsAN1及CsPH8的表达水平动态变化趋于一致。
3.2 矿质元素的效应
氮肥可增加果实的有机酸含量,并且果实内的柠檬酸含量也会随施氮量的增加而显著增加[9];磷素通过抑制柠檬酸合成、促进柠檬酸分解的共同作用,从而达到降低果实中的柠檬酸含量的目的[10];钾离子通过影响果实中液泡的渗透压和pH 值,调节果实中的有机酸含量[11,12];梁和等[13]在柑橘的研究中发现,喷洒钙肥可提高果实发育过程中中性转化酶的活性,促进果实中有机酸转化和糖积累;此外,合理施镁还可明显提高非挥发性有机酸含量[14]。本研究结果表明,过量的矿质元素,镁肥、氮肥、钙肥有上调CsAN1基因表达和增加有机酸含量的作用,而磷肥与钾肥有下调CsAN1基因表达和降低有机酸含量的作用。因此,推测合理施用氮、磷、钾、钙、镁,可以提高有机酸含量与CsAN1基因表达水平,但具体的肥料用量和施用时期等还需深入研究。
3.3 树冠覆膜效应
四川盆地的一些椪柑、脐橙和杂柑进行调查后发现树冠覆膜后可滴定酸含量轻微提高,本研究中,覆盖黑色遮阳网或白色防虫网,均会使得果实中CsAN1的表达显著上调,并且可滴定酸含量也有提高,与李明娟等[15]研究结果相似。也有研究表明,纽荷尔脐橙[16]、清见桔橙[17]和沙糖桔[18]在留树贮藏过程中酸含量逐渐降低,而树冠覆膜可延缓这种变化[19]。与前人研究结果的差异,可能与栽培地的气候和覆膜材料有关,曾有实验证明,覆膜不严,有雨水渗入也会使结果相差较大[20]。
3.4 脱落酸(ABA)效应
ABA 是一种高效的生长调节抑制剂,一般来说,干旱、寒冷、高温、盐渍和水涝等逆境条件都能使植物体内ABA 含量迅速增加,同时抗逆性增强[22,23]。植物中存在三种质子泵,即V 型质子泵[V-H+-ATPase(VAP)]、F 型质子泵(VHA 和VHP)和质模型质子泵[P-H+-ATPase(PHA)][24],PH5即为细胞质膜上的一种P 型ATP 酶基因,具有决定液泡pH 的功能[1]。Shi 等[2]发现ABA 注射可以显著上调CsPH8表达,且证实了CsPH8可调节柑橘果实液泡中的柠檬酸积累。本研究结果也表明,在柑橘果实汁胞中注射ABA,可显著上调CsAN1与CsPH8的表达,增加柠檬酸含量,似乎是ABA注射激活了CsAN1的表达和P 型ATP 酶的相关活性,进而促进了柠檬酸积累。
3.5 温度效应
前人研究表明环境条件变化会对基因结构产生影响。AN1基因座由结构基因和监管区域构成,其中的结构基因决定花青素合成反应中的相关酶活性,监管区域决定着结构基因的位置、活化时间和活化速率[6],而当转座因子插入基因座后可以诱导监管区域突变,产生不稳定的AN1等位基因,等到突变修复后又产生了不稳定等位基因的回复[21]。由于酶必须参与基因的回复与逆转,因此,人们猜测AN1等位基因回复率易受温度影响。Doodeman 等[21]在环境因素对矮牵牛AN1等位基因逆转率的影响中发现当温度从18°C 升高到25°C 时,参与花青素合成的AN1等位基因表达大幅下降,本实验研究结果表明,当温度从4°C 升高至35°C 时,会显著下调CsAN1基因表达水平,其原因可能是温度影响修复所涉及的酶的活性,因此影响回复率,使得CsAN1明显下调表达。
