三氯化六氨合钴制备条件的优化
2020-04-09刘晓红唐家璇
刘晓红,唐家璇,田 乐
(延安大学化学与化工学院,陕西延安716000)
与二价钴盐相比较,三价钴盐在水溶液中稳定性较差,但在形成配合物后,三价钴的配合物比二价钴的配合物更稳定。通常,三价钴的配合物是二价钴经过配位后在空气或过氧化氢溶液存在条件下氧化而制得[1]。
钴(Ⅲ)的氨配合物有多种,这些配合物在被合成时如控制条件不同产物即不同。如三氯化六氨合钴[Co(NH3)6]Cl3(橙黄色),二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2(紫红色)和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3(砖红色)等。在制备三氯化六氨合钴[Co(NH3)6]Cl3的实验教学中经常会出现砖红或紫红色产物,主要就是因为没有准确控制温度[2],生成了上述后2个配合物。
三氯化六氨合钴(Ⅲ)是一种橙黄色单斜晶体,是制备其他三价钴配合物的重要试剂。溶于稀盐酸中,但在高浓度盐酸中溶解度较小[3]。在结构上,由于低自旋的钴离子处于六氨合钴(Ⅲ)阳离子的八面体中心,且符合18电子规则,因此三氯化六氨合钴在配体交换反应中表现出惰性[4]。在配合物中,氨分子与中心原子钴的配位非常紧密,分子配体NH3在酸中进行解离和质子化极其困难,因此三氯六氨合钴能够在浓盐酸中结晶析出。与其他金属的氨配合物如二氯化六氨合镍[Ni(NH3)6]Cl2相比较,后者在酸溶液中会快速分解,就是由于Ni(II)-NH3键的不稳定。但是三氯六氨合钴受热后氨分子会部分逸出[5]。
三氯化六氨合钴(Ⅲ)的制备是大学化学无机化学实验中掌握配合物合成方法的一个重要实验,其操作性和综合性较强,能有效地激发学生学习配合物制备的兴趣,提高学生的实验操作能力。
但目前有关三氯化六氨合钴制备实验的文献报道,其涉及的内容多是讨论三氯化六氨合钴[Co(NH3)6]Cl3制备的微型化设计[6]、[Co(NH3)6]Cl3组成测定方法的改进[7]、合成步骤中实验试剂量分析及绿色化探索[8]以及对实验中重金属化学试剂的回收再利用等[9],对影响产品制备的主要实验控制因素进行优化的研究鲜见报道。为了解决学生实验中经常出现的三氯化六氨合钴制备产物合成困难,合成条件不精确等问题,实验选择了制备过程的4个主要因素,用正交设计进行实验,得到产品产率,并对实验结果进行极差分析和方差分析,得出最优的实验条件。
1 实验部分。
1.1 主要仪器与试剂
仪器:85-2数显恒温磁力搅拌器,HH·S21-6S电热恒温水浴锅,SHB-Ⅲ循环式多用真空泵,球磨机,烘箱等。
试剂:CoCl2,H2O,NH4Cl,活性炭,硫酸,氨水,浓盐酸,4%、6%和8%的H2O2溶液
1.2 实验原理
实验室制备[Co(NH3)6]Cl3的原理是:因为φθ(Co3+/Co2+)为1.84 V,由标准电极电势可以看出,二价钴在水溶液中比三价钴稳定,所以在水中Co2+不易被氧化为Co3+。相反的,因为该标准电极电势值大于φθ(O2/H2O)=1.229 V,所以Co3+很不稳定,Co3+在水溶液中容易氧化水释放出氧气。当有配位剂NH3存在时,由于配合物的电极电势φθ(Co(NH3)63+/Co(NH3)62+)=0.1 V,说明钴(Ⅲ)的氨配合物比钴(Ⅱ)的氨配合物稳定。因此在配合物中二价钴易于被氧化为三价钴。
实验中使用的氧化剂是H2O2,在氯化铵与氨大量存在下,利用活性炭作为催化剂,将二价钴转化为三价钴配合物,从而由粉红色反应物得到橙黄色三氯化六氨合钴(III)[Co(NH3)6]Cl3配合物,其反应式为2[Co(H2O)6]Cl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+14H2O。

1.3 三氯化六氨合钴制备步骤
①准确称取3.0 g CoCl2·6H2O和4.0 g NH4Cl固体加入5 mL高纯水中溶解,60 ℃水浴,溶液由红色变为蓝色,即得到[Co(H2O)2Cl4]2-,加入1.5 g活性炭,搅拌均匀,冷却至室温,再加入7 mL浓NH3·H2O,搅拌,得到一种黑紫色溶液([Co(NH3)6]Cl2)。将该溶液冷却至10 ℃,后向溶液中加入7 mL浓度为4%的H2O2,置于恒温水浴锅中保持温度为55 ℃水浴15 min,同时进行持续搅拌。
②将上述溶液在冰水中快速冷却至2 ℃并抽滤,用2 ℃的高纯水冲洗烧杯,抽滤完成后弃掉滤液,收集沉淀备用。
③将抽滤得到的沉淀转移入100 mL烧杯中,用温度为80 ℃热的高纯水进行冲洗,用量20 mL,之后加入1 mL的浓HCl,搅拌均匀后趁热过滤,将活性炭滤出弃去,在滤液中再加入3.5 mL浓HCl,搅拌后用冰水浴冷却至2 ℃析出沉淀,之后快速抽滤,弃去滤液,用无水乙醇洗涤沉淀3次,得到产品[Co(NH3)6]Cl3。
④将得到的产品放入烘箱干燥,称量,计算产率。
1.4 制备三氯化六氨合钴的正交实验设计
为了进一步研究制备三氯化六氨合钴过程中各因素的影响,分别选取实验过程中水浴加热温度、水浴时间、活性炭与反应物的质量比和过氧化氢的质量分数这4个主要因素来进行设计,每个因素选取3个水平,根据单因素预实验结果确定各因素的水平值。选取水浴温度为55 ℃、60 ℃和65 ℃,水浴时间为15 min、20 min和25 min,活性炭与反应物的质量比为2.1%、2.8%和3.6%,过氧化氢的质量分数为4%、6%和8%,进行L9(34)正交试验,根据合成得到的产品三氯化六氨合钴(III)的产率考察这4个实验因素对产物制备的影响,具体实验设计如表1所示,按照正交设计的表1共进行9组实验。
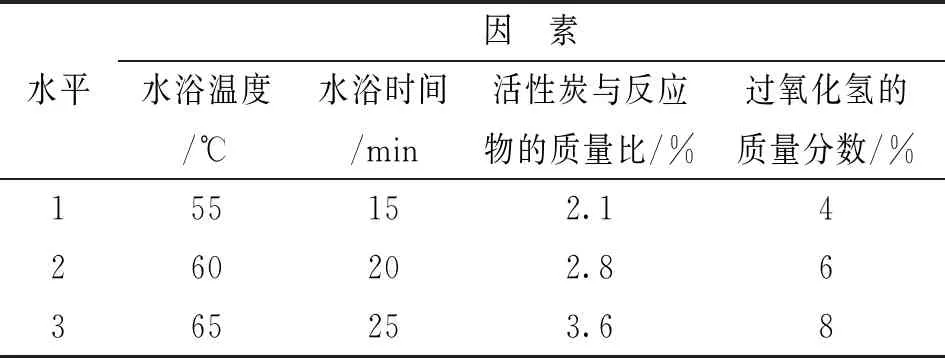
表1 因素和水平表
2 结果与讨论
2.1 实验条件的优选
将三氯化六氨合钴的制备产率输入实验设计表中得到完整正交表。通过正交设计软件进行极差分析和方差分析,结果如表2。
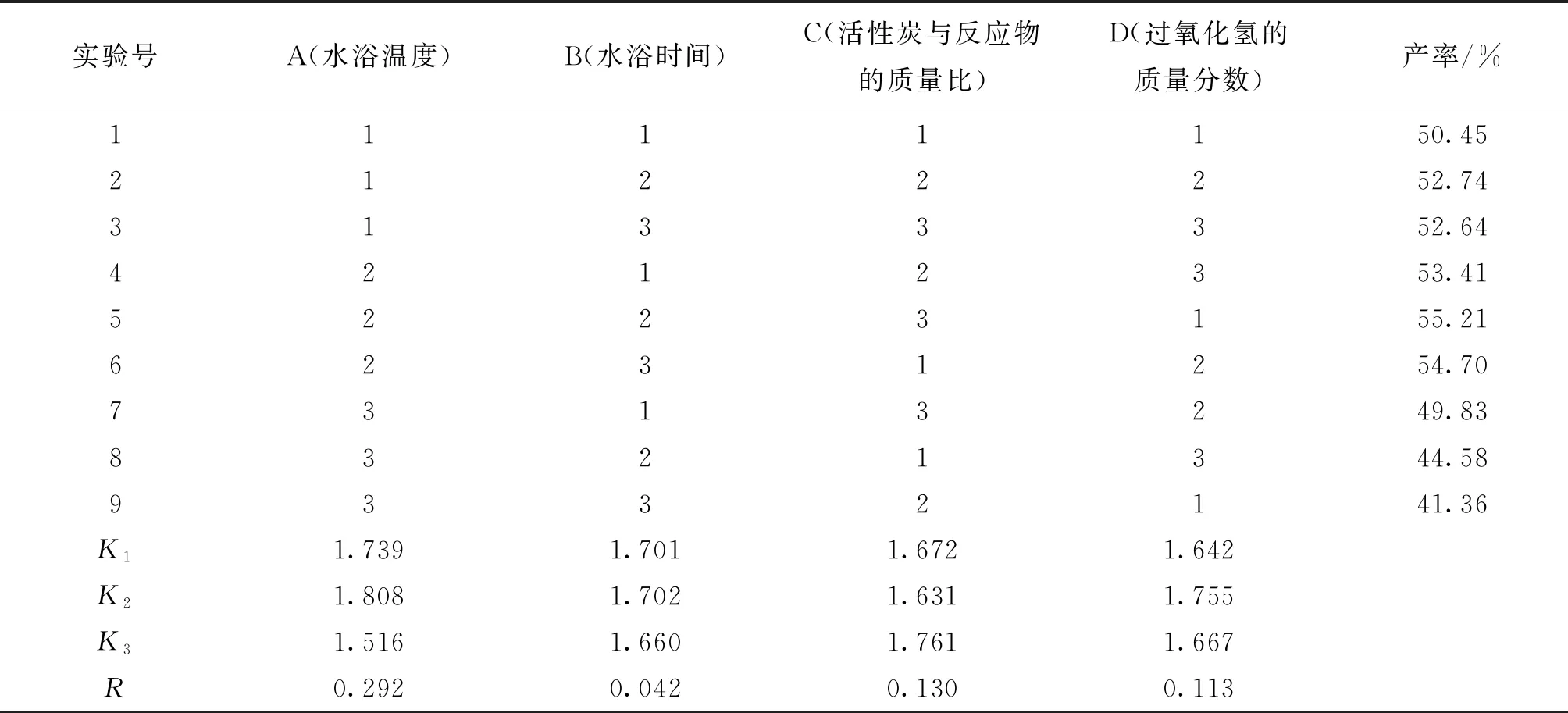
表2 正交设计实验的直观分析表
通过表2正交设计实验的直观分析,比较各个因素的均值大小得到本实验的最佳条件是:水浴温度为60 ℃,水浴时间控制为20 min,活性炭与反应物的质量比最佳为3.6%,过氧化氢的质量分数是6%。
通过比较实验结果的极差大小可以得到:水浴温度>活性炭与反应物的质量比>过氧化氢的质量分数>水浴时间,说明选取的4个因素对实验结果三氯化六氨合钴(III)产率的影响程度为:水浴温度最大,其次为活性炭与反应物的质量比和过氧化氢的质量分数,最后才是水浴时间,所以其中影响产品产率最大的因素是水浴温度,影响最小的因素是水浴时间。
再应用极差最小的因素水浴时间作为误差进行方差分析,得到表3的方差分析数据。
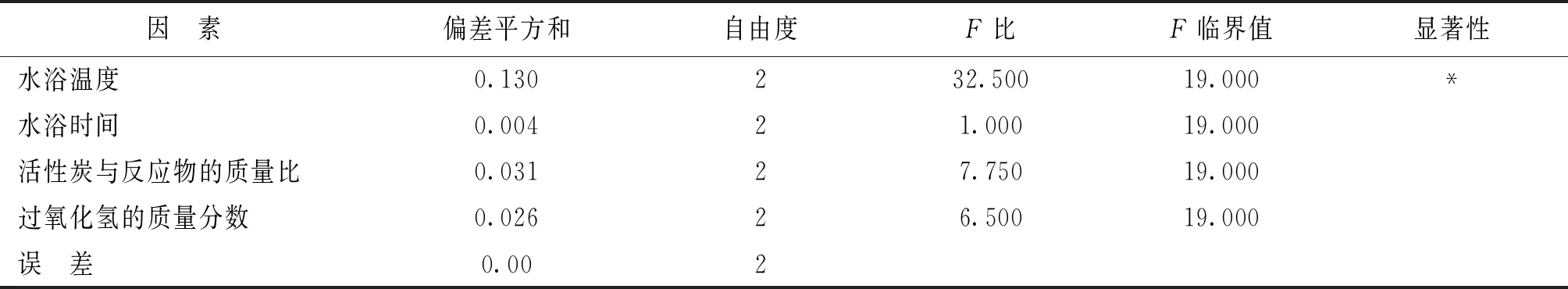
表3 制备三氯化六氨合钴(III)的方差分析表
注:F0.01(2,2)=99;F0.05(2,2)=19.00;F0.10(2,2)=9.00
表3的方差分析表明,在95%的置信度下,以水浴时间为误差进行分析,结果显著的只有水浴温度。因此,水浴温度是这4个因素中对三氯化六氨合钴(III)的合成产率影响最为显著者,而活性炭与反应物的质量比和过氧化氢的质量分数对三氯化六氨合钴(III)[Co(NH3)6]Cl3的合成产率无显著影响,其水平可在实验设计范围内选取。
综上所述,合成三氯化六氨合钴(III)的最优条件为水浴温度60 ℃,水浴时间20 min,活性炭与反应物的质量比3.6%,过氧化氢的质量分数6%。按照上述最佳条件组合追加1组进行实验,得到三氯化六氨合钴产品产率为56.79%,产率达到最大。
由紫外-可见分光光度计测得该产品的最大吸收波长为475 nm,符合该配合物的理论值。
制备后的含钴废液回收采用将含有钴离子的废液与碱性溶液反应,钴离子与氢氧根结合形成钴的氢氧化物沉淀再进行过滤分离,并将洗涤后的沉淀与盐酸反应生成二价钴离子,浓缩结晶后进一步回收为二氯化钴固体。
2.2 实验中应注意的问题
首先是活性炭的颗粒大小。研究表明[10]粉状活性炭比表面积较粒状活性炭大,理论上催化效果较好,但由于粉状活性炭比表面积大,对产物也会有较强的吸附作用,故也会降低理论产量,这是两种对最终结果起相反影响的因素,最终以比表面积大,催化效果好的因素占据主导,所以建议在反应前对活性炭进行充分研磨。
其次是实验中必须准确控制温度。温度控制不精准就会有不同结构的其他配合物生成,部分同学往往是由于忽略这个问题,所以最后得到的产品不是橙黄色,而是砖红或紫红色的产物。
最后注意制备中造成产率减小的几个关键环节。如制备中晶体析出时间短或冰浴冷却不充分使得产品未完全析出,或过度加热使样品分解,以及抽滤时因为未全部转移而剩有残留。
3 结论
通过对制备三氯化六氨合钴(Ⅲ)的4个影响因素水浴温度、水浴时间、活性炭与反应物的质量比和过氧化氢的质量分数进行正交实验,得出最优的合成条件,即水浴温度控制在60 ℃,水浴时间为20 min,活性炭与反应物的质量比最佳为3.6%,过氧化氢的质量分数是6%,得到三氯化六氨合钴(Ⅲ)的产率为56.79%,高于其他合成条件的产率值。对产品产率影响最显著的因素为水浴温度。
