丙烯腈暴露通过NF-κB信号通路诱导大鼠脑组织氧化应激
2020-04-08张瑞萍魏倩高霞赵粉线薛红丽李芝兰
张瑞萍,魏倩,高霞,赵粉线,薛红丽,李芝兰
兰州大学公共卫生学院,兰州 730000
丙烯腈(acrylonitrile, ACN)是一种高毒类有机氰化物,用于制造腈纶纤维、丁腈橡胶和ABS塑料等高分子材料,是职业环境中的常见污染物[1]。脑组织是ACN毒作用的靶器官,动物实验研究表明,ACN染毒后,大鼠海马区和大脑皮层区胶质增生,神经元排列不规则;胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)阳性细胞数目增加,胞体肥大,突体增粗且不规则[2]。通过ACN处理人星形胶质细胞发现,细胞内活性氧(reactive oxygen species, ROS)和氧化型谷胱甘肽(oxidized glutathione, GSSG)含量增加,谷胱甘肽(glutathione, GSH)含量降低,过氧化氢酶(catalase, CAT)活性上升[3]。罗波艳等[4]以不同剂量ACN染毒SD大鼠也得出相似结果,提示ACN可诱导机体脑组织氧化损伤。国外有调查发现,长期接触ACN使神经衰弱综合征的发生率较高,包括头晕、头痛、乏力、失眠多梦及心悸等症状。此外,3年以上接触浓度接近6 mg·m-3的ACN使部分工人发生头痛、全身无力、易激动、不自主运动和工作效率低下等神经精神症状[5-6]。
核转录因子κB(nuclear factor kappa-B, NF-κB)是存在于真核细胞中的重要转录因子,未激活状态下,与其抑制因子IκB在非活化的形式存在于胞浆中,当细胞内ROS含量升高或处于氧化/抗氧化失衡过程中,其可激活NF-κB信号通路,被称为氧化还原敏感转录因子。Dang等[7]研究发现,N-乙酰半胱氨酸(N-acetylcysteine, NAC)作为一种有效的抗氧化剂,可抑制ROS介导的NF-κB活化以及凋亡相关基因BaxmRNA表达水平。高玲等[8]用TNF-α和IL-1β处理大鼠脑皮层培养的神经细胞,可使NF-κB蛋白相对表达水平升高,环孢素A预处理可抑制IL-1β诱导的NF-κB活化。以上研究结果表明,ROS和炎症细胞因子均可激活NF-κB信号通路。
本研究通过不同剂量ACN灌胃染毒雄性SD大鼠,建立短期脑损伤模型,测定大鼠脑组织炎症细胞因子水平的变化,检测大鼠脑组织氧化应激水平、NF-κB信号通路相关基因mRNA和蛋白表达水平,探讨ACN通过诱导脑组织氧化/抗氧化失衡和炎症反应对NF-κB信号通路的影响,为ACN的神经系统毒性机制提供依据。
1 材料与方法(Materials and methods)
1.1 实验动物及分组
由甘肃中医药大学医学实验动物中心提供健康成年SPF级雄性SD大鼠(动物合格证编号:SYXK(甘)2015-0005)。将60只大鼠随机分为5组,每组12只,对照组灌胃玉米油,染毒组分别给予11.5、23.0和46.0 mg·kg-1ACN灌胃,NAC干预组先给予300 mg·kg-1NAC灌胃,30 min后再灌胃46.0 mg·kg-1ACN。每天1次,每周6 d,连续灌胃28 d。染毒剂量主要依据本团队前期研究成果设定。
1.2 试剂
ACN(纯度>99%)购买于天津凯信化学工业有限公司,NAC购买于美国Amersco公司,超氧化物歧化酶(superoxide dismutase, SOD)、CAT、GSH、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和丙二醛(malondialdehyde, MDA)试剂盒购买于南京建成生物工程研究所,IL-1β、IL-6和TNF-α酶联免疫(Elisa)试剂盒购买于武汉Elabscience生物科技有限公司。BCA总蛋白测定试剂盒购买于美国Thermo公司,IKKα、p-IKKα/β、p-IκBα、NF-κB(兔抗)、IκBα和TLR4(鼠抗)一抗购买于美国CST公司,GAPDH一抗、HRP标记山羊抗兔二抗购买于美国SAB公司,HRP标记山羊抗小鼠二抗购买于美国CST公司,引物由日本TAKARA公司设计合成。
1.3 大鼠脑组织氧化应激相关指标测定
染毒结束后,处死大鼠。每组随机选取6只大鼠脑组织,按脑组织质量(g)∶匀浆介质体积(mL)=1∶9的质量体积比在冰水浴下用玻璃匀浆器将其制成10%匀浆,12 000 g·min-1、4 ℃下低温离心10 min,分装上清用于后续实验。按照试剂盒说明书操作,测定氧化应激相关指标。
1.4 大鼠脑组织炎症细胞因子的测定
严格按照IL-1β、IL-6和TNF-α酶联免疫(Elisa)试剂盒步骤,测定炎症细胞因子浓度。
1.5 RT-qPCR检测mRNA表达水平
采用Trizol法提取大鼠脑组织总RNA,加入30 μL DEPC水充分溶解总RNA;测定总RNA浓度,选取吸光度比值(A260/A280)在1.8~2.2的样品进行实验。按照TaKaRa反转录试剂盒说明,选择20 μL的反转录体系,37 ℃反转录15 min后,85 ℃反转录酶失活反应5 s,最终获得cDNA模板。RT-qPCR检测大鼠脑组织IKKα、IκBα、NF-κB和β-actinmRNA相对表达水平,选择25 μL反应体系进行PCR扩增反应(三步法),反应条件为:95 ℃预变性反应30 s;95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,共50个循环;60 ℃熔解反应15 s,共71个循环(表1)。
采用Pfaffl法计算基因mRNA相对表达水平,公式为

式中:E为扩增效率,E=(Rn,A/Rn,B)1/(CT,ACT,B)-1,A和B为荧光扩增曲线上的任意2个点,Rn,A、Rn,B为A和B这2点对应的荧光值。E靶基因为目标基因的扩增效率,E内参基因为内参基因的扩增效率;ΔCT靶基因=对照组目标基因CT值-待测样本目标基因CT值,ΔCT内参基因=对照组内参基因CT值-待测样本内参基因CT值。
1.6 Western-Blot检测蛋白表达水平
随机提取6只大鼠脑组织总蛋白,测定脑组织匀浆总蛋白含量,根据测定结果加入RIPA裂解液和5×上样缓冲液,调整样品蛋白浓度为4 μg·μL-1,沸水变性5 min。然后在各泳道内加入15 μL各组蛋白样品进行SDS-PAGE电泳,根据彩虹marker标识裁取所需部分,将目的蛋白转移至PVDF膜上,封闭2 h后,孵育一抗,用含BSA的5%的封闭液配制IKKα(1∶1 000)、p-IKKα/β(1∶1 000)、NF-κB(1∶1 000)和TLR4(1∶1 000)一抗(鼠抗)。GAPDH(1∶5 000)、IκBα(1∶1 000)和p-IκBα(1∶1 000)用含脱脂奶粉的5%的封闭液配制,4 ℃水平摇床过夜,TBST漂洗后孵二抗2 h,显影成像并保存,采用Image J软件对目的蛋白进行半定量分析。

表1 各基因引物序列及产物大小Table 1 Primer sequence and product size of each gene
1.7 统计分析
2 结果(Results)
2.1 ACN对大鼠脑组织抗氧化能力及脂质过氧化的影响
如表2所示,ACN染毒后,与对照组比较,11.5、23.0和46.0 mg·kg-1ACN组大鼠脑组织MDA含量均升高(P<0.05);23.0 mg·kg-1和46.0 mg·kg-1ACN组GSH含量降低(P<0.05);46.0 mg·kg-1ACN组GSH-Px活性下降(P<0.05);11.5 mg·kg-1组CAT活性下降(P<0.05);各暴露组大鼠脑组织SOD活性与对照组比较差异均无统计学意义(P>0.05)。NAC组大鼠脑组织SOD活性与46.0 mg·kg-1ACN组比较升高,MDA含量和CAT活性与46.0 mg·kg-1ACN组比较均降低,差异均具有统计学意义(P<0.05)。
2.2 ACN对大鼠脑组织炎症细胞因子水平的影响
如图1所示,ACN染毒后,与对照组相比,各剂量组大鼠脑组织TNF-α浓度均升高(P<0.05);23.0 mg·kg-1和46.0 mg·kg-1ACN组IL-1β浓度均升高(P<0.05);46.0 mg·kg-1ACN组IL-6浓度升高(P<0.05)。与46.0 mg·kg-1ACN组比较,NAC组大鼠脑组织中炎症细胞因子IL-6、IL-1β和TNF-α浓度均降低,差异均具有统计学意义(P<0.05)。
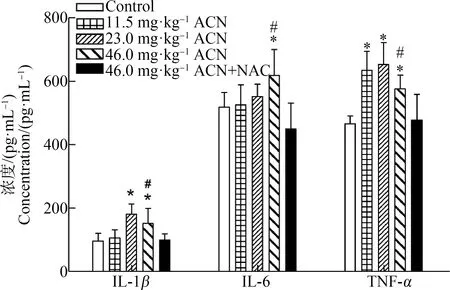
图1 ACN染毒后大鼠脑组织IL-6、IL-1β和TNF-α浓度变化注:与对照组比较,* P<0.05;与NAC组比较,# P<0.05;n=6。Fig. 1 Effects of ACN exposure on the changes of IL-6, IL-1β, TNF-α concentrations in rat brainNote: Compared with the control group, *P<0.05; compared with the NAC group, # P<0.05; n=6.
2.3 ACN染毒对大鼠脑组织NF-κB信号通路相关基因表达的影响
RT-qPCR结果显示(图2),23.0 mg·kg-1和46.0 mg·kg-1ACN组大鼠脑组织IKKα和NF-κB mRNA表达水平均上调,差异均有统计学意义(P<0.05),各暴露组IκBmRNA表达水平与对照组比较差异无统计学意义(P>0.05)。NAC组大鼠脑组织IKKα和NF-κB mRNA表达水平与46.0 mg·kg-1ACN组比较均下调,差异均具有统计学意义(P<0.05)。
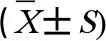
表2 丙烯腈(acrylonitrile,ACN)染毒对大鼠脑组织抗氧化能力及脂质过氧化的影响Table 2 Effects of ACN (acrylonitrile) exposure on the anti-oxidative capacity and lipid peroxidation of rat brain tissues
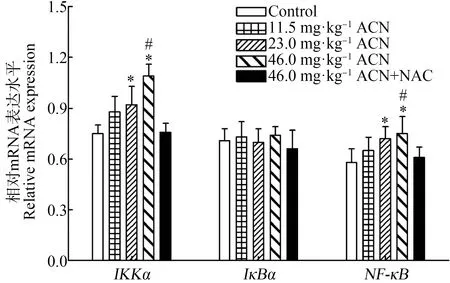
图2 ACN染毒后大鼠脑组织IKKα、IκBα和NF-κB mRNA表达水平变化注:与对照组比较,*P<0.05;与NAC组比较,# P<0.05;n=6。Fig. 2 Effects of ACN exposure on IKKα, IκBα and NF-κB mRNA expression in rat brain tissueNote: Compared with the control group, *P<0.05; compared with the NAC group, # P<0.05; n=6.
2.4 ACN染毒对大鼠脑组织NF-κB信号通路相关蛋白的影响
Western Blot结果表明(图3),各剂量染毒组大鼠脑组织p-IKKα/β、IKKα和NF-κB蛋白相对表达水平均升高,差异均具有统计学意义(P<0.05);23.0 mg·kg-1和46.0 mg·kg-1ACN组p-IκBα蛋白相对表达水平均显著升高(P<0.05);各暴露组IκBα蛋白相对表达水平与对照组比较差异无统计学意义(P>0.05)。与46.0 mg·kg-1ACN组比较,NAC组大鼠脑组织p-IKKα/β和NF-κB蛋白相对表达水平降低(P<0.05)。
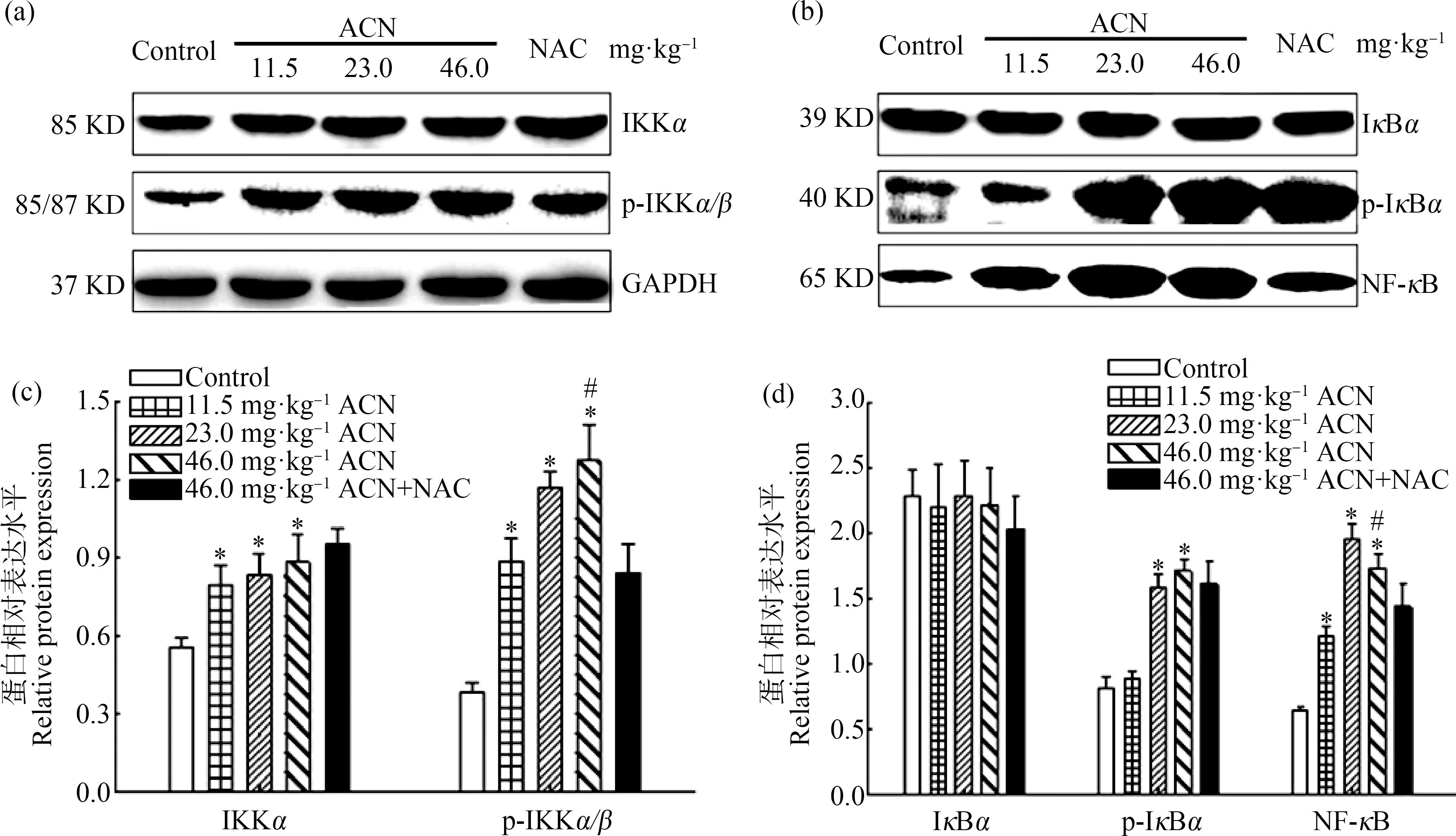
图3 ACN染毒后大鼠脑组织NF-κB信号通路相关蛋白表达水平变化注:(a)和(b)为蛋白免疫印迹条带((a)和(b)共用同一内参GAPDH条带);(c) p-IKKα/β和IKKα蛋白相对表达水平;(d) p-IκBα、IκBα和NF-κB蛋白相对表达水平;n=6;与对照组比较,*P<0.05;与NAC组比较,# P<0.05。Fig. 3 Effects of ACN exposure on protein expression related to NF-κB signaling pathway in rat brainNote: (a) and (b) the immune printing strips ((a) and (b) share the same GAPDH strip); (c) relative protein expression of p-IKKα/β and IKKα; (d) relative protein expression of p-IκBα, IκBα and NF-κB; n=6; compared with the control group, *P<0.05; compared with the NAC group, # P<0.05.
2.5 ACN对大鼠脑组织TLR4 mRNA和蛋白表达水平的影响
如图4所示,46.0 mg·kg-1ACN组大鼠脑组织TLR4 mRNA、蛋白相对表达水平均升高(P<0.05),与46.0 mg·kg-1ACN组比较,NAC组TLR4 mRNA、蛋白相对表达水平差异均无统计学意义(P>0.05)。

图4 ACN染毒后大鼠脑组织TLR4 mRNA和蛋白表达水平变化注:(a)蛋白免疫印迹条带;(b)TLR4蛋白相对表达水平;(c)TLR4 mRNA相对表达水平;与对照组比较,*P<0.05;与NAC组比较,# P<0.05;n=6。Fig. 4 Effects of ACN exposure on the TLR4 mRNA and protein expression in rat brainNote: (a) the immune printing strips; (b) TLR4 relative protein expression; (c) TLR4 relative mRNA expression; compared with the control group, *P<0.05; compared with the NAC group, # P<0.05; n=6.
3 讨论(Discussion)
机体在细胞呼吸和能量代谢过程中发生有氧氧化并产生ROS,包括超氧根离子(·O2-)、羟自由基(·OH)和过氧化氢(hydrogen peroxide, H2O2)等。当机体内产生过量的ROS、抗氧化能力减弱引起ROS清除减慢时,会破坏机体的氧化/还原平衡状态,导致机体发生氧化应激。ROS可引发组织细胞DNA氧化损伤、脂质过氧化、蛋白变性或失活,并参与细胞内信号通路转导[9],衰老、神经退行性病变、炎症性疾病和癌症等其他重大疾病也与氧化应激有关[10]。细胞内存在有效的抗氧化防御系统,抗氧化酶类如SOD、CAT和GSH-Px在消除ROS的过程中起着至关重要的作用[11]。Mahalakshmi等[12]以100 mg·kg-1ACN经饮水染毒雄性Wistar大鼠,14 d和28 d后大鼠脑组织GST含量显著减少,SOD、CAT和GSH-Px活性均显著降低。本研究表明,11.5 mg·kg-1的ACN暴露导致大鼠脑组织CAT活性降低,提示CAT可保护机体免受氧化损伤,但23.0 mg·kg-1和46.0 mg·kg-1ACN暴露组与对照组比较差异无统计学意义,其原因可能是CAT通过代偿性升高来催化H2O2生成无毒的H2O和O2,使H2O2不会被金属离子催化分解为毒性更强的·OH。GSH-Px是含有巯基催化过氧化物分解的酶,其活性的高低间接反映机体清除活性氧的能力。46.0 mg·kg-1ACN组大鼠脑组织GSH-Px活性与对照组比较降低,其原因可能是GSH-Px在清除机体内过量的过氧化物过程中被大量消耗,同时自由基攻击GSH-Px的巯基部位引起酶活性的降低[13]。GSH是机体内重要的非酶性小分子抗氧化剂,通过非酶促反应清除单线态氧和·OH,是机体抵抗氧化损伤的第一道防线[14]。本次研究发现,23.0 mg·kg-1和46.0 mg·kg-1ACN组大鼠脑组织GSH含量降低,这与金娜等[15]的研究结果相一致,ACN及其代谢产物2-氰环氧乙烷(2-cyanoethyleneoxide, CEO)在体内与GSH结合,GSH被消耗。CEO经环氧化物水解酶水解后释放CN-,CN-抑制线粒体呼吸链和抗氧化酶CAT和GSH-Px活性导致组织发生氧化损伤[16-17]。MDA是细胞膜脂质过氧化的终产物,其含量能间接反映生物膜系统受外源化学物氧化损伤的程度。本研究发现,各剂量染毒组大鼠脑组织MDA含量均明显升高,这与国外学者的研究结果相似[18],说明ACN可致大鼠脑组织发生氧化应激。
NAC是一种机体内清除自由基的强有力亲核试剂,也是细胞的巯基供应体,可竞争性地阻止自由基与抗氧化酶发生反应,同时也可促进机体内GSH的合成,减弱机体氧化损伤程度[19-20]。Esmat等[21]以5 mmol·L-1ACN处理大鼠原代神经胶质细胞后,细胞内GSH含量降低,MDA含量增加,并产生大量的CN-,NAC干预后可降低细胞内MDA含量、升高GSH含量,与ACN和/或其代谢产物反应,阻止其转化为CN-以及随后的三磷酸腺苷(adenosine triphosphate, ATP)消耗。本研究发现,通过300 mg·kg-1NAC干预后,大鼠脑组织SOD活性升高,MDA含量及CAT活性均降低,提示NAC可调节ACN引起的机体氧化还原失衡状态,使机体免受氧化损伤。
炎症反应是指当机体受到内外在刺激时产生的一种自我保护性应激反应。IL-6在自然免疫向获得性免疫转变的过程中起着关键作用,可促进单核细胞趋化因子的产生,诱导B细胞分化产生抗体以及T细胞的活化和增殖。IL-1有IL-1α和IL-1β这2种分子形式,正常生理状态下脑组织中IL-1β浓度非常低,在发生创伤性脑损伤时,神经元和星形胶质细胞迅速释放IL-1β,神经元发生肿胀、萎缩,随后消失溶解,神经元数目减少[22]。TNF有2种同源蛋白受体TNFR1和TNFR2,可通过激活下游NF-κB信号通路募集促炎症细胞因子,促进炎症反应[23]。本研究发现,ACN染毒后,大鼠脑组织IL-6、IL-1β和TNF-α浓度均升高,提示ACN可诱导大鼠脑组织发生炎症反应。
Toll样受体(toll-like receptors, TLRs)是吞噬细胞表面的一种模式识别受体(pattern recognition receptors, PRRs),可以识别一种或多种病原相关分子模式(pathogen-associated molecular patterns, PAMPs),对侵入机体的病原体迅速产生应答,产生急性炎症,调节机体的获得性免疫反应[24-25]。TLR4属于Ⅰ型跨膜蛋白受体,分为胞外段、胞内段和跨膜区3个部分,胞外段可识别PAMPs;跨膜区由半胱氨酸组成,胞内段与IL-1受体同源,被称为Toll/IL-1受体(Toll/interleukin-1 receptor, TIR),即TIR区域,该结构域招募下游衔接蛋白形成复合体,将信号传导至细胞核内[26]。TLR4信号通路分为MyD88依赖性和MyD88非依赖性/TRIF依赖性2条细胞信号传导途径,TLR4的TIR与MyD88连接,MyD88与IRAK-1及其配体结合,IRAK-1在激酶的作用下高度磷酸化,脱离MyD88与TNF受体相关因子6(TRAF-6)结合,TAK-1被TRAF-6激活后介导NF-κB抑制因子IκB磷酸化,激活NF-κB,与炎症反应调节基因启动子区域的NF-κB结合位点相结合,启动细胞因子如TNF-α、IL-1、IL-6、IL-8和IL-12基因的转录[27-28]。
NF-κB是细胞核内重要的转录调节因子,细胞未受刺激时,NF-κB二聚体p65/p50与其抑制蛋白IκB以无活性的三聚体复合物p65/p50·IκB存在于胞质中,阻止NF-κB活化后向核内转移。当受到紫外线、脂多糖(lipopolysaccharide, LPS)、IL-6、IL-1β、TNF-α及ROS等多种刺激时,该三聚体被激活,进而激活IKK,使IκB磷酸化并发生泛素化,最后被26S蛋白酶小体识别并降解,NF-κB从胞质易位到细胞核,活化后的NF-κB可上调下游多种促炎性因子(如IL-1、IL-6、TNF-α和IL-8)、黏附分子和趋化因子mRNA表达水平并产生次级炎症介质的酶(图5)。同时NF-κB可被这些下游细胞因子再次刺激,造成炎症反应的持续或放大[29]。
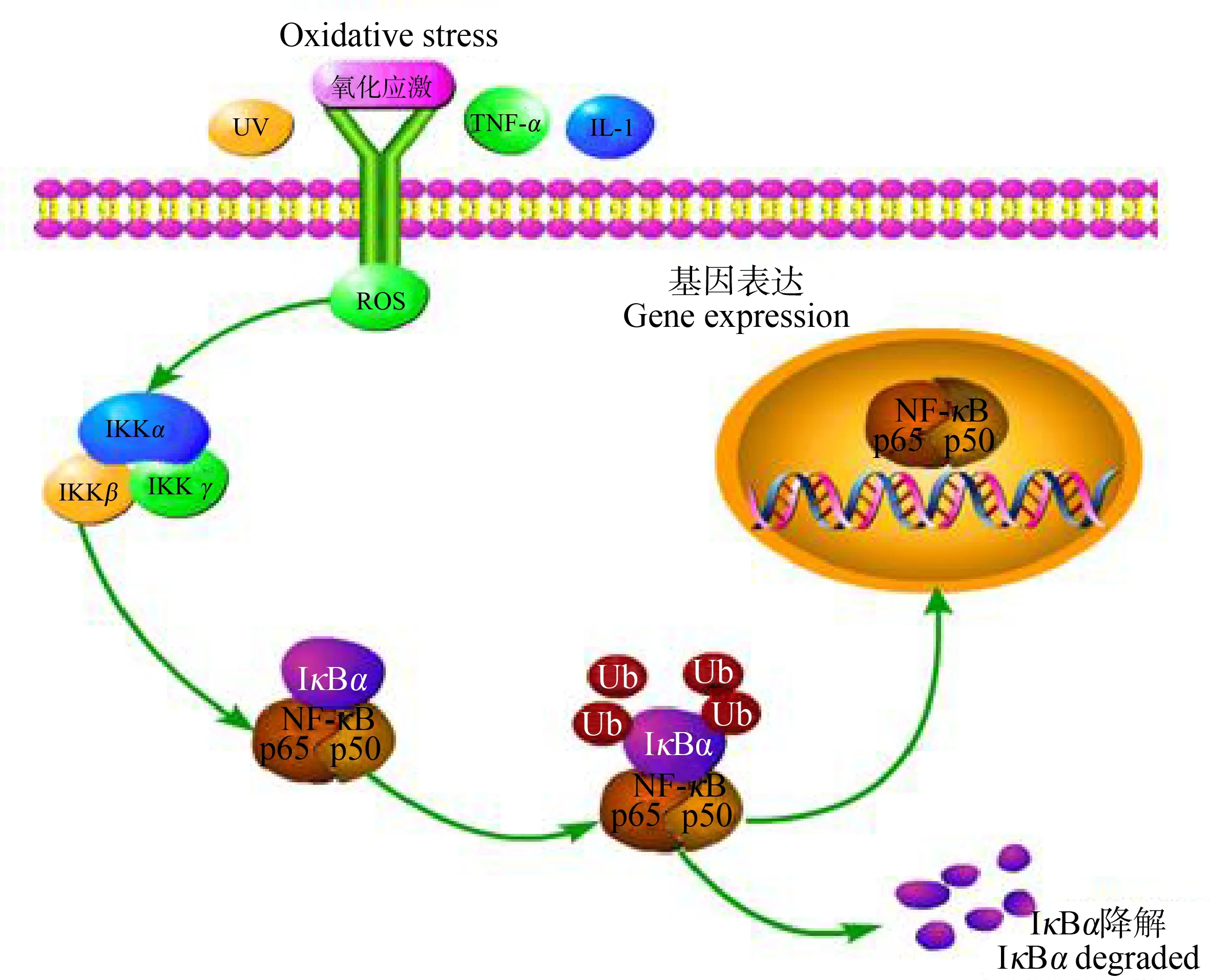
图5 NF-κB信号通路机理图Fig. 5 Mechanism diagram of NF-κB signaling pathway
本次研究表明,ACN染毒后,大鼠脑组织IKKα、NF-κB和TLR4 mRNA相对表达水平均上调,IKKα、p-IKKα/β、IκBα、p-IκBα、NF-κB和TLR4蛋白相对表达量均升高,提示ACN诱导大鼠发生氧化应激、炎症反应,进而激活NF-κB信号通路,TLR4参与了ACN染毒后NF-κB的活化。本研究发现,IκBαmRNA和蛋白相对表达量与对照组比较差异无统计学意义,其可能原因是IκBα基因启动子中的NF-κB结合位点诱导IκBα基因表达迅速上调,当胞浆内IκBα浓度减少后,IκBα通过自身的负反馈调节NF-κB的活性,维持细胞的自身稳定性[30-31]。经300 mg·kg-1NAC干预后,与46.0 mg·kg-1ACN组比较,大鼠脑组织IKKα和NF-κB mRNA表达水平均下调,p-IKKα/β和NF-κB蛋白相对表达量均下降,说明NAC通过拮抗ACN诱导脑组织发生氧化应激,抑制NF-κB的活化。
综上所述,在本研究的实验条件下,ACN通过诱导大鼠脑组织氧化/抗氧化失衡和炎症反应,进而激活NF-κB信号通路,这可能是ACN致大鼠脑损伤的机制之一。NAC干预可拮抗ACN诱导脑组织发生氧化应激,抑制NF-κB的活化。
