臭氧暴露诱发小鼠急性肺部损伤及抗氧化剂的拮抗作用
2020-04-08郑子龙陈雨珊杨旭曾燕李金泉
郑子龙,陈雨珊,杨旭,2,曾燕,李金泉,*
1. 武汉科技大学医学院,脑科学先进技术研究院,武汉 430081 2. 华中师范大学生命科学学院,武汉 430079
在工业化、城市化和全球变暖三重压力下,我国城市臭氧(ozone, O3)的污染风险不断提高。城市臭氧污染主要是指城市近地面臭氧,是由氮氧化物和挥发性有机物等臭氧前体物质,在强烈的阳光紫外线照射下,发生光化学反应,生成主要成分为臭氧的光化学烟雾。近年来,随着我国“大气十条”方案的逐步落实,空气质量改善显著,PM2.5浓度下降明显,但是臭氧污染的势头却持续上升,导致在我国许多地区臭氧已超越PM2.5成为夏秋季各地空气首要污染物[1-4]。我国生态环境部2019年空气质量数据显示,全国337个地级及以上城市臭氧平均浓度同比上升6.5%,高达148 μg·m-3,接近我国空气质量臭氧污染红线160 μg·m-3。作为一种强氧化剂,臭氧几乎可与任何生物组织反应并引起不利健康的影响。臭氧暴露会引起气道炎症、导致气道狭窄、支气管反应性增加和肺功能下降[5]。此外,暴露于臭氧与患有阻塞性肺疾病(例如哮喘和慢性阻塞性肺疾病)的患者症状恶化、呼吸系统疾病的发病率和死亡率增加紧密相关[6-7]。Francis等[8]研究发现,暴露于臭氧后,趋化因子受体2(CCR2)在肺中的促炎和抗炎巨噬细胞积累中均起作用。Li等[9]研究发现,线粒体活性氧(mtROS)和NLRP3炎性体均在臭氧诱导的肺部炎症中起作用。然而,虽然臭氧污染带来的健康风险已受到普遍关注,但相关防治策略及其生物学机制仍不清楚,亟待深入研究。
核因子E2相关因子2 (Nuclear factor E2-related factor 2,Nrf2)是氧化还原敏感的转录因子,在编码抗氧化剂和/或排毒酶和相关压力响应蛋白的基因的启动子区域中起重要作用[10-11]。Nrf2可调节血红素加氧酶1(HO-1)、NADPH:醌氧化还原酶1(NQO-1)和γ-谷氨酸半胱氨酸连接酶(GCL)等抗氧化酶,以减轻炎症损害并中和炎性损伤引起的细胞/组织的活性氧(ROS)[12]。氧化/抗氧化失衡被认为在肺部炎症损伤中起到重要作用。激活以Nrf2为代表的抗氧化酶系统能够减轻氧化应激引起的肺损伤,但其在抑制臭氧吸入毒性从而减轻肺部炎症中的作用仍有待研究。褪黑素(melatonin, MT)是一种松果体激素,有抗氧化、调节免疫和调节昼夜节律等多种生理功能[13],可抑制体内氧化应激[14-15],保护细胞蛋白质、脂质和DNA免受氧化损伤[16]。因此,本研究通过构建小鼠臭氧急性暴露模型,观察臭氧暴露对肺组织氧化应激和炎症损伤的相关指标,通过抗氧化剂MT的处理,探究MT是否通过激活Nrf2及其下游抗氧化酶拮抗臭氧诱发小鼠急性肺部损伤,以期验证臭氧暴露诱导的肺部损伤机制。
1 材料与方法(Materials and methods)
1.1 实验动物
SPF级雄性Balb/c小鼠,购买于湖北省疾病预防控制中心(国家级实验动物中心),6~8周龄,体重(22±2) g,饲养于华中师范大学实验动物中心,12 h昼夜循环光照,温度保持在22~24 ℃,湿度为40%~60%,小鼠饮食饮水充足供应。臭氧暴露前,小鼠适应性饲养7 d。
1.2 主要仪器
KTB便携式臭氧发生器(广州创环臭氧电器设备有限公司),KP836便携式臭氧检测仪(江苏羽翼科技有限公司)、DW-HL100型-80 ℃超低温冰箱(中科美菱有限公司,中国)、5415R低温冷冻离心机(艾本德有限公司,德国)、DNM-9602全长酶标仪(北京普朗新技术有限公司,中国)、Dancer/MS3涡旋仪(艾卡仪器设备有限公司,德国)、移液器(艾本德有限公司,德国)、CFX96 Real-time PCR仪(伯乐生命医学产品有限公司,美国)。
1.3 主要试剂和检测试剂盒
褪黑素(Sigma公司,美国)、小鼠IL-1β(货号:88-7013-22,灵敏度:8 pg·mL-1)、IL-33(货号:88-7333-22,灵敏度:25 pg·mL-1)、IL-4(货号:88-7044-22,灵敏度:4 pg·mL-1)、IL-17A(货号:88-7371-22,灵敏度:4 pg·mL-1)酶联免疫试剂盒(eBioscience公司,美国),小鼠微量GSH试剂盒(南京建成生物工程研究所,中国),BCA蛋白质测定试剂盒(生工生物工程股份有限公司,中国),戊巴比妥钠(Sigma公司,美国),硫代巴比妥酸(国药集团化学有限公司,中国),苏木精和伊红(国药集团化学有限公司,中国),多聚甲醛(国药集团化学有限公司,中国),荧光实时定量PCR试剂盒(新英格兰生物实验室,美国),Nrf2、HO-1和NQO-1引物(生工生物工程股份有限公司,中国)。
1.4 实验分组和染毒方案
将24只Balb/c小鼠随机分为4组,每组6只,分别为:(1)生理盐水对照组(Control);(2)褪黑素对照组(MT);(3)臭氧暴露组(2.14 mg·m-3O3);(4)臭氧暴露+褪黑素保护组(2.14 mg·m-3O3+MT)。连续进行7 d,每天上午8:00到11:00对臭氧暴露组与臭氧暴露+褪黑素保护组小鼠进行2.14 mg·m-3的臭氧暴露,臭氧由便携式臭氧发生器产生,根据便携式臭氧检测仪调节进气流量;对照组小鼠暴露于洁净空气。臭氧暴露后对MT组和2.14 mg·m-3O3+MT组小鼠按5 mg·kg-1浓度口服MT保护剂,连续进行7 d。臭氧暴露浓度2.14 mg·m-3是参考已发表以及本课题组前期实验结果制定的[17-19]。
1.5 小鼠肺泡灌洗液的提取
灭菌手术剪剥离小鼠颈部气管至清晰暴露,气管上段横切剪一个0.1 cm左右小口,将气管插管插入到小鼠气管中固定,按压小鼠肺部以排除其肺部空气。分别注入1、0.8和0.8 mL生理盐水至气管插管中,轻轻揉压小鼠肺部,使生理盐水充分接触肺部后缓慢回收3次肺泡灌洗液(BALF)保存。
1.6 肺组织匀浆制备
用预冷的磷酸缓冲盐溶液(PBS)清洗取出的小鼠肺组织,用吸水纸吸干后称重,放入灭菌的2 mL玻璃匀浆器(上海信裕生物科技有限公司,中国)中,加入预冷的PBS制备成10%的肺组织匀浆液,8 000 ×g、4 ℃离心10 min,取上清分装后置于低温环境保存。
1.7 小鼠肺组织病理切片
取部分肺组织,用4%多聚甲醛固定48 h,脱水后进行石蜡切片(5 μm)与苏木精-伊红染色(H&E stain),于DM4000B光学显微镜(徕卡微系统有限公司,德国)下观察肺组织切片染色结果,并拍照分析。
1.8 各项生物学指标的测定
小鼠肺泡灌洗液细胞因子包括IL-1β、IL-33、IL-4和IL-17A的测定,均采用商用酶联免疫(ELISA)试剂盒进行测定,按照ELISA试剂盒的说明书进行操作。
还原型谷胱甘肽(GSH)含量测定:2-硝基苯甲酸(DTNB)可以在黑暗的条件下与GSH反应形成黄色化合物1,3,5-三硝基苯(TNB),在412 nm波长处测定吸光值,同时采用GSH标准品制作标准曲线,使用标准曲线计算GSH的含量。使用改良的BCA蛋白质测定试剂盒测定样品蛋白质浓度。
硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量:MDA可与TBA缩合,形成红色产物,在532 nm处有最大吸收峰。取200 μL肺组织匀浆液,加入800 μL质量分数为0.6%的TBA溶液,沸水浴15 min后,8 000 ×g、4 ℃下离心10 min,取上清液200 μL于酶标板,分别在450、532和600 nm波长下测定吸光度,按照公式CMDA=(6.45(OD532 nm-OD600 nm)-0.56OD450 nm)/Cprotein,计算出MDA含量(μmol·g-1protein)。样品蛋白质浓度使用改良的BCA蛋白质测定试剂盒测定。
目的基因mRNA表达测定:Trizol法提取总mRNA,对mRNA含量及纯度进行测定。按照逆转录试剂盒说明建立反应体系反转录成cDNA,根据目的基因引物进行RT-qPCR测定,最后采用2-△△CT法分析目的基因表达情况。引物序列如表1所示。
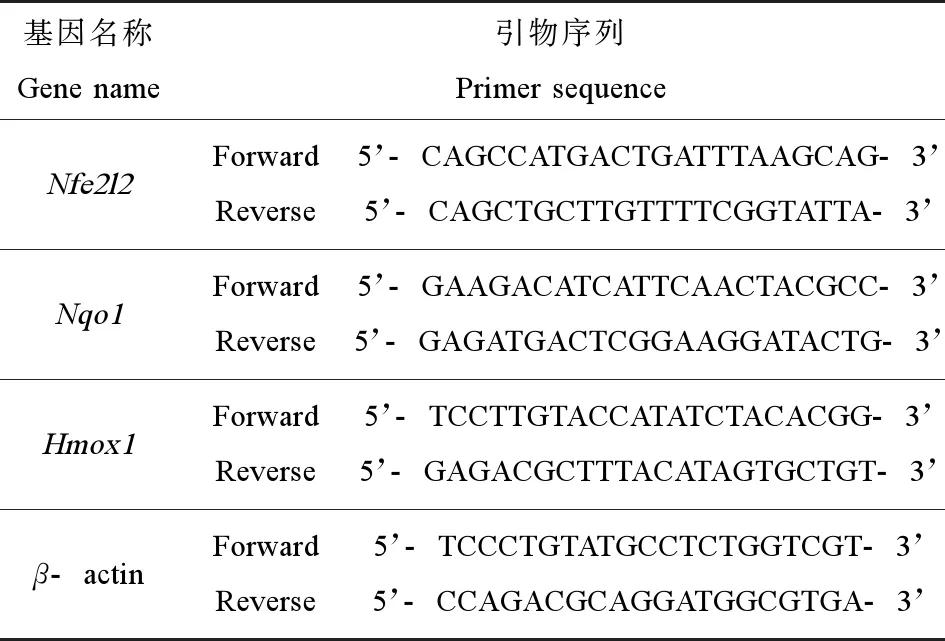
表1 RT-qPCR测试的引物序列Table 1 Primer sequence for RT-qPCR
1.9 统计分析
实验数据均采用平均值±标准偏差表示,利用Graph Pad8.0统计分析软件进行数据处理及绘图,组间各指标比较均采用单因素方差分析,随后进行Holm-Sidak多重比较检验,P<0.05为差异有统计学意义。
2 结果(Results)
2.1 小鼠肺组织病理学改变
如图1所示,与对照组相比,2.14 mg·m-3O3组小鼠气道发生了明显的重塑现象,包括气道壁增厚,气道腔变得狭窄,并且炎细胞浸润显著性增加;与2.14 mg·m-3O3组相比,2.14 mg·m-3O3+MT组小鼠炎细胞浸润和气道重塑现象均显著减轻。
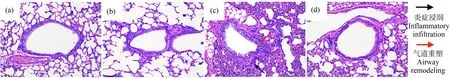
图1 不同处理组小鼠肺组织苏木精-伊红染色图注:MT表示褪黑素;(a)对照组(生理盐水组),(b) MT(5 mg·kg-1)处理组,(c) 2.14 mg·m-3 O3处理组,(d) 2.14 mg·m-3 O3+MT(5 mg·kg-1)处理组。Fig. 1 H&E stain of lung section of mice in different treatment groupsNote: MT stands for melatonin; (a) control group (saline group), (b) MT (5 mg·kg-1) treatment group, (c) 2.14 mg·m-3 O3 treatment group, (d) 2.14 mg·m-3 O3+MT (5 mg·kg-1) treatment group.
2.2 小鼠肺组织细胞因子含量的变化
如图2所示,与对照组相比,MT处理组并没有引起小鼠肺组织中IL-1β、IL-33、IL-4和IL-17A的含量发生显著性改变;2.14 mg·m-3O3组的IL-1β、IL-33、IL-4和IL-17A的含量增高,差异均有统计学意义(P<0.01)。与2.14 mg·m-3O3组相比,2.14 mg·m-3O3+MT组小鼠肺组织IL-1β、IL-33、IL-4和IL-17A含量均降低,差异均有统计学意义(P<0.01)。
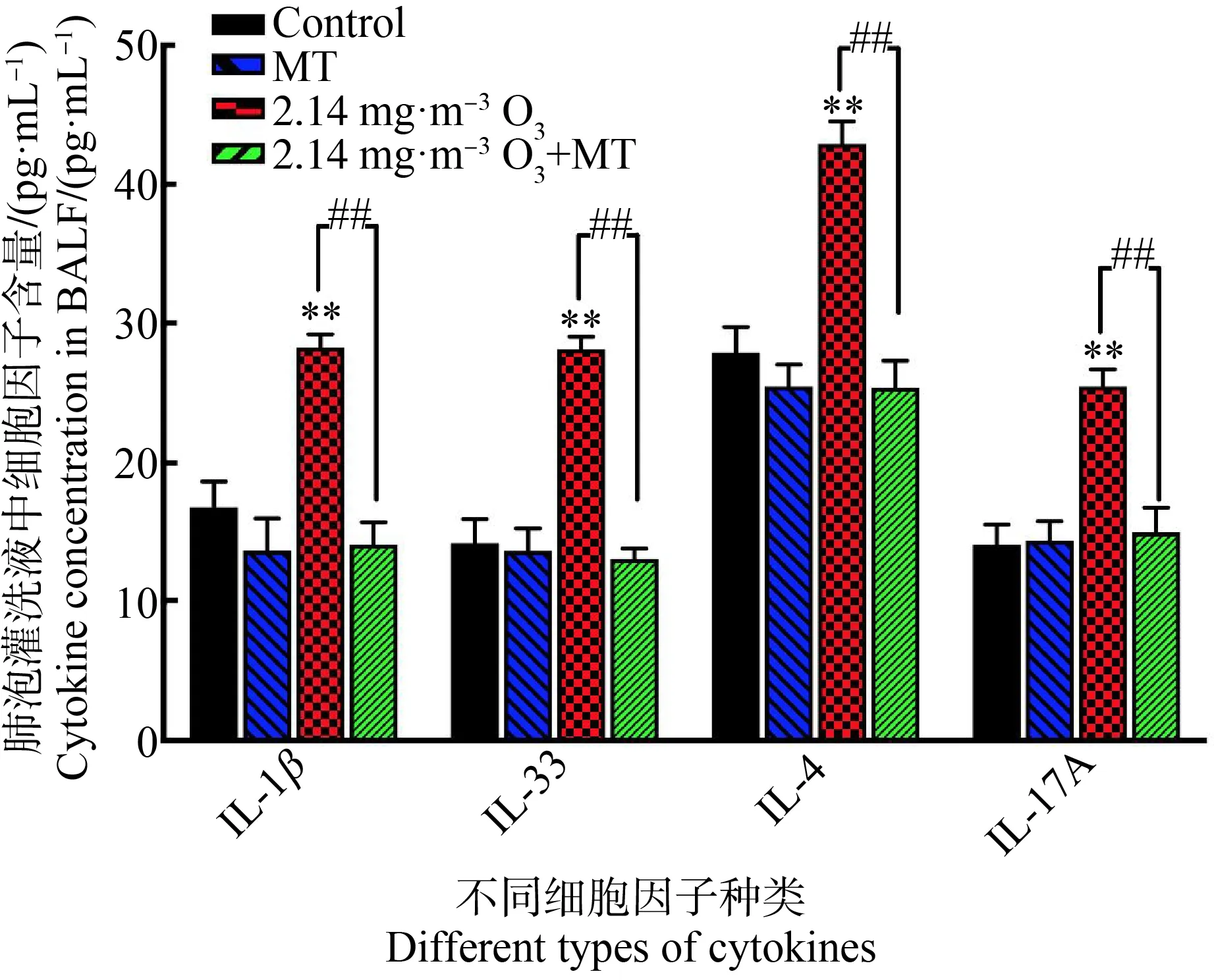
图2 小鼠肺泡灌洗液细胞因子含量注:**表示P<0.01,与生理盐水组相比;##表示P<0.01,与2.14 mg·m-3 O3组相比。Fig. 2 Cytokine concentration in bronchoalveolar lavage fluid (BALF) of miceNote: **represents P<0.01, compared with the control group; ## represents P<0.01, compared with the 2.14 mg·m-3 O3 group.
2.3 小鼠肺组织GSH和MDA含量的变化
如图3所示,与对照组相比,2.14 mg·m-3O3组的GSH含量降低,差异均有统计学意义(P<0.01);MDA含量显著性升高,差异均有统计学意义(P<0.05);MT组GSH和MDA含量无明显改变。与2.14 mg·m-3O3组相比,2.14 mg·m-3O3+MT组肺组织GSH含量上升,MDA含量下降,且均具有显著性差异(P<0.01)。
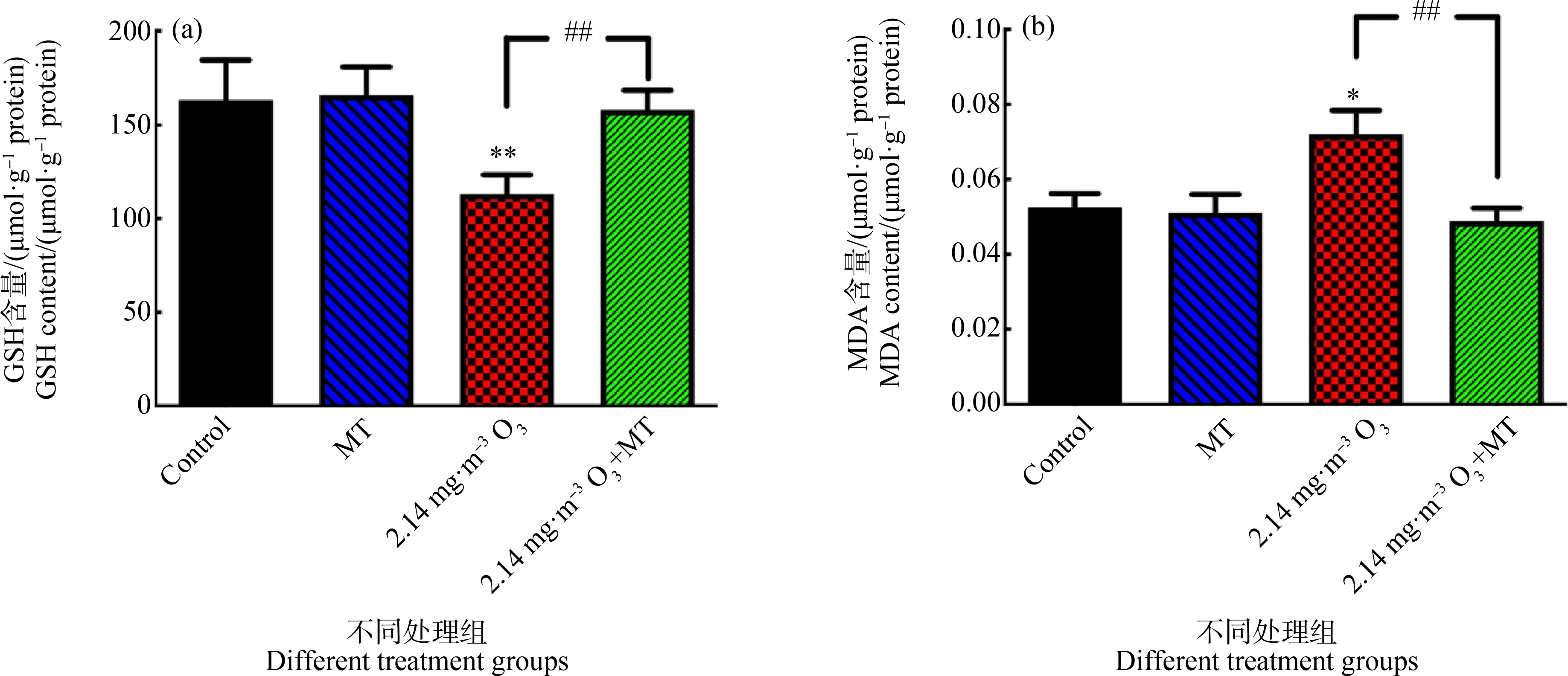
图3 小鼠肺组织谷胱甘肽(GSH)和丙二醛(MDA)含量注:*表示P<0.05,**表示P<0.01,与对照组相比;##表示P<0.01,与2.14 mg·m-3 O3组相比。Fig. 3 The content of glutathione (GSH) and malondialdehyde (MDA) in mice lungNote: *represents P<0.05, **represents P<0.01, compared with the control group; ## represents P<0.01, compared with the 2.14 mg·m-3 O3 group.
2.4 Nrf2、HO-1和NQO-1 mRNA相对表达量的变化
如图4所示,与对照组相比,2.14 mg·m-3O3组小鼠肺部Nrf2、HO-1和NQO-1的mRNA相对表达量降低,且差异均具有统计学意义(P<0.01)。MT单独作用并不会造成肺组织中Nrf2、HO-1和NQO-1表达量发生改变;与2.14 mg·m-3O3组相比,2.14 mg·m-3O3+MT组的小鼠肺组织Nrf2、NQO-1和HO-1的表达量都发生上调,且均具有显著性差异(P<0.01或P<0.05)。
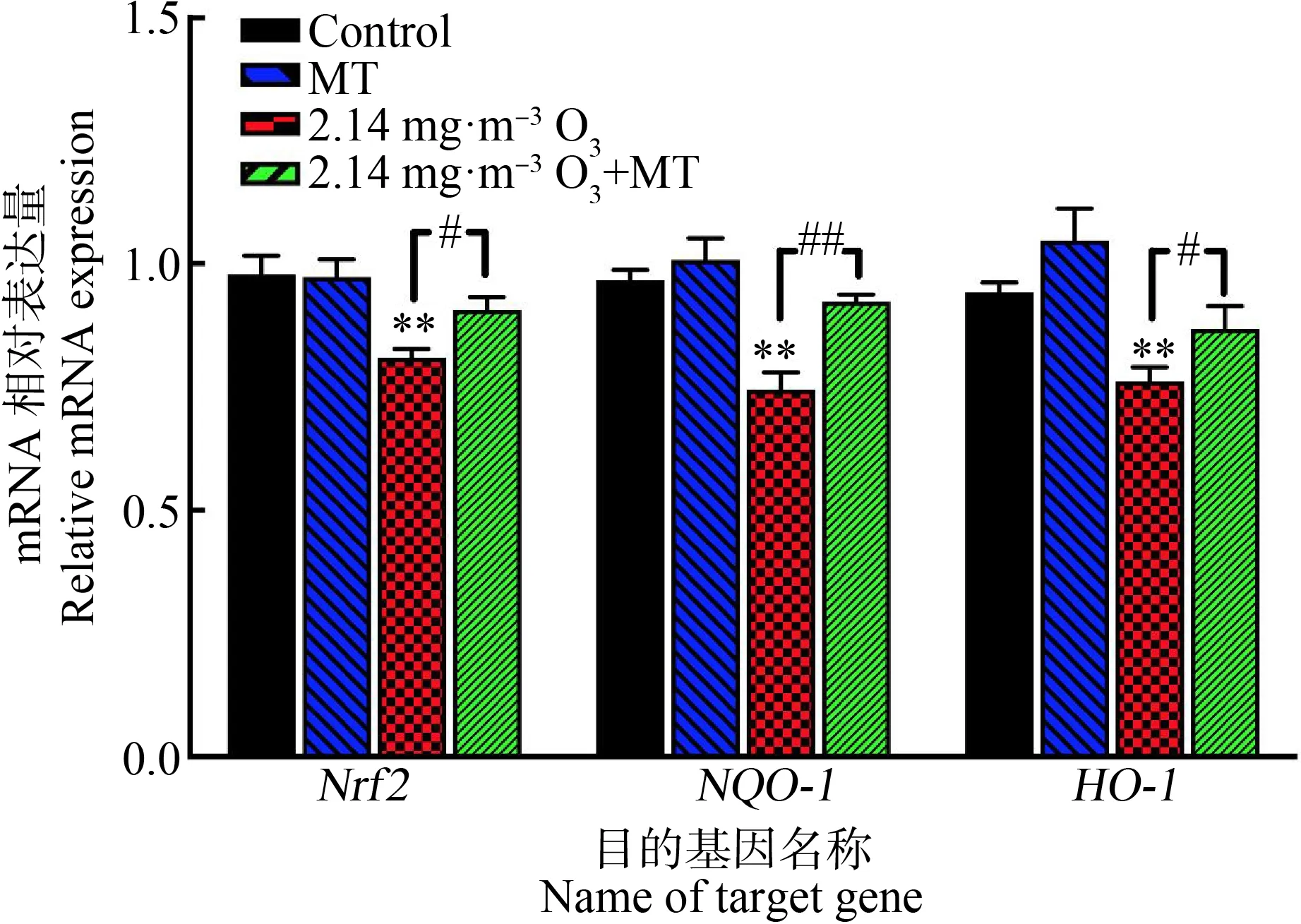
图4 Nrf2与抗氧化基因NQO-1和HO-1的表达注:Nrf2代表核因子-E2相关因子2基因,HO-1代表血红素加氧酶1基因,NQO-1代表NADPH:醌氧化还原酶1基因;**表示P<0.01,与生理盐水组相比,#表示P<0.05、##表示P<0.01,与2.14 mg·m-3 O3组相比。Fig. 4 Expression of Nrf2 and antioxidant genes NQO-1 and HO-1Note: Nrf2 stands for nuclear factor E2-related factor 2; HO-1 stands for heme oxygenase 1 gene; NQO-1 stands for NADPH:quinone redox enzyme 1 gene; **represents P<0.01, compared with the control group; # represents P<0.05, ## represents P<0.01, compared with the 2.14 mg·m-3 O3 group.
3 讨论(Discussion)
本研究使用Balb/c小鼠,通过构建臭氧急性暴露小鼠模型,探究抗氧化剂对臭氧诱发肺组织损伤的拮抗作用。研究结果表明,臭氧暴露后模型小鼠肺组织炎症细胞浸润加剧,气道重塑,IL-1β、IL-33、IL-4和IL-17A等多种细胞因子的表达升高,同时,抗氧化元件Nrf2及其下游抗氧化酶mRNA表达下调,出现更为严重的肺组织氧化损伤。更为重要的是,通过抗氧化剂MT的使用,模型小鼠肺组织氧化应激水平显著降低。同时,拮抗了臭氧暴露对小鼠肺组织造成的炎症损伤以及病理学改变。
氧化损伤是机体氧化还原平衡被打破向氧化水平升高方向转化后造成的细胞和组织的损伤,在各类过敏性疾病的发病过程中都起着重要作用[20]。氧化应激是多种病理损伤的关键因素,高水平的氧化应激与脂质、蛋白质、遗传物质和细胞膜的损伤有关。臭氧作为具有高度活性的氧化剂,可通过产生ROS导致细胞毒性[21],造成组织出现不同程度的损伤[20,22]。体内具有可以清除ROS的还原性多肽如GSH,它的消耗可以反映机体氧化还原平衡被打破的程度[23]。ROS过量后会造成对细胞和组织中脂质物质的氧化,而MDA则是脂质过氧化的产物。本研究表明,臭氧暴露后肺组织匀浆中MDA含量的上升、GSH含量的下降,表明小鼠肺部氧化还原平衡被打破,造成了明显的氧化损伤。此外,小鼠肺组织中的细胞因子IL-1β、IL-33、IL-4和IL-17A含量显著上升表明了臭氧暴露在小鼠模型中引发了明显的炎症反应。H&E染色也发现臭氧暴露后小鼠气道出现重塑和明显的炎细胞浸润。
褪黑素是松果体的一种激素,也存在于许多的植物中,该化合物具有多种有利的生物学和治疗活性,例如用于抗氧化剂、抗炎剂、抗肿瘤剂、抗糖尿病药和心脏保护剂的生产[24-25]。Ding等[26]的研究表明,在实验性脑外伤中,褪黑素可刺激抗氧化酶活性并降低氧化应激效应。本研究拟通过口服暴露褪黑素减轻臭氧暴露对小鼠肺部造成的损伤。研究结果表明,褪黑素处理后,臭氧暴露组小鼠肺组织MDA含量显著性下降,GSH含量显著性上升;且肺泡灌洗液中细胞因子IL-1β、IL-33、IL-4和IL-17A含量也显著性下降。这表明,褪黑素的使用不仅可以降低肺组织中的氧化损伤,还可以抑制炎症反应,减轻肺组织病理学的改变。Nrf2是氧化应激调节中的一种强大的氧化还原传感器,也是启动许多抗氧化基因的基本要素[27]。在本实验中,没有经过臭氧暴露的小鼠由于体内的氧化还原处于平衡状态,所以MT的单独作用并不会引起Nrf2的活化及其相关抗氧化基因HO-1和NQO-1的表达。但是,当臭氧暴露后,肺组织中的氧化还原平衡被打破,此时MT可以通过激活Nrf2通路实现其抗氧化功能。
综上所述,臭氧急性暴露能显著增加小鼠肺组织中的氧化应激和炎症水平,造成肺组织病理学改变和损伤;而抗氧化剂的使用可增加Nrf2及其下游抗氧化酶的表达,有效降低臭氧暴露后小鼠肺组织氧化应激水平,拮抗臭氧对小鼠肺组织的炎症损伤,进一步验证了臭氧暴露引起的肺部损伤是通过氧化性损伤机制介导的。
