不同品种酿酒葡萄根系抗寒性鉴定*
2020-04-08张晓煜陈仁伟刘兆宇李芳红李红英
杨 豫, 张晓煜,**, 陈仁伟, 刘兆宇, 李芳红, 冯 蕊, 王 静, 李红英
不同品种酿酒葡萄根系抗寒性鉴定*
杨 豫1, 张晓煜1,2,3**, 陈仁伟1, 刘兆宇1, 李芳红1, 冯 蕊1, 王 静2,3, 李红英2,3
(1. 宁夏大学农学院 银川 750021; 2. 中国气象局旱区特色农业气象灾害监测预警与风险管理重点实验室 银川 750002; 3. 宁夏气象科学研究所 银川 750002)
越冬冻害是制约中国北方酿酒葡萄产业发展的限制性因素之一, 葡萄根系的抗寒能力很弱且随品种遗传性状差异而变化。为鉴定不同品种酿酒葡萄根系抗寒性, 为葡萄越冬冻害的监测、预警和防御提供理论依据。本研究以贺兰山东麓‘赤霞珠’ ‘美乐’ ‘马瑟兰’ ‘威代尔’ ‘西拉’ ‘北玫’ ‘北红’ ‘龙眼’8个品种酿酒葡萄根系为试材, 测定其在模拟自然降温冷冻过程中的生理响应指标(过冷却点、结冰点、可溶性糖、可溶性蛋白、电导率及半致死温度)。运用相关分析与聚类分析方法, 综合评价8个品种酿酒葡萄根系的抗寒能力。研究结果表明: 1)可溶性蛋白含量显著影响葡萄根系组织的抗寒性。2)供试的8个品种葡萄根系抗寒能力可分为3类: 弱抗寒型(‘赤霞珠’ ‘美乐’ ‘西拉’), 过冷却点–3.8~–3.2 ℃, 结冰点–2.8~–2.3 ℃, 半致死温度–4.34~–3.19 ℃; 中抗寒型(‘北玫’ ‘马瑟兰’ ‘威代尔’), 过冷却点为–5.4~–4.4 ℃, 结冰点在–4.1~–3.7 ℃, 半致死温度–5.90~–4.43 ℃; 强抗寒型(‘北红’ ‘龙眼’), 过冷却点在–6.4~–6.3 ℃, 结冰点–5.2~–4.8 ℃, 半致死温度–6.55~–6.11 ℃。3)根系抗寒能力在不同品种间有显著性差异, 8个品种葡萄根系的抗寒能力强弱顺序为: ‘北红’>‘龙眼’>‘北玫’>‘威代尔’>‘马瑟兰’>‘赤霞珠’>‘美乐’>‘西拉’。过冷却点、结冰点温度可以作为评价葡萄抗寒性的重要指标。研究结果对于完善葡萄抗寒性评价方法及指导防寒减灾工作具有重要意义。
越冬冻害; 酿酒葡萄; 根系; 抗寒性; 过冷却点; 电导率; 可溶性蛋白
越冬冻害是中国北方葡萄(L)种植区的主要气象灾害之一[1], 主要发生在西北内陆防寒埋土区, 特别是宁夏贺兰山东麓、甘肃河西走廊地区、新疆的焉耆盆地和石河子葡萄产区, 葡萄越冬冻害发生频率高, 影响范围大, 这一带的葡萄园3年一小冻, 5年一大冻, 10年1次特大冻害。越冬冻害发生严重的年份, 葡萄园植物大量死亡, 造成葡萄园缺苗断垄。越冬冻害发生轻度和中度年份, 葡萄植株表现为放条后生长迟缓、滞长、减产, 严重制约着这些产区葡萄产业的可持续发展[1]。开展酿酒葡萄抗寒性研究, 对揭示酿酒葡萄越冬冻害形成机理, 提高葡萄越冬冻害监测、预警和防御能力具有重要意义。
葡萄为木质藤本植物, 不同器官的抗寒性有所不同。有研究表明, 葡萄枝条抗寒性最强, 芽次之, 根系由于不休眠, 抗寒性最差[2-4]。因此, 葡萄根系抗寒性的强弱决定了葡萄树体能否安全越冬。目前, 对于酿酒葡萄抗寒性已有大量研究报道[5-7]。卢精林等[8]认为电导率、可溶性糖与葡萄枝条抗寒性密切相关; 高振等[9]认为低温放热法可判断葡萄芽的抗寒性。但有关评价葡萄根系抗寒性研究较少[10]。王丽雪等[11]、郭修武等[12]、张文娥等[13]研究表明, 不同种群葡萄的抗寒性差异较大。除山葡萄外, 葡萄根系在–5 ℃时已遭受明显冻害, 但不同品种的葡萄根系受冻临界温度不同。
差热分析(different thermal analysis, DTA)在国内主要应用于确定果树或昆虫遭受冻害过程中的临界温度[14-15], 根据植物细胞的“过冷却现象”判断植物对低温的响应。该技术的原理为: 细胞液在低温下形成冰晶时, 水由液态变为固态会释放热量, 通过DTA系统记录温度下降过程中的细胞放热现象。此技术在仁用杏(L)花器官[16]、玉米(L.)与向日葵(L.)[17]、早春开花植物[18]的抗寒性鉴定中均有应用。电导法结合半致死温度是比较可靠的判断植物逆境伤害的指标[19], 可溶性糖和可溶性蛋白作为细胞内渗透调节物质, 其含量可改变细胞液浓度, 从而显著影响细胞的结冰温度[20]。DTA系统在葡萄抗寒性上的应用较少, 特别是针对不同酿酒葡萄品种抗寒性鲜有报道。为此, 本文拟通过人工霜冻试验箱(DTA系统)和温度交变箱, 模拟酿酒葡萄根系越冬冻害自然冷冻过程, 通过检测葡萄根系的过冷却点和结冰点, 结合电导率和生化指标检测, 综合分析葡萄根系在冻害发生过程中的物理和生化过程, 从而鉴定各个葡萄品种根系的抗寒性强弱, 明确各个葡萄品种根系越冬冻害温度指标范围, 为中国北方酿酒葡萄越冬冻害监测、预警和防御提供理论参考。
1 材料与方法
1.1 试验材料
供试材料选择8个中国北方规模种植的酿酒葡萄品种根系, 欧亚种‘赤霞珠’(Cabernet Sauvignon)、‘美乐’(Merlot)、‘西拉’(Syrah)、‘马瑟兰’(Marselan), 欧美杂种‘威代尔’(Vidal), 欧山杂种‘北玫’(Beimei)、‘北红’(Beihong), 东亚种‘龙眼’(Longyan), 样本来源见表1。其中巴格斯、西夏王葡萄基地土壤类型为灌淤土; 美贺庄园、观兰酒庄葡萄园土壤下层为淡灰钙土, 上层为砾石土; 清徐园艺场土壤类型为褐土。采样树体树龄5~7 a, 南北行向种植, 行距3.0 m, 露地厂字型栽培, 植株健壮, 无病虫害, 产量水平为4.5 t∙hm–2。各园区均采用常规葡萄园养护管理措施。于2018年11月1—3日, 葡萄采收修剪后, 枝条下架埋土前取样。试验采取单株小区取样, 设置3次重复。在30~40 cm土层内, 取长势良好、均匀一致的当年生葡萄侧根20根, 根系直径2~3 mm, 去离子水漂洗干净, 纱布吸干表面水分, 在样本袋内密封待测。
1.2 研究方法
1.2.1 过冷却点和结冰点检测
试验以各品种的根系表皮作为测定部位。取酿酒葡萄根系放入人工霜冻试验箱(型号: SDX-20)内, 将T(K)-G 0.32型热电偶温度传感器固定在待测部位, 温度传感器与FrosTem40 V2.0数据采集系统和微机连接, 计算机每10 s扫描采集1次数据, 自动连续记录数据,分析根系表面温度变化, 绘制温度变化曲线, 精度±0.3 ℃。设置温度曲线模拟自然降温过程, 以3.0 ℃·h–1的速度降温, 从室温降至–15.0 ℃。降温过程中由温度曲线可确定根系的过冷却点和结冰点(图1)。当温度下降到一定程度时, 葡萄根系细胞溶液从液态转变为固态时放热, 温度骤然上升, 表现为温度变化曲线出现峰值跳跃, 该峰的起点温度就是过冷却点(1)。当细胞溶液形成冰晶核后, 温度不再上升, 放热与吸热处于平衡状态, 该温度峰到达顶点, 此时温度即结冰点(2)。根系的过冷能力以过冷却点和结冰点的温度差表示, 即过冷能力=过冷却点温度-结冰点温度。
表1 供试酿酒葡萄品种及来源
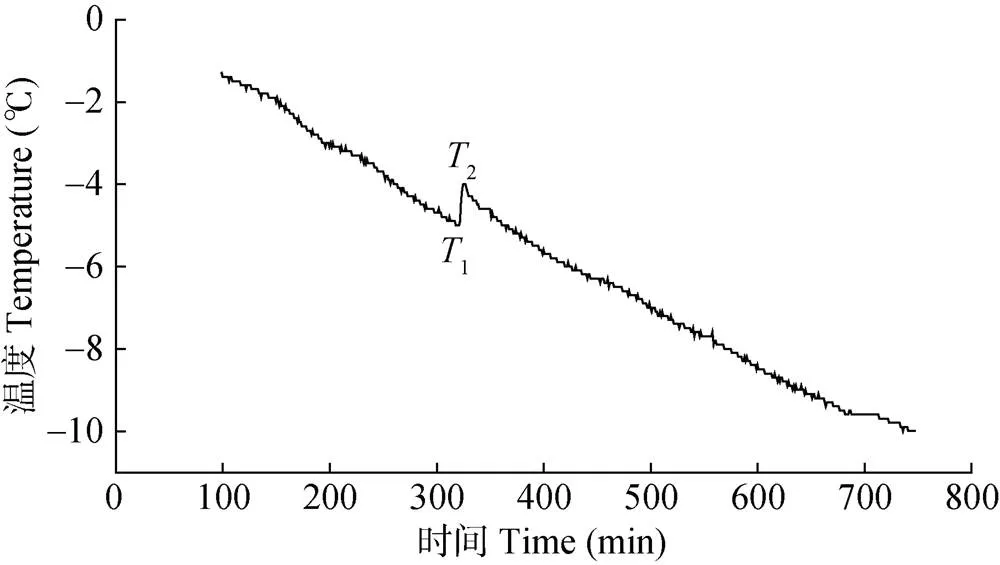
图1 降温过程葡萄根系过冷却点(T1)和结冰点(T2)模拟图
1.2.2 相对电导率测定和半致死温度(LT50)计算
用高低温交变试验箱(型号: BC1300)对8个品种根系进行低温冷冻处理。以4 ℃保存的根系样本为对照, 设置–2.0 ℃、–4.0 ℃、–6.0 ℃、–8.0 ℃4个低温处理。以2.0 ℃·h–1的幅度降温, 从4.0 ℃降至处理温度时保持8 h, 后以相同的幅度匀速升温, 升至室温后取出放置2 h。将冷冻后的根系剪成3~4 mm小段[21],混合均匀, 称取1 g放入具塞试管中, 加20 mL去离子水摇匀, 每处理3次重复。在室温下浸提24 h后, 用DDSJ-308F型电导仪测初电导率。封口于沸水中煮30 min, 冷却至室温, 测定终电导率。
相对电导率(%)=初电导率/终电导率×100 (1)
LT50计算参照Logistic回归方程:
=/(1+e–bt) (2)
式中:为电导率,为处理温度,为的最大值。将Logistic方程=/(1+e-)转化为ln[(-)/]=ln-, 变成转化细胞伤害率(′)与处理温度()的直线方程, 通过直线回归的方法求出方程参数、值。拐点温度即为根系的半致死温度(LT50)。
在作品《传承》中运用中国画小写意技法,描绘广西黑衣壮族妇女在织壮锦,并传授三位黑衣壮少女织锦技艺,体现广西非遗文化传承后继有人。画面构图完整,人物形象各异,黑白灰关系处理基本得当,国画水墨语言表现到位,不失为一幅佳作。
1.2.3 渗透调节物质含量测定
将冲洗干净的葡萄根系用剪刀剪成1~2 cm的薄片, 用液氮迅速冷冻后放入–78 ℃超低温冰箱保存待测。可溶性蛋白含量采用考马斯亮蓝法测定[22], 标准曲线回归方程:=5.005+0.002 5,2=0.999 0。可溶性糖含量采用蒽酮-硫酸比色法测定[22], 标准曲线回归方程:=4.905-0.024 7,2=0.999 7。
1.3 数据分析方法
采用SPSS 22.0对数据进行统计分析, 方差分析为单因素方差分析(One-way ANOVA), 聚类分析方法为分层聚类法(Hierarchical Cluster Method)。采用Origin 9.0软件制图。
2 结果与分析
2.1 不同品种葡萄根系过冷却点与结冰点
2.1.1 冷却点与结冰点温度范围
温度降至0 ℃以下时, 葡萄根系组织细胞内的水分仍然保持液体状态, 即根系组织处于过冷却的状态, 过冷却状态下的细胞不会受到冰冻伤害。因此, 过冷却点越低, 根系组织抗寒性越强。但过冷却点和结冰点并不是一个确定值而是一个范围(表2)。此次供试的8个酿酒葡萄品种根系中, ‘北红’的过冷却点温度范围最低, 最低能抵御–7.2 ℃的低温环境; ‘西拉’的过冷却点温度范围最高, 抗低温能力较差。结冰点温度范围在–6.8~–1.8 ℃, ‘北红’的结冰点温度最低, 可忍受–6.8 ℃的低温环境; ‘西拉’的结冰点温度最高, 温度降至–1.8 ℃即有可能发生根系结冰的情况。
2.1.2 过冷却点频率分析
各品种葡萄根系过冷却点出现的温度范围不尽相同, 各温度频段出现过冷却点的频率也不尽相同。以‘北玫’为例说明, ‘北玫’的过冷却点温度范围为–6.2~–4.5 ℃(图2), 在–5.9~–5.5 ℃间分布次数最多, 占‘北玫’根系过冷却点全部样本的40%, 而在–6.3~–5.9 ℃的温度范围内仅出现1次。说明‘北玫’的根系在–5.9~–5.5 ℃范围内最易受冻, 温度高于–5.5 ℃时受冻几率较小, 能抵御–5.9 ℃以下低温的个体也较少。
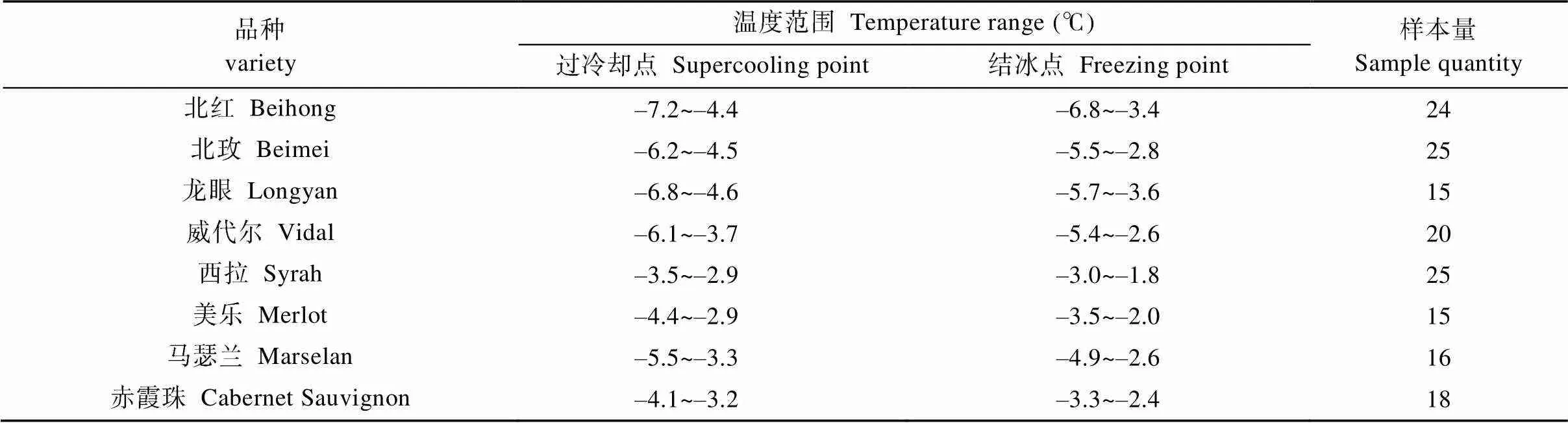
表2 8个品种酿酒葡萄根系过冷却点与结冰点温度范围
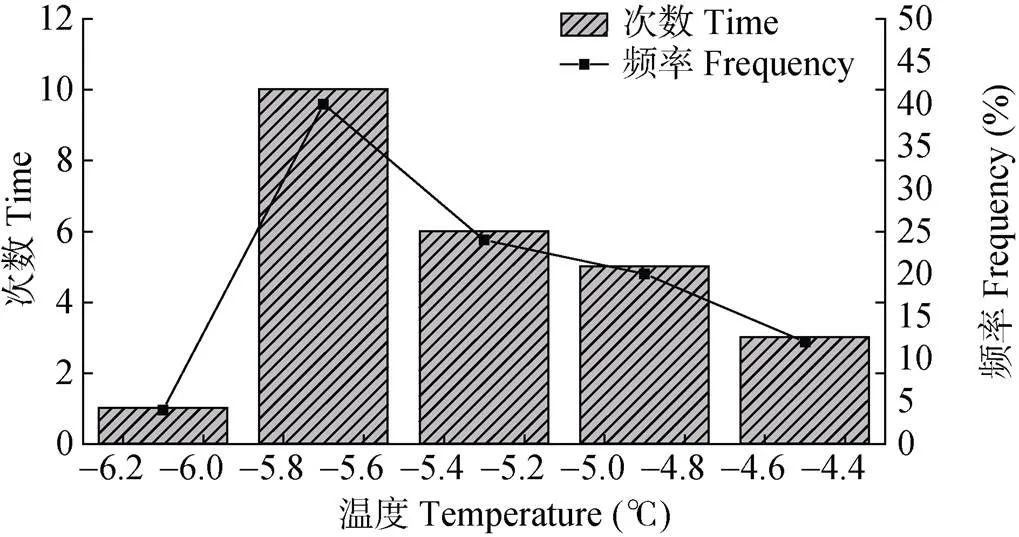
图2 ‘北玫’葡萄根系在不同温度范围的过冷却点频率分布(n=25)
8个葡萄品种根系的过冷却点、结冰点温度方差分析结果(表3)表明: ‘北红’ ‘龙眼’的过冷却点温度显著低于其他品种, ‘赤霞珠’ ‘美乐’ ‘马瑟兰’ 3个品种间没有显著差异, ‘西拉’显著高于其他品种。‘北红’的结冰点显著低于其他品种, 其次是‘龙眼’ ‘北玫’ ‘威代尔’和‘马瑟兰’, ‘西拉’根系结冰点的温度最高。过冷却点和结冰点在‘北玫’ ‘威代尔’两个品种间均没有显著性差异。葡萄根系组织的过冷能力可用结冰点与过冷却点温度差来表示[17], 温度差越大, 说明组织的过冷能力越强。由表3可知, ‘北玫’和‘龙眼’根系的过冷能力相同并强于其他品种, 温度差达1.6 ℃。其次是‘威代尔’ ‘北红’, 温度差均为1.1 ℃, ‘西拉’过冷能力较弱, 温度差为0.9 ℃。
根据酿酒葡萄根系过冷却点和结冰点温度范围、均值、方差分析结果与过冷能力综合分析, 8个酿酒葡萄品种根系抗寒能力依次为: ‘北红’>‘龙眼’>‘北玫’>‘威代尔’>‘马瑟兰’>‘赤霞珠’>‘美乐’> ‘西拉’。

表3 不同品种酿酒葡萄根系过冷却点与结冰点的温度
表中同列数据后不同大、小写字母分别表示品种间在<0.01和<0.05水平差异显著。The capital and lowercase letters in the same column mean significant differences among varieties at< 0.01 and< 0.05 levels, respectively.
2.1.4 基于过冷却点和结冰点的不同品种葡萄根系抗寒能力聚类分析
结合过冷却点、结冰点平均值结果(表3)对8个酿酒葡萄品种进行聚类分析(图3)。结果表明, 供试的8个葡萄品种抗寒能力可分为3类: 第1类为弱抗寒型, 过冷却点在–3.8~–3.2 ℃, 结冰点–2.8~–2.3 ℃, 包括‘赤霞珠’ ‘美乐’ ‘西拉’3个品种; 第2类中等抗寒型, 过冷却点为–5.4~–4.4 ℃, 结冰点在–4.1~–3.7 ℃, 包括‘北玫’ ‘威代尔’ ‘马瑟兰’3个品种; 第3类为强抗寒型, 过冷却点低于–6.3 ℃, 结冰点低于–4.8 ℃, 包括‘北红’ ‘龙眼’2个品种。聚类分析结果表明, ‘北红’与‘龙眼’两个葡萄品种的根系抗寒性较强, 所测定的8个品种中有4个过冷却点温度低于–5 ℃。
2.2 不同品种葡萄根系电导率与半致死温度分析
葡萄根系的相对电导率随处理温度的变化如表4所示, 不同品种葡萄根系经不同低温处理后, 电解质渗出率随处理温度的降低呈上升趋势。4 ℃下保存的根系电解质渗出率在品种间没有显著差异。–2 ℃时, 电解质渗出率与4 ℃时相比差别不大, 8个品种均未遭受冰冻伤害。当温度降至–6 ℃时, 只有‘北红’ ‘龙眼’两个品种的电解质渗出率未超过50%, 说明这两个品种抗寒性较好, 其他品种根系组织细胞均已遭受严重的冻害损伤。以相对电导率拟合Logistic方程计算的拐点温度LT50(半致死温度)可反映植物的抗寒能力差异。由表4可知, 所测定的8个葡萄品种根系中有4个品种半致死温度低于–5 ℃, ‘北红’最低, 为–6.55 ℃, ‘西拉’最高, 为–3.19 ℃。8个葡萄品种根系的半致死温度与过冷点温度呈现一一对应的关系。根据半致死温度对8个品种根系抗寒能力进行排序, 其抗寒性强弱依次为‘北红’>‘龙眼’>‘北玫’>威代尔’>‘马瑟兰’>‘赤霞珠’>‘美乐’>‘西拉’, 与过冷却点分析结果相同。
2.3 不同品种葡萄根系渗透调节能力
蛋白质可提高细胞保水能力, 增强植物的抗寒能力。不同品种葡萄根系可溶性蛋白含量存在差异, ‘北玫’ ‘龙眼’的可溶性蛋白含量较高, 分别为2.93 mg·g–1、2.81 mg·g–1; 其次‘北红’为2.40 mg·g–1; ‘西拉’ ‘美乐’ ‘赤霞珠’3个品种可溶性蛋白含量较低, 且品种间没有显著性差异; 可溶性蛋白含量最低品种是‘马瑟兰’, 为1.50 mg·g–1(图4)。

图3 基于过冷却点、结冰点的酿酒葡萄品种根系抗寒性聚类分析
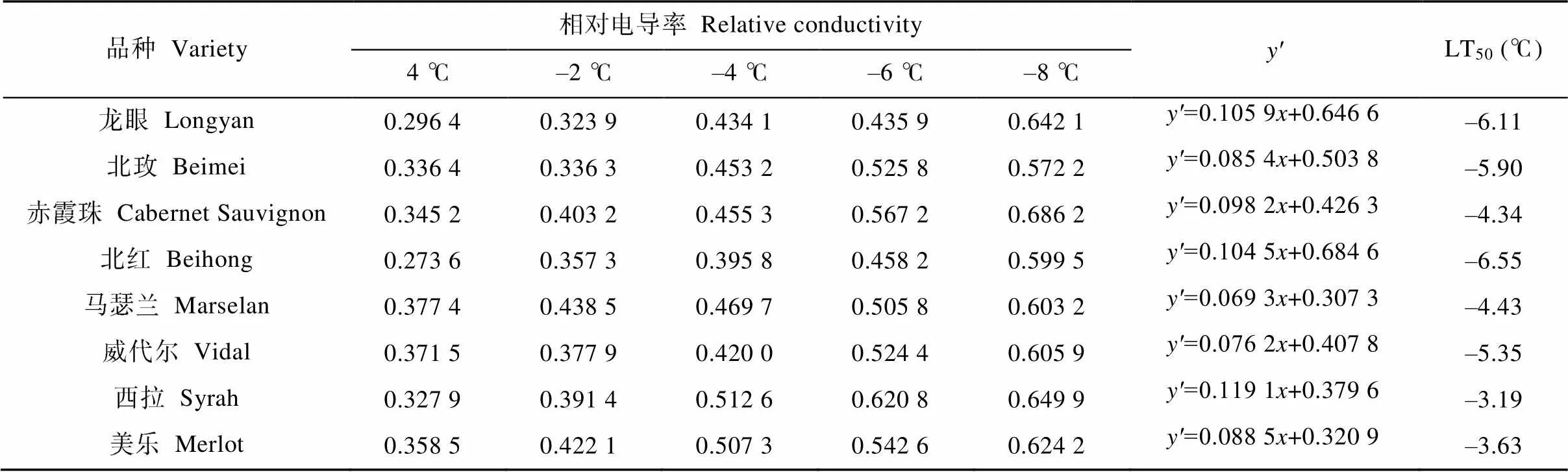
表4 8个品种酿酒葡萄根系低温胁迫过程中相对电导率及半致死温度(LT50)变化
可溶性糖可增加细胞液浓度, 提高渗透压, 从而使组织细胞免受冰冻伤害。8个供试品种中, ‘西拉’可溶性糖含量最低, 为11.25 mg·g–1, ‘北红’可溶性糖含量也较低, 为12.23 mg·g–1; ‘赤霞珠’和‘美乐’可溶性糖含量没有显著性差异, 分别为13.83 mg·g–1和14.59 mg·g–1; ‘北玫’和‘威代尔’可溶性糖含量较高且没有显著性差异, 分别为17.45 mg·g–1、17.62 mg·g–1; ‘龙眼’的含糖量最高, 为20.92 mg·g–1(图4)。渗透调节物质含量方差分析结果与过冷却点聚类分析分类结果相同。
2.4 葡萄根系各抗寒指标相关关系
8个品种葡萄根系的过冷却点、结冰点、半致死温度、可溶性蛋白含量、可溶性糖相关系数如表5所示。半致死温度与过冷却点有极显著的正相关关系, 相关系数0.964。其次是过冷却点与结冰点相关性较高, 相关系数达0.957。可溶性蛋白与过冷却点、半致死温度均呈显著负相关关系, 说明可溶性蛋白含量越高, 过冷却点和半致死温度越低。可溶性糖与半致死温度显著负相关, 与过冷却点和结冰点相关性不显著。
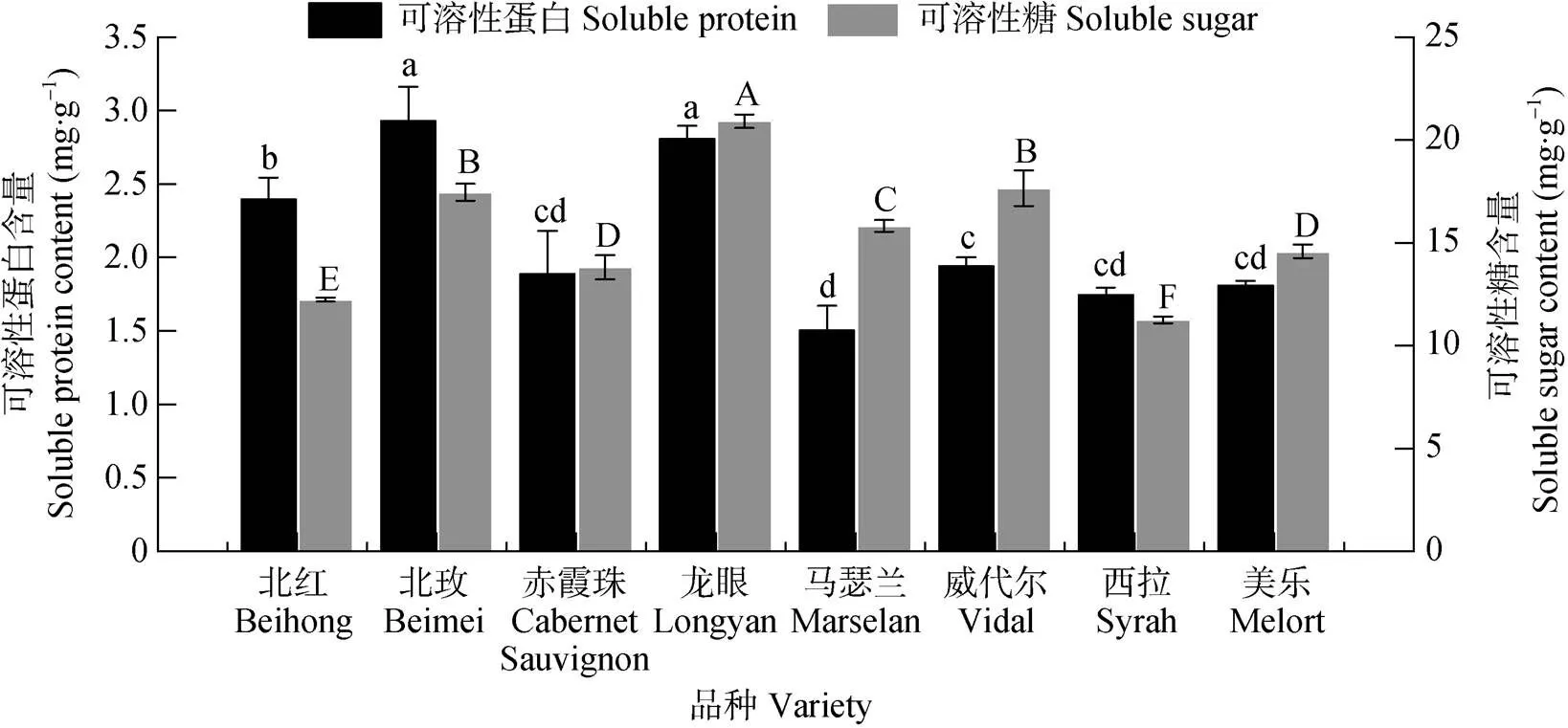
图4 8个品种酿酒葡萄根系可溶性蛋白及可溶性糖含量
图中不同小写和大写字母表示品种间可溶性蛋白含量和可溶性糖含量在<0.05水平差异显著。Different lowercase letters and capital letters show significant differences in soluble protein content and soluble sugar content among varieties at< 0.05 level, respectively.
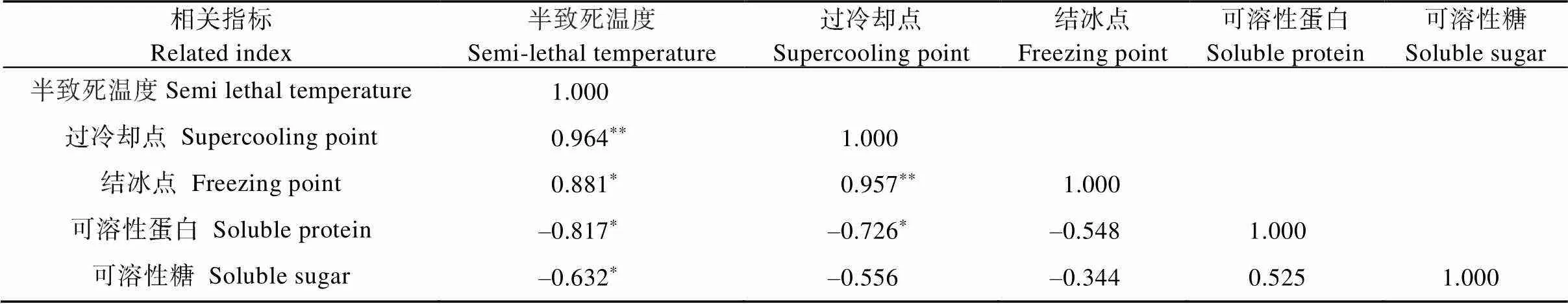
表5 葡萄根系抗寒性指标相关系数矩阵
*和**分别表示<0.05和<0.01水平显著相关。* and ** mean significant correlation at< 0.05 and< 0.01, respectively.
3 讨论与结论
半致死温度是判断植物逆境伤害的指标之一[23],尤其在果树抗寒性上有广泛应用[24]。本试验采用电导法与过冷却点、结冰点相结合的方法, 在测定葡萄根系抗寒性上是较为可靠的。根系抗寒性与根系含水量相关性较大[25-27], 而蛋白质可以与细胞中的自由水结合, 降低细胞液浓度, 同时减少细胞间隙中的水分, 从而降低细胞冰点[28]。本研究也表明可溶性蛋白含量与植物组织过冷却点与半致死温度有密切关系。可溶性糖是植物细胞内重要的渗透调节物质, 糖分积累可以增加渗透压, 保护细胞质胶体不致遇冷凝固, 从而起到冰冻保护剂的作用[29]。
此次供试的8个品种酿酒葡萄根系的过冷却点温度范围为–7.2~–2.9 ℃, 此温度范围与王丽雪等[11]研究所得根系受冻临界温度基本相同, 与高振等[30]研究结果相似。葡萄根系抗寒性从强到弱的排序为‘北红’>‘龙眼’>‘北玫’>‘威代尔’>‘马瑟兰’>‘赤霞珠’>‘美乐’>‘西拉’。本研究结果发现‘美乐’与‘赤霞珠’抗寒能力相差不大, 同为弱抗寒性品种。抗寒能力最强的品种是‘北红’和‘龙眼’, 过冷却点都低于–6.0 ℃。‘北玫’ ‘北红’在宁夏地区冬季不埋土即可安全越冬, 翌年可正常生长发育, 田间调查结果也显示其抗寒性较强。‘龙眼’抗寒能力仅次于‘北红’, 可能与其多年在中国北方种植, 逐步适应寒冷环境有关。同时也有研究表明, 由于‘龙眼’根系扎根较深, 遭到冻害后恢复能力比较强, 所以抗寒性较强[5]。‘赤霞珠’ ‘美乐’ ‘西拉’根系的抗寒性较弱, 过冷却点温度在–3.5 ℃左右。过冷却点、结冰点温度与半致死温度一致性很高, 且聚类分析结果与渗透调节物质含量方差分析结果基本一致, 抗寒能力相似的品种间渗透调节物质含量没有显著性差异。本研究各类指标所得不同品种酿酒葡萄的抗寒性结果比较一致, 因此可以把–7.2~–2.9 ℃作为这8个酿酒葡萄品种根系越冬冻害的温度参考指标。但需要说明的是, 不同风土条件与管理措施会对葡萄抗寒性产生一定影响[31], 不同土壤类型对根系抗寒性的影响还需进一步研究。
鉴于以上分析, 得出以下结论: 葡萄根系结冰点与半致死温度有很好的相关关系, 可溶性蛋白对增强葡萄品种的抗寒性有重要作用。葡萄根系的抗寒力可分为3类: 弱抗寒型(‘赤霞珠’ ‘美乐’ ‘西拉’), 过冷却点在–3.8~–3.2 ℃, 结冰点–2.8~–2.3 ℃, 半致死温度–4.34~–3.19 ℃; 中抗寒型(‘北玫’ ‘马瑟兰’ ‘威代尔’), 过冷却点为–5.4~–4.4 ℃, 结冰点在–4.1~–3.7 ℃, 半致死温度–5.90~–4.43 ℃; 强抗寒型(‘北红’ ‘龙眼’), 过冷却点在–6.4~–6.3 ℃, 结冰点–5.2~–4.8 ℃, 半致死温度–6.55~–6.11 ℃。8个品种葡萄根系抗寒性强弱依次为: ‘北红’>‘龙眼’>‘北玫’>‘威代尔’>‘马瑟兰’>‘赤霞珠’>‘美乐’>‘西拉’。8个品种酿酒葡萄根系过冷却点在–6.4~–3.2 ℃, 半致死温度在–6.55~–3.19 ℃。
需要指出的是: 由于试验条件所限, 本研究没有采集葡萄主根进行抗寒性分析, 在各类土壤环境下, 因根系分布不均匀, 根系的形态、结构不尽相同, 分布的深浅也不一样, 其抗寒性也不尽相同。因此, 不同粗细和形态葡萄根系的抗寒性还有待进一步研究。
[1] 王奉玉, 刘效义, 王银川, 等. 2002年冬季葡萄冻害调查简报[J]. 中外葡萄与葡萄酒, 2003, (5): 38–39 WANG F Y, LIU X Y, WANG Y C, et al. Brief report on the survey of frost damage on grape in 2002 winter[J]. Sino-overseas Grapevine & Wine, 2003, (5): 38–39
[2] ZHENG C L, HALALY T, ACHEAMPONG A K, et al. Abscisic acid (ABA) regulates grape bud dormancy, and dormancy release stimuli may act through modification of ABA metabolism[J]. Journal of Experimental Botany, 2015, 66(5): 1527–1542
[3] QUAMME H A. Use of thermal analysis to measure freezing resistance of grape buds[J]. Canadian Journal of Plant Science, 1986, 66(4): 947–952
[4] 焦奎宝. 葡萄根系抗寒性的研究[D]. 哈尔滨: 东北农业大学, 2010 JIAO K B. Study on cold hardiness of grape roots[D]. Harbin: Northeast Agricultural University, 2010
[5] 曹建东, 陈佰鸿, 王利军, 等. 葡萄抗寒性生理指标筛选及其评价[J]. 西北植物学报, 2010, 30(11): 2232–2239 CAO J D, CHEN B H, WANG L J, et al. Cold resistance indexes identification and comprehensive evaluation of grape varieties[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(11): 2232–2239
[6] 范宗民, 孙军利, 赵宝龙, 等. 低温胁迫下不同砧木‘赤霞珠’葡萄枝条抗寒性比较[J], 果树学报, 2019, doi.org/ 10.13925/j.cnki.gsxb.2019020190450 FAN Z M, SUN J L, ZHAO B L, et al. Effect of low temperature stress on cold resistance of one-year branch of ‘Cabernet Sauvignon’ grape grafted on different rootstocks[J]. Journal of Fruit Science, 2019, doi.org/10.13925/j.cnki. gsxb.2019020190450
[7] TODARO T M, DAMI I E. Trunk renewal methods for recovery of ‘Cabernet Franc’ grapevines after winter injury in Ohio[J]. Horticulture Technology, 2018, 28(3): 382–390
[8] 卢精林, 李丹, 祁晓婷, 等. 低温胁迫对葡萄枝条抗寒性的影响[J]. 东北农业大学学报, 2015, 46(4): 36–43 LU J L, LI D, QI X T, et al. Effect of low temperature stress on cold resistance of grapes branch[J]. Journal of Northeast Agricultural University, 2015, 46(4): 36–43
[9] 高振, 翟衡, 孙鲁龙, 等. 基于温度-伤害度关系分析酿酒葡萄根系及芽抗寒性[J]. 应用生态学报, 2014, 25(4): 983–990 GAO Z, ZHAI H, SUN L L, et al. Evaluation of root and bud cold hardiness of wine grape varieties based on temperature-injury relation[J]. Chinese Journal of Applied Ecology, 2014, 25(4): 983–990
[10] 付晓伟, 张倩, 刘崇怀, 等. 评价葡萄根系抗寒性指标的确定[J]. 果树学报, 2014, 31(1): 52–59 FU X W, ZHANG Q, LIU C H, et al. Index for the evaluation of grape root cold-resistance[J]. Journal of Fruit Science, 2014, 31(1): 52–59
[11] 王丽雪, 赵金枝, 余茂莉, 等. 葡萄根系抗寒力的研究[J]. 内蒙古农牧学院学报, 1982, (1): 111–123 WANG L X, ZHAO J Z, YU M L, et al. Study on cold resistance of grape roots[J]. Journal of Inner Mongolia Institute of Agriculture & Animal Husbandry, 1982, (1): 111–123
[12] 郭修武, 傅望衡. 葡萄根系抗寒性的研究[J]. 园艺学报, 1989, 16(1): 17–22 GUO X W, FU W H. Studies on cold hardiness of grape roots[J]. Acta Horticulturae Sinica, 1989, 16(1): 17–22
[13] 张文娥, 王飞, 潘学军. 应用隶属函数法综合评价葡萄种间抗寒性[J]. 果树学报, 2007, 24(6): 849–853 ZHANG W E, WANG F, PAN X J. Comprehensive evaluation on cold hardiness ofspecies by Subordinate Function (SF)[J]. Journal of Fruit Science, 2007, 24(6): 849–853
[14] 王景红, 刘璐, 高峰, 等. 陕西富士系苹果花期霜冻灾害气象指标的修订[J]. 中国农业气象, 2015, 36(1): 50–56 WANG J H, LIU L, GAO F, et al. Revision on meteorological indices of florescence frost disaster for Fuji apple in Shaanxi Province[J]. Chinese Journal of Agrometeorology, 2015, 36(1): 50–56
[15] 秦明, 王红芳, 刘振国, 等. 中华蜜蜂和意大利蜜蜂耐寒性能差异比较[J]. 中国农业科学, 2017, 50(12): 2380–2388 QIN M, WANG H F, LIU Z G, et al. Comparison of different cold resistance betweenand[J]. Scientia Agricultura Sinica, 2017, 50(12): 2380–2388
[16] 孟庆瑞, 王文凤, 梁隐泉, 等. 杏品种花器官过冷却点及结冰点的研究[J]. 中国农业科学, 2008, 41(4): 1128–1133 MENG Q R, WANG W F, LIANG Y Q, et al. Study on supercooling point and freezing point in floral organs of apricot[J]. Scientia Agricultura Sinica, 2008, 41(4): 1128–1133
[17] 王海梅, 侯琼, 云文丽, 等. 内蒙古河套灌区玉米与向日葵霜冻的关键温度[J]. 生态学报, 2014, 34(11): 2948–2953 WANG H M, HOU Q, YUN W L, et al. Key temperatures of corn and sunflower during cooling process in Hetao irrigation district, Inner Mongolia[J]. Acta Ecologica Sinica, 2014, 34(11): 2948–2953
[18] 李盼华. 低温胁迫对早春开花植物花器官抗寒性及花色的影响[D]. 保定: 河北农业大学, 2011LI P H. The impact of cold hardiness and floral color under low temperature stress on floral organs of early spring flowering plants[D]. Baoding: Hebei Agricultural University, 2011
[19] 王文举, 张亚红, 牛锦凤, 等. 电导法测定鲜食葡萄的抗寒性[J]. 果树学报, 2007, 24(1): 34–37 WANG W J, ZHANG Y H, NIU J F, et al. Study on cold tolerance of table grape cultivars by measuring the conductivity[J]. Journal of Fruit Science, 2007, 24(1): 34–37
[20] 贺普超. 葡萄学[M]. 北京: 中国农业出版社, 1999 HE P C. Viniculture[M]. Beijing: China Agriculture Press, 1999
[21] 郭修武. 葡萄根系抗寒性鉴定方法研究[J]. 葡萄栽培与酿酒, 1994, (4): 26–29 GUO X W. Study on identification method of cold resistance of grape roots[J]. Sino-overseas Grapevine & Wine, 1994, (4): 26–29
[22] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2003 LI H S. Experimental Principles and Techniques of Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2003
[23] 刘建, 项东云, 陈健波, 等. 应用Logistic方程确定三种桉树的低温半致死温度[J]. 广西林业科学, 2009, 38(2): 75–78 LIU J, XIANG D Y, CHEN J B, et al. Low temperature LT50 of three eucalyptus seedlings with electrical conductivity method and Logistic equation[J]. Guangxi Forestry Science, 2009, 38(2): 75–78
[24] 王玮, 李红旭, 赵明新, 等. 7个梨品种的低温半致死温度及耐寒性评价[J]. 果树学报, 2015, 32(5): 860–865 WANG W, LI H X, ZHAO M X, et al. Study on the cold resistance and the semi-lethal temperatures for seven pear cultivars[J]. Journal of Fruit Science, 2015, 32(5): 860–865
[25] 张建文. 苹果根系分区灌溉的水分运输及分配机理[D]. 保定: 河北农业大学, 2008 ZHANG J W. Mechanism of water transportation and distributing with partial rootzone irrigation in apple[D]. Baoding: Hebei Agricultural University, 2008
[26] 李艳, 付艳东, 马艳春, 等. 淹水对不同葡萄砧木生长及光合特性的影响[J]. 中国农业科学, 2013, 46(5): 995–1004 LI Y, FU Y D, MA Y C, et al. Effects of waterlogging on characteristics of growth and photosynthesis in different grape rootstocks[J]. Scientia Agricultura Sinica, 2013, 46(5): 995–1004
[27] 李敏敏, 袁军伟, 韩斌, 等. 26个葡萄砧木品种耐旱性评价[J].西北林学院学报, 2018, 33(4): 132-138 LI M M, YUAN J W, HAN B, et al. Evaluations on the drought resistance of 26 grape rootstocks[J]. Journal of Northwest Forestry University, 2018, 33(4): 132-138
[28] RUIZ N, BARRANCO D, RAPOPORT H F. Anatomical response of olive (L.) to freezing temperatures[J]. The Journal of Horticultural Science and Biotechnology, 2006, 81(5): 783–790
[29] Grant T N L, Dami I E. Physiological and biochemical seasonal changes ingenotypes with contrasting freezing tolerance[J]. American Journal of Enology and Viticulture, 2015, 66(2): 195-203
[30] 高振, 翟衡, 张克坤, 等. LT-Ⅰ分析7个酿酒葡萄品种枝条的抗寒性[J]. 中国农业科学, 2013, 46(5): 1014–1024 GAO Z, ZHAI H, ZHANG K K, et al. A study on cold hardiness of seven wine grape canes by LT-I analysis[J]. Scientia Agricultura Sinica, 2013, 46(5): 1014–1024
[31] GUSRA L V, WISNIEWSKI M. Understanding plant cold hardiness: an opinion[J]. Physiologia Plantarum, 2013, 147(1): 4-14
Comparing the cold resistance of roots of different wine grape varieties*
YANG Yu1, ZHANG Xiaoyu1,2,3**, CHEN Renwei1, LIU Zhaoyu1, LI Fanghong1, FENG Rui1, WANG Jing2,3, LI Hongying2,3
(1. College of Agriculture, Ningxia University, Yinchuan 750021, China; 2. Key Laboratory for Meteorological Disaster Monitoring, Early Warning and Risk Management of Characteristic Agriculture in Arid Regions, China Meteorological Administration, Yinchuan 750002, China; 3. Ningxia Institute of Meteorological Sciences, Yinchuan 750002, China)
Winter freezing injury of wine grape refers to the phenomenon in which grape tissue cells are injured or even killed when they are exposed to temperatures lower than 0 ℃. Northern China in winter is colder and drier than areas of similar latitude elsewhere in the world. Winter freezing injury is one of the most significant limiting factors restricting the development of wine grape cultivation in northern China. Different parts of the grapevine vary in their resistance to cold. The root has the least resistance as it does not have the process of dormancy in winter. However, the cold tolerance level of the root depends on the genetic character of the wine grape varieties. An investigation into the cold resistance of roots of different wine grape varieties should provide scientific guidance on the monitoring, early warning, and prevention of winter-freezing injury of wine grape in northern China. In this paper, roots from eight common varieties of wine grape, such as ‘Cabernet Sauvignon’, ‘Merlot’, ‘Marselan’, ‘Vidal’, ‘Syrah’, ‘Beimei’, ‘Beihong’ and ‘Longyan’, in the eastern foothills of Helan Mountain were selected and tested. The freezing experiment on these roots was carried out by an artificial freezing system simulating the natural cooling and freezing processes. The temperatures of the supercooling point and the frozen point, the concentrations of the soluble sugar and the soluble protein, the relative electronic conductivity, and the semi-lethal temperature of the roots were measured in the laboratory. The critical temperatures for roots of different varieties were further identifiedusing correlation analysis and cluster analysis. After that, the cold resistance abilities of roots of eight tested wine grapes were comprehensively analyzed for the indicators mentioned above. The following conclusions were drawn: 1) The content of soluble protein in the root significantly affected the cold resistance ability of wine grapes. 2) The cold resistance ability of roots from the eight varieties could be grouped into three categories: the light cold resistance type (‘Cabernet Sauvignon’, ‘Merlot’, ‘Syrah’), for which the supercooling point was –3.8 ℃ to –3.2 ℃, the frozen point was –2.8 ℃, to –2.3 ℃, and the semi-lethal temperature was –4.34 ℃ to –3.19 ℃; the moderate cold resistance type (‘Beimei’, ‘Marselan’, ‘Vidal’), for which the supercooling point was –5.4 ℃ to –4.4 ℃, the frozen point was –4.1 ℃ to –3.7 ℃, and the semi-lethal temperature was –5.90 ℃ to –4.43 ℃; the strong cold resistance type (‘Beihong’, ‘Longyan’), for which the supercooling point was –6.4 ℃ to –6.3 ℃, the frozen point was –5.2 ℃ to –4.8 ℃, and the semi-lethal temperature was –6.55 ℃ to –6.11 ℃. 3) The cold resistance abilities of roots of the eight varieties varied from strong to light in this order: ‘Beihong’ > ‘Longyan’ > ‘Beimei’ > ‘Vidal’ > ‘Marselan’ > ‘Cabernet Sauvignon’ > ‘Merlot’ > ‘Syrah’. The results showed that both temperatures of the supercooling point and the frozen point for the grape roots could be used as indicators to evaluate the cold resistance ability of grapes.
Freezing injure; Wine grapes; Roots; Cold resistance; Supercooling point; Conductivity; Soluble protein

S663.1
10.13930/j.cnki.cjea.190787
杨豫, 张晓煜, 陈仁伟, 刘兆宇, 李芳红, 冯蕊, 王静, 李红英. 不同品种酿酒葡萄根系抗寒性鉴定[J]. 中国生态农业学报(中英文), 2020, 28(4): 558-565
YANG Y, ZHANG X Y, CHEN R W, LIU Z Y, LI F H, FENG R, WANG J, LI H Y. Comparing the cold resistance of roots of different wine grape varieties[J]. Chinese Journal of Eco-Agriculture, 2020, 28(4): 558-565
* 国家自然科学基金项目(41675114)、宁夏回族自治区重点研发计划项目(2018BFH03012)和宁夏自然科学基金项目(NZ16202)资助
张晓煜, 主要从事酿酒葡萄气象研究。E-mail: zhang_xynet@163.com
杨豫, 主要从事果树生理生态研究。E-mail: 17614731944@163.com
2019-11-07
2020-01-09
* This study was supported by the National Natural Science Foundation of China (41675114), the Key R&D Program of Ningxia (2018BFH03012) and the Natural Science Foundation of Ningxia (NZ16202).
, E-mail: zhang_xynet@163.com
Nov. 7, 2019;
Jan. 9, 2020
