通过ITS序列分析鉴定云南重楼内生真菌
2020-04-08张晓云李维蛟
张晓云,任 可,李维蛟
(1.云南中医药大学/云南省道地濒危中药材繁育与栽培工程技术研究中心,云南 昆明 650500; 2.云南农业大学,云南 昆明 650500)
0 引言
云南重楼[ParispolyphyllaSmith var.yunnanensis(Franch.) Hand.-Mazz.],为百合科重楼属植物,是《中华人民共和国药典》2015版收录的重楼的原材料[1],属于我国特有的一种名贵药用植物,主要分布在云南部分地区,生于海拔1400~3100 m的常绿阔叶林、云南松、竹林、灌丛、草坡背阴处或阴湿山谷中,为阴生植物[2]。云南重楼是药用重楼的植物来源之一,以干燥根茎入药,具有清热解毒、消肿止痛、凉肝定惊的功效,是抗病毒冲剂、云南白药、四川白药、宫血宁、夺命丹等一些重要中成药的主要原料。现代研究表明,该药具有止血、镇痛、镇静、抗炎、抗肿瘤、免疫调节等广泛的药理活性[3]。云南重楼的主要药用成分为甾体皂苷类物质,其具多种生理活性,有很高的药用价值和开发潜力[4,5]。重楼作为我国许多重要中成药的原料,需求量逐年增加,但由于其生长缓慢,繁殖系数低等,其蕴藏量大大减少,已逐渐难以满足生产所需。近年来的研究表明,许多植物的内生真菌可以产生与寄主药用植物相同的药用成分。目前对云南重楼内生真菌的研究还非常浅薄,研究主要集中在筛选产甾体皂苷菌株及其他活性菌株方面[6,7],而对其内生真菌的分离、鉴定以及多样性等方面的研究则鲜有报道。我们从云南重楼根、根状茎、叶3个部位的组织块中分离出内生真菌,并通过ITS序列分析对这些内生真菌进行了属及种的鉴定,现将结果报道如下。
1 材料与方法
1.1 实验材料
云南重楼采集于云南省曲靖市师宗县,栽培于云南中医药大学实验大棚中,经鉴定,均为药用植物云南重楼(图1)。
1.2 实验方法
1.2.1 云南重楼内生真菌的分离纯化 选择健康的云南重楼,将其主根、茎和叶三个部位剪离分开,分别将主根、茎及叶的组织块表面洗净,拭干表面水分,迅速移至超净工作台上利用植物病原分离的快速消毒装置(授权公告号:CN202620294U)进行表面消毒。在无菌操作台下按如下步骤进行:切取同一个植物组织若干份,每一份植物组织块长为3~5 mm;选取滤纸或者透气性及耐水性好的纸巾,剪取边长为3~4 cm的纸块,将剪取好的植物组织块用剪好的纸块包住,严格按照植物病原分离的快速消毒装置说明书中所述的步骤对植物组织进行表面消毒(首先用75%乙醇进行处理,茎处理30 s,主根处理50 s,叶处理30 s;然后用0.1%升汞进行处理,对茎、主根、叶分别处理5、15、3 min)。将组织块小块接种于PDA培养基上,每皿接种2块,置28 ℃恒温培养箱中培养3~30 d,当观察到培养基上有从组织块内部向周围长出菌丝时,采用尖端菌丝挑去法把真菌转移到新的培养基上继续培养、转接,待纯化后编号,备用。在分离过程中设置对照组,将经表面消毒的组织块在空白培养基上涂搽,使组织块各表面接触到培养基,与接种好的培养皿一起培养;若对照培养皿上未长出菌落,则说明表面消毒彻底。

A:植株;B:叶片;C:茎;D:主根及须根。图1 药用植物云南重楼
1.2.2 云南重楼内生真菌的传统形态学鉴定 对分离到的内生真菌进行传统形态学观察,主要观察并记录菌落在平板上的生长速度、菌落形态、颜色、质地、是否有色素分泌到培养基中。预先将盖玻片插入PDA培养基中,待真菌长满培养皿后,选取较好的插片,以无菌水为浮载剂制成玻片标本,然后在显微镜下观察菌丝的粗细,分生孢子器的着生部位、形状、类型、大小、产孢方式,以及分生孢子的出芽方式、是否有隔、大小、形状、表面特征、色泽等形态特征。
1.2.3 云南重楼内生真菌的分子生物学鉴定和检测 用CTAB法提取全基因组DNA:用刮刀刮取平板培养7 d的菌落菌丝,置于1.5 mL离心管中,加500 μL经65 ℃预热的CTAB提取缓冲液及少量石英砂,用玻棒研磨5~10 min后,65 ℃水浴1 h;再加入500 μL氯仿-异戊醇(24∶1)充分混匀后,以12000 r/min离心15 min;取上清液,加入等体积的氯仿-异戊醇(24∶1),混匀后,在4 ℃下以12000 r/min离心15 min,重复抽提1次;加入2/3体积的异丙醇(400 μL),混匀,在出现沉淀后,在4 ℃下以10000 r/min离心2 min,重复洗涤1次;弃去液相,加入400 μL 70%乙醇,震荡洗涤,以10000 r/min离心2 min,重复洗涤1次;在40~60 ℃下真空干燥DNA约10 min;加入100 μL TE缓冲液(10 mmol/L Tris-HCl、1 mmol/L EDTA,pH 8.0)。在37 ℃下溶解DNA样品,并于-20 ℃下保存。
用PCR扩增菌株的ITS区段,通用引物为ITS4、ITS5;以真菌基因组的DNA为模板,扩增菌株的ITS区段。PCR扩增体系为50 μL,含DNA模板1 μL、去离子水33.5 μL、10×PCR buffer 5 μL、10 μmol/L ITS4 1 μL、ITS5 1 μL、10 mmol/L dNTPs 4 μL、25 mmol/L MgCl24 μL、TaqDNA酶0.5 μL。PCR反应程序为:95 ℃预变性3 min;94 ℃变性40 s,52 ℃退火50 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。PCR产物经DNA凝胶电泳分离纯化,将回收产物送昆明擎科生物有限公司测序。用每个菌株的ITS序列作为靶序列,在NCBI的GenBank数据库中用Blast程序来搜索同源序列,挑选与菌株序列最相近的参考序列。
2 结果与分析
2.1 内生真菌的分离结果
从6个云南重楼样品中共获得26个真菌分离物,根据菌落的生长速率、形态、颜色,以及菌丝、分生孢子等显微形态特征,将分离纯化后的内生真菌划分为9类;从每类中选取1株具有代表性的菌株进行形态学观察,共9株,编号为1~9,见图2。采用滤纸片法将菌株保存在-20 ℃下。

A:1号菌; B:2号菌; C:3号菌; D:4号菌; E:5号菌; F:6号菌; G:7号菌; H:8号菌; I:9号菌。图2 9类内生真菌菌落的形态
2.2 内生真菌分子鉴定结果
从云南重楼中共分离到内生真菌26株,经分子生物学鉴定,将它们分为8属9种(表1),其中优势菌种为1号菌和3号菌,分别被鉴定为尖孢镰刀菌(Fusariumoxysporum)和博宁炭疽菌(Colletotrichumboninense),分离率分别为23.07%和19.23%;从根中分离到2株,鉴定为1属1种,为球毛壳菌(Chaetomiumglobosum)(表2)。
对优势菌种1号菌和3号菌以及从主根中分离出的9号菌进行形态鉴定和分子鉴定。1号菌的形态特征如图2A所示,菌落为类圆形,有突起;菌落粉白色,略带有紫色;菌落背面白色,有少数较大黑点;菌落生长速度快,絮状菌丝白色质密。将该真菌菌株的ITS全序列(图3)提交到GenBank,与其它真菌的ITS全序列进行比对,发现1号菌株与尖孢镰刀菌(Fusariumoxysporum)序列的相似度达99%。综合形态和分子鉴定结果,确定1号菌株为尖孢镰刀菌(F.oxysporum)。
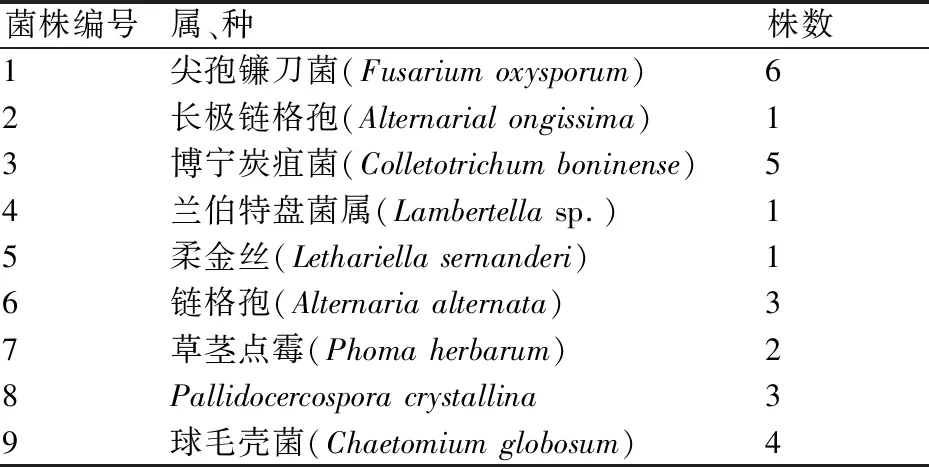
表1 云南重楼内生真菌的种类
3号菌的形态特征如图2C所示,菌丝白色质密,菌落类圆形,粉白色,有多数黑色团状突起,背面黄色,可见多数小黑点,生长速度快。将该真菌的ITS全序列(图4)提交到GenBank核酸序列库中,与GenBank中其它真菌的ITS全序列进行比对,发现3号菌株与博宁炭疽菌(Colletotrichumboninense)序列的相似度为99%。综合形态和分子鉴定结果,确定3号菌株为博宁炭疽菌(C.boninense)。
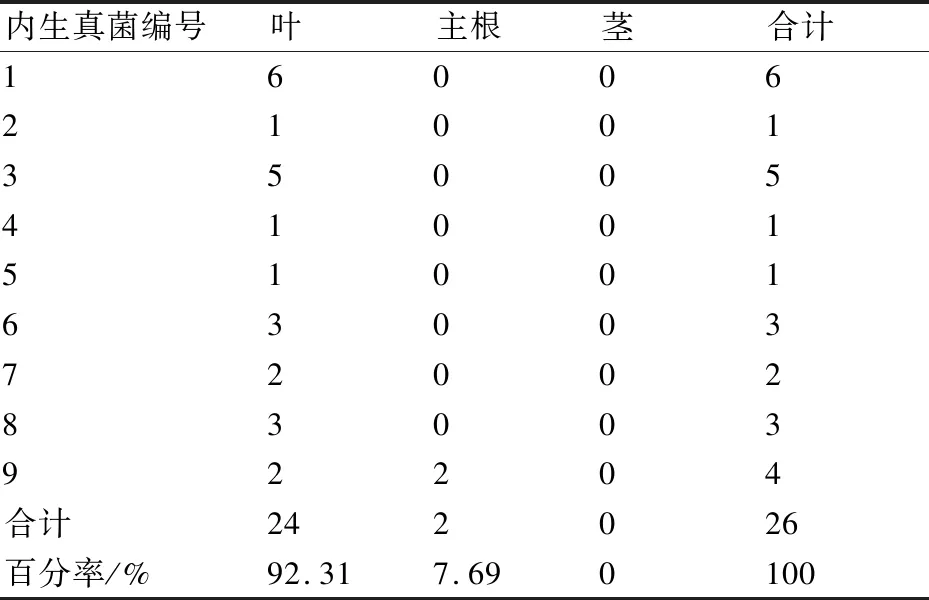
表2 云南重楼不同部位内生真菌的数量与种类分布
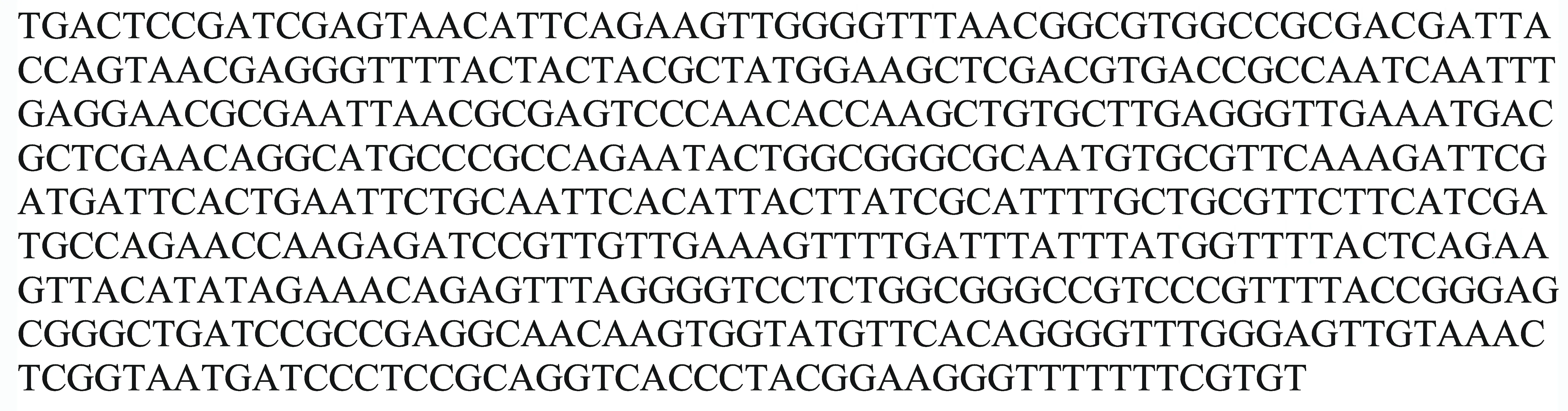
图3 1号菌的ITS全序列
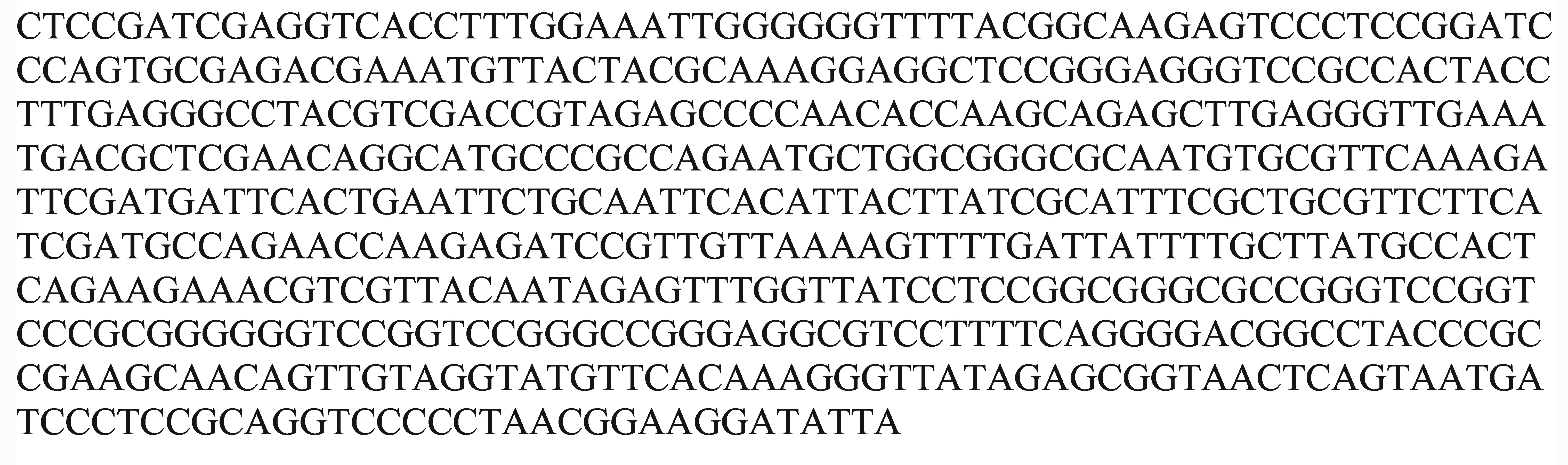
图4 3号菌的ITS全序列
9号菌的形态特征如图2I所示,菌丝浅黄色,气生菌丝发达,菌落类圆形,生长速度较快,背面白色。将该真菌的ITS全序列(图5)提交到GenBank核酸序列库,与其中其它真菌的ITS全序列进行比对,发现9号菌与球毛壳菌(Chaetomiumglobosum)序列的相似度为99%。综合形态和分子鉴定结果,确定9号菌株为球毛壳菌(C.globosum)。
3 讨论
本实验对云南重楼的内生真菌进行了分离、鉴定分析,由于所分离云南重楼的数量、年龄、分离手段的限制,样品中绝大多数内生真菌并未被分离出来,尤其是主根及茎中内生真菌的分离率极低甚至为0%,需要进一步研究和摸索培养条件。其实造成菌种分离困难的因素有很多,如:培养基单一,不同真菌对生存环境的要求不尽相同;其次,有些真菌专一性很强,不能在人工培养条件下生长,即使使用不同的培养基也不能把植物组织中所有的内生真菌分离出来,而且有些内生真菌是非可培养的,只有在混合培养时才能生长,纯培养反而对其生长不利[7]。
内生真菌的鉴定较困难,部分内生真菌在人工培养基上不产生可育性孢子,甚至导致菌丝体死亡而造成菌种丢失。已有的研究结果表明,内生真菌中不产孢菌株的比例高达41.3%,因此对于这些菌株须结合ITS序列分析进行鉴定[8]。2013年王茜等[2]从云南重楼中分离出749株内生真菌,其中从根中分离出133株,从叶中分离出231株;分离到的内生真菌以镰刀菌属(Fusarium)和刺盘孢属(Colletotrichum)为优势种群,分别占总菌株数的11.62%、8.95%。本实验中的优势菌为镰刀菌属真菌尖孢镰刀菌(Fusariumoxysporum)和刺盘孢属真菌博宁炭疽菌(Colletotrichumboninense),分离率分别为23.07%和19.23%,与王茜等的研究结果相似。与之相比,本实验分离出3个不同的菌株,分别为兰伯特盘菌属菌株、柔金丝和Pallidocercosporacrystallina。但此次实验因中途超净工作台被黑根霉污染,并没有成功将从根状茎中长出的内生真菌纯化出来。
植物内生真菌普遍存在于植物界,它们长期生活在宿主植物体内,其数量和种类因寄主和环境的不同而有显著差异[9,10]。内生真菌与宿主协同进化,在演化过程中形成了密切的互惠共生关系,对宿主的一生有着不可代替的作用。经研究,内生真菌具有促进宿主植物的生长发育和生物量积累,增强宿主植物的抗病虫害能力,提高宿主植物的抗逆性等生物学作用[11,12]。此外,内生真菌能够通过分泌化感物质抑制其他各植物的生长,从而提高宿主在群落中的竞争能力[13]。近年来,对内生真菌的相关研究越来越火热,内生真菌次生代谢产物的研究也深受学者们的喜爱。经研究,内生真菌能产生丰富的代谢产物,主要为萜类、生物碱类、芳香类、肽类等化合物,且具有抗菌、抗肿瘤、抗氧化、杀虫、促生长、提高免疫活性及抗病毒等生物活性[13,14]。植物内生真菌是一个巨大的微生物新资源,在未来会有多方面的发展和应用,是人类拥有的宝贵财富,在农业、医药以及新能源开发等领域的应用也越来越广泛。虽然对植物内生真菌的研究在不断地深入,也取得了一些成果,但是,植物内生真菌的研究现在还处于起步阶段,还有许多问题需要进行深入系统的研究。
近年来,不断有学者从重楼中分离出有价值的内生真菌,如:曹晓冬等从云南重楼根状茎中分离到133株内生真菌,对其中的7株真菌进行了生物学性状观察和甾体化合物含量测定,结果表明2号、8号和12号真菌能合成大量的甾体化合物,培养液中甾体化合物的产率分别为208.62、144.97和198.79 mg/L[15];宣群等[16]从云南重楼的根中分离到1株内生真菌菌株,该菌株对白色念珠菌有较强的抑制作用,被鉴定为无孢菌群;孙静贤从云南重楼的内生真菌中筛选到了具有抗金黄色葡萄球菌活性的菌株[17],为属于粘鞭霉属的墙粘鞭霉(Gliomastixmurorum),此外他还发现该属G.luzulae的次生代谢产物中含有抗生素环孢菌素C。已有的实验结果证明能从重楼内生真菌及其代谢物中获得重楼的活性成分;植物内生真菌几乎存在于所有的植物中,且大多数内生真菌还没有被研究,因此今后有必要深入挖掘植物内生真菌中的生物活性物质,这些生物活性物质在农药、医药、食品等领域将具有广阔的应用前景。本实验结果可为植物内生真菌的进一步研究提供理论依据,也有助于研究云南重楼内生真菌与其生理活性物质的关系及其内生真菌多样性的开发利用。
