云南糯玉米地方品种糯性等位基因wx-xuanwei的分子特征
2020-04-08武晓阳隆文杰周国雁伍少云
武晓阳,隆文杰,陈 丹,周国雁,杜 娟,伍少云,蔡 青
(云南省农业科学院 生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部 西南作物基因资源与种质创制重点实验室,云南 昆明 650223)
糯玉米起源于中国,所以中国拥有非常丰富多彩的糯玉米地方品种,尤其是中国的西南地区,如云南及其周边地区更是中国糯玉米的起源中心和遗传多样性中心[1-4]。糯玉米在云南的4个玉米生态种植区,即滇中温暖、滇西北冷凉、滇南暖热和滇东北温凉生态区[5]都有分布,农家品种数量众多,约占收集、保存的云南地方玉米种质资源样品数的10%以上,达400多份,且类型多样,籽粒色泽变化丰富。其中滇中和滇南玉米生态区是云南糯玉米品种多样性和性状多样性的中心。这种多样性可能与聚居在云南、尤其是南部和西南部多个少数民族的糯食文化,以及这些地理区域的特殊生态、地理和立体农业气候有一定关联。这些丰富多样的云南糯玉米地方种质资源是开展糯玉米研究的物质基础,深入分析其waxy基因的等位变异类型与组成,发掘新基因,对针对性保护和利用携带珍稀基因的遗传资源材料具有重要意义和实用价值。糯玉米(ZeamaysL. var.certainKulesh)是在中国境内被成功驯化的特殊栽培类型,因其籽粒胚乳淀粉几乎全部为支链淀粉而导致籽粒或淀粉表现为糯性[6-7]或粘性,此糯性受隐性waxy单基因的控制。普通玉米的waxy基因能正常表达GBSSⅠ蛋白并合成直链淀粉,而糯玉米因waxy基因突变造成GBSSⅠ蛋白失活、直链淀粉合成受阻,便产生糯性籽粒和糯性支链淀粉。玉米的waxy基因定位于9号染色体,全长约4.5 kb,包含有14个外显子[8]。

箭头表示插入突变,下划线表示缺失突变。图1 waxy基因的突变位点
目前,在糯玉米中已发现超过50种以上的waxy基因突变类型(图1),但绝大多数都是插入或缺失突变,因此玉米waxy基因的等位突变不仅呈现出多样性,而且插入/缺失突变也是其基因突变的主要形式[9]。在中国糯玉米地方品种中,糯性基因wx-D7和wx-D10是序列缺失造成的突变类型,其中wx-D7是其第7外显子存在有30 bp的序列缺失,而wx-D10是其第10外显子有15 bp的序列缺失[10,11]。基因wx-Cin4、wx-124和wx-Reina都发现存在于云南糯玉米地方种质资源中,而且都是由转座子插入造成的突变类型,其中,wx-Cin4是由一个466 bp的反转录转座子Cin4插入waxy基因的第6外显子当中造成的插入突变,wx-124是由一个116 bp的MITE(Miniature Inverted-repeat Transposable Element)类转座子“124”插入waxy基因的第7外显子当中造成的插入突变,wx-Reina则是在waxy基因的第10内含子中插入了一个约5.4 kb的反转录转座子Reina[12,13]。在我们前期研究中,虽然现在已基本明确,在大量丰富的云南糯玉米地方种质资源中,基因wx-D10和wx-Reina有相当高的分布频率,分别有约50%和 30%的云南糯玉米地方种质资源携带有这两个基因,是云南糯玉米地方种质资源的糯性优势基因或高频率基因。同时,基因wx-D7、wx-Cin4和wx-124在云南糯玉米地方种质资源当中出现的频率相当低,只在少数或个别云南地方糯玉米品种中存在,是稀有基因或低频基因。然而,除已明确携带有上述5个waxy基因的材料外,还有约占云南糯玉米地方品种数1/5的100份左右材料带有未知的waxy基因。因此,深入分析这些资源的waxy基因突变类型及其分子特征,有助于了解和掌握整个云南糯玉米地方品种的waxy基因构成、分布,探讨云南糯玉米waxy基因与生态地理、立体农业气候和民族饮食文化之间的协同进化关系。本文通过现代分子生物学方法的克隆、测序等手段,研究分析了携带未知糯性基因的云南糯玉米地方种质资源waxy基因的突变形式及其分子特征,以期发掘新基因,为有针对性地保护和利用具稀有或低频基因的种质资源提供科学依据。
1 材料与方法
1.1 植物材料
含未知waxy等位基因的云南糯玉米地方品种共10份(表1)及对照材料普通(非糯)玉米自交系B73,取自国家科技资源共享服务平台—国家作物种质资源库(云南)暨 “云南省作物种质资源保存库”。10份实验材料涵盖滇南(元江县、澜沧县、广南县和元阳县)、滇中(宜良县、保山市隆阳区、双柏县)、滇西北(泸水县、华坪县)和滇东北(宣威市)4个云南玉米的生态区。
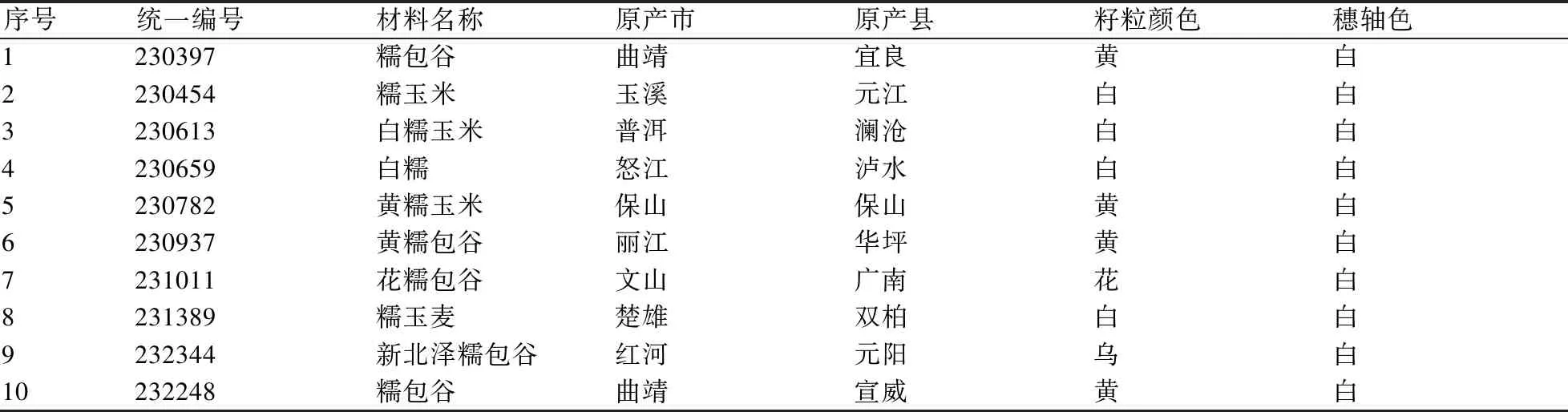
表1 实验材料的信息
1.2 突变点的发现
为检测带有未知糯性基因的云南糯玉米地方品种的waxy基因突变位点,首先从幼叶提取实验材料的基因组DNA[15],然后用可以覆盖整个waxy基因的11对分子标记(表2)来检测10份实验材料的基因组DNA。PCR反应体系为50 μL,包括1×PCR buffer、1 U Taq酶(TaKaRa公司)、0.2 mmol/L的dNTPs、0.4 μmol/L的两端引物和50 ng的基因组DNA。PCR反应程序为:94 ℃持续5 min;35个循环,包括94 ℃持续1 min、57 ℃持续1 min和72 ℃持续1~3 min;最后72 ℃持续5 min。
1.3 xuanwei的序列测定
染色体步移采用简化的热交错不对称PCR(Tail-PCR)方法[13],其扩增过程简化为两轮反应。第一轮Tail-PCR反应使用的引物为上游特异引物和在5′-端增加结合点的随机引物。其PCR采用普通PCR反应体系,而Tail-PCR反应程序为:首先,94 ℃持续5 min;然后包括94 ℃持续1 min,58 ℃持续1 min和72 ℃持续3 min的5个循环;接着为94 ℃持续1 min,且每秒降低0.5 ℃并在30 ℃下持续1 min,72 ℃持续3 min;再包括94 ℃持续1 min,58 ℃持续1 min,72 ℃持续3 min,94 ℃持续1 min,50 ℃持续1 min和72 ℃持续3 min的15个循环;最后72 ℃持续5 min。第二轮Tail-PCR反应使用的引物是下游特异引物和结合到随机引物5′-端的引物。反应体系仍采用普通PCR反应体系,但其模板为第一轮Tail-PCR的产物1 μL,反应后的PCR产物用1%的琼脂糖检测,并直接测序。
用已测序的普通玉米自交系B73的基因组序列作为参考序列,以分段式方法克隆大片段xuanwei。分3段完成xuanwei的PCR扩增,其中对前后两段的扩增使用结合到waxy基因和xuanwei的引物,所获得的PCR产物被用于直接测序。中间一段的扩增采用巢式PCR法。其中,第一轮扩增使用结合到waxy基因序列的引物,而第二轮扩增则以第一轮扩增结束后的1 μL PCR产物为模板,用结合到xuanwei的引物来扩增,最终的PCR产物用1%的琼脂糖检测和直接测序。

表2 用于检测waxy基因外显子区域插入片段的引物
1.4 wx-xuanwei的序列分析
利用基因结构显示系统(Gene Structure Display Server,GSDS)绘制waxy基因结构图[16],而用基因组序列ZmB73_AGPv1_genome (http://ftp.maizesequence.org/current/assembly/)建立的本地Blast数据库[17]分析转座子在玉米基因组中的拷贝数。NCBI中的blast N被用于分析插入片段的类型和参考序列,而blast X和NCBI Conserved Domain Search(CDD)被用于分析转座子的结构域[18],NCBI中的ORF finder则被用于分析开放阅读框。软件CLUSTAL X (1.8)被用于序列比对[19]。Primer3 (http://bioinfo.ut.ee/primer3-0.4.0/primer3/)被用于引物的在线设计[20]。
2 结果与分析
2.1 waxy基因的检测
为检测具有未知等位基因的糯玉米资源,本研究开发了可以检测整个野生型waxy基因的分子标记(表2)。利用这些分子标记进一步检测具有未知等位基因的10份糯玉米材料,发现其中一份材料糯包谷(232248)中在标记waxy-22的PCR扩增区域,也就是14个外显子区域不能有效扩增。初步认为这一区域存在基因突变。
2.2 突变位点序列的测定
为了测定在宣威糯包谷中发现的waxy基因第14外显子突变点的序列,采用简化Tail-PCR方法进行染色体步移。同时,PCR过程分两步完成,第一步采用热交错PCR预扩增,第二步则将第一步获得的PCR产物作为模板进行普通PCR扩增。利用这种方法,获得了突变位点约700 bp的序列。然后,通过blast N与B73基因组的序列进行比对,发现宣威糯包谷waxy基因的突变是由于未命名的LTR反转录转座子的插入造成的,因而得到的序列是该转座子的LTR结构的部分序列。因此,宣威糯包谷waxy基因第14外显子的突变点xuanwei也就是插入片段xuanwei。
利用转座子LTR序列注释出的B73基因组的同源序列(Chr2:23743198-23748113)作为设计扩增该突变位点的参考序列,以便对该突变位点作进一步地扩增和测序。由于LTR在玉米基因组中为多拷贝,直接扩增将会影响其扩增的特异性,因此使用waxy基因引物加转座子结合引物扩增插入片段xuanwei的两端序列,而xuanwei中间部分的序列则采用巢式PCR扩增。测序并拼接得到的完整的突变位点xuanwei的序列见图2,为无义链序列。为在不同的云南糯玉米地方品种中发现有效检测基因wx-xuanwei,并对其开展分布或频率等深入研究,开发设计了1对特异显性标记。具有wx-xuanwei基因的糯玉米材料能扩增出约100 bp的条带(图3)。该特异显性引物的序列为:F:5′-TTGGCCGACTCTACTGGTTT-3′,R:5′-TTCTCCCAGTTCTTGGCAGT-3′。 F引物结合位点在转座子的LTR序列上,R引物结合位点在waxy基因上。
2.3 基因wx-xuanwei的分子特征
云南糯玉米地方品种宣威糯包谷的waxy基因是由反转录转座子xuanwei插入在waxy基因的第14内外显子区域形成的插入突变基因wx-xuanwei(图1),该转座子为完整的LTR转座子,具有5 bp的靶位点重复序列5′-CTGCC-3′。转座子xuanwei的长度为4893 bp,具有两个大的开放阅读框,分别编码Gag和Pol蛋白,其阅读方向与waxy基因相反。该转座子的两端具有序列完全一致的两个LTR结构,是云南糯玉米地方种质资源存在的一个新的插入点。通过结构域CP、INT、RT和RNASE H的顺序分析,该转座子属于Ty1-Copia类的长末端重复的反转录转座子(图4),在玉米基因组中的高倍数约为2个,是低拷贝类的转座子家族成员之一。目前,在中国糯玉米waxy基因中发现的转座子均属于低拷贝家族的成员(表3)。

M为marker,1、2为突变型, 3、4为野生型。图3 等位基因wx-xuanwei特异分子标记扩增结果
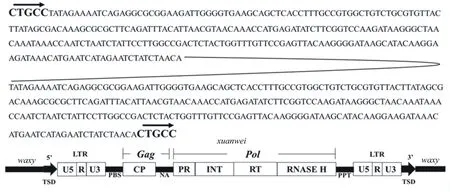
图4 等位基因wx-xuanwei的序列及结构特征
3 讨论
玉米是原产于美洲[21]大陆的作物,在400~500年前才传入中国[22],而且糯玉米是由普通硬粒玉米[23]或爆裂玉米[24]发生基因突变并被选择、驯化而来的,已是学术界公认的观点。但是糯玉米在中国的种植历史有200多年[2,25]。说明玉米在从美洲引入中国后的100~200年时间里就发生了基因突变,并且这种突变就恰巧被当时处在“糯稻栽培区”或“糯稻文化圈”又或者“糯食文化圈”的中国西南地区的壮、侗、布依、傣[26]等少数民族注意到,且把这种突变类型选择并保留了下来。这些少数民族是由他们的先人百越人在明、清时期发展而来的[27],而百越人是中国最早的稻谷栽培者[28],当然也应该是最早的糯稻栽培者和食用者。所以,这些少数民族也许是从他们的祖先那里学习、借鉴了食用、祀用糯稻方面的经验与知识,把与糯稻一样带有粘性的糯玉米当新鲜食物祭祖、祭神,以及食用等,从而使玉米的糯性突变型糯玉米得以保留、延续,并积累、形成数以百计的地方品种或种质资源。从这个角度看,中国西南地区,尤其是云南及周边地区的少数民族的糯食文化与知识是中国糯玉米形成的主要动力。

表3 不同waxy等位基因中转座子在B73基因组中的拷贝数
DNA序列的缺失和插入是造成玉米waxy基因突变的主要原因,而在插入突变中转座子插入是造成糯性玉米waxy基因突变的一种主要形式[9]。所以,根据转座子在基因组内跳跃的媒介的不同,将其分为DNA转座子和RNA转座子。MITE类型的转座子[22]即属于DNA转座子。RNA转座子也叫反转录转座子,可进一步划分为长末端重复(LTR)的反转录转座子和非长末端重复(Non-LTR)的反转录转座子。长末端重复的反转录转座子的5′-末端和3′-末端具有长的正向重复序列,在跳跃过程中LTR序列由同一条DNA模板合成,而随着时间的推移,其两端的LTR会发生一定频率的突变,使得两端序列不一致。因此,根据基因组碱基变化速率可以计算转座子的插入时间[29]。
插入在基因wx-xuanwei中的转座子xuanwei属于Ty1-Copia[30](表3),因而基因wx-xuanwei与wx-xuanwei一样都具有相同的LTR结构,均属于新的突变位点。但是,与wx-xuanwei不同,wx-Reina在云南糯玉米地方品种或种质资源中属于优势或高频基因,约30%的云南糯玉米地方品种都带有该基因,而wx-xuanwei目前只发现于宣威糯包谷之中,因而与wx-Cin4、wx-124和wx-D7一样,在云南糯玉米地方品种中都属于稀有或低频基因。这些基因在地方品种的传播过程中更容易丢失,因此在保存过程中值得更加关注。
4 结论
wx-xuanwei基因是由反转录转座子或RNA转座子插入玉米waxy基因,在云南糯玉米地方品种中形成的突变型新等位基因和低频基因。另外9个研究材料的情况依然需要进一步鉴定。
