冠状病毒肺炎的病理学特征回顾与展望
2020-04-08
(南方医科大学法医学院,广东 广州 510515)
冠状病毒肺炎是由冠状病毒(coronavirus)感染引起的一类呼吸系统传染病,自2003年严重急性呼吸综合征(severe acute respiratory syndrome,SARS)冠状病毒流行并引起全球感染以来,冠状病毒肺炎逐渐进入人们的视野并引发多次严重疫情。冠状病毒是一类可在动物与人类之间传播的人畜共患RNA病毒[1],分类上属于网巢病毒目、冠状病毒亚目、冠状病毒科。其基因组大小在26 000~32 000个碱基对,在RNA病毒中是基因组规模最大的一类[2]。电子显微镜下呈球状或椭圆形,包膜上有规则排列的囊状胶原纤维突,形似皇冠状,因此得名冠状病毒。病毒内部为RNA和衣壳蛋白组成的螺旋式核蛋白核心[2-3]。冠状病毒可感染哺乳动物、鸟类,自然界中常见的已知可感染人类的冠状病毒共有7种,均可引起呼吸系统疾病[4],轻则引发普通感冒,重则导致SARS、中东呼吸综合征(Middle East respiratory syndrome,MERS)、新型冠状病毒肺炎(corona virus disease 2019,COVID-19)等严重疾病。
1 严重急性呼吸综合征(SARS)
1.1 SARS流行病学、病原学
SARS,俗称“非典型肺炎”,是由SARS冠状病毒(severe acute respiratory syndrome coronavirus,SARSCoV)引起的一种具有明显传染性、可累及多个器官系统的特殊肺炎[5-6],世界卫生组织(World Health Organization,WHO)将其命名为严重急性呼吸综合征[7]。其临床表现主要为发热、乏力、头痛、肌肉关节酸痛等全身症状和干咳、胸闷、呼吸困难等呼吸道症状,部分可有消化道症状如腹泻等表现[5]。2003年,SARS全球流行,曾波及29个国家和地区,根据WHO统计,8096名感染者中有774人死亡,病死率达9.6%[7]。
1.2 SARS病理学研究
2003年SARS发生后,笔者团队及国内外病理学、法医学技术人员对SARS的病理学特点进行了广泛报道[8-11],发现该病以肺和免疫系统的病变最为严重。根据DING等[10]报道,南方医科大学南方医院4例SARS尸体检验的主要病理变化可归纳为肺部病变、免疫器官损伤、全身小血管炎、全身中毒性改变及继发感染4个方面。(1)肺部病变:肺部是病毒攻击的主要靶器官,表现为肺水肿、肺实变、肺出血。显微镜下肺部在早期呈脱屑性肺泡炎和渗出性病变,病变进展有广泛性肺透明膜形成,伴有严重的炎症反应及坏死,部分肺泡上皮增生融合,部分细胞胞质内含有嗜酸性病毒包涵体,肺泡腔有大量单核巨噬细胞,CD68免疫组织化学染色呈阳性。恢复期肺部呈机化性肺炎改变。电镜下可见肺泡腔内有活跃增生的肺泡Ⅱ型上皮细胞及单核巨噬细胞,胞质有群集的病毒颗粒。(2)免疫器官损伤性变化:免疫器官是病毒攻击的另一主要靶器官。根据病变不同状态可见脾和淋巴结充血、出血,脾萎缩、脾组织大片坏死;淋巴结高度血管扩张,淋巴小结消失,组织片状坏死,淋巴窦内单核巨噬细胞增生;其他淋巴组织灶状坏死等。(3)全身各器官小血管炎:肺、心、肝、肾、脑、肾上腺及横纹肌间等均可发现小血管周围水肿,血管内皮细胞肿胀,部分血管壁呈纤维素样坏死,血管壁内单核巨噬细胞、淋巴细胞浸润,部分血管腔内可见纤维素样坏死及血栓形成。(4)全身中毒反应及继发感染:主要表现为肝、肺、肾、肾上腺、心等重要实质器官组织有灶状坏死改变,骨髓粒细胞系统、巨核细胞系统抑制明显。WANG等[9]报道,SARS患者可因全身中毒性改变及继发感染致死,其中1例系继发全身性曲菌感染死亡。除了常规组织病理学检验外,还采用了组织化学、免疫组织化学、RT-PCR、原位杂交、电子显微镜等技术对病理组织进行了研究,不仅在病变组织证实SARS病毒包涵体、病毒颗粒、病毒结构蛋白等,还通过研究提出弥漫性肺泡损伤及炎性渗出物导致肺实变,且肺实变及免疫功能紊乱是患者死亡的重要原因[10]。并首次报道了SARS合并全身播散性曲菌感染尸体检验病例,提出SARS治疗过程中应合理应用皮质激素,避免继发霉菌感染的观点[9]。基于上述文献,绘制出SARS导致全身机体反应及病理学改变的机制图(图1)。研究结果[8-11]不仅明确了SARS的病理学改变,及时为临床治疗提供了帮助,还从病理学发现对SARS的损伤机制进行了探讨。
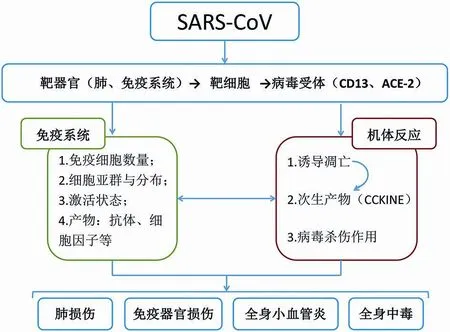
图1 SARS导致全身机体反应及病理学改变的机制Fig.1 Mechanism of SARS leading to systemic reactions and pathological changes
国内外学者也对SARS的病理学研究进行了报道[12-15],主要病理学改变与笔者团队发现一致。如NICHOLLS等[12]报道了SARS患者穿刺活检结果,这些结果代表了SARS早期进程的病理学改变,在活检样本中主要检见肺间质中淋巴细胞轻度增多,少数肺泡间隔细胞肥大、核增大、核仁深染,未发现典型的病毒包涵体,以及肺泡巨噬细胞轻度增多和早期透明膜形成。而死亡后肺组织的病理学改变与活检总体相似,均表现为肺高度水肿、淋巴细胞和浆细胞渗出、单核-巨噬细胞浸润、肺泡上皮细胞增生并脱落和透明膜形成等病理学改变,终末期可见弥漫性肺泡间隔断裂、肺纤维化形成等改变。电镜下,可见肺泡间隔细胞质中高尔基体扩张,并且在高尔基体中发现病毒颗粒附着[12,15]。
2 中东呼吸综合征(MERS)
2.1 MERS流行病学、病原学
MERS是一种由中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)所引起的新型人畜共患的呼吸系统传染病。患者常见的症状为发热、咳嗽、咽痛或胸痛、腹泻或呕吐[16]。2012年,MERS在中东地区沙特阿拉伯首次爆发[7],首发患者以呼吸系统病变为主要症状,经过11 d治疗后,最终因肾衰竭死亡。经过实验室分析,确认该新发现的呼吸道疾病是由冠状病毒引起,且与SARSCoV不同,系未曾在人类身上发现过的一种新冠状病毒[17-18]。MERS-CoV与SARS-CoV同隶属于冠状病毒家族,但MERS-CoV所导致的肺炎病死率比SARS更高[19]。至2019年11月,全球2494名MERS感染者中有858人死亡,病死率高达34.4%[7]。
2.2 MERS病理学研究
由于MERS发病数量相对较低,传染性与致死性高,有报道的尸体检验与活检病例数量也较少[20-21]。MERS的病理学特征可以归纳为:(1)弥漫性肺部病变。2篇报道均显示肺部有弥漫性渗出性肺泡损伤,肺泡间隔破坏、扩张,Ⅱ型肺泡上皮细胞增生、脱落,大片状水肿液伴出血和纤维蛋白渗出,透明膜形成,部分肺泡间隔和肺泡腔见数量不等的单核-巨噬细胞及多核巨细胞,伴有支气管上皮脱落、支气管黏膜下淋巴细胞轻中度浸润。电镜下见肺细胞、巨噬细胞内见密集的穗状结构的致密圆形病毒。(2)多器官小血管炎、淋巴细胞浸润。与SARS类似,MERS感染者在肺、气管、肾、肝、骨骼肌等器官均可见小血管或组织间隙淋巴细胞浸润,部分区域可见坏死性炎性灶。(3)免疫器官变化。多个淋巴结中见淋巴滤泡减少、多形免疫母细胞和反应性淋巴细胞混合的小泡间增殖,脾中含有大量免疫母细胞及反应性淋巴细胞,骨髓未见异常。
3 新型冠状病毒肺炎(COVID-19)
3.1 COVID-19流行病学、病原学
COVID-19是由新型冠状病毒引发的传染病[22]。2019年末,该病在中国湖北省武汉市首先发现,并扩散至全球。2020年2月11日国际病毒分类委员会正式将致病病毒命名为严重急性呼吸道综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。大多数患者以下呼吸道症状为主,常见临床表现包括发热、咳嗽、咳痰、四肢乏力、头痛等症状;有些仅表现为腹泻、低热、轻微乏力、嗜睡等,无肺炎表现[23-24];部分患者甚至无任何临床表现[25]。感染晚期,危重型患者病程中出现多种并发症,包括急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒、急性心肌损伤及弥散性血管内凝血(disseminated inravascular coagulation,DIC)等[23-24,26]。SARSCoV-2的基因序列与已有的类SARS病毒变种有86%的相似性[22-23],然而与SARS不同的是,目前流行病学认为,SARS-CoV-2对人群普遍易感,主要感染途径为侵入人体呼吸道上皮细胞,可通过包括呼吸道飞沫、气溶胶及接触带有病毒的分泌物进行传播[23]。同时,无症状感染者也可能成为传染源,这增加了病毒的扩散能力。因此,COVID-19发病人数远远超过SARS和MERS,截至2020年2月20日,COVID-19感染者仅中国已达74675人,其中2121人死亡[26-27]。这也显示出COVID-19的发病人数尽管较多,但死亡率低于SARS的9.6%和MERS的34.4%。
3.2 COVID-19病理学研究进展
关于COVID-19的病理学特征报道,目前仅有2篇。TIAN等[28]的一项早期COVID-19回顾性病理学研究发现,两名因肺腺癌接受肺叶切除术的患者患有COVID-19,观察到COVID-19病变早期的病理学改变。而XU等[29]的研究从死者的肺、肝、心等器官穿刺取样,发现了COVID-19病变终末期的病理学改变。对其病理变化主要归纳总结如下:病变早期表现出肺水肿、蛋白渗出、肺间质增厚、肺泡腔内有多核巨细胞和巨噬细胞浸润等病理学改变,且发现了疑似的病毒包涵体,但透明膜形成不明显。终末期双肺弥漫性肺泡损伤伴纤维黏液样渗出物,同时右肺可见明显肺泡上皮细胞脱落、透明膜形成,表现为急性呼吸窘迫综合征,而左肺肺水肿和透明膜形成,提示早期呼吸窘迫综合征的表现。双肺均表现出以淋巴细胞为主的间质炎症细胞浸润,以及核大、两亲性粒状细胞质和突出的核仁为特征的病毒性细胞变化,肺泡中见多核巨细胞,未检见细胞内含有病毒包涵体。XU等[29]认为,COVID-19的病理特征与SARS和MERS感染极为相似。同时,其他器官也发现一些病变:肝活检显示轻度脂肪变性和轻微小叶及门脉异常,提示可能与病毒损害或药物性损害有关;心脏组织可见少量单核细胞炎性浸润,无其他实质性损害,提示心肌组织也被病毒受累。但由于迄今仍未有完整的尸体检验病理报告,对COVID-19的病理学改变仍需进一步探索。
综上所述,通过对SARS、MERS及COVID-19的病理学改变及特征、机制的研究进展进行文献回顾,发现COVID-19与前述两种冠状病毒感染的病理学改变有一定共性。COVID-19与SARS、MERS一样,病理学主要改变靶向于双肺,侵入后造成肺的弥漫性损伤、水肿、透明膜形成(表1),表现以单核巨噬细胞和淋巴细胞渗出为主的炎症细胞浸润和肺泡上皮损伤为主要特征的病毒性肺炎改变。笔者认为,后续通过系统尸体解剖完善病理学研究,能更好地解释COVID-19的临床病理联系及SARS-CoV-2引起肺损伤的机制,为武汉乃至国内外患者的救治提供参考,有助于医生及时制定重症患者的治疗策略。关于传染病尸体检验,笔者曾主刀了第1、第2例SARS死亡病例的尸体检验,参与了第3例的尸体检验,随后又参与SARS的病理学研究,当时是法医和病理专业人员共同组成团队,病理在组织学和病原学的研究方面发挥了作用,法医在尸体检验和死因分析方面的突出表现难以替代。2020年2月16日在武汉金银潭医院完成首例和第2例COVID-19尸体检验,参加人员均为法医病理人员。中国的两次大规模冠状病毒性传染病的尸体检验和研究都有法医的身影,说明法医病理在传染病尸体检验和研究方面的现实作用,有可能为今后法医病理学发展提出了新的方向。

表1 SARS、MERS及COVID-19的病理学特征比较Tab.1 Comparison of pathological features of SARS,MERS and COVID-19
