活性多糖提取纯化及结构解析的研究进展
2020-04-07刘艳红唐祥李娅琳
刘艳红 唐祥 李娅琳

【摘 要】 多糖是来源于植物、动物、微生物中的一类天然大分子化合物,具有免疫调节、抗肿瘤、抗病毒、抗氧化、降血糖等多种药理活性。多糖来源广泛,安全性高,具有广阔的开发应用前景。但多糖提取、纯化方法重现性差,不易得到高纯度的均一多糖,常用的结构解析方法难以得到确切的结构信息,导致多糖构效关系及作用机制尚不明确,极大地阻碍了多糖类药物的研发。文章将活性多糖的提取、纯化和结构解析的方法和技术进行综述,以期推动专属性更强,效率更高的分离纯化及结构解析方法的建立,为构效关系研究提供依据,并为多糖类药物研发提供参考。
【关键词】 活性多糖;提取;分离纯化;结构解析;研究进展
【中图分类号】R284 【文献标志码】 A 【文章编号】1007-8517(2020)3-0067-07
Abstract:Active polysaccharide derived from animals, vegetation and microorganism medicinal materials, which is a macromolecular compound that has immunoregulation, antitumor, antiviral, antioxidant, hyperglycemic and other activities. Active polysaccharide has wide source, and high safety, which has broad prospects. However, the research methods of polysaccharide has such disadvantages as poor reproducibility of extraction and purification methods, immaturity of structure analysis methods, unclear of functional mechanism and structure-function relationship. Therefore, we summarized the isolation, purification methods and structure analysis technologies of active polysaccharide, in order to provide reference for design research progress and development of new purification methods in the industrial production, and provide evidence for the mechanism of action study of polysaccharides in vivo.
Keywords:Active polysaccharide;Isolation and purification;Structure analysis
多糖(polysaccharide)是由10個以上单糖通过糖苷键连接而成的高分子化合物,广泛存在于自然界中,参与生命体的多个生理活动过程,如纤维素、肽聚糖参与构成细胞壁,淀粉、糖原等作为养分,参与动植物的整个使命过程。
通常能调节人体生理功能的特异性多糖称之为活性多糖,具有免疫调节[1-2]、抗肿瘤[3-4]、抗病毒[5]、抗氧化[6]、降血糖[7]等多种活性。因其来源广泛,安全性高,活性多糖具有较高的开发潜力。多糖是大分子物质,结构复杂,获得高纯度多糖是进行结构解析的前提,而对多糖结构进行解析又是构效关系研究的起点。目前所用结构解析方法仅能得到局部的信息,对于多糖结构的确证仍是一个需要突破的难点。因此本文就活性多糖的提取、分离纯化和结构解析方法做一综述。
1 多糖的提取
1.1 水提醇沉 多糖为极性大分子化合物,易溶于热水,不溶于乙醇,丙酮等溶剂,因而水提醇沉法是提取多糖最常用的方法。该方式所需设备简单,溶剂价廉易得且易于回收,广泛用于多糖的提取及初步纯化。赵嵩月等[8]用水提醇沉法从三七废渣中提取得到含量为56.70%的三七粗多糖。
1.2 酸碱法 酸提取法以稀盐酸或稀醋酸为提取溶剂,用浓度为0.10~0.15mol/L的盐酸溶液提取多糖,所得多糖活性、得率均较高[9-10]。但因糖苷键在酸性环境中易断裂,会影响多糖的活性及结构解析,故而该方法现已较少使用。碱液有助于多糖的浸出,提高多糖得率,常用浓度为0.1~10mol/L氢氧化钠溶液提取多糖[11-12],但碱液对容器腐蚀性较强,且所提多糖黏性大,不适于工业生产。
1.3 酶提取法 酶提取法就是选择适宜的酶,将细胞壁酶解,使胞内多糖溶出,常用于提取多糖的酶有纤维素酶,蛋白酶,果胶酶等。该方法能极大地提高多糖得率和缩短提取时间,且该方法通常在较温和的条件下进行,对多糖结构影响较小。杨佳琦等[13]用复合酶法提取云芝多糖,得率较水提醇沉法提高了43.63%。但因酶具有高度专一性,选择适宜的酶就显得尤为重要。同时提取的温度,pH,时间均会影响提取效率,且酶价格较昂贵,用量大,极大地限制了该方法的使用。
1.4 物理提取法 常用的物理提取法包括超声提取法和微波提取法。超声波能增加溶剂的穿透力,可缩短提取时间,提高提取效率。Mehdi Alboofetileh等[14]以196W的超声波提取褐藻多糖,可使得率提高至3.51%。微波可使溶剂迅速气化,进而在细胞膜和细胞壁上形成大量孔洞,有利于胞内多糖释放,以微波功率700W,20min/次,提取两次,可使多糖得率达15.75%[15]。超声和微波提取法常协同用于多糖提取[16],但上述两种方法需要配备专门的仪器设备,且能耗较大,使用率远远不及水提醇沉法。
近年来发展了一些新的提取技术,如超临界流体萃取法[17-18]、高压脉冲法[19]等,但由于需要特殊设备,使用率不如传统方法高。
2 多糖的纯化
2.1 多糖脱蛋白
2.1.1 Sevage法 提取得到的粗多糖常含蛋白质,蛋白质在有机溶剂中易变性,Sevage法可用于多糖脱蛋白。当氯仿:正丁醇比例为4:1时,蛋白去除效果较好[20-21]。Sevage法反应条件温和,能较好的避免多糖降解,但该法需重复操作多次,才能获得较高的蛋白脱除率,但多糖损失量较大,操作也较繁琐。
2.1.2 三氯乙酸法 三氯乙酸(TCA)也是常用的蛋白沉淀试剂,蛋白的脱除率和多糖的损失率与TCA用量密切相关。Chen L等[22]发现用10% TCA可较好去除粗多糖中的蛋白质,当多糖提取液与TCA的比例为1∶3,TCA浓度为6%时,蛋白质脱除率可达84.16%[23]。TCA法操作简单,所需试剂相对单一,蛋白脱除率及多糖保留率均高于Sevage法[24],可以对大批量多糖进行处理,但该方法的反应较为剧烈,应控制好条件,避免TCA对多糖结构的影响。
2.1.3 酶解法 蛋白质除以游离蛋白的形式存在外,还与多糖形成糖蛋白复合物,而复合物用Sevage法及TCA法都较难完全去除。特异性蛋白酶可水解蛋白质,从而达到脱除蛋白质的目的。常用的酶有中性蛋白酶[25]、木瓜蛋白酶[26]、纤维素酶、果胶酶[27]等,可单独使用,也可以复合酶的形式用于脱蛋白。酶解法专一性强,不易造成有机试剂的污染,蛋白脱除效果较好。
除了上述传统方法外,还有三氟三氯乙烷法、氢氧化钠法、盐酸法、鞣酸法、氯化钠法、氯化钙法、乙酸铅法、反复冻融法、阴离子交换树脂法、径向流动色谱法等,同时多种方法的联用为多糖提取液更好脱除蛋白提供了更多的可能。
2.2 多糖脱色素 多糖提取液通常颜色较深,影响产品外观及进一步的纯化,常需选择适宜的方法去除色素。常用的脱色方法包括活性炭吸附法,过氧化氢法,大孔树脂法等。活性炭具有多孔结构,对芳香族有机物具有较强的吸附性[28],该法条件较为温和,应用范围广,但活性炭加入量、溶液pH值、脱色温度、时间等直接影响脱色效果。过氧化氢对酚类、羟基蒽醌衍生物类色素有较好的去除效果,但过氧化氢的氧化性较强,若用量过大,反应时间较长,有可能会破坏多糖的结构。大孔树脂性质稳定,对多种色素、蛋白质均有不同程度的吸附性,在脱色的同时对蛋白质也有一定的去除作用。大孔树脂型号众多,选择适宜的型号有助于提高色素脱除率及多糖保留率,常用的有NKA-9、AB-8、D303、D101、D941、HPD-100等。
2.3 多糖的纯化
2.3.1 沉淀法 不同组分多糖往往具有不同的分子量,在不同的溶液中具有不同的溶解性,因而可以根据溶解特性进行分离纯化。包括乙醇分步沉淀法,盐析法等。乙醇分步沉淀法是最常使用的沉淀法,增加乙醇的浓度,多糖按分子量从大到小依次被沉淀。鹽析法通常是在多糖提取液中加入中性盐(如氯化钠,氯化钾,硫酸铵等)后使其达到一定浓度,此时在盐溶液中溶解度最小的多糖将会先沉淀出来,然后继续升高上清液中的盐浓度,则另一多糖又将沉淀,依次进行分离,但沉淀法仅适合于溶解度相差较大的多糖组分。
灰树花多糖[33]D94174.2467.81
2.3.2 膜分离法 膜分离技术是一项高效分离技术,也是基于多糖各组分分子量差异而进行分离。分离过程以不同截留分子量的膜为分离介质,在膜两侧施加推动力,使待分离液体中各组分选择性通过膜。根据膜的孔径大小可分为微滤、超滤、纳滤和反渗透,超滤技术因其截留的分子量范围在2-300kDa,被用于多糖的分离纯化[34-35]。研究表明,截留分子量为50和300 kDa的陶瓷超滤膜对香菇多糖提取液有较好的分级效果[33]。膜分离法条件温和,不会对多糖结构造成影响,且分离量较大,不需要额外的试剂,尤其适用于工业大生产中多糖的纯化。
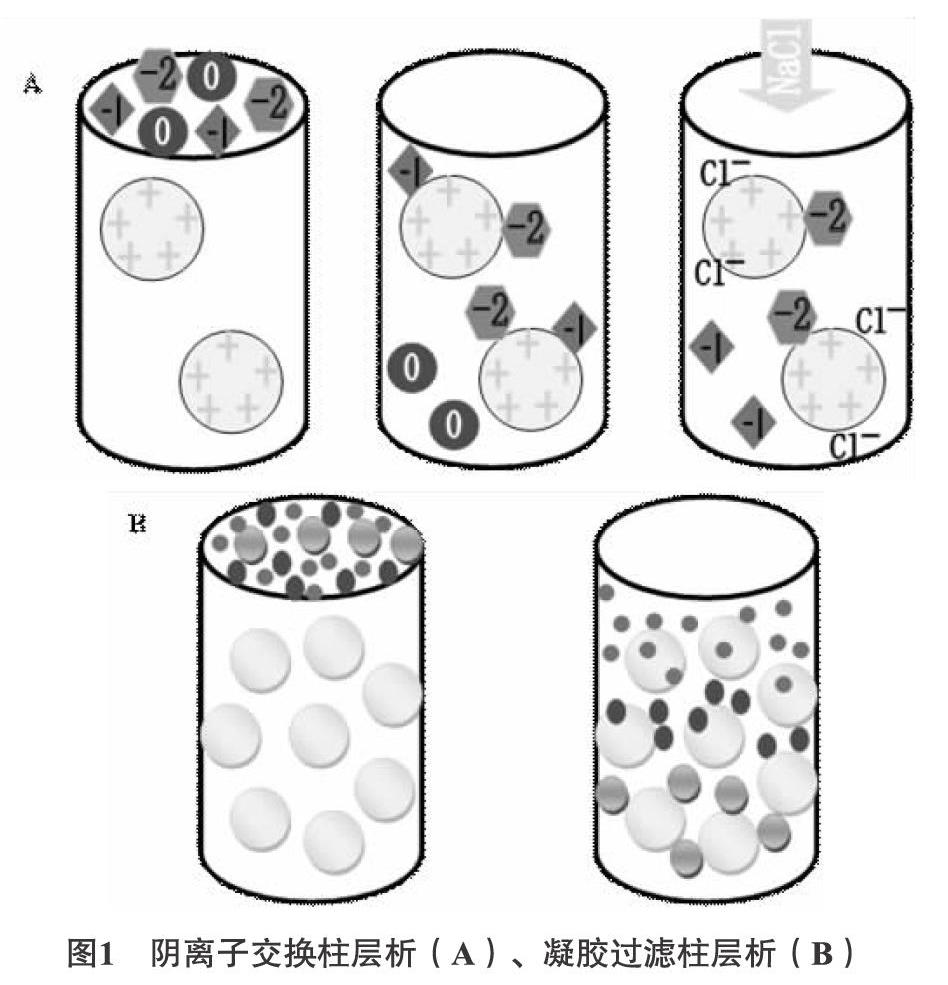
2.3.3 色谱分离法 根据分离原理的不同,可将柱色谱法分为离子交换柱色谱法和凝胶柱色谱法。酸性多糖带负电,可用阴离子交换柱层析将其与中性多糖相分离,同时可控制洗脱液的离子强度将带电性不同的酸性多糖进行分离(分离原理如图1 A所示)。最常用的阴离子交换柱层析填料是DEAE-52,DEAE Sepharose Fast Flow,洗脱剂可用水及不同浓度的盐溶液、碱溶液和硼砂溶液等。
利用分子筛原理将分子量大小不同的组分进行分离的方法称为凝胶过滤柱层析。在流动相的洗脱下,待分离的各组分按其分子由大到小的顺序依次分离(分离原理如图1 B所示),常用的凝胶过滤填料有Sephadex,Sephacryl,Superdex系列填料。离子交换层析和凝胶过滤层析常联合用于多糖纯化。Feng SL等[36]用DEAE-52 cellulose 和Sephadex G-100柱层析,从三七根中分离到具有抗氧化活性MRP5 和MRP5A。柱色谱法所需设备简单,操作方便,不需要有机溶剂,对多糖等高分子物质具有很高的分离效率。但因上样量小,流速慢,不耐压,且填料价格昂贵,限制了其在工业生产中的应用,目前大多局限于实验室使用。
通过一种或数种分离纯化方法的应用,可得到均一多糖组分。而均一多糖组分的获得是结构解析的前提,因此要对多糖结构有清晰认识,还要借助于分离纯化方法的发展及应用。
3 多糖的结构分析方法
结构不明确,药效物质基础不清楚已成为多糖类新药研发的关键问题和瓶颈问题。认识多糖结构有利于深入研究其生物活性,对多糖的基础研究和应用具有重要意义。
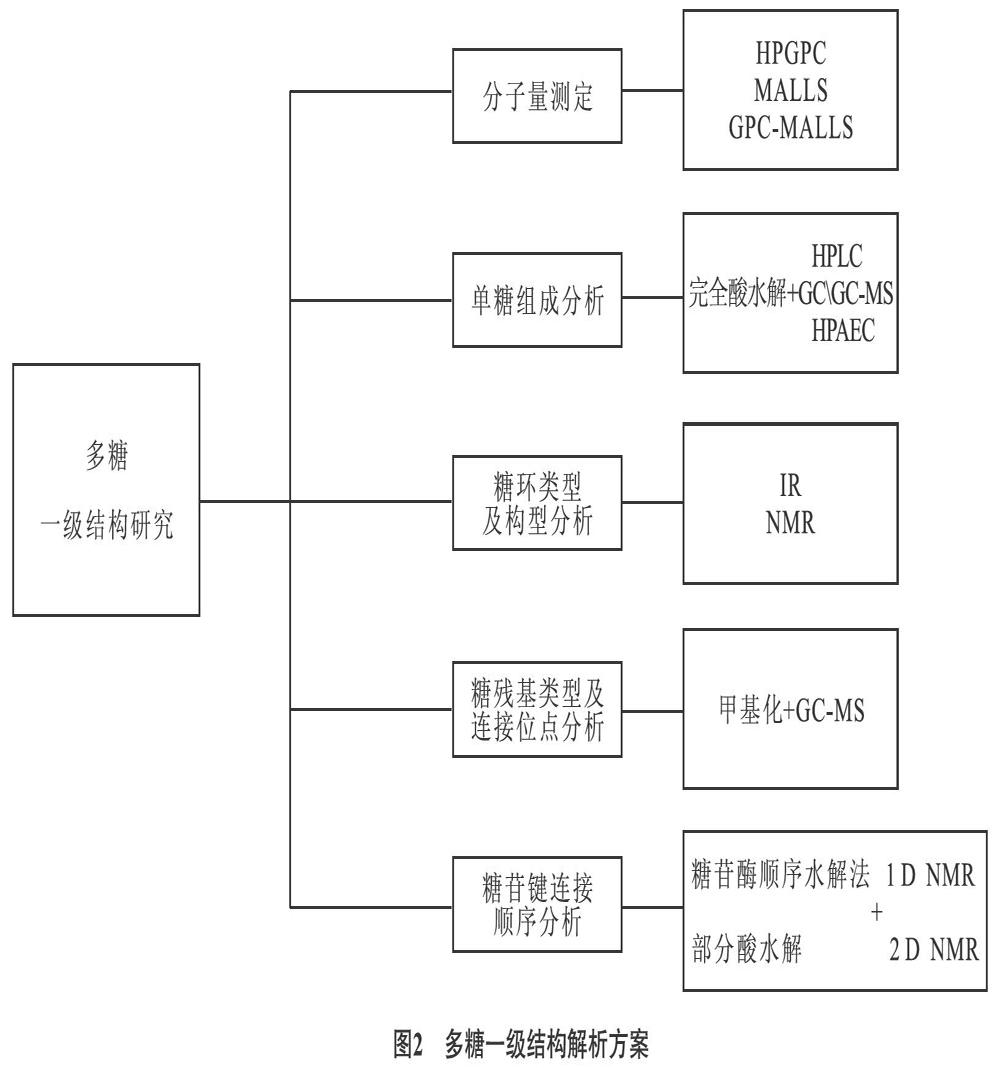
多糖的结构较复杂,分为一级、二级、三级和四级结构,因而多糖结构解析存在很大的难度,特别是对二、三、四级结构的解析目前尚无有效手段,但当前对多糖一级结构解析技术已相对成熟(如图2所示)。
3.1 多糖分子量测定 多糖属于大分子物质,获取分子量大小及分布对认识多糖结构具有重要意义,常用检测方法有:超速离心法,高效凝胶渗透色谱法(HPGPC)、电泳法和旋光度测定法,质谱法,光散射法。
HPGPC法测定多糖分子量的原理是:不同分子量多糖组分在凝胶柱上的保留时间不一致,常选用一系列已知分子量的标准物质(常用葡聚糖[37]),建立分子量与保留时间的关系曲线,然后根据待测样品在凝胶柱上的保留时间求得相对分子质量及分子量分布范围。该方法快速,分辨率高,重现性好,是目前测定多糖分子量的主要方法,但HPGPC法测定结果与所用标准品密切相关,若标准品与待测样品的性质,形状等有较大的差别[38],或所选凝胶柱,流动相不恰当,则会造成较大的误差。
光散射法是应用多角度激光光散射仪(MALLS)测定多糖的绝对分子质量,当激光照射到多糖样品时,会在各个方向产生散射光,在任何方向的光散射强度与分子质量和溶液的浓度成正比,散射光角度的变化与分子的尺寸大小有关[39],故而可通过相关参数的变化,求得待测样品的分子质量,该方法不需要标准品,结果的可靠性较高,但该方法要求待测样品为单一组分,否则将无法得到准确的分子量信息。
综合考虑上述两种方法的优缺点,凝胶渗透色谱(GPC)与多角度激光光散射联用技术已成为当前較为理想的分子量测定方法,该方法不需要标准品校正,有较高的精度,而GPC又可将混合组分按一定顺序洗脱出来,从而克服了光散射法不能测定混合物分子量的缺点,因此,GPC-MALLS越来越多的被用于多糖分子量测定。吴扬兰等[40]研究发现,GPC-MALLS可较准确测定香菇多糖的分子量并对构型进行分析。
3.2 单糖组成分析 单糖组成分析是研究多糖结构的基础,常以完全酸水解配合高效液相色谱法(HPLC),气相色谱法(GC),离子色谱法(HPAEC)等进行分析。2mol/L三氟乙酸可将多糖水解为单糖[41],但水解后的单糖无紫外吸收,也不能气化,必须经过衍生化才能进行分析。1-苯基-3-甲基-5-吡唑啉酮(PMP)是应用最多的衍生化试剂,经衍生化处理后,单糖在250nm附近有较强紫外吸收,以C18柱,紫外检测器即可对单糖组成进行分析[42],该方法灵敏,重现性较好。
气相色谱法灵敏度高,样品用量少,若与质谱法连用,则会大大地提高分析的准确度。但水解后的单糖极性大,难以气化,因而必须经过衍生,常将单糖衍生为糖腈乙酸酯衍生物[43]。
离子色谱法(HPAEC)是新发展的单糖组成分析方法,该方法不需要经过复杂的衍生化处理就可以进行分析。其基本原理为:糖类化合物具有电化学活性,在强碱溶液中(pH>12)呈离子状态,可以在阴离子交换柱上被保留从而被分离。常用0.01~0.2 mol/L NaOH,NaAC作梯度洗脱,以金电极的脉冲安倍检测器检测[44-45]。该方法非常灵敏,可检测pmol/L的糖[46]。
3.3 多糖键合结构分析
3.3.1 糖环类型及构型分析 单糖在自然界中以吡喃环或呋喃环的形式存在,借助红外光谱及核磁可分析单糖的成环类型。吡喃环在1010~1100cm-1之间有三个吸收峰,而呋喃环只有两个吸收峰[47]。同时可依据13C NMR数据确定糖环类型,呋喃环的C3和C5在δ82-84ppm间有信号,吡喃环的C3和C5化学位移小于δ80ppm[48]。单糖成环后会形成一个端基碳原子,有α和β两种构象,α-端基差向异构的C-H变角振动在(844±4)cm-1,H-1质子化学位移大于δ4.95ppm;而β-端基差向异构的C-H变角振动在(891±7)cm-1[49],H-1质子化学位移小于δ4.95ppm[50]。
3.3.2 糖残基类型及糖苷键连接位点分析 糖残基类型及糖苷键连接位点分析主要方法是甲基化反应与GC-MS法联用。甲基化反应将单糖残基中游离的羟基全部甲基化,然后将糖苷键水解,水解后羟基的位置,就是糖残基的连接位点。多糖甲基化方法主要包括Haworth法[51]、Kuhn法[52]、Purdie法、Needs法[53]和改良Haworth法等。样品甲基化完全后,完全水解为单糖,然后衍生化为部分甲基化糖醇乙酸酯,经GC-MS分析,与标准谱图进行比较,确定糖残基类型及糖苷键连接位点。随着NMR技术的发展,NMR也逐步引入到多糖结构研究中[54]。通过1H NMR异头氢的信号确定糖残基的数目。多糖由几种糖残基,则在1H NMR δ4.3-5.9ppm就有几个信号[55]。高碘酸氧化是用高碘酸为氧化剂的选择性氧化降解反应,反应过程中每断开一个C-C键消耗一份子高碘酸,通过测定高碘酸消耗量及甲酸生成量,可判断糖苷键的位置和支链多糖的分支数目等。同时,结合Smith降解法综合分析,有益于更好的获得多糖的一级结构信息。但随着GC-MS,2D NMR的发展,上述两种方法已较少使用。
3.3.3 糖苷键连接顺序分析 糖残基的连接顺序可以看作是高级结构的基础。基于多糖水解规律(吡喃糖残基比呋喃糖残基稳定解,己糖比戊糖稳定,1,6-糖苷键对酸水解较稳定,主链比支链稳定)的糖苷酶顺序水解法,选择性酸水解法[56]可用于获得主链、支链等小片段,再结合单糖组成、甲基化分析、1D NMR和2D NMR等方法共同用于糖残基连接顺序的研究。
4 展望
多糖的研究在近年来已取得较大突破,现代仪器分析技术与经典的化学分析方法结合在多糖结构解析上取得了长足的进步。但仍然存在一系列棘手问题,首先,在多糖的分离纯化方面,由于同一中药可能含有数种或数十种多糖,各种多糖性质相似,同时多糖分离纯化方法的重现性较差,因而要得到均一活性多糖组分并不容易。其次,多糖结构解析仍难度较大,当前对多糖结构解析多停留在解析一级结构,对多糖高级结构信息知之甚少,从而限制了寻求更加稳定,专属性更强、效率更高的分离纯化方法,更加制约了多糖构效关系及作用机制研究。在未来,多糖的研究将集中于寻找更加有效的结构解析方法,以此来推动高效率的分离纯化方法的建立和加快多糖作用机制研究。
参考文献
[1]TANG C,DING RX, SUN J, et al. The impacts of natural polysaccharides on intestinal microbiota and immune responses - a review [J]. Food Funct, 2019, 10(5): 2290-2312.
[2]YELITHAO K, SURAYOT U, LEE C, et al. Studies on structural properties and immune-enhancing activities of glycomannans from Schizophyllum commune [J]. Carbohydr Polym, 2019(218): 37-45.
[3]MAO G H, ZHANG Z H, FEI F, et al. Effect of Grifola frondosa polysaccharide on anti-tumor activity in combination with 5-Fu in Heps-bearing mice[J]. Int J Biol Macromol, 2019(121): 930-935.
[4]WANG Y, WANG S X, SONG R Z, et al. Ginger polysaccharides induced cell cycle arrest and apoptosis in human hepatocellular carcinoma HepG2 cells [J]. Int J Biol Macromol, 2019(123): 81-90.
[5]CHEN L, HUANG G L. The antiviral activity of polysaccharides and their derivatives [J]. Int J Biol Macromol, 2018(115): 77-82.
[6]HUANG G L,MEI X Y,HU J C. The antioxidant activities of natural polysaccharides [J]. Curr Drug Targets, 2017, 18(11): 1296-1300.
[7]ZHANG Q P, OLATUNJI O J, CHEN H X, et al. Evaluation of the anti-diabetic activity of polysaccharide from Cordyceps cicadae in experimental diabetic rats [J]. Chem Biodivers, 2018, 15(8):e1800219.
[8]趙嵩月,陈彤,张要武,等.醇提三七总皂苷副产物中三七多糖的提取及含量测定[J]. 华西药学杂志, 2011, 26(5): 481-483.
[9]刘贝贝,李小定,谭正林,等.菜籽饼粕中多糖的酸提取工艺优化[J]. 农业工程学报, 2006(11): 213-216.
[10]陈燊.橄榄多糖提取分离及其功能特性的研究[D]. 福州:福建农林大学, 2014.
[11]丁重阳,张笑然,张梁,等.姬松茸胞内多糖碱提取工艺[J]. 生物加工过程, 2008(5): 21-26.
[12]陈浩.菜籽多糖的提取、分离、结构及生物活性的研究[D]. 武汉:华中农业大学, 2007.
[13]杨佳琦,江洁,冀春阳,等,复合酶法提取云芝多糖及其抗氧化活性[J]. 食品工业科技, 2017, 38(23): 176-181.
[14]ALBOOFETILEH M, REZAEI M, TABARSA M, et al. Ultrasound-assisted extraction of sulfated polysaccharide from Nizamuddinia zanardinii: Process optimization, structural characterization, and biological properties [J]. J Food Process Eng, 2019, 42(2):530-536.
[15]LIANG X, JIA Q Y, X Y W, et al. Microwave extraction optimization using the response surface methodology of Fructus Meliae Toosendan polysaccharides and its antioxidant activity [J]. Int J Biol Macromol, 2018(118):1501-1510.
[16]黄生权,李进伟,宁正祥.微波-超声协同辅助提取灵芝多糖工艺[J]. 食品科学, 2010, 31(16): 52-55.
[17]朱俊玲. 超临界流体萃取芦荟多糖的研究[J]. 农产品加工, 2011(7): 67-68.
[18]赵子剑,连琰,王国全,等.正交实验法优化二氧化碳超临界流体萃取茯苓多糖工艺参数[J].时珍国医国药, 2008(7): 1628-1629.
[19]汪承德,迟俊枫,陆宇兰,等,高压脉冲电场提取杨树菇多糖工艺及其抗氧化研究[J]. 现代食品, 2019(6): 46-48.
[20]潘雪丰.铁皮石斛多糖Sevage法脱蛋白效果分析[J]. 亚热带农业研究, 2015, 11(4): 258-261.
[21]穆文静,杜玲,扈瑞平,等.钝顶螺旋藻多糖Sevage法脱蛋白工艺的研究[J].内蒙古石油化工, 2011, 37(10): 1-4.
[22]CHEN L,HUANG G L,HU J C. Preparation, deproteinization, characterization, and antioxidant activity of polysaccharide from cucumber (Cucumis saticus L.)[J]. Int J Biol Macromol, 2018(108):408-411.
[23]臧玉红,李仁杰.响应面法优化三氯乙酸脱除滑子菇粗多糖蛋白质的工艺[J]. 食品工业科技, 2014, 35(16): 243-247.
[24]李知敏,王伯初,周菁,等.植物多糖提取液的几种脱蛋白方法的比较分析[J]. 重庆大学学报(自然科学版), 2004(8): 57-59.
[25]LI S F, WANG A J, LIU L, et al. Effect of deproteinization methods on the antioxidant activity of polysaccharides extracted from Lentinus edodes stipe [J]. J Food Meas Charact, 2019, 13(2):867-876.
[26]胡庆娟,吴光杰,牛庆川,等.响应面试验优化木瓜蛋白酶法脱马齿苋多糖蛋白工艺[J]. 食品科学, 2018, 39(20): 246-252.
[27]许静.北苍术多糖的提取、性质及抗肿瘤活性研究[D]. 天津:天津医科大学, 2015.
[28]付学鹏,杨晓杰.植物多糖脱色技术的研究[J]. 食品研究与开发, 2007(11): 166-169.
[29]HE B L, GUO L Q,ZHENG Q W, et al. A simple and effective method using macro porous resins for the simultaneous decoloration and deproteinisation of Cordyceps militaris polysaccharides [J]. Int J Food Sci Tech, 2019, 54(5):1203-1205.
[30]马若影,李幼梅,邓志勇,等.大孔树脂对红心火龙果茎多糖脱色除蛋白及抗氧化活性的影响[J]. 热带作物学报, 2018, 39(7): 1297-1303.
[31]雷呈,王桂桢.山茱萸多糖大孔树脂脱色技术的优化[J]. 天然产物研究与开发,2016,28(7): 1116-1120.
[32]刘富岗,李汉伟,郑群杰,等.响应面法优选泽兰多糖的大孔吸附树脂纯化工艺[J].暨南大学学报(自然科学与医学版),2019,40(1):1-9.
[33]刘力萍,吴天祥,张宗启.灰树花胞外多糖不同脱色方法的研究[J].食品科技,2018,43(11):196-201.
[34]叶红,周春宏,曾晓雄,等.马尾藻多糖的膜分离纯化[J]. 湖北农业科学, 2011, 50(2): 375-377.
[35]谢红旗,周春山,杜邵龙,等.酶法提取、超滤分离香菇多糖新工艺研究[J]. 食品科学, 2007(4): 217-219.
[36]FENG S L, CHENG H R, ZHOU X, et al. Antioxidant and anti-aging activities and structural elucidation of polysaccharides from Panax notoginseng root [J]. Process Biochem, 2019(78):189-199.
[37]魏遠安,方积年.高效凝胶渗透色谱法测定多糖纯度及分子量[J]. 药学学报, 1989(7): 532-536.
[38]吕志华,于广利,赵峡,等.不同标准品对HPGPC法测定多糖相对分子质量的影响[J]. 中国新药杂志, 2002(3): 220~221.
[39]秦建鲜,黄锁义.中药多糖相对分子质量测定方法的概述[J]. 中国实验方剂学杂志, 2015, 21(14): 226-229.
[40]吴扬兰,王远亮,杨力.SEC-RI-MALLS技术在香菇多糖分子量与分子量分布分析方面的应用研究[J]. 药物分析杂志, 2011, 31(12): 2256-2259.
[41]杨兴斌,赵燕,周四元,等. 柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J]. 分析化学, 2005(9): 1287-1290.
[42]ZHANG J J, ZHANG Q B, WANG J, et al. Analysis of the monosaccharide composition of fucoidan by precolumn derivation HPLC [J]. Chin J Oceanol Limn, 2009, 27(3):578-582.
[43]白娣斯,张静.气相色谱分析多糖衍生化方法的研究与比较[J]. 食品工业科技, 2011, 32(2): 322-324.
[44]乐胜锋,王尉,王雅萱,等.离子色谱-脉冲安培法测定芦荟多糖中7种单糖的含量[J]. 色谱, 2019, 37(3): 319-324.
[45]柴银,王虹,刘雅萌,等.离子色谱测定多糖的单糖组成的方法学研究及其应用[J]. 药物生物技术, 2016, 23(4): 332-336.
[46]刘庆生,张萍,范志影.离子色谱法检测糖[J]. 现代科学仪器, 2005(1): 75-78.
[47]WU M,WU Y, ZHOU J, et al. Structural characterization of a water-soluble polysaccharide with high branches from the leaves of Taxus chinensis var. mairei[J]. Food Chemistry, 2009(113): 1020-1024.
[48]AHRAZEM O, PRIETO A, LEAL A, et al. Fungal cell wall galactomannan isolated from apodous deciduous [J]. Carbohydr Res, 2002, 337(16): 1503-1506.
[49]SI H Y, CHEN N F,CHEN N D, et al. Structural characterization of a water-soluble polysaccharide from tissue-cultured Dendrobium huoshanense C.Z. Tang et S.J. Cheng[J]. Nat Prod Res, 2018, 32(3):252-260.
[50]CORSARO M M, DE CASTRO C, NALDI T, et al. 1H and 13C NMR characterization and secondary structure of the K2 polysaccharide of Klebsiella pneumoniae strain 52145[J]. Carbohyd Res, 2005, 340(13): 2212-2217.
[51]HAKOMORI S-I. A Rapid permethylation of glycolipid, and polysaccharide catalyzed by methylsulfinyl carbanion in dimethyl sulfoxide [J]. J Biochem, 1964(55): 205-208.
[52]HARRIS P, HENRY R, B. BLAKENEY A, et al. An improved procedure for the methylation analysis of oligosaccharides and polysaccharides [J]. Carbohyd Res, 1984, 127(1):59-73.
[53]NEEDS P W, SELVENDRAN R R. Avoiding oxidative degradation during sodium hydroxide/methyl iodide-mediated carbohydrate methylation in dimethyl sulfoxide [J]. Carbohyd Res, 1993, 245(1): 1-10.
[54]DUUS J, GOTFREDSEN C H, BOCK K. Carbohydrate structural determination by NMR spectroscopy: modern methods andlimitations [J]. Chem Rev, 2000(12):4589-4613.
[55]葉立斌, 张劲松, 潘迎捷. 食药用菌多糖结构解析中的核磁共振技术[J]. 食用菌学报, 2007(4): 68-75.
[56]谢明勇, 殷军艺, 聂少平. 天然产物来源多糖结构解析研究进展[J]. 中国食品学报, 2017, 17(3): 1-19.
