金银花提取物对冷却肉中假单胞菌黏附性的影响
2020-04-07王琳李宇轩范维李贺楠高晓月陈淑敏
王琳 李宇轩 范维 李贺楠 高晓月 陈淑敏
摘 要:研究冷却肉中假单胞菌的黏附能力及金银花提取物的降黏附效果。结果表明:从15 份市售冷却肉中分离得到46 株假单胞菌,经16S rDNA结合VITEK 2系统鉴定为恶臭假单胞菌22 株,占47.8%;荧光假单胞菌10 株,占21.7%;铜绿假单胞菌6 株,占13.0%;浅黄假单胞菌8 株,占17.4%;33 株(71.7%)假单胞菌具有黏附能力,具有强黏附能力的菌株占17.4%,其中恶臭假单胞菌数量最多;金银花提取物能够降低4 种假单胞菌的黏附能力,且对恶臭假单胞菌5-3和铜绿假单胞菌5-1作用效果更强,作用效果与金银花提取物质量浓度有关;金银花提取物质量浓度高于最小抑菌质量浓度(minimum inhibitory concentration,MIC)时,主要通过抑制菌体生长、减少胞外多糖产生而降低假单胞菌的黏附能力;金银花提取物质量浓度低于MIC时,主要通过溶解菌体胞外多糖、增强通透性、降低均匀度而降低假单胞菌的黏附能力。
关键词:冷却肉;假单胞菌;黏附能力;金银花提取物
Abstract: The adhesion ability of Pseudomonas strains from chilled pork and the inhibitory effect of Flos Lonicerae Japonicae extract on it was analyzed in this study. A total of 46 strains of Pseudomonas strains were isolated from 15 commercial chilled pork samples, including 22 strains of Pseudomonas putida (47.8%), 10 strains of Pseudomonas fluorescens (21.7%), 6 strains of Pseudomonas aeruginosa (13.0%), and 8 strains of Pseudomonas luteola (17.4%), as identified by 16S rDNA sequence analysis and VITEK 2 system. In total 33 (71.7%) of them were found to have adhesion ability, 17.4% of which had strong adhesion ability, mostly Pseudomonas putida. Flos Lonicerae Japonicae extract could reduce the adhesion ability of the four Pseudomonas species, and had stronger effect on P. putida 5-3 and P. aeruginosa 5-1 in a concentration-dependent manner. At concentrations higher than the minimum inhibitory concentration (MIC), it excerted its effect mainly by inhibiting the growth of bacteria and reducing the production of extracellular polysaccharides. At concentrations lower than the MIC, its excerted its effect mainly by dissolving extracellular polysaccharides, consequently increasing the membrane permeability and reducing uniformity.
Keywords: chilled pork; Pseudomonas; adhesion ability; Flos Lonicerae Japonicae extract
中图分类号:TS251.1 文獻标志码:A 文章编号:1001-8123(2020)02-0020-07
目前,人们对致病菌在食品上的黏附特性研究较多,对腐败菌在食品上的黏附特性及黏附的控制方法研究较少[5],研究冷却肉中假单胞菌的黏附能力及控制方法对冷却肉保鲜具有重要意义。
黏附能力的形成与菌体分泌胞外多糖有关,胞外多糖能够与水、蛋白质、脂类形成膜状结构,包裹在菌体外层,增加菌体耐药性和抗胁迫能力[6]。虽然黏附能力是在特定初始菌浓度、培养温度、培养时间[7-8]、培养基质和表面材质[9-10]等研究体系中测得,但与胞外多糖的差异性表达及菌株基因型存在相关性[11-12],是菌株自身的固有属性[13]。
植物提取物中含有多糖类活性物质,可通过结合多糖基质降低菌群的黏附能力,且能够通过荧光显微镜直接观察到[14-15]。植物提取物对菌体黏附能力的作用效果也与菌株类型、生长状态、多糖物质组成和含量有关。金银花是一种较为常见的中药材,具有抑菌[16]、抗炎[17]、抗内毒素等药理作用[18]。金银花早在2012年就被原国家卫生和计划生育委员会批准作为药食同源食品原料,研究金银花提取物对冷却肉中假单胞菌黏附能力的作用与机理,有助于拓宽新资源食品应用范围,也能够为冷却肉保鲜提供理论支持。
微生物引起的食品安全事件多与其黏附能力有关[19-20]。
本研究从15 份市售冷却肉中分离假单胞菌并对其进行鉴定,利用微孔板法测定菌株黏附能力,研究冷却肉中假单胞菌的类型及黏附能力,并研究金银花提取物对假单胞菌黏附能力的影响。
1 材料与方法
1.1 材料与试剂
冷却肉购自北京大型超市和农贸市场,采购信息如表1所示。
营养琼脂培养基、胰酪胨大豆肉汤(tryptic soy broth,TSB)培养基、LB培养基、氧化酶试剂 北京陆桥技术股份有限公司;假单胞菌显色培养基 法国科玛嘉公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;异硫氰酸荧光素标记刀豆蛋白A(fluoresce inisothiocyanate-conjugated concanavalin A,FITC-conA) 美国Sigma公司;金银花提取物粉末 南京泽朗生物科技有限公司。
1.2 仪器与设备
BPC-150F生化培养箱 上海一恒科学仪器有限公司;MULTISKAN GO 1510酶标仪 美国Thermo公司;BH2显微镜、BX 51荧光显微镜 日本Olympus公司;MQD-S2R恒温振荡培养箱 上海旻泉仪器有限公司;VITEK 2 Compact全自动微生物鉴定系统 生物梅里埃(中国)有限公司。
1.3 方法
1.3.1 冷却肉中假单胞菌的分离
多点取样,共取25 g冷却肉样品,加入225 mL无菌生理盐水,用拍击式均质器拍打1 min ,取200 μL稀释液涂布至假单胞菌显色培养基,(30±1) ℃培养48 h。挑取单菌落划线至假单胞菌显色培养基,30 ℃培养24 h。将蓝绿色菌落在营养琼脂平板上进行3 次划线分离纯化,用LB培养基过夜活化单菌落,4 000 r/min离心10 min,用无菌生理盐水重悬菌株,加入体积分数20%甘油,菌株于-80 ℃冷冻保存[21]。
1.3.2 菌株鉴定
将筛选出的菌株进行革兰氏染色、形态观察和氧化酶实验,将鉴定结果为假单胞菌属的菌株用16S rDNA进行确证。引物由深圳华大基因科技有限公司合成。上游引物(27F):5-AGAGTTTGATCCTGGCTCAG-3;下游引物(1492R):5-GGTTACCTTGTTACGACTT-3;以细菌总DNA为模板进行聚合酶链式反应(polymerase chain reaction,PCR)擴增。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1.5 min;30 个循环;72 ℃保温5 min。PCR产物送深圳华大基因科技有限公司测序。测序结果在NCBI网站进行Blast比对,用MEGA 5软件构建系统发育树[22],利用VITEK 2 Compact全自动微生物鉴定系统作进一步鉴定[23]。
1.3.3 假单胞菌黏附能力测定
将2 次过夜活化的菌悬液在600 nm波长处的光密度(optical density,OD600 nm)调整至0.5,移取5 μL菌悬液至含有195 μL TSB培养基的96 孔酶标板中,每株菌做6 个平行,以加入5 μL无菌生理盐水作空白对照;将上述96 孔板在(30±1)℃条件下培养24 h,用无菌生理盐水清洗孔板3 次去除浮游菌,用200 μL甲醇固定15 min,吸出甲醇并晾干;每孔加入200 μL 1 g/mL草酸铵结晶紫溶液染色5 min,吸出染液后用流水冲洗孔板至滴水无色;将孔板自然晾干后每孔加入200 μL体积分数33%乙酸,用酶标仪测定OD655 nm[24-25]。
OD655 nm反映菌株与接触表面的黏附程度,依据临界OD655 nm(ODc)对黏附能力进行分类,表示为相对形成单元(relative forming unit,RU)。RU按式(1)计算。
1.3.4 金银花提取物对假单胞菌黏附能力的影响
参考Andreia[28]、刘永吉[29]等的方法,利用微量肉汤稀释法测定最小抑菌质量浓度(minimum inhibitory concentration,MIC)。将195 μL用TSB培养基稀释的金银花提取物溶液加入到96 孔板中,金银花提取物质量浓度分别为100、50、25、12.5、6.25、3.125、1.563、0.781、0.391、0.195 mg/mL,再分别接种5 μL OD600 nm=0.5的菌悬液。以接菌但不含金银花提取物的TSB培养基作培养基对照,以不接菌的无菌生理盐水作空白对照。30 ℃恒温培养24 h。通过观察判断,以明显不长菌的孔对应的金银花提取物溶液质量浓度为MIC。在MIC实验基础上选择所有澄清的孔,将其培养液稀释100 倍后取0.2 mL涂布于假单胞菌显色培养基琼脂平板,30 ℃恒温培养24 h,最小杀菌质量浓度(minimum bactericidal concentration,MBC)为菌落数不超过5的孔对应质量浓度中的最低质量浓度[30]。
根据测得的MIC,用TSB液体培养基稀释金银花提取物溶液至以下质量浓度:1/4×MIC、1/2×MIC、1×MIC、2×MIC、4×MIC、8×MIC、16×MIC、32×MIC、64×MIC、128×MIC,分别取200 μL不同质量浓度金银花提取物溶液加入到96 孔板,每个质量浓度重复8 孔。以等体积不含金银花提取物的TSB培养基为对照,30 ℃培养24 h。按照1.3.3节的方法测定菌株黏附能力,并按式(2)计算清除率。
1.3.5 荧光显微镜表观成像检测
在24 孔板中每孔放1 个无菌盖玻片(直径15 mm),加入1 mL TSB培养基。实验孔每孔加入5 μL OD600 nm=0.5的菌悬液,30 ℃培养24 h;将菌液吸出,用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗孔板3 次后,分别添加1 mL金银花提取物质量浓度为50、25、12.5、6.25、0 mg/mL的TSB培养基;以不接菌但加入金银花提取物的TSB培养基作对照,每组3 个复孔。再将24 孔板置于30 ℃培养24 h;吸出菌液,用PBS清洗孔板3 次,每次3~5 min;加入2.5 g/100 mL戊二醛溶液1 mL,固定2 h后再用PBS清洗孔板3 次;从玻片边缘吸干水分,在玻片上滴加50 μg/mL的FITC-ConA,置于4 ℃避光染色30 min后,用荧光显微镜获取图像。
1.4 数据处理
采用Microsoft Excel软件进行数据处理,采用Origin 7.5软件作图。
2 结果与分析
2.1 冷却肉中假单胞菌的鉴定
将显色培养基上呈现蓝绿色的菌落进行氧化酶实验和革兰氏染色。结果表明,氧化酶实验呈阳性的革兰氏阴性杆菌共46 株,16S rDNA鉴定结果均为假单胞菌属。假单胞菌属中的不同种间相似性较大,简单的生理生化和16S rDNA鉴定难以确定菌株所属的种。VITEK 2 Compact全自动微生物鉴定系统是根据生化反应结果与库中标准菌株进行比对[31-32]。
由表2可知,46 株假单胞菌中包括恶臭假单胞菌22 株,占47.8%;荧光假单胞菌10 株,占21.7%;浅黄假单胞菌8 株,占17.4%;铜绿假单胞菌6 株,占13.0%。VITEK 2鉴定结果是由仪器根据生化反应的真实性作出判断,菌株的实测生化反应与假单胞菌属的典型反应符合度均在85%以上,结果可信度较高。
2.2 冷却肉中假单胞菌的黏附能力测定结果
46 株假单胞菌中,33 株具有黏附能力,占71.7%。根据鉴定结果将菌株以菌种名称+菌株编号命名。由表3可知:具有黏附能力的33 株假单胞菌中,恶臭假单胞菌共17 株,具有强黏附能力的3 株为Pse. putida 2-4、Pse. putida 3-7、Pse. putida 5-3;浅黄假单胞菌共5 株,具有强黏附能力的2 株为Pse. luteola 8-4、Pse. luteola 7-6;铜绿假单胞菌共4 株,仅1 株(Pse.aeruginosa 5-1)具有强黏附能力;荧光假单胞菌共7 株,具有强黏附能力的2 株为Pse. fluorescens 3-2、Pse. fluorescens 10-3。从4 种类型假单胞菌中各选择1 株用于后续研究。
由表4可知:在具有黏附能力的33 株假单胞菌中,具有强黏附能力的菌株占17.4%,具有中等黏附能力的菌株占43.5%,具有弱黏附能力的菌株占10.9%;在具有黏附能力的菌株中,恶臭假单胞菌数量最多,占37.0%、浅黄假单胞菌占10.9%、铜绿假单胞菌占8.7%、荧光假单胞菌占15.2%,因此,恶臭假单胞菌对黏附能力贡献最大,后期应重点对其进行研究。
2.3 金银花提取物对假单胞菌黏附能力的影响
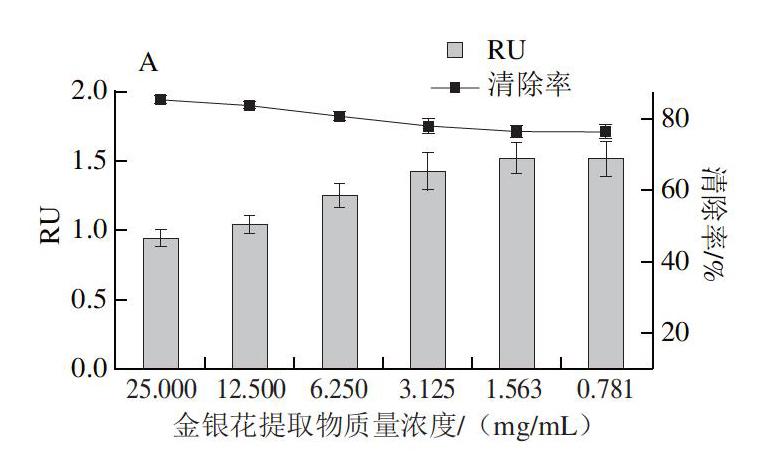
由表5~6可知,冷却肉中的假单胞菌对金银花提取物均具有敏感性。质量浓度12.5 mg/mL金银花提取物可以很好地抑制Pse. luteola 8-4和Pse. aeruginosa 5-1生长,质量浓度25 mg/mL金银花提取物能抑制4 种假单胞菌生长,金银花提取物对Pse. luteola 8-4和Pse. aeruginosa 5-1的MIC为12.5 mg/mL,对Pse. putida 5-3和Pse. fluorescens 3-2的MIC为25 mg/mL。金银花提取物对Pse. putida 5-3和Pse. aeruginosa 5-1的MBC为50 mg/mL,对Pse. luteola 8-4和Pse. fluorescens 3-2的MBC为25 mg/mL。因此,一定质量浓度的金银花提取物对4 种假单胞菌具有殺菌抑制效果。
在低于MIC的亚抑菌质量浓度条件下进行金银花提取物对上述4 种假单胞菌黏附能力的清除实验。
由图1可知,金银花提取物具有降低假单胞菌黏附能力的效果。随着金银花提取物质量浓度的增加,冷却肉中4 种假单胞菌的RU均逐渐降低。在金银花提取物质量浓度为MIC时,其对Pse. putida 5-3和Pse. aeruginosa 5-1的清除率均高于80%,且金银花提取物对Pse. putida 5-3和Pse. aeruginosa 5-1的作用效果强于Pse. luteola 8-4和Pse. fluorescens 3-2。
2.4 荧光显微镜法观察金银花提取物对假单胞菌生物被膜的作用
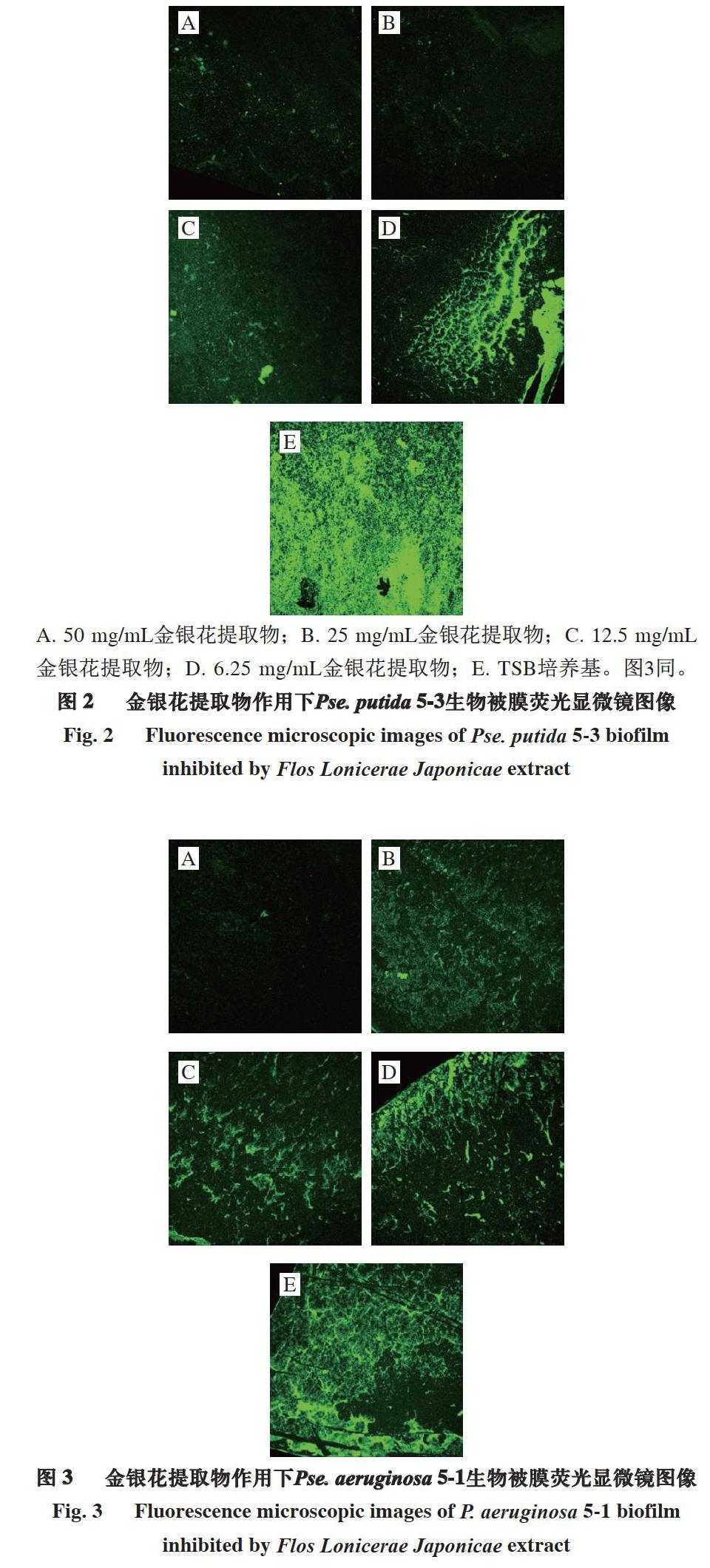
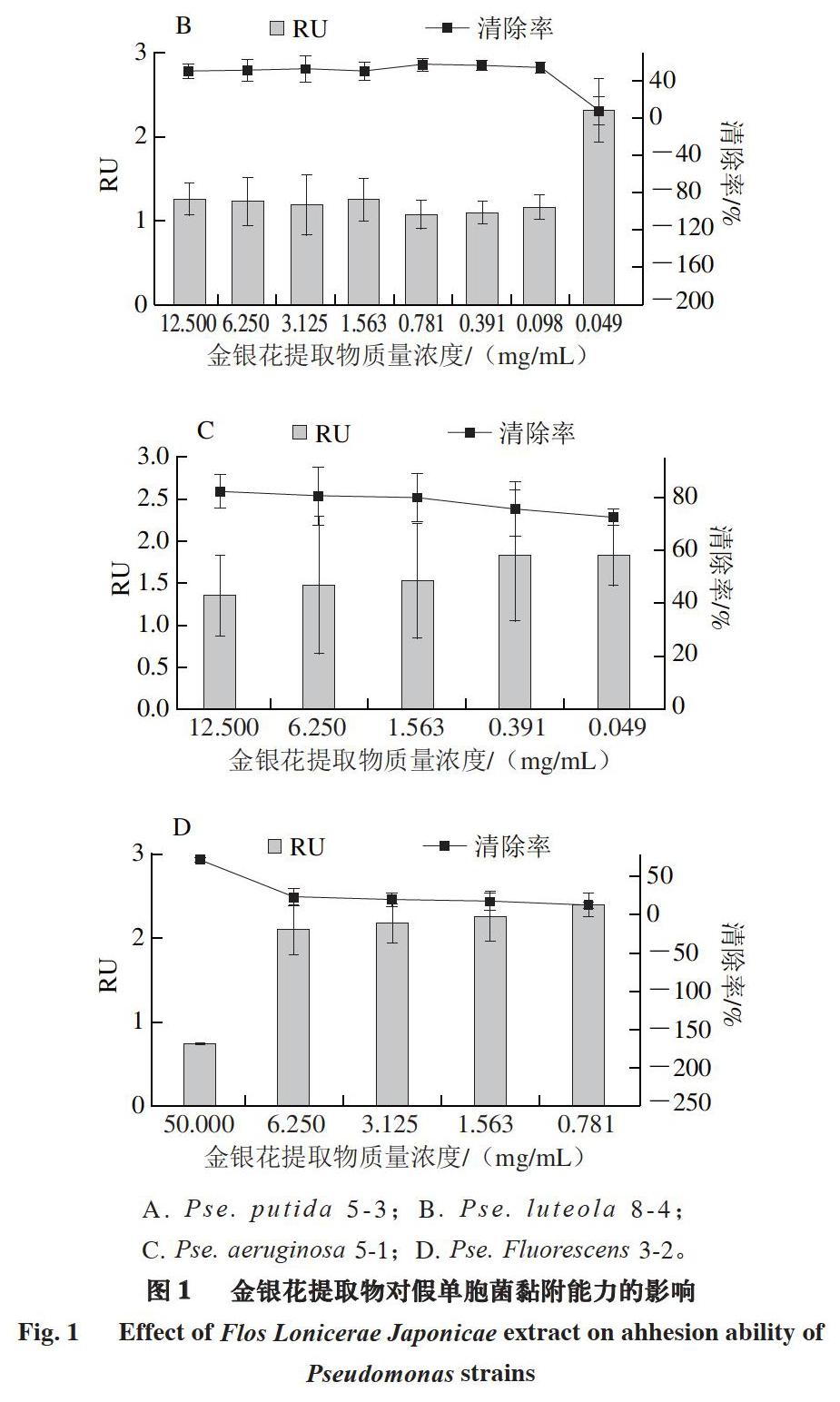
荧光染料FITC标记的ConA与细菌的胞外多糖特异结合并呈绿色荧光,荧光信号的强弱与多糖黏附量有关,多糖黏附量增加,荧光信号积累增强。利用荧光显微镜检测金银花提取物作用下Pse. putida 5-3和Pse. aeruginosa 5-1的胞外多糖。由图2~3可知:未添加金银花提取物的TSB培养基中生长的菌体堆积形成褶皱、沟壑状立体结构;随着金银花提取物质量浓度增加,荧光图像通透性增加,表现为沟壑状结构消失,褶皱逐渐减少。图像明显变亮表明多糖黏附量增加,与2.3节中得出的结论一致,因此荧光显微镜观察能够直观验证2.3节通过测定数值得出的结论,金银花提取物能够降低冷却肉中假单胞菌的黏附能力。
A. 50 mg/mL金银花提取物;B. 25 mg/mL金银花提取物;C. 12.5 mg/mL金银花提取物;D. 6.25 mg/mL金银花提取物;E. TSB培养基。图3同。
金银花提取物降低假单胞菌黏附能力的作用机制也能够通过荧光显微镜观察结果体现。在金银花提取物质量浓度为MIC(Pse. putida 5-3为25 mg/mL、Pse. aeruginosa 5-1为12.5 mg/mL)时,Pse. putida 5-3和Pse. aeruginosa 5-1菌体生长受到抑制,无法聚集黏附。在金银花提取物质量浓度50 mg/mL条件下,菌体产生的荧光信号很弱,菌体分泌胞外多糖均较少,仅可见零散分布的少数菌体,因此该质量浓度条件下金银花提取物对菌体生长具有明显抑制作用,这与2 种菌MBC为50 mg/mL的测定结果一致。金银花提取物质量浓度为25 mg/mL时,Pse. aeruginosa 5-1表面形成大范围聚集,但未见立体结构,而Pse. putida 5-3未见明显聚集,金银花提取物质量浓度12.5 mg/mL时才形成明显聚集。在金银花提取物质量浓度6.25 mg/mL条件下,菌体大量黏连成网状结构,且堆积形成沟壑。
在高于金銀花提取物对Pse. putida 5-3的MIC时(图2A),金银花提取物对Pse. putida 5-3的作用主要是通过抑制菌体生长而降低菌体黏附能力;在低于金银花提取物对Pse. putida 5-3的MIC时(图2C、2D),金银花提取物质量浓度降低导致菌体黏连堆积而成的结构立体性增强。金银花提取物对Pse. aeruginosa 5-1的作用效果也具有相似规律,高质量浓度金银花提取物抑制菌体生长,随金银花提取物质量浓度降低,其对菌体的抑制作用减弱。从MIC(12.5 mg/mL)开始,金银花提取物的作用体现在影响Pse. aeruginosa 5-1黏连堆积形成的立体结构,对菌体生长的抑制效果较微弱。菌体能够黏连堆积主要是由于多糖的存在,而金银花提取物的主要功能性成分是绿原酸等多糖,因此能够产生相似相溶作用,导致胞外多糖分布均匀度降低、改变胞外多糖通透性,从而减少菌体黏附聚集,降低黏附能力。
3 结 论
鉴定冷却肉中恶臭假单胞菌、铜绿假单胞菌、荧光假单胞菌和浅黄假单胞菌等46 株菌,通过临界OD值法确定具有黏附能力的菌株占总数的71.7%,具有强黏附能力的菌株占总数的17.4%,其中恶臭假单胞菌黏附能力最强,能够为冷却肉保鲜提供理论支持。本研究结果证明金银花提取物可明显降低Pse. putida 5-3和Pse. aeruginosa 5-1的黏附能力,其作用效果与金银花提取物质量浓度有关,并从表观成像的角度阐释金银花提取物影响假单胞菌黏附能力的作用机制,为研究开发应用于肉制品保鲜的植物资源提供新思路。
参考文献:
[1] 赵丽珺, 谢晶, 乔丽君. 冷却猪肉中特定腐败菌的靶向筛选[J]. 食品科学, 2014, 35(9): 174-180. DOI:10.7506/spkx1002-6630-201409035.
[2] 李苗云, 赵改名, 张建威, 等. 冷却猪肉贮藏过程中主要腐败菌的聚类分析[J]. 中国农业科学, 2011, 44(12): 2531-2537. DOI:10.3864/j.issn.0578-1752.2011.12.015.
[3] GIAOURIS E, HEIR E, HEBRAUD M, et al. Attachment and biofilm formation by foodborne bacteria in meat processing environments: causes implications, role of bacterial interactions and control by alternative novel methods[J]. Meat Science, 2014, 97(3): 298-309. DOI:10.1016/j.meatsci.2013.05.023.
[4] Wang Huhu, Zhang Xinxiao, Zhang Qiuqin, et al. Comparison of microbial transfer rates from Salmonella spp. biofilm growth on stainless steel to selected processed and raw meat[J]. Food Control, 2015, 50: 574-580. DOI:10.1016/j.foodcont.2014.09.049.
[5] 陈小雪, 陈晶瑜, 韩北忠. 食品加工过程中细菌生物被膜的危害及控制[J]. 中国酿造, 2016, 35(1): 1-4. DOI:10.11882/j.issn.0254-5071.2016.01.001.
[6] HENRIQUES A R, FRAQUEZA M J. Biofilm-forming ability and biocide susceptibility of Listeria monocytogenes, strains isolated from the ready-to-eat meat-based food products food chain[J]. LWT-Food Science and Technology, 2017, 81: 180-187. DOI:10.1016/j.lwt.2017.03.045.
[7] DEWANTI R, WONG A C L. Influence of culture conditions on biofilm formation by Escherichia coli O157:H7[J]. International Journal of Food Microbiology, 1995, 26(2): 147-164. DOI:10.1016/0168-1605(94)00103-d.
[8] 邓旗, 孙力军, 王雅玲, 等. 环境条件对腐败希瓦氏菌生物被膜形成能力的影响[J]. 中国食品学报, 2013, 13(10): 43-50. DOI:10.3969/j.issn.1674-7712.2014.17.023.
[9] DANIEL V S, HABIMANA O, HOLCK A. Impact of food-related environmental factors on the adherence and biofilm formation of natural Staphylococcus aureus isolates[J]. Current Microbiology, 2013, 66(2): 110-121. DOI:10.1007/s00284-012-0247-8.
[10] WANG Huhu, CAI Linlin, LI Yunhan, et al. Biofilm formation by meat-borne Pseudomonas fluorescens on stainless steel and its resistance to disinfectants[J]. Food Control, 2018, 91: 397-403. DOI:10.3390/ijms17070979.
[11] 杨帅. 铜绿假单胞菌黏附表型及其差异的研究[D]. 合肥: 中国科学技术大学, 2018: 79-85.
[12] GALVALO N N, CHIARINI E, DESTRO M T, et al. PFGE characterisation and adhesion ability of Listeria monocytogenes isolates obtained from bovine carcasses and beef processing facilities[J]. Meat Science, 2012, 92(4): 635-643. DOI:10.1016/j.meatsci. 2012.06.011.
[13] YANG Xiaolong, SHA Kaihui, XU Guangya, et al. Subinhibitory concentrations of allicin decrease uropathogenic Escherichia coli (UPEC) biofilm formation, adhesion ability, and swimming motility[J]. International Journal of Molecular Sciences, 2016, 17(7): 979-990. DOI:10.3390/ijms17070979.
[14] 陈俭清, 周永辉, 杨艳北, 等. 中药水提物对体外猪链球菌生物被膜作用的试验[J]. 中国兽医杂志, 2016, 52(11): 14-16.
[15] 邬丽红, 陈一强, 孔晋亮, 等. 金银花主要活性成分对烟曲霉生物膜的体外影响[J]. 中国现代医药杂志, 2014, 16(6): 1-4. DOI:10.3969/j.issn.1672-9463.2014.06.001.
[16] 高铎, 马峰涛, 孙鹏. 金银花提取物的生物学功能及其在养殖中的应用[J]. 动物营养学报, 2019, 31(5): 2045-2051.
[17] 王芳, 黄超培, 李彬, 等. 复方蜂胶金银花提取物对炎症大鼠和小鼠的抗炎作用[J]. 广西医学, 2018, 40(16): 1833-1836. DOI:10.11675/j.issn.0253-4304.2018.16.17.
[18] 路俊仙, 梁瑞雪, 林慧彬. 金银花抗流感病毒作用研究进展[J]. 现代中药研究与实践, 2018, 32(5): 77-81.
[19] GHOLAMI S, TABATABAEI M, SOHRABI N. Comparison of biofilm formation and antibiotic resistance pattern of Pseudomonas aeruginosa, in human and environmental isolates[J]. Microbial Pathogenesis, 2017, 109: 94-98. DOI:10.1016/j.micpath.2017. 05.004.
[20] VATAN A, SALTOGLU N, YEMISEN M, et al. Association between biofilm and multi/extensive drug resistance in diabetic foot infection[J]. International Journal of Clinical Practice, 2018, 72(3): 1-7.DOI:10.1111/ijcp.13060.
[21] 黃家乐, 王玥, 何睿, 等. 制药企业微生物实验室菌种保存方法的探讨[J]. 中国药事, 2017, 31(9): 1007-1011. DOI:10.16153/j.1002-7777.2017.09.008.
[22] 王琳, 曹雁平, 张单单, 等. 真空包装麻酱中腐败菌的分离鉴定及对麻酱品质的影响[J]. 中国食品学报, 2017, 17(6): 187-194. DOI:10.16429/j.1009-7848.2017.06.025.
[23] 张吉红, 陆承平. 嗜水气单胞菌生物被膜对其耐药性的影响[J]. 微生物学报, 2003, 43(4): 498-502. DOI:10.3321/j.issn:0001-6209.2003.04.016.
[24] KOCOT A M, OLSZEWSKAl M A. Biofilm formation and microscopic analysis of biofilms formed by Listeria monocytogenes, in a food processing context[J]. LWT-Food Science and Technology, 2017, 84: 47-57. DOI:10.1016/j.lwt.2017. 05.042.
[25] MALEGORI C, FRANZETTI L, GUIDETTI R, et al. GLCM, an image analysis technique for early detection of biofilm[J]. Journal of Food Engineering, 2016, 185: 48-55. DOI:10.1016/j.jfoodeng.2016.04.001.
[26] 桂中玉, 李琳, 李冰, 等. 金黄色葡萄球菌耐药性与生物被膜能力的鉴定[J]. 现代食品科技, 2014, 30(3): 69-75.
[27] LAURA B R, LUCIANA R S, VINICIUS Z C, et al. Quantification of biofilm production on polystyrene by Listeria, E. coli and Staphylococcus aureus isolated from poultry slaughterhouse[J]. Brazilian Journal of Microbiology, 2010, 41: 1082-1085. DOI:10.1590/S1517-83822010000400029.
[28] ANDREIA D, ALVES A C, Susana F, et al. Resveratrol inclusion complexes: antibacterial and anti-biofilm activity against Campylobacter spp. and Arcobacter butzleri[J]. Food Research International, 2015, 77: 244-250. DOI:10.1016/j.foodres.2015.05.047.
[29] 劉永吉, 范玉慧, 郭红辉. 桃金娘果实花色苷提取物对两种假单胞菌生物被膜的抑制[J]. 食品工业科技, 2018, 39(12): 28-31. DOI:10.13386/j.issn1002-0306.2018.12.006.
[30] 朱军莉, 王慧敏, 王桂洋, 等. 茶多酚和葡萄籽提取物对假单胞菌抗生物被膜的抑制作用[J]. 中国食品学报, 2016, 16(1): 84-90. DOI:10.16429/j.1009-7848.2016.01.012.
[31] CUENCAESTRELLA M, GOMEZLOPEZ A, ALASTRUEYIZQUIERDO A, et al. Comparison of the VITEK 2 antifungal susceptibility system with the clinical and laboratory standards institute (CLSI) and European Committee on Antimicrobial Susceptibility Testing (EUCAST) broth microdilution reference methods and with the sensitire yeast-one and etest techniques for in vitro detection of antifungal resistance in yeast isolates[J]. Journal of Clinical Microbiology, 2010, 48(5): 1782-1786. DOI:10.1128/JCM.02316-09.
[32] BOSSHARD P P, ZBINDEN R, ABELS S, et al. 16S rRNA gene sequencing versus the API 20 NE system and the VITEK 2 ID-GNB card for identification of non fermenting Gram-negative bacteria in the clinical laboratory[J]. Journal of Clinical Microbiology, 2006, 44(4): 1359-1366. DOI:10.1128/jcm.44.4.1359-1366.2006.
