大黄鱼HIF-1α基因的克隆鉴定与表达分析
2020-04-06母尹楠李婉茹何亮华陈新华
母尹楠 李婉茹 何亮华 陈 炯 陈新华
(1. 宁波大学海洋学院,宁波 315832; 2. 福建农林大学海洋研究院,福建省海洋生物技术重点实验室,福州 350002)
低氧诱导因子(Hypoxia-inducible factor, HIF)是一类调节细胞和组织低氧应答的关键分子, 包括HIF-1、HIF-2和HIF-3[1]。其中, HIF-1是由HIF-1α和HIF-1β 两个亚基组成的具有转录激活活性的异源二聚体。HIF-1α的分子量约为120 kD, 在细胞内的含量受到氧浓度的影响, 是HIF-1的功能调节亚基; HIF-1β在细胞内的表达量相对稳定, 不受氧浓度影响[2]。目前, 对于哺乳动物HIF-1α蛋白的结构和功能已经研究得较为透彻, HIF-1α一般具有1个基础的HLH/PAS结构区, 主要负责HIF-1α与HIF-1β二聚化, 以及与靶基因启动子的调控区结合, 调节靶基因表达; 在HIF-1α序列的中部存在一个氧依赖性降解结构域(ODDD), 控制其常氧降解, 对调节HIF-1活性起关键作用; 羧基末端含有2 个反式激活结构域(CTAD)和1个保守的天冬氨酸残基, 可以被缺氧诱导因子抑制因子(FIH-1)识别, 阻碍HIF-1α与转录辅激活子CBP/p300结合[3,4]。在常氧状态下,细胞质内的HIF-1α蛋白ODDD结构域中的2个脯氨酸残基(Pro402和Pro564), 被脯酰胺羟化酶(PHD)催化而发生羟基化, 导致HIF-1α与肿瘤抑制基因蛋白(Von Hippel-Lindau tumor suppressor, VHL)相互作用, 通过泛素蛋白酶体通路被降解[5,6]。当低氧发生时, 脯氨酰基的羟基化过程受到抑制, 稳定状态的HIF-1α蛋白在细胞内累积, 并向细胞核转移与HIF-1β结合形成二聚体HIF-1, HIF-1再与靶基因表达调控区的低氧应答元件(HRE)结合, 从而调控血管生成、红细胞生成、糖酵解等通路相关基因的表达[7—9]。
近年来研究发现, 低氧还影响多个免疫过程,包括免疫细胞迁移、凋亡、病原吞噬、抗原递呈以及细胞因子和抗菌因子的产生[9]。HIF-1α在多种免疫细胞类群中都有表达, 如中性粒细胞、巨噬细胞、树突状细胞、T淋巴细胞、B淋巴细胞等, 并参与调控这些免疫细胞增值、发育和功能, 是协调低氧应答与免疫应答的重要因子[10]。特异性地敲除小鼠(Mus musculus)巨噬细胞HIF-1α基因会干扰其ATP的产生, 对巨噬细胞存活、迁移、聚集以及杀菌活性都会产生不利影响[11]。相反, 活化HIF-1α会促进巨噬细胞向感染部位迁移, 增强巨噬细胞的吞噬能力, 并增加细胞因子的表达[12]。敲除小鼠HIF-1α基因引发T淋巴细胞细胞周期阻滞和B淋巴细胞凋亡, 影响T、B淋巴细胞的发育[13—15]。HIF-1α直接调控一些免疫基因的表达, 例如IFN-γ基因的启动子区域含有一个HRE位点, 实验已经证实低氧活化的HIF-1α能够与之结合, 增强IFN-γ基因的表达[16]。此外, HIF-1α还能够诱导趋化因子CCL5和CXCL12的产生[17]。目前,HIF-1α的序列和分子特征在多种鱼类中都有报道, 包括鳜(Siniperca chuatsi)[18]、大弹涂鱼(Boleophthalmus pectinirostris)[19]、青海湖裸鲤(Gymnocypris przewalskii)[20]、斑马鱼(Danio rerio)[21]等, 结果表明鱼类HIF-1α的功能结构域和哺乳动物相比高度保守。但是, 关于HIF-1α在鱼类免疫应答中的功能仍鲜有报道, 仅发现鳜HIF-1α蛋白过表达显著地抑制鳜蛙虹彩病毒(MRV)和弹状病毒(SCRV)复制[18]。
大黄鱼(Larmichthys crocea)是我国重要的海水经济鱼类, 2018年年产量达到19.8×107kg, 是我国海水养殖产量最高的鱼类[22]。然而, 随着大黄鱼养殖规模的不断扩大, 各种疾病频繁爆发, 尤其是一些危害较大的细菌性疾病和寄生虫病, 严重地制约了大黄鱼养殖业的健康发展[23]。大黄鱼疾病暴发与高温、低氧等环境胁迫密切相关。HIF-1α在低氧应答和免疫应答中都发挥重要作用, 是协调低氧应答与免疫应答的关键因子。因此, 解析HIF-1α在大黄鱼免疫应答中的功能, 对于理解低氧胁迫对大黄鱼免疫应答的影响, 以及大黄鱼病害的免疫防治具有重要意义。本研究克隆并鉴定了大黄鱼HIF-1α(LcHIF-1α)基因, 通过荧光定量PCR检测其在健康大黄鱼组织或器官, 以及免疫细胞中的表达水平,分析其在溶藻弧菌感染的大黄鱼脾脏和肾脏, 以及LPS诱导的中性粒细胞和巨噬细胞中表达变化, 揭示LcHIF-1α参与大黄鱼免疫应答过程, 为阐明其在鱼类免疫应答中的功能和机制提供依据。
1 材料与方法
1.1 实验材料
实验所用大黄鱼[体长: (21.0±1.5) cm; 体重:(104±13.6) g]均购自宁德市富发水产有限公司, 养殖基地水温在25℃左右。在适应性养殖两周后, 取健康大黄鱼的脑、眼、心脏、肝脏、脾脏、头肾、胃、肠、肌肉等组织或器官, 用于LcHIF-1α基因的组织分布研究。随机选取60尾大黄鱼分为对照组和实验组, 每组各30尾, 在麻醉后, 对照组大黄鱼腹腔注射200 μL生理盐水, 实验组大黄鱼腹腔注射200 μL生理盐水稀释的浓度为1×108CFU/mL的溶藻弧菌(Vibrio alginolyticus)菌液。分别于注射后6h、12h、24h和48h, 每个时间点随机选取6尾大黄鱼, 取脾脏和头肾组织样品, 样品液氮速冻后放入-80℃超低温冰箱保存。
实验所用引物信息详见表 1, 引物合成及DNA测序均由擎科生物完成。

表 1 引物序列Tab. 1 Primer information
1.2 大黄鱼免疫细胞分离
大黄鱼头肾巨噬细胞: 将大黄鱼头肾置于70 μm滤网上, 使用1 mL注射器的活塞反复研磨组织块,加入RPMI-1640培养基(含1%青霉素、链霉素和肝素钠)冲洗, 将洗下的细胞悬液320×g水平离心5min后收集细胞。使用RPMI-1640培养基把收集的细胞制备成细胞悬液, 缓慢加到34%/51% Percoll分离液的表层, 650×g水平离心30min, 吸取中间层的细胞, 在细胞培养皿内28℃培养2h, 去除未贴壁的细胞, 即得到大黄鱼头肾巨噬细胞。
大黄鱼外周血淋巴细胞: 使用2 mL注射器从大黄鱼的尾静脉抽取血液, L-15培养基稀释后, 缓慢加到34%/51% Percoll分离液的表面, 650×g水平离心30min, 吸取中间层的细胞, 反复清洗2次后, 使用L-15培养基稀释到1×106细胞/mL备用。
大黄鱼头肾中性粒细胞: 将大黄鱼头肾置于70 μm滤网上, 使用1 mL注射器的活塞反复研磨组织块,加入无菌的PBS, 制成单细胞悬液, 缓慢加到72.5%Percoll分离液的表面, 400×g水平离心30min, 收集位于管底部的粒细胞, 用含1%肝素钠的L-15培养基反复清洗两次, 稀释到1×106细胞/mL备用。
1.3 LcHIF-1α基因克隆与序列分析
LcHIF-1α基因序列来源于大黄鱼基因组数据库(GenBank登录号: JRPU02000000)。使用大黄鱼头肾cDNA作为模板, 对其ORF序列进行PCR扩增并测序验证, 所用引物序列见表 1, 测序结果与预测序列基本一致。利用SMART在线软件预测LcHIF-1α蛋白功能结构域, SignalP 4.1预测其信号肽,NetNGlyc1.0预测其潜在的糖基化位点, 系统进化树则使用MEGA 6.0软件构建(近邻法)。氨基酸序列多序列比对使用CLUSTAL Omega在线程序(https://www.ebi.ac.uk/Tools/msa/clustalo/)。其他物种HIF-1α的氨基酸序列从NCBI数据库收集所得,相应的序列登录号详见表 2。
1.4 荧光定量PCR实验
利用Trizol试剂提取来源于6尾大黄鱼混合样品的总RNA, 反转录成cDNA作为模板, 大黄鱼βactin作为内参基因, 使用LcHIF-1α特异性引物(表 1,HIF-1α-F2 和HIF-1α-R2)进行荧光定量PCR反应,检测LcHIF-1α的表达水平。反应体系如下: 2×SYBR GreenⅠ10 μL, 引物各0.5 μL, cDNA模板9 μL;反应程序: 95℃预变性1min; 95℃ 10s, 58℃ 15s,72℃20s, 共40个循环。通过2-ΔΔCt方法计算LcHIF-1α的相对表达量, 使用SPSS 18.0软件进行统计学分析,P<0.05表示差异显著,P<0.01表示差异极显著[24]。
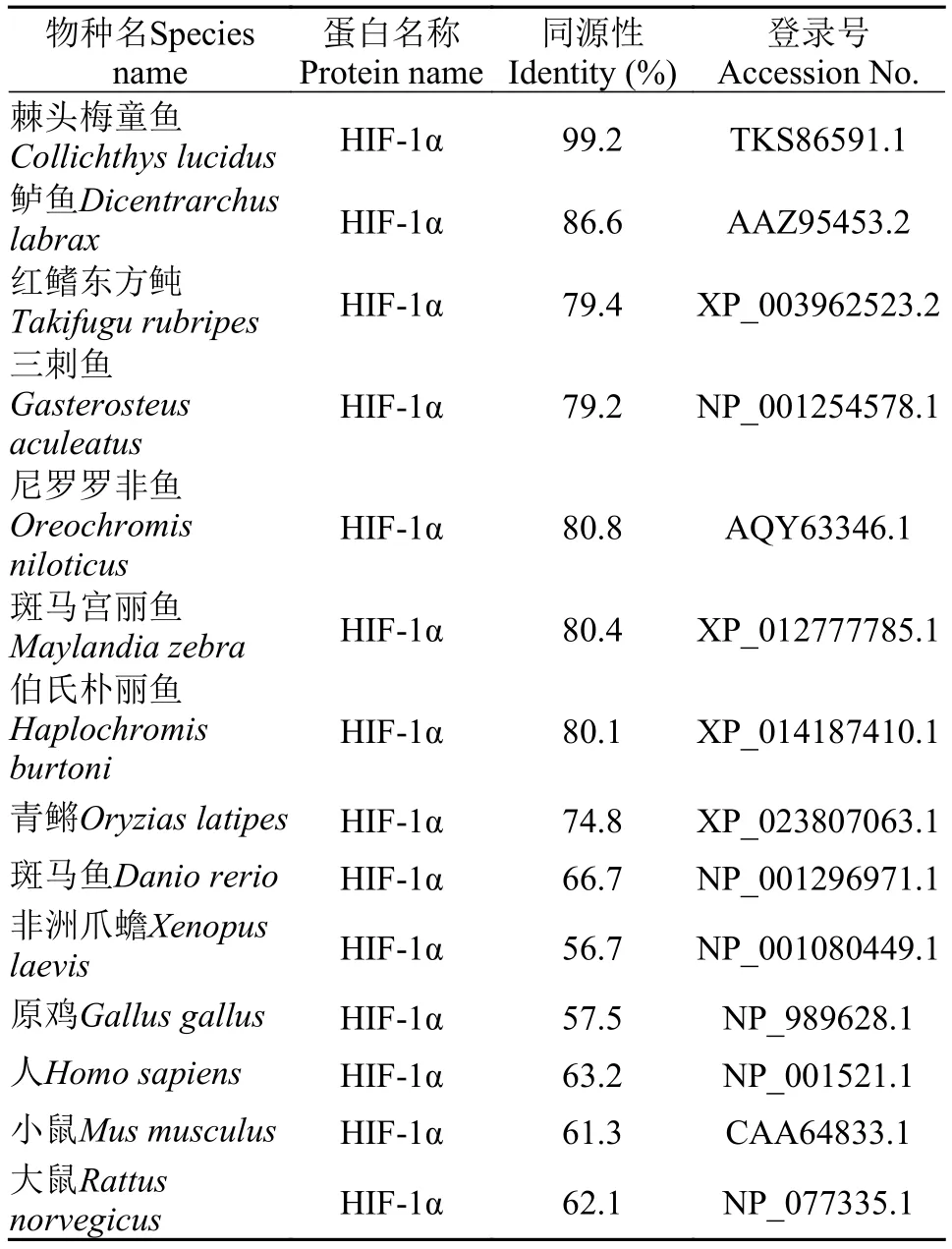
表 2 大黄鱼HIF-α与其他物种HIF-α氨基酸序列的同源性分析Tab. 2 The identity between large yellow croaker HIF-α and other known HIF-α proteins
1.5 LcHIF-1α在大黄鱼免疫细胞中的表达模式分析
采用荧光定量PCR检测LcHIF-1α在大黄鱼中性粒细胞、巨噬细胞和淋巴细胞中的相对表达水平。再分别使用终浓度为50 μg/mL的LPS和等体积的无菌PBS处理大黄鱼中性粒细胞和巨噬细胞, 于处理后不同的时间点收集细胞, 使用微量RNA提取试剂盒提取细胞的总RNA, 制备第一链cDNA, 通过荧光定量PCR检测LcHIF-1α的表达水平变化。荧光定量PCR方法和数据处理方法如上。
2 结果
2.1 大黄鱼HIF-1α分子特征
LcHIF-1α基因的开放阅读框全长2256个核苷酸, 编码一个由751个氨基酸组成的蛋白质(Gen-Bank登录号: XP_027130453.1), 预测其蛋白分子量为84.2 kD, 理论等电点为4.64。序列分析发现,LcHIF-1α与哺乳动物HIF-1α蛋白序列特征相似, 不具有信号肽和跨膜区, 在氨基端具有一个基础的HLH结构域(第22—77位氨基酸)和2个PAS结构域(第88—254位氨基酸; 第229—295位氨基酸), 共同组成HIF的特征基序HLH/PAS; 在羧基端具有1个DNA结合结构域HIF-1(第547—578位氨基酸)和1个HIF-1a-CTAD结构域(第714—750位氨基酸)。氨基酸序列比对表明, LcHIF-1α与其他物种HIF-1α都具有5个保守的功能结构域(HLH、2个PAS、HIF-1和HIF-1a-CTAD)和3个重要的羟基化位点(脯氨酸Pro402、Pro564以及天冬酰胺Asp803)。氨基酸序列同源性对比显示, LcHIF-1α与棘头梅童鱼(Collichthys lucidus)和鲈(Dicentrarchus labrax)HIF-1α的序列一致性最高, 分别为99.2%和86.6%(表 2)。在系统进化树中, 鱼类HIF-1α形成一个大的分支,远离两栖类、禽类和哺乳类的HIF-1α; LcHIF-1α与棘头梅童鱼HIF-1α的亲缘关系最近(图 1)。
2.2 LcHIF-1α在健康大黄鱼不同组织中的表达情况
采用荧光定量PCR技术检测健康大黄鱼脑、眼、心脏、肝脏、脾脏、头肾、胃、肠、肌肉等组织或器官中LcHIF-1α的表达情况。结果显示,LcHIF-1α在检测的所有组织中都有表达, 在皮肤中的表达量最高, 其次是血液、肌肉和心脏, 而在肠、肾脏和胃里面表达量相对较低(图 2)。
2.3 溶藻弧菌感染对LcHIF-1α表达的影响
为进一步探明LcHIF-1α在大黄鱼免疫反应中的作用, 使用溶藻弧菌感染健康的大黄鱼, 检测LcHIF-1α在大黄鱼脾脏和头肾中的转录水平。结果如图 3所示, 溶藻弧菌感染后6h和12h, 大黄鱼脾脏中LcHIF-1α的转录水平在显著下调, 然而, 24h和48h后表达量显著增加, 在24h表达水平达到最高,是对照组的6.8倍(图 3A); 在头肾组织中,LcHIF-1α的转录水平在感染后6h和12h无明显变化, 24h和48h显著上调, 也是在24h 达到最高峰, 为对照组的2.9倍(图 3B)。
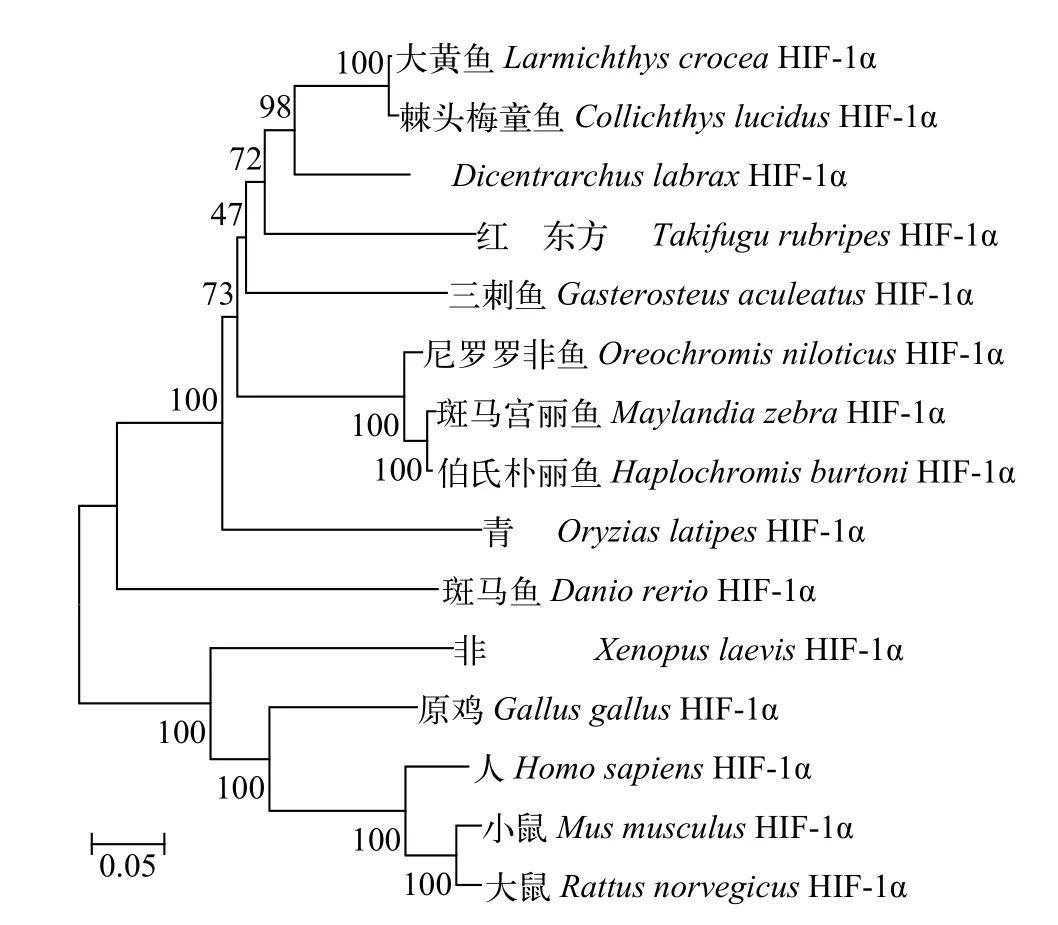
图 1 大黄鱼与其他物种HIF-1α氨基酸序构建的进化树Fig. 1 A phylogenetic tree was constructed based on the amino acid sequences of HIF-1α from large yellow croaker and other vertebrates

图 2 大黄鱼HIF-1α组织表达谱Fig. 2 Tissue expression analysis of LcHIF-1α
2.4 LcHIF-1α在大黄鱼免疫细胞中的表达调控模式
LcHIF-1α在大黄鱼中性粒细胞、巨噬细胞和淋巴细胞中都有表达, 中性粒细胞中的相对表达水平最高, 巨噬细胞次之, 淋巴细胞中表达量相对较少(图 4)。进一步使用细菌的表面成分脂多糖(LPS)刺激大黄鱼中性粒细胞和巨噬细胞, 检测LcHIF-1α的转录水平变化。结果显示, LPS诱导后LcHIF-1α在中性粒细胞和巨噬细胞中的表达水平均显著升高, 都是于2h达到最高值, 是对照组的2.6倍和1.8倍(图 5)。
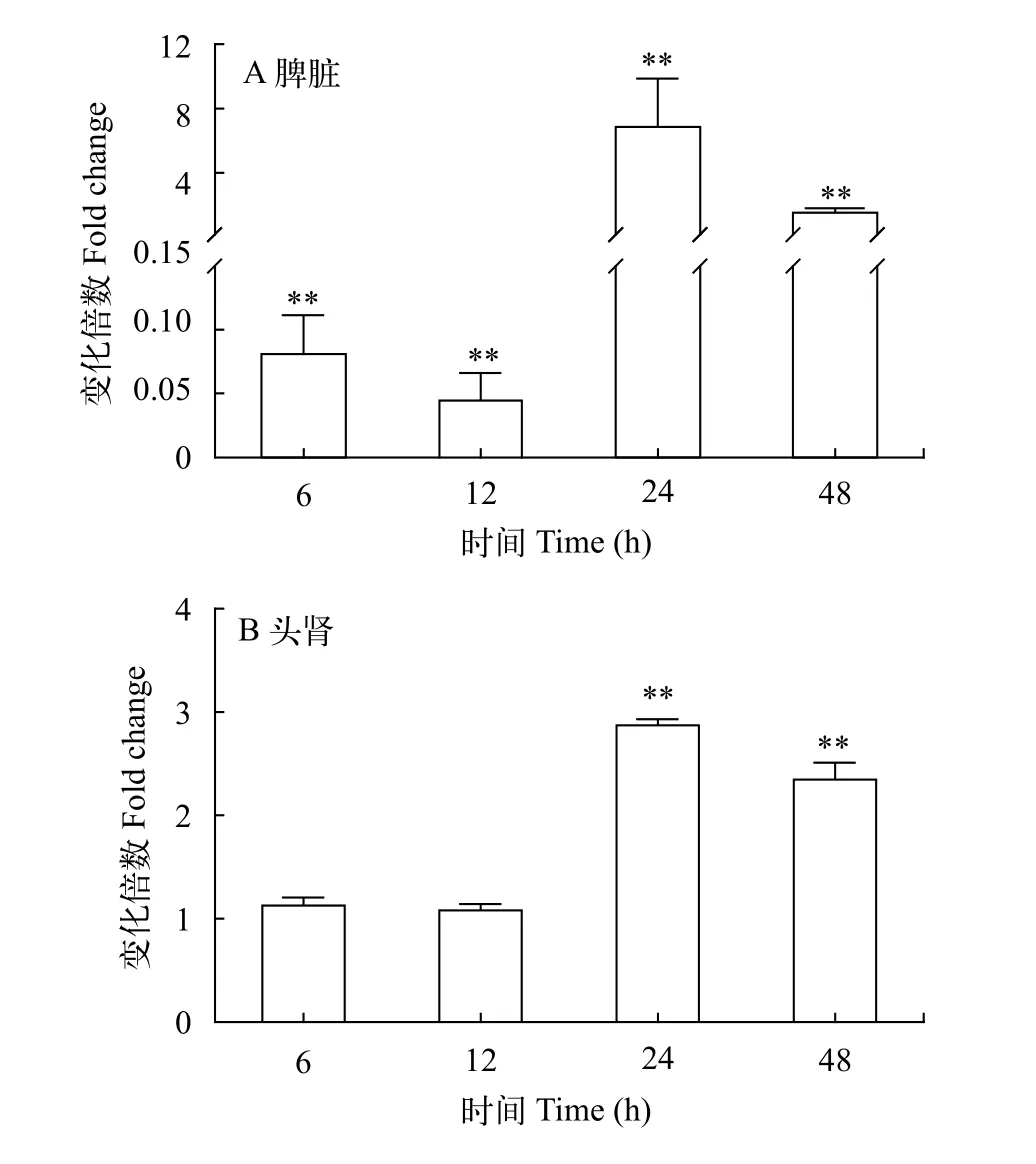
图 3 溶藻弧菌感染后大黄鱼脾脏和头肾中LcHIF-1α表达变化Fig. 3 Expression change of LcHIF-1α in spleen and head kidney of large yellow croaker after Vibrio alginolyticus stimulation
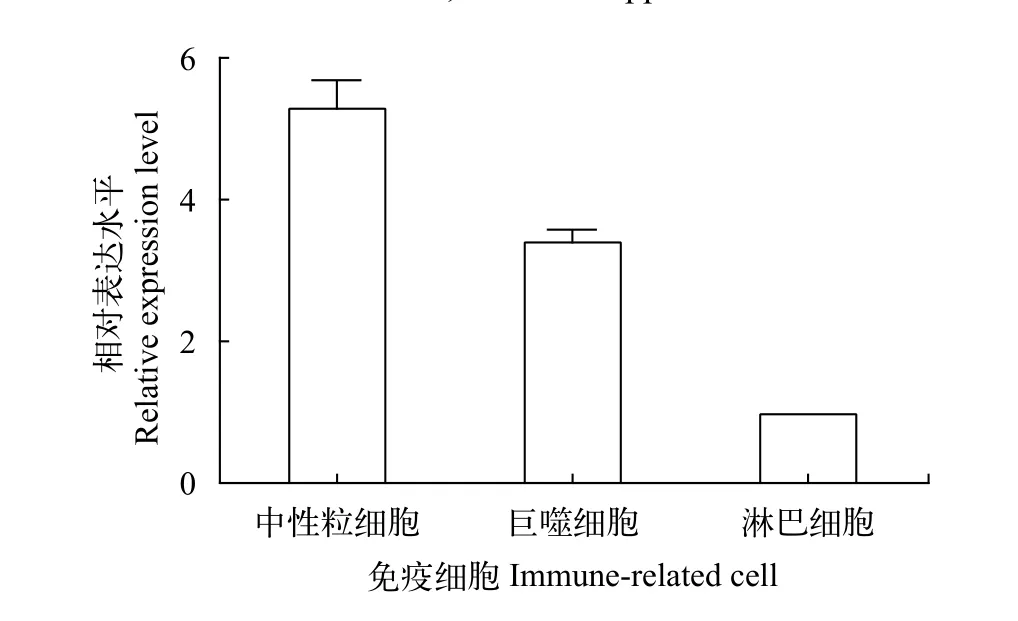
图 4 LcHIF-1α在免疫细胞中的表达分析Fig. 4 LcHIF-1α expression in immune-related cells
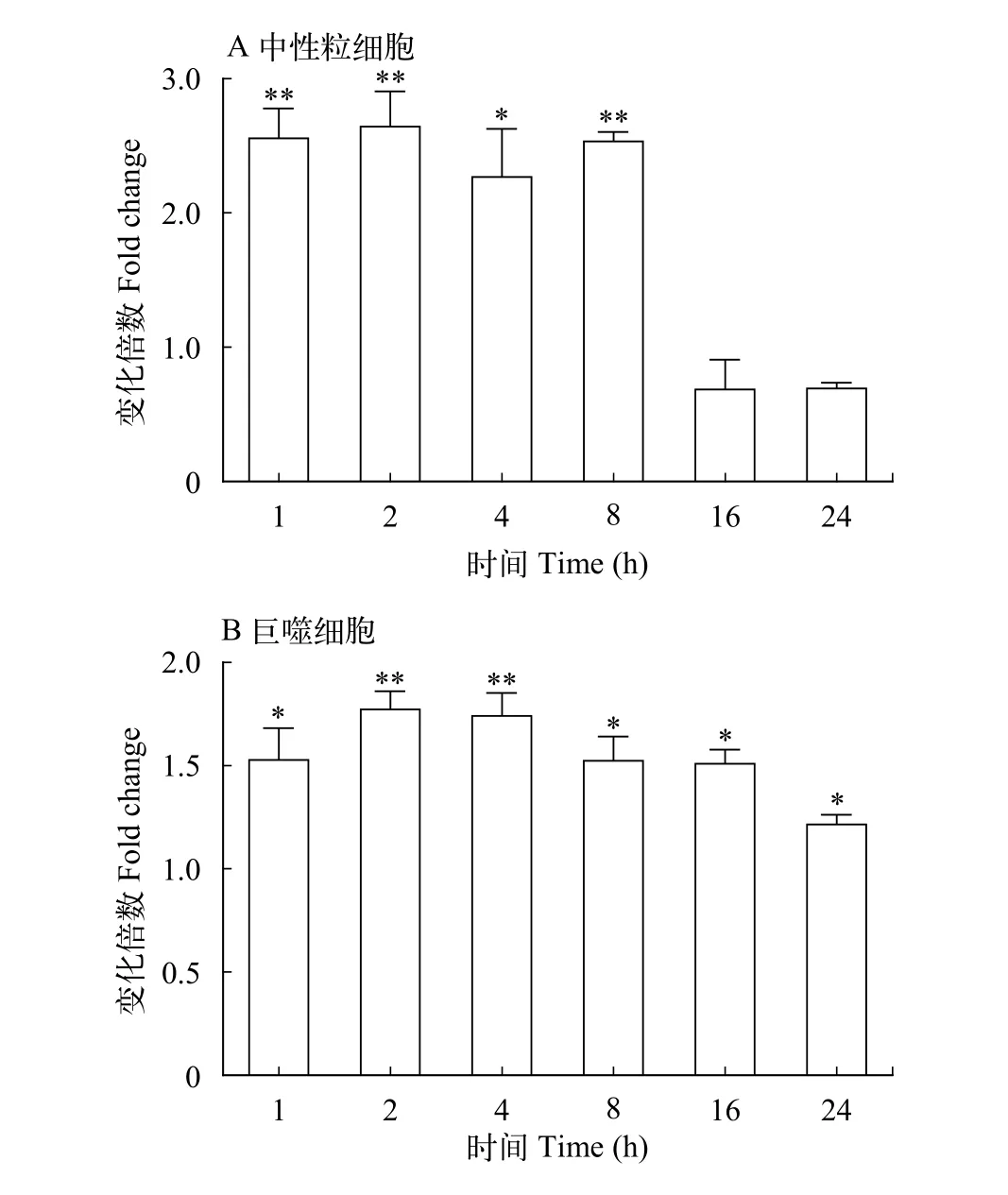
图 5 LPS刺激后中性粒细胞和巨噬细胞中LcHIF-1α的表达变化Fig. 5 LcHIF-1α expression analysis in neutrophils and macrophages stimulated with LPS
3 讨论
分子氧是地球上所有有氧生物生存所必需的成分[25]。鱼类生活在水生环境中, 生长、摄食、运动、繁殖等各项生命活动都需要有充足的溶解氧进行代谢来提供能量。然而, 无论是自然水环境还是人工养殖环境, 溶解氧的分布极不均匀, 浓度变化幅度大, 缺氧情况频繁发生[26]。HIF-1信号通路是调控低氧应答的重要途径, 其中, HIF-1α是最关键的调控蛋白, 哺乳动物HIF-1α在低氧应答中的功能和作用机制已经研究的非常清楚。近年来, 研究发现HIF-1还与NF-κB信号通路交互作用, 参与调节免疫应答过程, 包括诱导免疫相关基因的表达, 调节免疫细胞增殖、发育、分化和功能等[27]。目前,已经在多种鱼类中克隆得到了HIF-1α序列, 发现低氧胁迫显著诱导其表达, 但是对其在免疫应答中的表达模式和功能仍知之甚少。
本研究从大黄鱼基因组数据中检索到LcHIF-1α序列, 扩增得到了其cDNA序列并测序验证。LcHIF-1α的开放阅读框全长为2256个核苷酸, 编码1个751个氨基酸的蛋白。通过序列比对发现,LcHIF-1α与其他鱼类和高等动物HIF-1α蛋白结构类似, 具有1个HLH结构域, 2个PAS结构域, 1个HIF-1结构域和1个HIF-1a-CTAD结构域, 并且这些物种HIF-1α功能结构域的序列相似性较高, 表明HIF-1α在进化过程中的保守性, 也预示着其功能的保守性。但是, 在功能结构域以外的区域, 鱼类HIF-1α与两栖类、鸟类、哺乳类HIF-1α序列同源性相对较低, 出现多个差异较大的区域; 系统进化分析也得到了相似的结果, 鱼类的HIF-1α形成一个独立的分支, 远离哺乳类、鸟类及两栖类的HIF-1α,说明鱼类HIF-1α在功能方面可能具有一些独特之处。此外, 调节HIF-1α功能的两个脯氨酸Pro402和Pro564在不同物种间高度保守, 这两个位点发生羟基化后, 引导HIF-1α蛋白发生蛋白酶体降解[28]; 另一个重要的功能调控位点天冬酰胺Asp803在LcHIF-1α序列中也有发现, 其发生羟基化将抑制HIF-1α蛋白的活性[28]; 这些结果表明大黄鱼可能具有与哺乳动物相似的HIF-1α表达调控机制, 也预示着其在低氧应答中功能的保守性。
组织表达分析表明,LcHIF-1α在所检测的各组织中均有表达, 在皮肤中表达量最高, 其次依次为血液、肌肉和心脏, 在肠、肾脏和胃里面表达量相对较低。鳜HIF-1α的组织分布模式与LcHIF-1α类似, 也是血液和心脏里面表达量较高, 但是其在肌肉中表达量最低, 与LcHIF-1α明显不同[18]。大弹涂鱼HIF-1α在小肠和心脏内表达水平最高。虽然不同鱼类HIF-1α的组织表达模式略有差异, 但在血液、心脏等部位的表达量相对较高, 可能由于血液是运输氧的重要途径,HIF-1α在含血量较高的组织中能够更及时的感应到氧浓度的变化, 调节低氧应答反应。此外,LcHIF-1α在大黄鱼皮肤中高表达,可能是由于皮肤是鱼类的辅助呼吸器官, 对水环境中溶解氧浓度变化较为敏感。为了探明大黄鱼HIF-1α在免疫应答中的作用, 我们利用荧光定量PCR检测了LcHIF-1α在两个重要的免疫器官中的表达变化。结果显示, 溶藻弧菌感染后大黄鱼脾脏和头肾中LcHIF-1α的表达量都显著增加。相似的结果在其他鱼类HIF-1α基因的研究中也有报道, 爱德华氏菌(Edwardsiella tarda)感染显著上调大弹涂鱼脾脏和肾脏中HIF-1α的转录水平[19], PMA和poly I:C都能够诱导鳜HIF-1α的表达[18], 这些结果提示HIF-1α可能在鱼类免疫应答过程中发挥作用。脾脏和头肾是鱼类重要的免疫器官, 含有大量的巨噬细胞、淋巴细胞、中性粒细胞、碱性粒细胞等免疫细胞,LcHIF-1α在脾脏和头肾中表达量升高, 可能是其在某些免疫细胞表达量增加导致的。因此,我们分析了LcHIF-1α在大黄鱼免疫细胞中的表达模式, 发现LcHIF-1α在大黄鱼中性粒细胞和巨噬细胞中表达水平相对较高, LPS诱导后,LcHIF-1α在中性粒细胞和巨噬细胞内的表达水平显著上调, 与其组织表达模式一致。在爱德华氏菌刺激后, 大弹涂鱼单核/巨噬细胞中HIF-1α转录水平和蛋白水平都显著上调[19]。斑马鱼HIF-1α通过促进巨噬细胞IL-1β表达诱导中性粒细胞NO产生, 抵御海分枝杆菌(Mycobacterium marinum)感染[29]。这些结果进一步说明了HIF-1α可能参与调控鱼类的免疫应答过程。
综上所述, 本研究鉴定了LcHIF-1α基因的序列特征, 分析了鱼类、两栖类、鸟类和哺乳类HIF-1α的进化关系, 通过荧光定量PCR技术分析了LcHIF-1α在不同组织中的表达水平, 溶藻弧菌感染后在脾脏和头肾组织的表达变化, 以及免疫细胞中的表达调控模式, 表明LcHIF-1α功能结构域相对保守, 可能参与大黄鱼抗细菌免疫应答过程, 这些结果为了解大黄鱼和其他硬骨鱼类低氧应答与免疫应答之间的关系提供数据参考。
