洪湖碘泡虫SYBR Green Ⅰ实时荧光定量PCR检测方法的建立及其应用
2020-04-06赵媛莉刘新华章晋勇
罗 丹 赵媛莉 刘新华 章晋勇
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 农业部淡水养殖病害防治重点实验室, 淮安中心, 武汉430072; 2. 中国科学院大学, 北京 100049)
异育银鲫(Carassius auratus gibelioBloch)具有生长快、食性广、抗病性强等特点, 是我国主要的鲫养殖品种, 年产量近300×107kg[1]。然而随着异育银鲫集约化养殖的发展, 病害问题日益严重; 其中黏孢子虫病对当前异育银鲫养殖的危害仅次于鲤疱疹病毒Ⅱ型(CyHV-Ⅱ)引起的“鳃出血”病。黏孢子虫病可发生于异育银鲫养殖全过程, 迄今缺乏有效的防控措施, 已成为制约我国异育银鲫养殖业健康发展的主要瓶颈问题[2]。黏孢子虫物种多样性高, 仅寄生于异育银鲫的就有60余种。当前, 对异育银鲫养殖产生严重危害的有4种[3—6], 其中危害最严重的是由洪湖碘泡虫(Myxobolus honghuensis)引起的“喉孢子虫病”; 自21世纪初流行于江苏苏北异育银鲫主养区以来, 已传播至全国大部分异育银鲫养殖区[3]。该病对异育银鲫的苗种培育及成鱼养殖均造成严重危害。患病鱼主要表现为鱼体发黑消瘦、眼球凸出、咽喉部红肿、鳃丝呈暗紫色、鳃丝及体表黏液增多等症状, 大量繁殖的虫体引起咽部膨大并顶起鳃盖, 最终导致患病鱼进食、呼吸困难。在异育银鲫主养区江苏盐城, 该病的发病季节为每年5—10月, 感染率及死亡率都很高, 最高可达100%。因此, 建立基于洪湖碘泡虫生物学特征的鲫“喉孢子虫病”防控手段迫在眉睫。
鉴于黏孢子虫成熟孢子坚硬的外壳, 针对该阶段的药物防控几乎不可能实现。尽管洪湖碘泡虫的全生活史尚未阐明, 但黏孢子虫的两宿主发育, 即无脊椎动物(主要为底栖寡毛类)体内的放射孢子虫发育阶段与脊椎动物(主要为鱼类)体内发育的黏孢子虫阶段, 已得到学术界普遍认同[7]。前期研究表明,相对于成熟黏孢子, 鱼类黏孢子虫生活史中的其他阶段对药物、环境等更为敏感, 因此, 发展基于非成熟孢子的鱼类黏孢子虫病防控措施更为可行。然而, 目前尚缺乏指导确定包括灭活养殖水体中放射孢子虫活性、阻断营养体或前孢子发育阶段继续发育等干预措施实施时机的技术手段。另一方面, 对鲫跨境贸易过程中出现的潜伏感染个体的检疫、新的养殖系统发病风险的评价及所采取的干预措施的效果评价等都缺乏快速检测方法。根据病害发生“宿主-环境-病原”三环理论, 养殖系统中一定丰度的病原蓄积是导致病害的爆发必要条件之一, 发展养殖系统中洪湖碘泡虫全生活史发育阶段的定量监测技术是解决上述防控问题的关键。
目前, 洪湖碘泡虫的检测方法主要有基于显微镜检查成熟孢子的形态学方法、基于抗体-抗原反应的免疫学方法[8,9]、普通PCR法、多重PCR法及巢式PCR法[10,11]等。形态学方法虽然操作简便, 但是存在检测滞后、效率低、易于漏检及不适宜病害的早期诊断等问题。由于黏孢子虫生活史复杂,且种类繁多, 决定了挖掘适用于早期检测的特异性抗原的困难, 因此尽管免疫学检测具有快速且适用于生产实践的等特点, 但考虑到洪湖碘泡虫生活史各阶段抗原谱变异大且早期阶段特异性抗原尚未鉴定, 因此我们认为目前发展黏孢子虫病的免疫学早期诊断方法存在较大困难[12]。分子检测由于适用于检测寄生虫全生活史阶段, 在水产寄生虫病害检测领域被广泛应用。然而现有的针对洪湖碘泡虫的分子生物学方法只能定性检测。
SYBR Green Ⅰ实时荧光定量PCR方法具有特异性强、灵敏度高、重复性好、操作简便、用时短和可自动定量分析等优点, 已被广泛应用于病原微生物的检测[13]。因此, 本研究根据洪湖碘泡虫的ITS基因序列设计了一对特异性引物, 建立了洪湖碘泡虫的SYBR Green Ⅰ实时荧光定量检测方法,其特异性好、灵敏度较常规PCR高1000倍, 且在对养殖系统中的环境样品进行定量监测的应用中显示出良好的性能, 可为基层水产病害检疫部门或大型养殖企业开展鲫“喉孢子虫病”的苗种检疫、早期诊断、暴发风险预警、防控干预措施实施时机的确定及干预效果评价提供技术支撑。
1 材料与方法
1.1 样品采集与保存
洪湖碘泡虫、多涅茨尾孢虫(Henneguya doneci)、倪李碘泡虫(Myxobolus nielii)、普洛宁碘泡虫(Myxobolus pronini)、吴李碘泡虫(Myxobolus wulii)虫体的基因组DNA均为本实验室保存。3份发病鲫的喉部组织、3份无明显感染症状鲫的喉部组织、3份水样和3份泥样样品均采集自湖北黄冈市蕲春县八里湖五里墩正大水产(湖北)有限公司周年发生喉孢子虫病的池塘。
洪湖碘泡虫各类型样品的采集与保存方法如下: 发病鲫的喉部组织, 在喉孢子虫病发病时期, 从池塘中采集3尾患喉孢子虫病症状明显的鲫, 将鲫的喉部组织取出, 保存于无水酒精中; 无明显感染症状鲫的喉部组织, 在喉孢子虫病发病时期, 从池塘中采集3尾无明显感染症状的鲫, 将鲫的喉部组织取出, 保存于无水酒精中; 水样, 在喉孢子虫病发病时期, 用采水器在距离池塘水层表面的50 cm处收集3份500 mL水体, 用3个洗净的1 L塑料瓶收集并低温带回实验室, 用0.2 μm滤膜在真空泵上过滤,将滤膜保存于无水酒精中; 泥样, 在喉孢子虫病发病时期, 用彼得森采泥器采集池塘表层3份50 g底泥, 用锡箔纸包裹后置于冻存管中, 带回实验室于-20℃保存。
1.2 ITS基因克隆及引物设计
由于洪湖碘泡虫小核糖体RNA(18S)基因序列与吴李碘泡虫相似性过高(93%以上), 因此我们选择变异度较大的核糖体间隔区域(ITS)为引物设计靶序列[14]。
分别以洪湖碘泡虫、多涅茨尾孢虫、倪李碘泡虫、普洛宁碘泡虫、吴李碘泡虫基因组DNA为模板, 使用黏孢子虫18S通用上游引物F(18R: 5′-CGT AACAAGGTTTCCGTAG-3′)和28S通用下游引物R(Myxo28S1F: 5′-CACTTCACTCGCAGTTACT-3′)进行常规PCR扩增[15]。PCR扩增体系为: 10×PCR Buffer MIX 12.5 μL, 上游引物F(10 μmol/L) 1 μL,下游引物R(10 μmol/L)1 μL, DNA模板 1 μL, 灭菌ddH2O补加至25 μL; 反应程序为: 94℃预变性5min, 94℃变性50s, 54℃退火50s, 72℃ 2min, 35个循环, 最后72℃延伸10min[15]。
在扩增结束后将扩增产物进行1%琼脂糖凝胶电泳, 使用胶回收试剂盒将扩增得到条带切胶回收,与pMD18-T载体连接并转化入大肠杆菌DH5α感受态细胞。将转化入大肠杆菌DH5α感受态细胞成功的菌落纯化培养, PCR鉴定筛选得到阳性克隆。分别将阳性克隆菌液送往武汉擎科生物技术有限公司进行测序和序列拼接, 即获得5种黏孢子虫的ITS序列。利用Clustal X软件对5种黏孢子虫的ITS基因序列进行同源性分析, 根据比对结果确定洪湖碘泡虫特异的非同源性区段, 利用Primer 5.0设计一对特异性引物, 设计的引物序列如下: 上游引物HH-F: 5′-CCACGTTTGTCAGAGTGATTGC-3′;下游引物HH-R: 5′-GGTCGTATATTCACTGCGAC T- 3′, 扩增产物长度为176 bp。引物由武汉擎科生物技术有限公司合成。
1.3 洪湖碘泡虫阳性重组质粒的构建
以洪湖碘泡虫基因组DNA为模板进行常规PCR扩增。采用25 μL反应体系: 10×PCR Buffer MIX 12.5 μL, HH-F(10 μmol/L) 0.8 μL, HH-R(10 μmol/L) 0.8 μL, DNA模板2 μL, 灭菌ddH2O补加至25 μL;反应程序为: 94℃预变性5min, 94℃变性30s, 58℃退火30s, 72℃延伸30s, 共循环30次, 最后72℃延伸5min。
扩增结束后取5 μL PCR扩增产物进行2%琼脂糖凝胶电泳, 切胶回收, 纯化后的扩增片段与pMD18-T载体连接后转化入大肠杆菌DH5α感受态细胞。对转化入大肠杆菌DH5α感受态细胞成功的菌落纯化培养, PCR鉴定筛选得到阳性克隆。将阳性克隆菌液送往武汉擎科生物技术有限公司测序。测序验证的阳性克隆菌液使用质粒小提试剂盒作少量提取和纯化。所提取的质粒纯度及溶度用Nano Drop 2000测定的260/280 nm比值判断和计算(1.8—2.0), 换算为拷贝数, 拷贝数计算公式:Nc=(6.02×1014×Cp) /(Ln+ 2694)×660,Nc为目的基因的拷贝数, 单位为 copies/μL;Cp为质粒浓度, 单位ng/μL;Ln为插入载体的基因长度, 单位bp。
1.4 SYBR Green Ⅰ实时荧光定量PCR方法的建立与优化
反应条件的建立: 反应体系为iQTMSYBR®Green Supermix 10.0 μL, HH-F(10 μmol/L) 0.8 μL,HH-R(10 μmol/L) 0.8 μL, 重组质粒DNA 1.0 μL,ddH2O 7.4 μL。反应程序为: 95℃预变性3min;95℃变性12s; 55℃退火20s, 72℃延伸20s, 75.5℃ 收集荧光5s, 40个循环; 溶解曲线温度、时间设置为65℃ 5s, 95℃ 5min。反应条件的优化: 通过对反应体系中的退火温度、重组质粒用量和引物用量等进行摸索, 获得扩增效率高、稳定性好、无特异性扩增的反应条件。
1.5 标准曲线的建立
将测定浓度的洪湖碘泡虫阳性重组质粒作10倍倍比稀释, 取106—102copies/μL重组质粒为模板在优化的反应条件下同时进行扩增, 每个浓度做3个重复, 并设置空白对照。在扩增过程中, 实时荧光定量PCR仪根据不同拷贝数重组质粒扩增产物的荧光信号到达设定域值所经历的循环数生成相应的Ct值。以106—102copies/μL重组质粒拷贝数的对数值为横坐标, 以相应的ΔCt值为纵坐标, 利用Excel绘制标准曲线。
1.6 SYBR Green Ⅰ实时荧光定量PCR方法的特异性、可重复性、灵敏性检测
特异性检测: 分别以洪湖碘泡虫、多涅茨尾孢虫、倪李碘泡虫、普洛宁碘泡虫、吴李碘泡虫的基因组DNA为模板在优化的反应条件下同时进行扩增, 并设置空白对照。此外, 扩增结束后取5 μL QPCR扩增产物加loading Buffer进行2%琼脂糖凝胶电泳,加以验证该方法的特异性。
可重复性检测: 将106—102copies/μL重组质粒作为模板在优化的反应条件下分别进行组内和组间重复性试验。组内重复性试验, 每个浓度做3个重复; 组间重复性试验, 同一次反应每个浓度做3个重复, 重复3次反应, 同时设空白对照。通过组内和组间Ct值变异系数(标准偏差/重复值平均数), 以验证该方法的可重复性。
灵敏性检测: 将105—101copies/μL重组质粒作为模板分别取1 μL在优化的反应条件下和上述常规PCR条件下进行扩增, 并设置空白对照。常规PCR扩增结束后取5 μL反应产物进行2%琼脂糖凝胶电泳。通过比较两种方法的最低检测限, 以验证该方法的灵敏性。
1.7 SYBR Green Ⅰ实时荧光定量PCR方法的应用
为了验证所建立的SYBR GreenⅠ实时荧光定量PCR扩增方法的临床应用性。对采集自湖北黄冈市蕲春县八里湖五里墩正大水产(湖北)有限公司周年发生喉孢子虫病池塘的3份发病鲫的喉部组织、3份未无明显感染症状鲫的喉部组织、3份水样和3份泥样待检样品进行洪湖碘泡虫的检测。待检样品分别采用QIAGEN DNeasy Blood & Tissue,EZNA Water DNA Kit, EZNA Soil DNA Kit试剂盒提取基因组DNA后, 以待检品基因组DNA为模板,在优化的反应条件下进行扩增, 每个样品均做3个重复, 将检测到的ΔCt值(3个Ct值取平均值)代入建立的标准曲线方程中, 计算出样品中洪湖碘泡虫的初始浓度和对应初始浓度的拷贝数。
2 结果
2.1 洪湖碘泡虫阳性重组质粒的构建
以洪湖碘泡虫基因组DNA为模板, 使用设计合成的HH-F和HH-R引物进行常规PCR扩增, 获得约为176 bp扩增片段。经PCR鉴定的阳性重组质粒,测序显示扩增片段成功插入pMD-18T载体中, 说明阳性重组质粒构建成功。将构建成功的洪湖碘泡虫阳性重组质粒在Nano Drop 2000上测得260/280 nm比值为1.97, 浓度为95 ng/μL, 对应浓度的拷贝数为3.02×1010copies/μL。
2.2 SYBR Green Ⅰ实时荧光定量PCR方法的建立与优化
在优化的反应条件下, SYBR Green Ⅰ实时荧光定量PCR方法的扩增效率为102.3%, 扩增效率高,组内和组间重复性试验的变异系数均小于2%, 稳定性好, 溶解曲线为单峰, 无特异性扩增。
2.3 标准曲线的建立
以3.02×106—3.02×102copies/μL重组质粒为模板在优化的反应条件下同时进行扩增, 标准曲线方程为Y=-3.2577X+39.043, 相关系数(R2)为0.999, 扩增效率为102.3%(图 1)。重组质粒拷贝数的对数值与QPCR的Ct值之间呈现良好的线性关系。重组质粒对应的扩增产物溶解曲线呈现单峰,Tm值为77.5,表明无引物二聚体和非特异性扩增。
2.4 SYBR Green Ⅰ实时荧光定量PCR方法的特异性、可重复性、灵敏性检测
特异性检测: 在建立的优化的反应条件下, 分别以洪湖碘泡虫、多涅茨尾孢虫、倪李碘泡虫、普洛宁碘泡虫、吴李碘泡虫基因组DNA为模板同时进行扩增, 只有洪湖碘泡虫基因组DNA出现典型“S”型扩增曲线, 其余均未出现典型“S”型扩增曲线,空白对照未见扩增(图 2)。电泳结果也显示(图 3),仅有洪湖碘泡虫基因组DNA出现一条条带, 大小约为176 bp, 而其他黏孢子虫和空白对照均未出现条带, 说明所建立的方法具有良好的特异性。
可重复性检测: 将3.02×106—3.02×102copies/μL 重组质粒作为模板在优化的反应条件下分别进行组内和组间重复性试验, 3次组内和组间重复性试验的变异系数均小于2%(表 1), 说明所建立的方法具有较好的重复性。

图 1 3.02×106—3.02×102 copies/μL重组质粒实时荧光定量PCR标准曲线Fig. 1 Standard curve of QPCR by using the serially diluted recombined plasmid at a concentration of 3.02×106—3.02×102 copies/μL
灵敏性检测: 将3.02×101—3.02×105copies/μL重组质粒作为模板分别取1 μL 在优化的反应条件下和上述常规PCR条件下进行扩增, 3.02×101—3.02×105copies/μL 重组质粒均呈现典型“S”型扩增曲线(图 4和图 5), 最低检测限为3.02×101copies/μL, 而普通PCR 的最低检测限为3.02×104copies/μL, 说明所建立的荧光定量PCR方法检出率较高, 是常规PCR方法的1000倍, 具有较高的灵敏性。
2.5 SYBR Green Ⅰ实时荧光定量PCR方法的应用
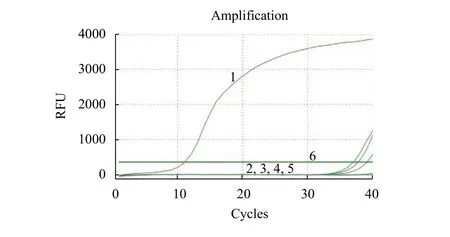
图 2 实时荧光定量PCR特异性性检测Fig. 2 Specificity of the developed QPCR

图 3 电泳检测QPCR的特异性Fig. 3 Specificity of the developed QPCR detected by gel electrophoresis
采用所建立的洪湖碘泡虫SYBR Green Ⅰ实时荧光定量PCR方法对采集自蕲春周年发生喉孢子虫病池塘的3份鲫喉部组织、3份无明显感染症状的鲫喉部组织、3份水样和3份泥样样品进行洪湖碘泡虫的检测, 空白对照(ddH2O)无扩增, 在3份鲫喉部组织、3份未无明显感染症状的鲫喉部组织、3份水样和3份泥样样品均能检测到洪湖碘泡虫(表 2)。这说明所建立的方法扩增效果良好, 既能从发病的鲫喉部组织中检测出洪湖碘泡虫, 又能从未发病但已感染的鲫喉部组织中检测出洪湖碘泡虫。对周年发病池塘的水样与泥样环境样品中的洪湖碘泡虫定量检测结果表明, 采样池塘存在洪湖碘泡虫蓄积, 具备鲫喉孢子虫病发病风险。同时也表明, 采样时, 水柱中存在感染源, 为采取相应的措施灭活或消降感染源丰度以降低发病风险提供了技术支撑。
3 讨论
在建立SYBR Green Ⅰ实时荧光定量PCR检测病原生物的过程中, 选择合适的靶序列尤为重要。在洪湖碘泡虫的早期分子检测中, 应用到的分子标记主要有18S rDNA和ITS区序列[8,9], 然而通过序列比对发现洪湖碘泡虫与吴李碘泡虫的18 SrDNA序列相似度为93%, ITS序列相似度为69%, 因此我们选择变异度较大的核糖体间隔区域(ITS)为引物设计靶序列, 建立洪湖碘泡虫的SYBR Green Ⅰ实时荧光定量PCR方法。

表 1 SYBR Green I实时荧光QPCR方法的组内与组间重复性试验Tab. 1 Intraassay and interassay repeatability tests of the SYBR Green I real-time QPCR assay

图 4 实时荧光定量PCR灵敏性检测Fig. 4 Sensitivity of the developed QPCR

图 5 常规PCR灵敏性检测Fig. 5 Sensitivity of the conventional PCR
通过以洪湖碘泡虫的ITS基因为靶标设计特异性引物, 对退火温度、重组质粒用量和引物用量等进行摸索, 优化反应条件, 建立了洪湖碘泡虫SYBR Green Ⅰ实时荧光定量PCR方法。该方法的标准曲线方程为Y=-3.2577X+39.043, 相关系数(R2)为0.999, 扩增效率为102.3%, Eff%在90%—110%[16],具有良好的线性关系; 溶解曲线为单峰, 产物的Tm值均一, 没有引物二聚体和非特异性扩增。为了验证所建立方法的特异性, 采用该方法对4种黏孢子虫进行检测, 并将扩增产物进行电泳分析, 由实验结果可知, 所建立的方法与4种黏孢子虫均不发生交叉反应, 表明该方法具有较好的特异性, 可以特异地检测洪湖碘泡虫。考虑到鱼类黏孢子虫多样性众多, 今后应扩大特异性检测种类范围, 以进一步该方法的特异性。由灵敏性实验结果可知, 该方法的最低检测限为3.02×101copies/μL(9.5×10-8pg/μL), 比李丹[10]建立的洪湖碘泡虫PCR检测方法的灵敏度(1×10-6pg/μL)高出约两个数量级, 与普通PCR相比, 灵敏度高出常规PCR约1000倍, 表明该方法具有较高的灵敏性。由可重复性实验结果可知, 组内和组间重复性试验的变异系数均小于2%,表明该方法具有较好的稳定性和可重复性。

表 2 临床样品的SYBR Green I实时荧光定量PCR检测Tab. 2 Detection results of clinical samples by the developed SYBR Green I real-time PCR
采用所建立的方法对临床样品进行洪湖碘泡虫的检测。结果表明, 该方法扩增效果良好, 不仅能从发病的鲫喉部组织中检测出洪湖碘泡虫, 还能从未发病但已感染的鲫喉部组织中检测出洪湖碘泡虫。不仅如此, 本方法可应用于周年发生喉孢子虫病的池塘水样、泥样环境样品中洪湖碘泡虫的定量监测, 为实时监控养殖系统中病原的丰度, 实施对鲫喉孢子虫病的早期干预措施奠定了技术基础。
综上所述, 本研究所建立的洪湖碘泡虫SYBR Green Ⅰ实时荧光定量PCR检测方法具有很好的特异性、较高的灵敏性、较好的稳定性和重复性、良好的应用性, 既可以用于临床的快速早期检测,又可对环境中的洪湖碘泡虫进行实时监控, 为洪湖碘泡虫病的诊断和防控提供了有力的技术支持。
