DCP1A与肝细胞癌预后的相关性研究
2020-04-06翟文龙
廖 原,于 龙,翟文龙
(郑州大学第一附属医院肝胆外科,河南 郑州 450052)
原发性肝癌是目前我国第4位常见的恶性肿瘤及第2位肿瘤致死原因,肝细胞癌(hepatocellular carcinoma,HCC)是其中最常见的类型,约占原发性肝癌的85%~95%[1]。我国每年约有46.6万例新发肝癌患者且每年约42.2万例死于肝癌[2]。慢性乙型肝炎病毒感染是肝癌发生的主要危险因素。约50%~80%的HCC患者有乙型肝炎病毒感染。除此之外,酒精、黄曲霉素、非酒精性脂肪肝和慢性丙型肝炎病毒感染也是HCC发生的主要危险因素[3-5]。目前对于HCC的根治性治疗多为手术切除或肝移植治疗。HCC患者早期症状隐匿,确诊时病情往往处于中晚期,无法进行根治性治疗,因此,对肝癌高危人群的的早期筛查,有助于肝癌的早发现、早诊断、早治疗。目前我国HCC普查的方式及手段较为单一,主要为血清甲胎蛋白及肝脏超声,其筛查的敏感性及特异性并不令人满意[6-7]。因此从分子水平深入探讨HCC的发生、发展机制对延长患者的存活期极其重要。
目前,越来越多的证据证明长链非编码RNA(long noncoding RNA, lncRNA)与人类疾病相关,lncRNA具有生物活性,并具有多种多样的功能,例如顺式或反式转录调控、核结构域的组织和蛋白质或RNA分子的转录后调控。目前的测序方法已经鉴定出了数以万计的lncRNA,因在组织及细胞中独特的表达方式,使得lncRNA成为一种潜在的恶性肿瘤生物标志物[8]。许多lncRNA已经被证明与HCC相关,尽管这些lncRNA的功能在很大程度上是未知的[8-10]。增强子元件作为非编码区的一段DNA序列,通过与特定转录因子结合强化基因转录,远距离增强目标基因的表达。增强子激活基因表达不依赖于其与靶基因的距离或方向。增强子RNA(enhancer RNA,eRNA)是指增强子转录产生的RNA,属于lncRNA的一个亚型,长度为500~5 000 bp[11]。eRNAs可以激活增强子,也能与其他蛋白质因子结合促进增强子启动子环的形成,从而激活下游基因的表达,其还可能以独立的形式行使某些生物学功能[12-13]。eRNAs的改变可影响肿瘤细胞的细胞周期和细胞生长等生物过程,或改变目标基因表达,提示了eRNAs可以作为新的肿瘤治疗靶点[14]。目前并没有HCC相关eRNAs的报告。
1 资料与方法
1.1 数据下载下载使用PreSTIGE算法鉴定出的2 695个由活性组织特异性增强子eRNA表达的带有注释的lncRNA转录本的ENCODE(DNA元素百科全书数据库[15])以及2 303个预测的靶基因[16]。癌症基因图谱(The Cancer Genome Atlas,TCGA)是美国国家癌症研究所和美国人类基因组研究所共同监督的一个项目,旨在应用高通量的基因组分析技术,提高对恶性肿瘤的预防、诊断和治疗能力,从而整体提高恶性肿瘤患者的预后,本研究从数据库下载了包括乳腺癌、膀胱癌、甲状腺癌等在内的33种恶性肿瘤的基因表达矩阵及对应的临床数据用于后续分析。
1.2 目标eRNAs的筛选提取TCGA数据库中HCC患者eRNAs的表达量通过Survival包对TCGA数据库中HCC患者eRNAs表达量及临床信息进行生存分析,并进行与生存相关eRNAs及其靶基因在HCC患者中表达量的相关性分析。与总生存期(P<0.001)和靶基因水平(Spearman秩相关系数r>0.4,P<0.05)相关的eRNAs被认为是HCC队列中的关键候选eRNAs。
1.3 目标eRNAs及其靶基因的差异性分析通过R软件edge包对肾透明细胞癌患者的基因表达矩阵进行处理,以LogFC>1和P<0.05为标准筛选具有差异表达的eRNAs及其下游靶基因。
1.4 eRNAs及其靶基因表达与TNM分期的相关性分析、Cox分析及联合效应分析对目标eRNAs及其靶基因表达和TCGA数据库中TNM分期进行相关性分析。在TCGA数据库中,将368例HCC患者的目标eRNAs及其靶基因表达按照中位数分为高表达组、低表达组,其中低表达组患者184例、高表达组患者184例。Cox比例风险模型对可能影响HCC患者预后的参数进行单因素和多因素分析。目标eRNAs及其靶基因表达高低为HCC患者的独立预后因素,对eRNAs及其靶基因表达进行联合效应分析。
1.5 GO功能注释及KEGG富集分析运用R语言分析筛选出HCC患者中与目标eRNAs共表达基因,并对基因进行GO功能注释及KEGG富集分析(筛选标准均为P<0.05)
1.6 目标eRNAs与其他类型恶性肿瘤生存的相关性分析利用R语言survival包分析目标eRNAs及相应的靶基因在其余32种恶性肿瘤中的表达水平与生存的相关性。
1.7 统计学处理采用SPSS 23.0进行统计分析,计量资料用 表示,比较用独立样本t检验,相关性分析采用Spearman秩相关分析,生存分析采用Kaplan-Meier法和log rank检验,多因素分析采用Cox多因素回归分析,检验水准α=0.05。散点图及基因联合效应分析生存图利用GraphPad Prism 7.0完成。
2 结果
2.1 目标eRNAs的筛选结果我们发现1 288个eRNAs中,有16个eRNAs在HCC患者中的表达与HCC患者生存率显著相关(P<0.001),将生存相关的eRNAs与其预测靶基因mRNA表达进行相关性分析时,只有3个eRNAs与其靶基因显著相关(P<0.001),其中DCP1A是与预后相关的首选eRNA(P值最小),在HCC患者中,DCP1A与其靶基因PRKCD的表达水平呈正相关(r=0.524,P<0.001),DCP1A高表达组患者的总生存率低于DCP1A低表达组患者(P<0.001),PRKCD高表达组患者的总生存率低于PRKCD低表达组患者(P=0.005)。见表1,图1~3。
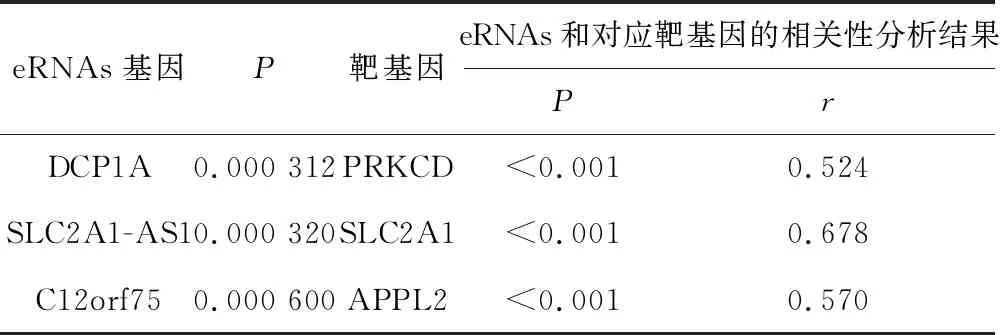
表1 与HCC患者生存相关的eRNAs列表
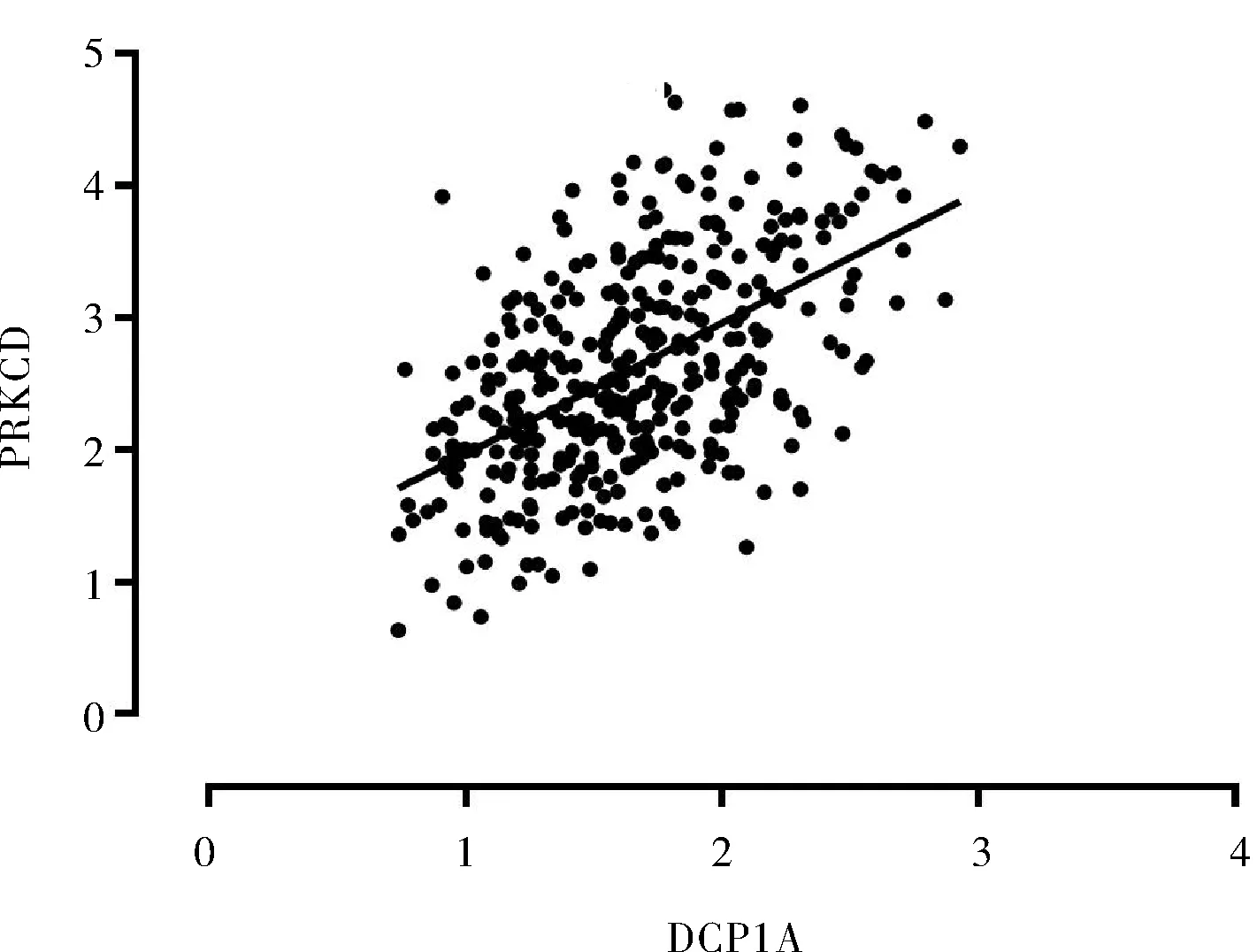
图1 DCP1A与PRKCD在HCC患者中表达的相关性分析图
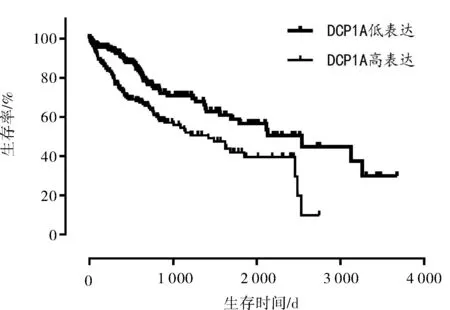
图2 DCP1A表达与HCC患者生存相关分析图
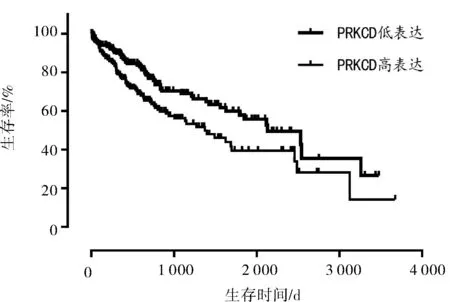
图3 PRKCD表达与HCC患者生存相关分析图
2.2 DCP1A及PRKCD的差异性分析DCP1A及PRKCD在HCC组织中表达均高于正常组织,差异有统计学意义(P均<0.001)。见图4。
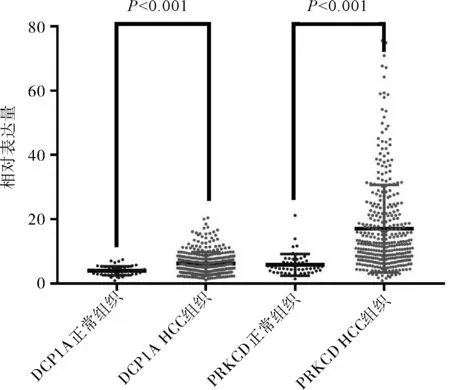
图4 DCP1A及PRKCD在HCC组织和正常组织中表达比较
2.3 DCP1A及PRKCD表达与TNM分期相关性分析、Cox分析及联合效应分析TNM分期早期患者中DCP1A基因表达较TNM分期晚期患者低。TNM分期早期患者中PRKCD表达较TNM分期晚期患者低。结合TCGA数据库中患者临床信息,Cox多因素分析校正年龄、性别、TNM分期后,DCP1A及PRKCD基因表达为HCC患者的独立预后因素。进行联合效应分析发现1组(DCP1A及PRKCD高表达组)HCC患者中位生存时间最短,2组(DCP1A及PRKCD低表达组)HCC患者中位生存时间最长。见图5、6,表2~4。
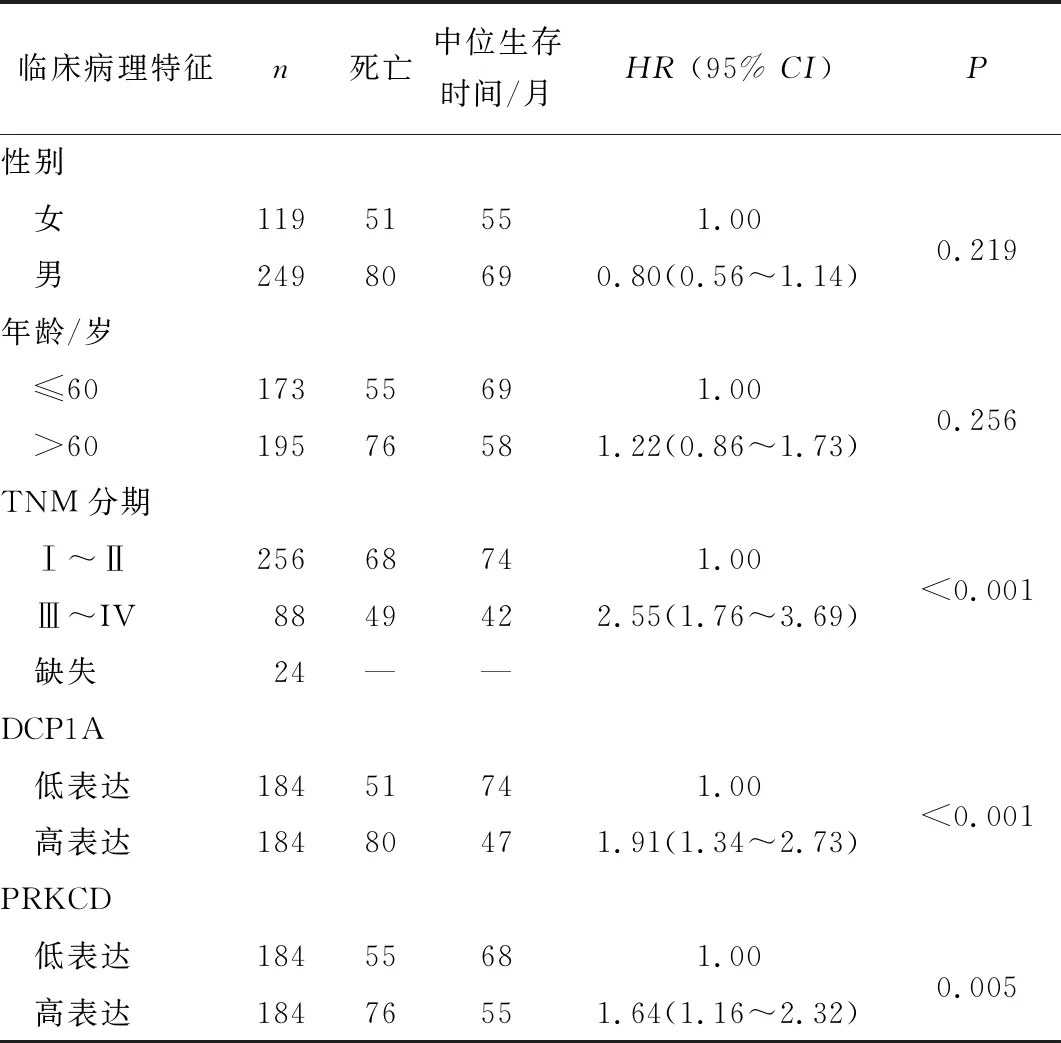
表2 TCGA数据库中HCC患者临床信息
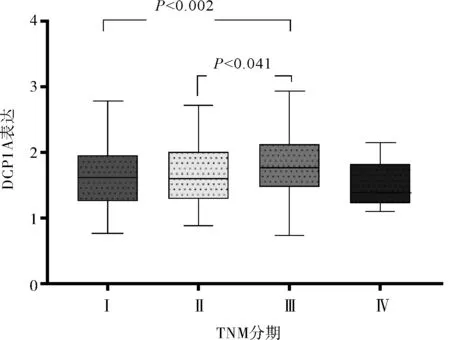
图5 DCP1A表达与HCC患者TNM分期的相关性分析图
2.4 GO功能注释及KEGG富集分析结果通过GO基因功能注释联合KEGG富集分析,综合效应评价得到了可取的结果:DCP1A及其靶基因主要参与共价染色体修饰、组蛋白修饰、DNA复制等过程,参与细胞周期、泛素介导的蛋白水解等通路。见图7、8。
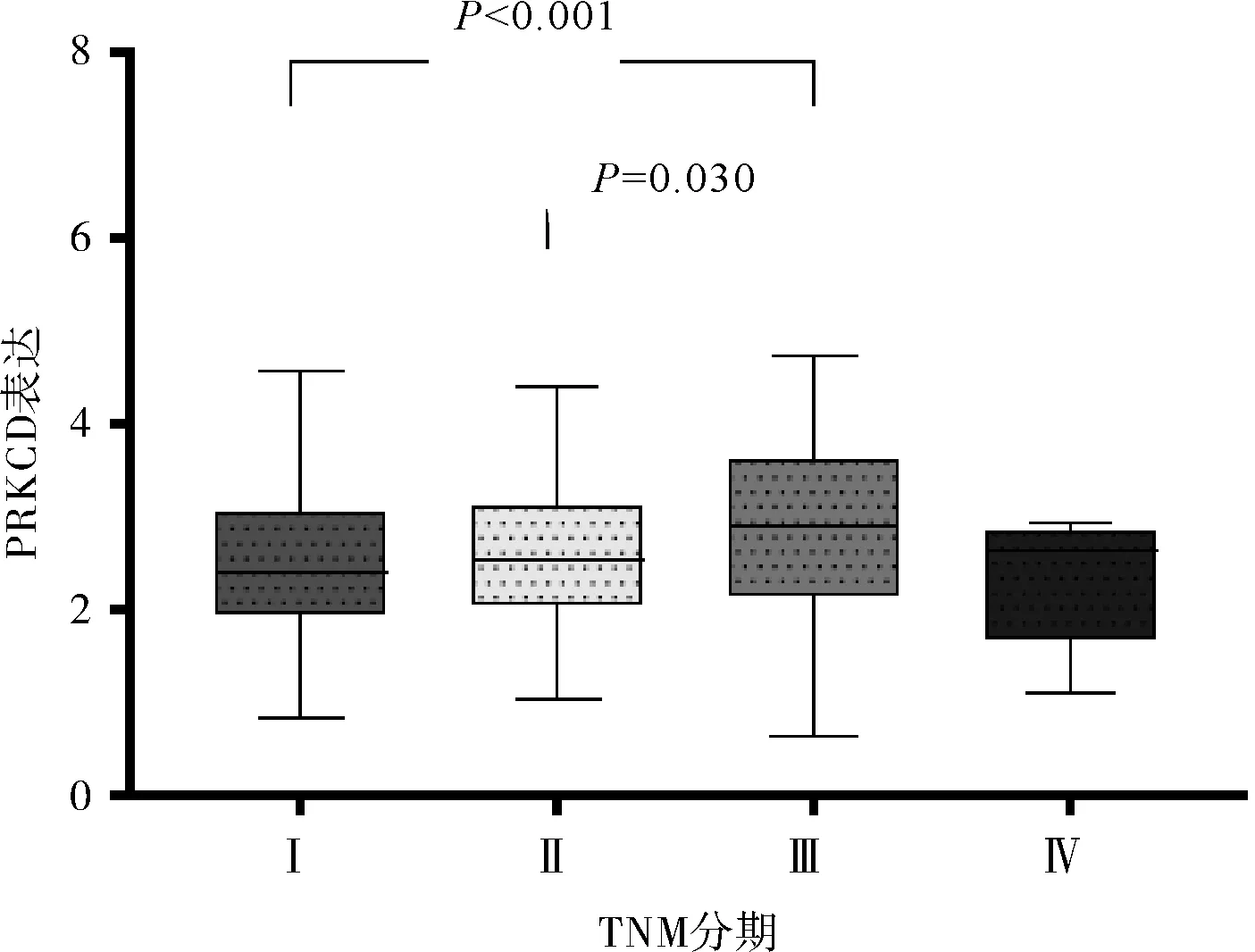
图6 PRKCD表达与HCC患者TNM分期的相关性分析图

表3 TCGA数据库中HCC患者DCP1A与PRKCD基因表达Cox分析结果

表4 TCGA数据库中HCC患者DCP1A及PRKCD联合效应分析结果
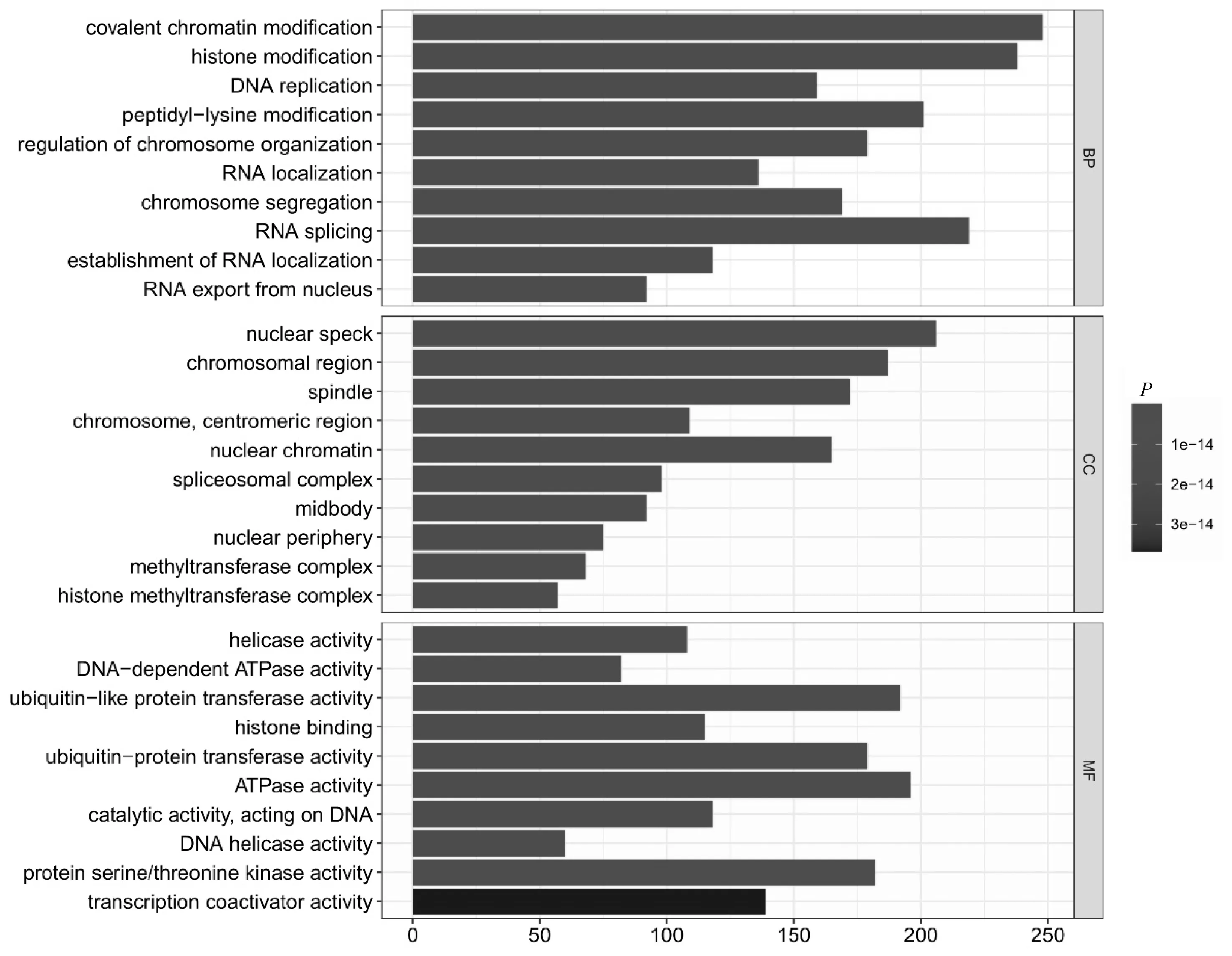
图7 DCP1A与其相关基因的GO功能注释
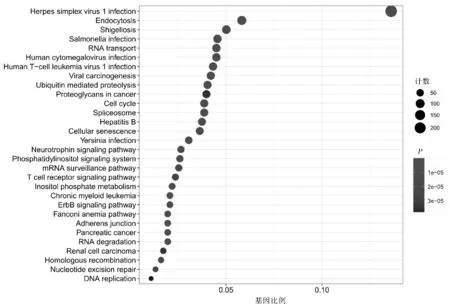
图8 DCP1A与其相关基因的KEGG通路富集分析图
2.5 DCP1A与其他类型恶性肿瘤生存的相关性分析结果对TCGA数据库中DCP1A基因表达与其余32种恶性肿瘤生存进行相关性分析发现,DCP1A表达量高低与肾透明细胞癌、直肠腺癌、胸腺瘤的预后相关(P=0.004,P<0.001,P=0.042)。
3 讨论
生物信息学方法可以提供基因表达水平,预测潜在的治疗靶点。大量的临床资料表明降低HCC病死率的最好方法是准确诊断和成功治疗。因此,识别与其发生、发展相关的关键基因对HCC的诊断和治疗至关重要。研究[17]发现,在基底细胞癌中,ACTRT1的eRNAs元件突变可损害ACTRT1的表达,导致Hedgehog信号通路的异常激活而促进肿瘤的发展,这表明eRNAs可以作为肿瘤预防的新靶点,因此研究HCC生存相关eRNAs,对研究HCC发生、发展的机制及指导HCC患者的治疗具有重要的意义。
DCP1A是参与mRNA去除和降解的主要成分。其靶基因PRKCD基因蛋白产物是蛋白激酶C家族的成员,该蛋白产物即是肿瘤抑制因子又是细胞周期进程的阳性调节剂。DCP1A及PRKCD的表达与多种肿瘤的发生、发展密切相关。DCP1A在黑色素瘤组织中表达均显著高于正常对照组,且DCP1A高表达组患者预后往往较差[18]。相比于正常组织,DCP1A在胃癌组织中表达也会显著上升[19]。DCP1A的高表达同样会促进了直肠癌的发生、侵袭及转移[20-21]。PRKCD在卵巢癌[22]、黑色素瘤[23]、子宫内膜癌[24]中都发现其表达显著上调,且PRKCD的高表达与卵巢癌的转移相关。PRKCD可以通过调控K-RAS基因来促进肿瘤生成进而促进子宫内膜癌的发生[24]。有研究[25]提出DCP1A可能与SMAD4蛋白进行结合形成复合物,在转化生长因子β的转化途径中起到激活作用,从而调节重要下游基因的表达,而转化生长因子β的激活同样可以促进细胞生长、分化、凋亡及恶性肿瘤的发生、发展。在本研究中DCP1A及PRKCD在HCC组织中表达明显高于正常肝组织;DCP1A及PRKCD的表达水平与TNM分期显著相关,TNM分期早期患者组织中DCP1A及PRKCD的表达较TNM分期晚期患者低,但在Ⅳ期患者组织中DCP1A及PRKCD的表达明显降低,这可能是由于Ⅳ期患者样本量过小或由于分期较高引发肿瘤组织内部机化等原因导致。生存分析显示,DCP1A及PRKCD的表达是HCC患者的独立预后因素,且DCP1A及PRKCD高表达组患者预后明显较差。为了进一步探索DCP1A及PRKCD在HCC患者中可能的作用机制,我们运用GO基因功能注释及KEGG富集分析综合效应评价发现:DCP1A的共表达基因显著富集在泛素介导的蛋白水解过程、内吞过程、Erbb信号转导、蛋白聚糖合成及核苷酸切除修复过程。有研究[26]通过实验证明异常的泛素介导蛋白水解过程会促进肿瘤的发生、发展。蛋白聚糖是一类特殊的糖蛋白,由一条或多条糖胺聚糖和一个核心蛋白共价链接而成,在肝脏内的聚集会改变肝脏的生理功能并且在肝癌发生、发展中起到重要作用[27],以上研究都与本研究结果相一致,进一步证明了结果的可靠性。
基于此,我们猜测DCP1A可能通过行使eRNAs功能促进其下游基因PRKCD表达,导致异常的泛素介导蛋白水解过程、蛋白聚糖合成等多种途径,从而促进HCC的发生、发展,同时eRNA DCP1A表达在肾透明细胞癌、直肠腺癌及胸腺瘤中同样与患者预后有显著相关,这进一步提示了eRNA DCP1A可以作为新的肿瘤治疗靶点,也为恶性肿瘤患者的治疗提供了新思路。
