从抑制髓源抑制性细胞的募集探索肺瘤平联合化疗对肺癌的作用和机制*
2020-04-06耿良,吕静,范敬
耿 良,吕 静,范 敬
(1. 郑州大学附属肿瘤医院 郑州 450008;2. 郑州卫生健康职业学院中医教研室 郑州 450005;3. 河南中医药大学管理学院 郑州 450000)
肺瘤平膏是中国中医科学院广安门医院院内制剂,以益气养阴、清热解毒活血为组方原则,在临床应用多年,深受患者好评。既往的基础研究显示:肿瘤细胞与肿瘤相关巨噬细胞共培养后,肿瘤细胞的上皮间质转化(Epithelial-mesenchymal transition,EMT)倾向增强,迁移和侵袭能力提高,同时伴有NF-κB 通路活性上调和培养上清中炎性因子水平升高,而肺瘤平干预后可部分逆转这种现象[1],这使我们认识到肺瘤平的作用可能与调控炎性微环境、影响肿瘤对机体细胞的修饰有关。近年来髓源抑制性细胞在肺癌乃至肿瘤中的作用逐渐引起重视,而炎症正是其募集的内在基础之一,而通过调控炎性微环境来抑制肿瘤对骨髓来源细胞的募集和修饰也可能是扶正解毒类中成药发挥作用的内在机制之一,本人所主持的一项国家自然科学基金和一项河南省科技厅科技攻关项目的设计思路即来源于此。本研究观察了肺瘤平联合环磷酰胺对肺癌小鼠炎性通路以及髓源抑制性细胞(Myeloid-derived suppressor cells,MDSCs)募集的作用,以进一步探索肺瘤平膏发挥抗肿瘤作用的内在机制。
1 材料和方法
1.1 实验动物、细胞株和药物
雄性BALB/c 裸鼠、Lewis 肺癌瘤株和实验药物肺瘤平膏、环磷酰胺购买途径均与本团队既往研究[2]相同。
1.2 主要试剂和仪器
小鼠白介素1β(IL-1β)单克隆抗体(ab200478)、信号转导与转录激活因子3(STAT3)单克隆抗体(ab119352)、核因子κB(NF-κB p65)多克隆抗体(ab16502)、基质金属蛋白酶2(MMP-2)单克隆抗体(ab181286)、基质金属蛋白酶9(MMP-9)单克隆抗体(ab228402)和肿瘤坏死因子α(TNF-α)单克隆抗体(ab215188)抗体购自美国abcam 公司,血管内皮生长因子A(VEGF-A)单克隆抗体(701124)、缺氧诱导因子1-α(HIF-1α)单克隆抗体(MA1-46457)购自美国Invitrogen 公司,单核细胞趋化蛋白1(MCP1)单克隆抗体(41987)购自美国Cell Signaling 公司,β-actin 单克隆抗体(TA-09)购自中国中杉金桥公司。FITC Rat anti-mouse Ly-6G/Ly-6C 流式抗体(553127)、PE Rat anti-mouse CD11b 流式抗体(553311)购自美国BD 公司。小鼠 IL-1β(MLB00C)、VEGF-A(MMV00)、MMP-2(MMP200)、MMP-9(MMP T90)、MCP1(MJE00B)和TNF-α(MTA00B)ELISA 试剂盒购自美国R&D 公司。
流式细胞仪(美国BD 公司);小型电泳系统(美国BIO-RAD 公司);凝胶成像系统(美国 BIO-RAD 公司);温控摇床(美国New Brunswich 公司);酶标仪(美国BioTek公司);恒温箱(中国Blue pard公司)。
1.3 动物造模和药物干预
建立动物模型和药物干预的方法同文献[2]。
1.4 取材和观察指标
记录各组小鼠的体质量、肿瘤大小、食物消耗量,绘制肿瘤生长曲线,计算肿瘤增殖指数。各组均在第15天结束给药,处死小鼠,提取小鼠外周血、脾脏和肿瘤局部的细胞,流式细胞术检测其中Gr-1+CD11 b+MDSCs的比例。取肿瘤组织采用免疫印迹法检测炎症通路 IL1、TNF-α、NF-kB、STAT3 和肿瘤相关因子MMP-2、MMP-9、MCP1、HIF-1α、VEGF-A 的表达。取血 清 采 用 ELISA 法 检 测 IL-1β、MMP-2、MMP-9、VEGF-A、TNF-α、MCP1的浓度。
1.5 流式细胞术检测MDSCs的比例

图1 瘤块大小
采用参考文献[3]方法,分别制备肿瘤组织细胞悬液、外周血细胞悬液和脾脏细胞悬液,将荷瘤小鼠外周血、脾脏和肿瘤组织的细胞分别装入4个试管中,每管细胞数调整为1 × 106个,用PBS 悬浮细胞,混匀后离心弃上清,重复本操作洗涤2 次。前3 管细胞为对照组,1 管细胞不加抗体,1 管细胞加入 0.25 μL 的FITC Ly-6G/Ly-6C 抗体,1 管细胞加入 0.25 μL 的 PE CD11b 抗体,最后1 管作为实验组加入上述2 种抗体,避光孵育后每管细胞加入PBS 悬浮细胞,混匀后离心弃上清,重复本步骤洗涤2次。每管加入200μL的1×PBS悬浮细胞,上流式细胞仪检测。
1.6 免疫印迹法检测蛋白表达
操作方法同文献[2]。
1.7 ELISA法测定血清中肿瘤相关因子的表达
摘取小鼠眼球取外周血,放置4 h,离心取血清保存于-20℃。临用时恢复至室温,按ELISA试剂盒说明书进行操作,测定小鼠血清 IL-1β、MMP-2、MMP-9、VEGF-A、TNF-α、MCP1的水平。
1.8 统计方法
数据应用SAS 9.2 统计软件进行处理。统计描述均采用均数±标准差()表示,假设检验均采用单因素方差分析,两两比较采用LSD 法;P<0.05 认为差异有统计学意义,所有检验均采用双侧检验。
2 结果
2.1 各组小鼠的肿瘤大小、肿瘤生长曲线和食物消耗量
各组小鼠的肿瘤大小在前9 天无明显差别,从第10 天开始出现差异,第15 天处死小鼠时H+F 组小鼠的肿瘤体积在各组中最小,F 组小鼠肿瘤体积最大,H组和S 组相近,介于二者之间(图1)。H+F 组小鼠的瘤块增值率在各组中最低,食料消耗量最高(图2-3)。
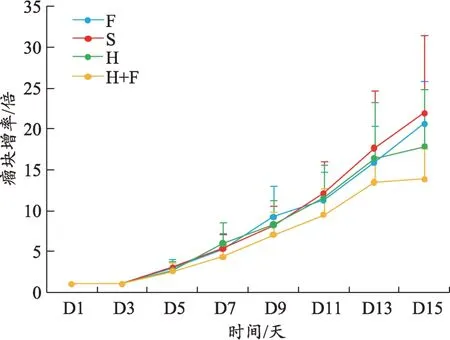
图2 瘤块增殖率
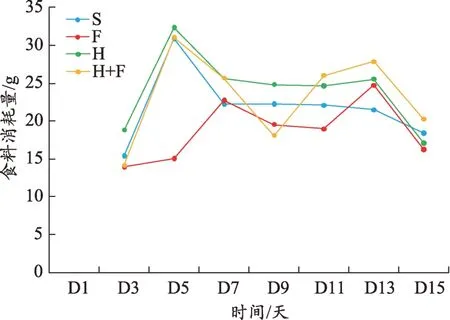
图3 食料消耗量
2.2 各组小鼠外周血、脾脏、肿瘤组织中MDSCs 的比例
H 组和H+F 组小鼠肿瘤组织中和外周血中MDSCs 比例与 S 组相比呈现下降(图 4、图5),其中H+ F 组下降最为明显,与S 组相比具有显著差异(P<0.05)。H 组和H+F 组小鼠脾脏中的MDSCs 比例与S组相比均明显下降(图6),与S 组相比具有显著差异(P< 0.05),而H+F组下降的更为明显(表1)。

图5 血MDSCs比例(%)
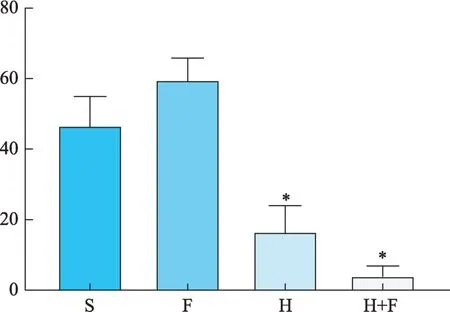
图6 脾MDSCs比例(%)

表1 肿瘤组织、外周血和脾脏中MDSCs的百分比(n = 10)
2.3 各组肿瘤组织炎症通路和肿瘤相关因子的蛋白表达
H 和 H + F 组肿瘤组织中 TNF-α/IL-1-NF-κB/STAT3 炎症通路的蛋白条带灰度值较S 组明显下降(P< 0.05),其中H + F 组下降的更加明显,但与H 组相比,差异不具有统计学意义(P> 0.05)。此外,F 组在 NF-κB/STAT3 和 TNF-α/IL-1 的表达上有所差别,与S 组相比,TNF-α/IL-1 的表达显著降低(P< 0.05),但NF-κB/STAT3则无明显差异(图7-图10、表2)。
H 和 H + F 组 MCP-1、VEGF、MMP-2 的蛋白条带灰度值较S 组显著下降,差异具有显著性(P<0.05)(图12、图13、图15)。但对HIF-1α和MMP-9来说,仅有 H + F 组的 HIF-1α和 MMP-9 的蛋白表达显著降低,H组和F组均未降低,反而呈现升高趋势(图11、图14、表2)。

图7 TNF-α蛋白灰度值

图8 IL1β蛋白灰度值
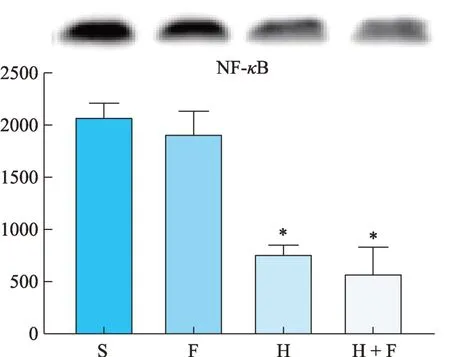
图9 NF-κB蛋白灰度值
2.4 各组小鼠血清肿瘤相关因子的表达
H+F组小鼠外周血中的IL-1β、MMP-2、MMP-9、VEGF-A 的水平均较S 组显著下降(P< 0.05),此外H组的IL-1β浓度与S 组相比差异也具有统计学意义(P< 0.05),而各组小鼠TNF-α、MCP1 的血清浓度均无显著性差异(表3)。

图10 STAT3蛋白灰度值
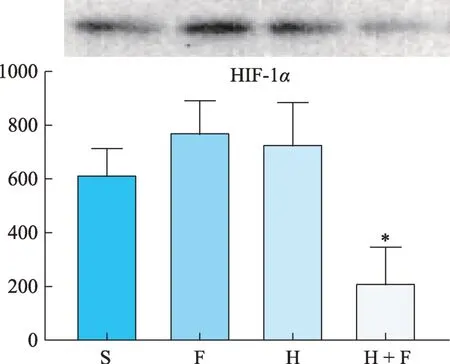
图11 HIF-1α蛋白灰度值
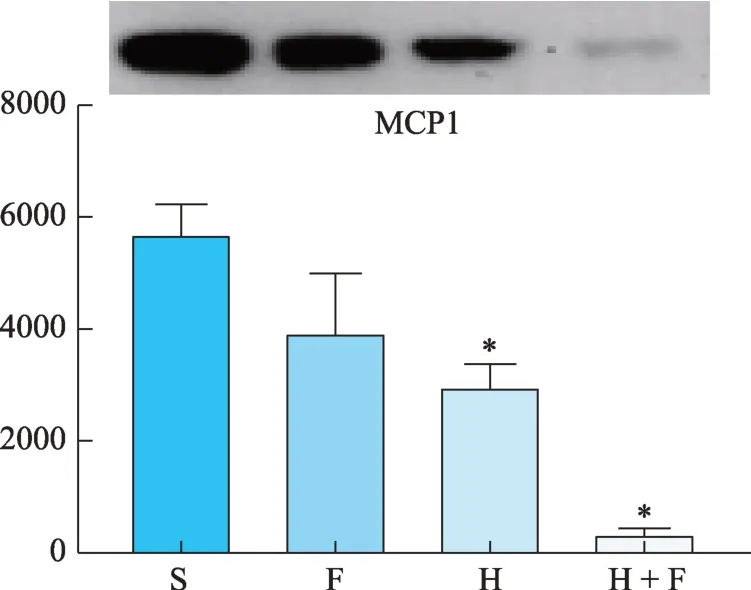
图12 MCP1蛋白灰度值
3 讨论
炎症是肿瘤微环境的核心特征之一,对肿瘤细胞的增殖、转移至关重要,而在炎症的形成和维持中并不是单单依靠肿瘤细胞自身,被肿瘤招募和修饰的各种细胞,如髓源抑制性细胞(MDSCs)、调节性树突状细胞(Regulatory dendritic cells,DCreg)等在其中发挥着重要作用[4],这些细胞在被肿瘤细胞招募后,他们的生物学特性就发生了变化,会被肿瘤细胞修饰,使其向有利于肿瘤进展的方向发展[5-7]。

表2 各组小鼠肿瘤组织相关指标的蛋白条带灰度值(n = 10)

图13 MMP-2蛋白灰度值
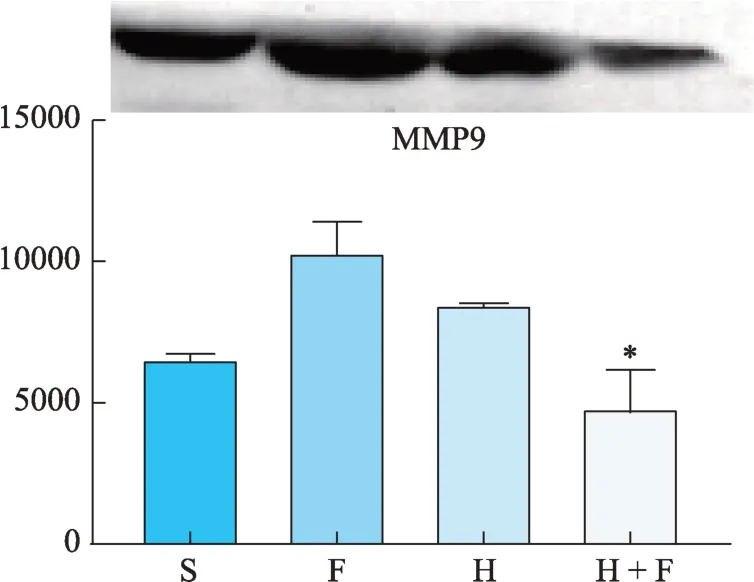
图14 MMP9蛋白灰度值
在被肿瘤招募的细胞中,MDSCs 的地位越来越受到重视,目前的研究发现,在多种肿瘤人群和荷瘤动物模型中都可见到MDSCs大量扩增,并在肿瘤的进展中发挥重要作用[8]。

图15 VEGF-A蛋白灰度值

表3 各组小鼠肿瘤相关因子的浓度/(ng·mL-1)(n = 10)
我们的研究发现,单用肺瘤平对荷瘤小鼠的肿瘤生长并没有明显的抑制作用,但对TNF-α/IL-1通路接到的炎症具有一定的抑制作用。而化疗药不但可直接抑制肿瘤生长,也能同时抑制TNF-α/IL-1-和NF-κB/STAT3 通路的表达,但对外周血和肿瘤组织中的MDSCs 数量没有显著的影响。而肺瘤平与化疗药联用后,小鼠肿瘤生长受到抑制最为明显,同时该组小鼠外周血、脾脏、肿瘤组织中的MDSCs 数量在各组中最低,并伴有TNF-α/IL-1-NF-κB/STAT3 炎症通路的抑制和 VEGF、MMP-2、IL-1β、MMP-9 等炎性和血管生成因子水平的下调。
既往研究表明,肿瘤细胞可通过自分泌途径释放IL-1β、TNF-α等促炎因子,TNF-α和 IL-1β在慢性炎症的启动中是必需的,可通过启动炎症反应参与肿瘤的血管生成、免疫抑制、上皮间质转化等多个方面,而且 TNF-α本身即可增加 MDSCs 的数量[9],IL-1β也可以诱导荷瘤小鼠体内MDSCs 的聚集和免疫的抑制[10],他们还能通过激活NF-kB 通路放大对MDSCs 的募集力度。NFκB 通路是促炎细胞因子及与慢性炎症相关重要介质释放的主要调控器[11],通过与目标蛋白特定基因序列绑定,可调控包括炎症、免疫调控、肿瘤细胞增殖、侵袭、转移、血管新生和放化疗耐受在内超过400 个基因的转录,从而在肿瘤的上皮间质转化和侵袭、免疫抑制、血管生成等多个环节中发挥重要作用[12]。STAT3与NFκB一样,是机体炎症调控的主要通路之一,激活后可促进肿瘤的生长增殖,增强肿瘤的侵袭转移能力,加速免疫抑制微环境的形成,更是调节MDSCs的主要转录因子之一,其活化后可显著扩增MDSCs,基因敲除或阻断 STAT3 后,可减少 MDSCs 数量并促其分化,进而下调免疫抑制,增强免疫抗瘤作用[13]。而且,越来越多的研究表明,NF-κB和STAT3两条信号通路之间存在着交叉联系[14,15]。TNF-α/IL-1-NF-κB/STAT3 通路的活化会形成恶性循环,被募集的细胞会同原有的肿瘤细胞一起产生更多的细胞因子从而加速肿瘤进展。
除了IL-1β、TNF-α等促炎因子外,肿瘤还可通过肿瘤微环境中另一个核心特征—缺氧诱导HIF-1α表达上调进而启动肿瘤募集。炎症是以炎性细胞浸润为标志,髓细胞系的中性粒细胞、单核/巨噬细胞是自然免疫系统最重要的细胞,炎症部位的髓细胞约95%是经趋化、召集,通过逆氧梯度的移动,向缺氧部位浸润的。因此,缺氧和炎症在肿瘤微环境中互为因果,密不可分,缺氧能够通过HIF-1α直接调控炎性因子的表达,反之亦然,IL-1β、TNF-α等致炎性细胞因子也能激活HIF-1α的转录活性。HIF-1α不但能通过激活COX-2、NF-κB等炎症通路从而启动MDSCs募集以外[16,17],还可以刺激 MDSCs 分泌更多的精氨酸酶 1 和诱导性一氧化碳合酶,减少自然杀伤细胞对肿瘤细胞的免疫攻击[18],以及直接上调VEGF 和MMPs 的表达,从而调控肿瘤的血管生成。
而VEGF、MMPs是肿瘤微环境中非常重要的细胞因子,VEGF 除了刺激血管生成促进肿瘤生长以外,还是MDSCs 的化学诱导物,能促进MDSCs 的募集,而被募集的MDSCs 又可以分泌VEGF 诱导活化更多的MDSCs[19]。而MMPs 除了可以介导肿瘤细胞的上皮间质转化和基底膜的降解,以及诱导血管新生从而促进肿瘤生长、转移以外[20,21],还可以通过将骨桥蛋白裂解成一种特殊的32 kDa 大小的碎片从而促进MDSCs 的活化和扩增[22]。
综合我们的结果,我们发现单用肺瘤平对小鼠的肿瘤生长并没有明显的抑制作用,而化疗药则可抑制肿瘤的生长,肺瘤平+化疗则抑瘤效果最优,因此我们认为肺瘤平和化疗药物在控制肺癌小鼠肿瘤生长上具有协同作用,而这种协同作用可能来自于化疗药物对肿瘤细胞的直接杀伤,和二者对TNF-α/IL-1-NF-κB/STAT3炎症通路的抑制,这种抑制降低了肿瘤局部VEGF、MMP-2、MMP-9、IL-1β等炎症和血管生成因子的水平,进而减少了肿瘤对MDSCs 的募集、活化和对机体免疫的抑制。此外,HIF-1α-VEGF/MMPs 介导的血管生成也在其中发挥作用,但其作用强度和具体通路,以及与TNF-α/IL-1-NF-κB/STAT3 炎症通路的关系如何,还需要下一步更深入的研究加以解答。
