运动与褪黑素抗抑郁的作用、机制以及联合策略研究进展
2020-04-06黄卓淳漆正堂刘微娜
黄卓淳 ,漆正堂 ,刘微娜 *
抑郁症患者多伴有昼夜节律紊乱或睡眠障碍,而经典的三环类抗抑郁药tricyclic antide pressive agents(TcAs)和选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)不但不能改善抑郁症相关的昼夜/季节性节律功能障碍或睡眠障碍,反而会扰乱患者的昼夜节律、睡眠结构等,进而影响长期治疗(Li et al.,2017)。理想的抗抑郁药除了能改善睡眠障碍外,还应重置紊乱的昼夜节律。因此,靶向改善昼夜节律或睡眠的抗抑郁药物或手段正在吸引越来越多的关注。运动是一种比药物干预更好的调节昼夜节律的方法。定期运动可显著延迟人体昼夜节律起搏器,有助于恢复生物钟的睡眠—觉醒周期(Richardson,2017)。运动可使人更快地适应剧烈变化的睡眠—觉醒周期,治疗因时差或轮班而引起的昼夜节律失调(Aoyama et al.,2017)。当然,运动对昼夜节律系统产生影响需要中长期重复训练,3个月的体能训练可明显减轻老年男性的节律紊乱(Van et al.,1997)。动物研究表明,即使在不定期的情况下进行剧烈跑轮运动,也能防止在持续光照下(这种环境会导致动物心律失常)的大鼠丧失节律性,并使移动到暗环境的心律失常大鼠加速恢复昼夜节律(Lax et al.,1998)。节律紊乱是抑郁症、阿尔茨海默病或帕金森病等神经精神疾病的特征之一,因此,定期运动可能通过调节昼夜节律改善疾病症状(Shub et al.,2009)。评估运动调节昼夜节律效应的主要缺陷是无法直接测量中央起搏器的相移效应。通常采用生物钟的主要输出信号之一,即褪黑素(melatonin,MT)的水平来反映运动对生物钟的相移效应。MT在昼夜节律调节方面起关键作用,有助于昼夜节律与环境光/暗循环的同步,还具有抗抑郁药物的潜力(De Bodinat et al.,2010)。具有抗抑郁活性的MT类似物阿戈美拉汀可通过对前额叶皮质、海马和杏仁核的5-羟色胺2C受体(5-hydroxytryptamine receptor 2C,5-HT2C)受体产生拮抗作用从而缓解抑郁症状。运动对MT昼夜节律和睡眠—觉醒周期(睡眠结构和时间)有显著影响(Atkinson et al.,2007),本文将着重讨论MT在运动调控生物节律以及改善抑郁症方面的作用及机制。
1 褪黑素概述
从蓝藻到人类,大多数生物在生理和行为上都表现出与24 h小时的环境周期同步的节律,即昼夜节律。MT是一种松果体与昼夜节律的黑暗时期同步产生的吲哚胺,MT的产生是通过5-HT作为前体,激活松果体细胞上的β-肾上腺素受体而引发的。MT通过细胞膜受体介导其神经生物学作用,如细胞内信号级联、神经传递、抗氧化和抗炎作用等(Valdes-Tovar et al.,2018)。
1.1 褪黑素生理功能
MT主要在夜间分泌,其合成和分泌受光照和黑暗条件的控制,关键功能是在昼夜环境中提供黑暗信号(Pytka et al.,2017)。MT是昼夜节律和睡眠的标志物和调节因子,其主要生理作用是稳定或加强机体的昼夜节律,也可通过矫正生物钟和调节神经内分泌功能而增强免疫功能、清除氧自由基、抗应激及延缓衰老等(黄雯等,2017)。MT的分泌具有明显的昼夜节律,白天分泌受抑制、晚上分泌活跃,再加上其受体在视交叉上核(suprachiasmatic nucleus,SCN)的定位,因此,MT在调节睡眠—觉醒周期和昼夜节律中作用显著(De Berardis et al.,2011)。研究发现,抑郁症患者血浆MT夜间峰值降低、节律相位紊乱,揭示了MT与抑郁症的联系(Sun et al.,2017)。抑郁症患者睡眠障碍可能与MT分泌异常有关。
1.2 褪黑素受体:MT1和MT2
褪黑素受体(melatonin receptor,MR)是G蛋白偶联受体,其2个亚型(MT1和MT2)主要在SCN、海马、黑质和腹侧背盖区表达(Ng et al.,2017)。下丘脑SCN高密度的MR表明,MT通过这些受体作用影响睡眠和睡眠觉醒周期(Sabolic et al.,2018)。两种MR都参与调节核心生物钟基因(Per1、Per2、Bmal1和Clock)的表达(Nagy et al.,2015)。MT2受体的激活使SCN神经元放电产生的昼夜节律相位前移,但不能排除MT1受体的作用(Dubocovich et al.,2005)。
MT1受体参与MT介导的昼夜节律相位进展,MT1与MT2均参与调节焦虑行为和抑郁行为。MT1和/或MT2受体基因缺失的小鼠表现出焦虑和抑郁表型。MT1基因敲除小鼠在强迫游泳和悬尾实验中活动能力降低,糖水消耗减少,并且皮质酮水平的昼夜节律变化减弱,表现出精神运动障碍(Comai et al.,2015)。终生缺乏MT1信号导致行为异常,包括感觉运动门控障碍和抑郁行为增加,表现出类似抑郁的行为;而MT2基因敲除小鼠则表现出认知缺陷和焦虑行为增加(Liu et al.,2017)。
MR在昼夜节律和情绪障碍中的作用的研究进展,促进了一类新的褪黑素受体激动剂的产生,即由MT受体激活介导的合成配体(Liu et al.,2016),如阿戈美拉汀、雷美替胺、他司美琼、TIK-301等,临床和临床前实验结果都表明靶向MR的选择性配体可以提高药物治疗的功效(Jockers et al.,2016)。基于上述研究,MR有望成为抑郁症干预的新靶点。
1.3 褪黑素合成酶:AANAT和ASMT
经典MT合成途径包括乙酰化和甲基化两步,即5-HT由关键酶芳烷基胺N-乙酰基转移酶(arylalkylamine N-acetyltransferase,AANAT)乙酰化形成N-乙酰血清素(N-acetylserotonin,NAS),随后通过N-乙酰基血清素甲基转移酶(N-acetylserotonin O-methyltransferase,ASMT)将NAS甲基化为MT(李俊彦,2017)。AANAT和ASMT是关键的MT水平调节因子,AANAT和ASMT的活性可能影响NAS的浓度(Dmitrzak-Weglarz et al.,2017)。
AANAT负责管控MT的峰值时间,AANAT基因在凌晨的表达和活性明显增加,MT水平也随之升高(Ma et al.,2017)。动物研究表明,AANAT活性与抑郁症之间存在联系,天生AANAT缺陷的C57BL/6J(B6)小鼠在强迫游泳实验中不动时间增多,表现出抑郁行为(Zhang et al.,2018)。但在深夜,进一步增强AANAT的表达和酶活性并不会导致MT合成的增强,这表明夜间MT合成速率受ASMT的限制(Soria et al.,2010)。抑郁症患者血浆MT水平降低,这与免疫细胞浸润血脑屏障导致大脑炎症反应和可溶性促炎蛋白水平增加有关,ASMT的基因多态性也参与了发病机制,ASMT调节序列的基因变异频率较高及ASMT调节基因的影响导致ASMT mRNA表达下降(Galecki et al.,2010)。另一研究同样证实,抑郁症患者MT水平的下降可能与较低的ASMT mRNA水平和活性有关(Valdes-Tovar et al.,2018)。ASMT催化MT生物合成的最后阶段,这种MT合成限速酶是MT分泌紊乱和抑郁症发展中最可能的遗传因素。
研究发现,AANAT和ASMT分别与重度抑郁症(major depressive disorder,MDD)或复发性抑郁症有关(Brown et al.,2018)。AANAT mRNA在松果体和视网膜以及脑中表达,AANAT多态性与抑郁有关,可能是通过其对NAS或MT合成的影响(Kripke et al.,2011)。NAS不仅是MT前体,还可有效激活TrkB受体从而增强药物的抗抑郁作用(Jang et al.,2010)。用抗抑郁药氟西汀治疗抑郁大鼠可增加大鼠海马中AANAT mRNA的含量,故AANAT缺乏可能与抑郁症的病理有关(Soria et al.,2010)。在复发性抑郁症患者中观察到血浆MT水平降低和海马组织ASMT mRNA及蛋白表达水平下降,可能与编码ASMT的基因变异相关(Galecka et al.,2011)。作为MT合成中的关键酶,ASMT的mRNA和蛋白表达水平在双相情感障碍患者B淋巴母细胞中明显降低,推测ASMT mRNA表达下降会增加双相情感障碍的发病率。
2 抑郁症的昼夜节律紊乱
昼夜节律系统的中断会引起神经生物学功能紊乱,这是由于MT能调节系统和生物钟功能的变化,最终导致抑郁发作和其他疾病(Campos et al.,2013)。MT可调整和恢复昼夜节律,进而发挥其抗抑郁作用,源于昼夜节律紊乱与抑郁症间的双向作用。昼夜节律紊乱不仅会损害或改变动物模型和人类的睡眠特征,而且导致抑郁、双相/季节性情感障碍。导致昼夜节律紊乱的因素是夜间活动增加,伴随着睡眠时间的减少和夜间延长的人造光照。通过控制照明和生活方式来破坏昼夜节律会使个体易患情绪障碍,包括冲动、躁狂和抑郁。反之,抑郁也会导致行为、内分泌和代谢功能的昼夜节律障碍(Emens et al.,2015)。基于时间疗法(如光疗、睡眠剥夺和定期用药等)的治疗效果和治疗机制表明,昼夜节律系统是治疗抑郁症的重要靶点(Swanson et al.,2017)。临床发现,昼夜节律的不同步程度与抑郁症状的严重程度存在关联;随着抑郁症状的改善,昼夜节律也逐渐恢复(Satyanarayanan et al.,2018)。抑郁症患者节律异常的类型具有高度特异性,包括节律的相位提前或相位延迟,节律振幅的增加或降低,以及节律的完全紊乱(Anderson,2018)(图1)。
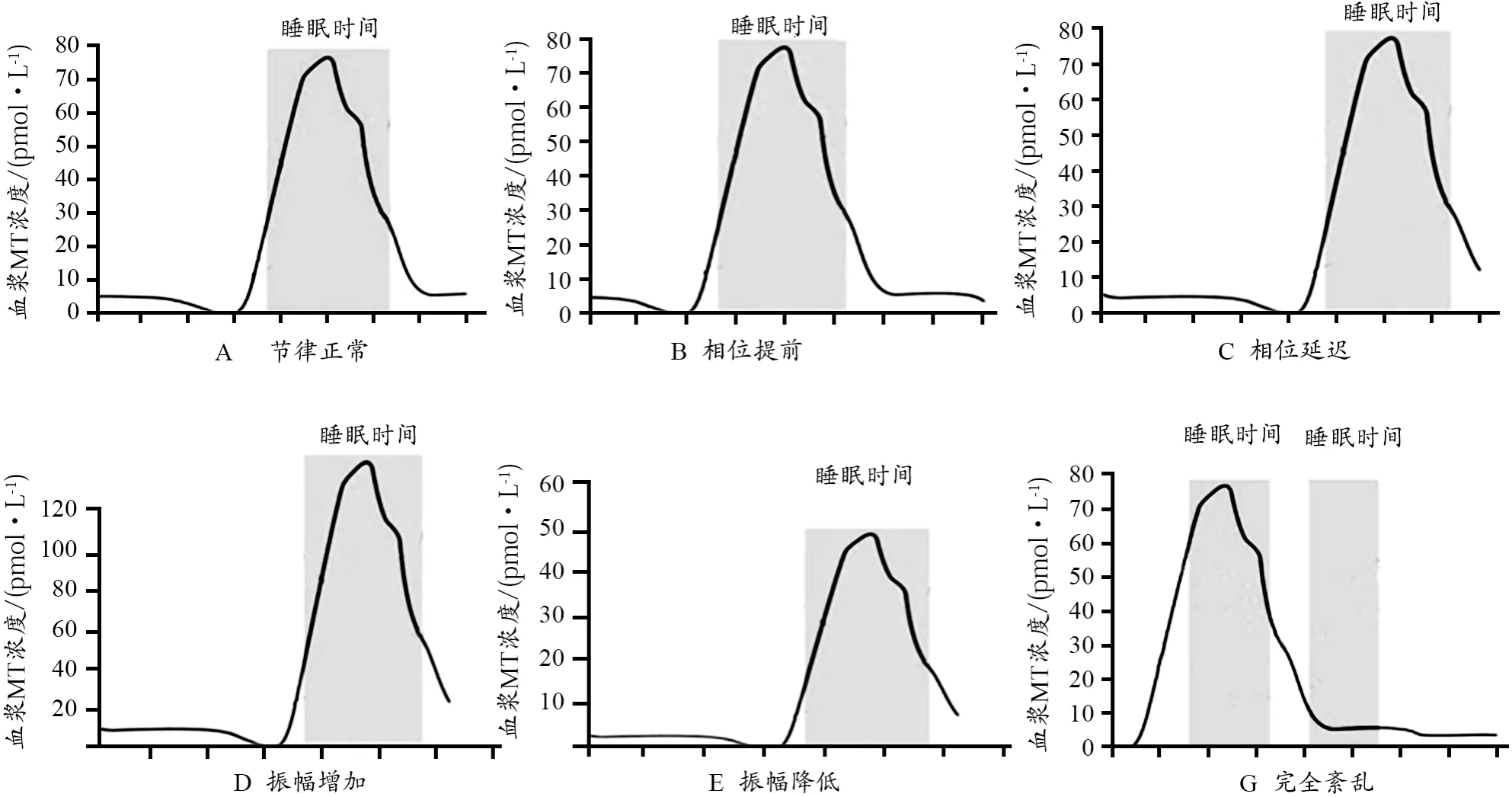
图1 抑郁症患者血浆MT昼夜节律异常的各种类型(Hickie et al.,2011)Figure 1. The Types ofAbnormal Circadian Rhythm of Plasma MT in MDD Patients
睡眠障碍是抑郁症中常见的与昼夜节律相关的紊乱。睡眠—觉醒中断被列为MDD的诊断标准之一,早期识别和治疗睡眠障碍可治疗和预防复发性抑郁症。MDD患者可能出现快速眼动潜伏期减少、快速眼动时间增加、慢波睡眠减少。典型抑郁症患者经常早醒和睡眠中断(Hickie et al.,2013);相反,非典型抑郁症患者通常睡眠时间较晚且睡眠时间更长,但白天容易疲劳。而且,睡眠过度和失眠与自杀有关,强调了治疗抑郁症睡眠障碍的重要性(Agargun et al.,1997)。此外,抑郁症中的一些昼夜节律紊乱可能是由于生物钟基因被扰乱引起的。遗传学研究表明MDD与生物钟基因变异有关,包括CLOCK、CRY1、Per1、BMAL1、NPAS2(神经元 PAS 结构域蛋白 2)、NR1D1(细胞核受体REV-ERBα)等(Etain et al.,2011)。
在抑郁状态下昼夜节律的重要生理生化参数和激素模式被破坏(Tchekalarova et al.,2018)。已有研究发现,MDD患者核心体温、身体活动、促甲状腺激素、去甲肾上腺素和皮质醇的昼夜节律振幅下降(Morris et al.,2009)。研究还发现,抑郁症患者具有典型昼夜节律的内分泌物(如皮质醇、生长激素、催乳素、促甲状腺激素、去甲肾上腺素、MT)失去了昼夜节律,而且人类最明显的昼夜节律过程(睡眠)也失去了昼夜节律性结构,这可能是由于内源性生理起搏器的输出减弱,是与抑郁症最相关的时间生物学异常之一,通过抗抑郁药物治疗可加以纠正(Wittmann et al.,2018)。
3 褪黑素类似物和受体激动剂在抑郁症中的作用
昼夜节律异常与抑郁症相关的发现表明,诸如MT等能复位正常昼夜节律的药物可能具有抗抑郁潜力(Pytka et al.,2017)。MT已成功用于治疗失眠和各种昼夜节律失调,MT及其激动剂可在动物模型中发挥抗抑郁或抗焦虑作用,而且已被证明可有效改善抑郁症状(Dalton et al.,2000)。
目前,在大量合成的MT类似物中仅有两种对治疗有重要意义:一是阿戈美拉汀(Valdoxan®),这是一种具有褪黑素受体激动剂活性的抗抑郁药物;另一是雷美替胺(Rozerem®),用于治疗以睡眠障碍为特征的原发性失眠症。两种非选择性MT1/MT2激动剂他司美琼和TIK-301是正在进行睡眠障碍临床试验最先进的MT候选药物。II期和III期研究表明,他司美琼可能具有治疗昼夜节律睡眠障碍中短暂性失眠的潜力(Zawilska et al.,2009)。Neu-P11也是一种正在开发且具有抗抑郁效应的药物。这些化合物调节啮齿类动物和人类的昼夜节律和神经内分泌功能,对MR的亲和力几乎相同。
3.1 阿戈美拉汀(Agomelatine)
阿戈美拉汀是一种MT1/MT2激动剂以及5-HT2C受体拮抗剂,其睡眠促进作用可归功于其MT能活性,但抗抑郁功能则归功于5-HT2C受体拮抗作用(Laudon et al.,2014)。抑郁动物模型研究发现,阿戈美拉汀在诸如强迫游泳模型(Bourin et al.,2004)、学习无助模型(Fornaro et al.,2010)、社会压力模型(Fuchs et al.,2006)和外源性皮质酮模型(Rainer et al.,2012)中,均显示出抗抑郁活性。抑郁症的重要特征之一是由于脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)表达下降导致的海马神经发生减少(Duman et al.,2006)。阿戈美拉汀可促进BDNF的表达,进而增加海马神经发生(Racagni et al.,2011)。阿戈美拉汀作为5-HT2C受体拮抗剂可促进海马神经祖细胞增殖,作为褪黑素受体激动剂可促进神经元分化和未成熟神经元存活(Liu et al.,2013)。由于阿戈美拉汀能够缓解睡眠障碍和抑郁症状,并且在MDD人群中也能起效,因此在有效控制MDD的抗抑郁药物中有独特的地位(Hojgaard et al.,2018)。
阿戈美拉汀改善紊乱的睡眠模式和昼夜/季节性节律系统的时间生物学特性可能是通过其对MR的激动作用来介导(Liu et al.,2016)。在动物研究中,大鼠被剥夺光线,因此昼夜节律可能被推进或延迟,并且昼夜节律受阿戈美拉汀和MT的影响(Armstrong et al.,1993)。这种作用已在临床上得到证实,如在下午6点给予单剂量阿戈美拉汀可导致MT分泌提前、核心体温和心率减慢,这是昼夜节律进展的标志(Souza et al.,2018)。未来需进一步研究抑郁症患者昼夜节律,利用昼夜节律的敏感指标,如核心体温或MT分泌来详细研究阿戈美拉汀在MDD中的时间生物学效应。
3.2 雷美替胺(Ramelteon)
雷美替胺是一种高亲和力选择性的MT1/MT2受体激动剂,在调节睡眠—觉醒周期和昼夜节律系统中有确定的作用。研究表明,雷美替胺可有效增加失眠患者的总睡眠时间和睡眠效率,减少睡眠潜伏期,且没有明显副作用(Cardinali et al.,2012)。许多临床研究证实了雷美替胺在治疗原发性失眠和与自闭症等神经退行性和神经发育障碍相关的继发性失眠症中的功效。作为辅助治疗手段,雷美替胺对促进双相情感障碍患者的情绪稳定特别有效,且复发可能性几乎是安慰剂治疗患者的一半(Norris et al.,2013)。雷美替胺也可显著改善焦虑症患者的睡眠参数,如睡眠潜伏期缩短、总睡眠时间增加、白天嗜睡减少,且焦虑症状明显改善(Gross et al.,2009)。雷美替胺具有时间生物学效应,有治疗昼夜节律紊乱和睡眠障碍的潜力,因此可能影响抑郁症(Hirai et al.,2005)。在对小鼠小脑颗粒细胞进行的体外研究中发现,雷美替胺可增加BDNF水平,表明它可能改善因MDD导致的海马、杏仁核、前额叶皮质在内的情绪调节关键性脑区的神经组织萎缩和神经细胞丢失(Imbesi et al.,2008)。
3.3 他司美琼(Tasimelteon)
他司美琼(VEC-162),以前称为BMS-214778,是一种对MR具有高亲和力的褪黑素受体激动剂。他司美琼在动物研究中表现出类似MT的昼夜相移特性,在睡眠时间转换后可有效重置昼夜MT节律(Vachharajani et al.,2003)。使用他司美琼可以促进睡眠,为失眠提供重要的治疗选择。在失眠症第II阶段的研究中,他司美琼降低了睡眠潜伏期;与安慰剂和剂量依赖的血浆MT节律相比,提高了睡眠效率。在第III阶段的研究中,他司美琼改善了睡眠潜伏期、睡眠效率和睡眠维持,且没有明显的副作用(Rajaratnam et al.,2009)。在一项大型MDD临床研究的元分析中,有507名受试者参加双重安慰剂对照研究,该研究随机分配为20 mg的他司美琼组(n=254)或安慰剂组(n=253)。研究持续8周,每周用包括汉密尔顿抑郁量表(HAMD)在内的多种抑郁量表对患者进行基线评估。结果显示,20 mg的他司美琼改善了MDD患者的抑郁症状,表明抑郁症的病因和治疗中涉及昼夜节律因素(Polymeropoulos et al.,2018)。
3.4 TIK-301
TIK-301(PD-6735;LY 156735;β-甲基-6-氯MT)是MT的氯化衍生物,具有MT1/MT2激动剂活性以及5HT2C受体拮抗剂活性。2004年,TIK-301收入了FDA用于治疗睡眠障碍。它对MR表现出高亲和力,其对MT1受体的亲和力与MT相似,对MT2受体亲和力更高(Messner et al.,2001)。与MT2受体优先结合是6-氯代MT衍生物的典型特征,TIK-301能有效调节昼夜节律,并表现出与MT相似的减少睡眠潜伏期的作用(Mazzucchelli et al.,1996)。TIK-301在5-HT2C和5-HT2B两种受体亚型中兼具了作为褪黑素受体激动剂和5-HT能拮抗剂的特性,具有潜在的抗抑郁作用(Cajochen et al.,2003)。
3.5 Neu-P11
Neu-P11是一种新型褪黑素受体激动剂,目前被开发用于治疗失眠症。Neu-P11以高亲和力与MR结合并发挥GABA能增强作用。Neu-P11已被证明可以促进睡眠,改善胰岛素敏感性,并在啮齿动物模型中发挥抗抑郁和抗焦虑作用。Neu-P11可降低抑郁大鼠学习无助实验中逃避失败的水平和强迫游泳实验中的不动时间,并增加抑郁大鼠高架十字迷宫实验中进入开放臂的次数和停留时间(Tian et al.,2010)。Neu-P11和MT在抗抑郁和抗焦虑中的不同作用可做如下解释:与MT相比,Neu-P11可与5-HT能受体相互作用,并且亲和力更好;Neu-P11代谢可能生成发挥抗抑郁和抗焦虑作用的活性代谢产物;MT和Neu-P11可能具有不同的药代动力学值,Neu-P11的代谢稳定性可能比MT更长或更强(She et al.,2009)。
4 褪黑素在运动调节昼夜节律中的作用
虽然多数研究发现血浆MT水平在运动后瞬时上升,但也有报道称运动后MT分泌减少或没有变化(Knight et al.,2005)。这种相互矛盾的发现可能是由于不同的照明条件和运动开始时间造成的(Yamanaka et al.,2014)。研究中的光照条件(是否强光)、运动类型、持续时间、强度,以及MT取样部位(唾液还是血浆)和测量方法(RIA还是ELISA)的相互差异也会影响结果(Edwards et al.,2009)。关于运动对MT的持续作用机制(即在运动后的几天),有人认为运动抑制、延缓或促进MT的分泌,取决于运动的相对时间(夜间还是晨间)(Van et al.,1994)。运动也可能影响MT的降解,从而改变血浆MT浓度。或者运动可能只是减少运动时MT的产生。夜间20 min中等强度到高强度的运动强烈抑制了夜间血浆MT水平的增加(Monteleone et al.,1990)。剧烈运动本身会增加机体的氧化应激,这反过来可能会影响外周循环中的MT水平,因为MT被迅速用于对抗自由基损伤;另一方面,MT也可能影响运动的身体表现(Lopez-Samanes et al.,2017)。因此,运动和MT之间存在相互作用,1)运动对MT的分泌有不确定的即刻或延时性影响,从而导致生物节律发生变化;2)MT水平本身也会影响机体的运动能力,从而导致运动能力呈现生物节律性特征。
除了影响MT的分泌水平外(振幅变化),运动还能促使MT昼夜节律发生相移效应。运动对MT节律的影响,取决于一天中的时间、光强度,以及运动时间与MT产生或下降的接近程度(Tahara et al.,2018)。在运动状态和年龄差异很大的人群中,不同时间和强度的运动可以调节分泌产物节律的相移,如MT、皮质醇和促甲状腺激素,独立于光的节律(Atkinson et al.,2007)(图2)。夜间运动会引起MT节律的相位延迟。连续数天的夜间运动对延迟MT节律会产生累积影响(Eastman et al.,1995)。夜间运动和光照条件之间的相移差异在年轻参与者和老年参与者之间相似,这表明年龄不会影响昼夜节律对运动的敏感性(Barger et al.,2004)。运动对昼夜MT节律和睡眠—觉醒周期有不同影响,在昏暗的光线和受限的睡眠下,运动加速恢复了紊乱的睡眠—觉醒周期,但没有加速MT的节律(Yamanaka et al.,2010)。而在明亮的光线中提前8 h进入睡眠,无论运动是否存在,睡眠—觉醒周期都由睡眠时间决定,但是MT昼夜节律的变化取决于运动(Yamanaka et al.,2014)。因此,光和运动是使昼夜节律产生强烈相移的信号。
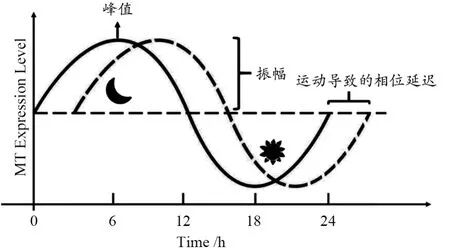
图2 运动导致的MT昼夜节律相移Figure 2. The Phase Shift of MT Circadian Rhythm Caused by Exercise
5 褪黑素与运动的抗抑郁作用
运动抗抑郁的临床效果已经得到了反复证实。在一项持续16周的大型随机对照试验中,运动训练和抗抑郁药物(选择性5-羟色胺再摄取抑制剂舍曲林)对中年和老年人MDD同样有效,维持运动可以降低MDD患者复发风险(Barbour et al.,2007)。研究还发现,身体活动水平与抑郁症之间存在反向关联,即较高的活动水平可以改善抑郁症状。在随访评估中,相对于身体活动水平较高的个体,不爱运动的人患抑郁症的风险增加(Hassmen et al.,2000)。运动还能显著减轻未诊断出临床抑郁症的成年人(Conn,2010)和慢性病患者(Herring et al.,2012)以及临床抑郁症患者(Schuch et al.,2016)的抑郁症状。与抗抑郁药物相比,运动的副作用更少,且可以减少抑郁症患者的各种代谢综合征(Vancampfort et al.,2015)。运动的抗抑郁作用与其改变某些神经生物学机制有关,包括单胺代谢(如增加CNS中的5-HT水平)、HPA轴功能(如长期降低皮质醇的基础水平)、神经营养因子(如增加BDNF和海马神经发生)和神经炎症(如降低促炎介质)。褪黑素能通过这些途径介入运动的抗抑郁作用。
5.1 MT通过促进海马神经发生介导运动抗抑郁作用
MDD患者的一个重要特征是海马体积减小导致认知功能降低,而MT对海马神经发生和神经元分化的刺激对MDD患者有益,MT的抗抑郁作用可能与海马神经发育受昼夜节律的调控有关。海马是典型和非典型抗抑郁药物的主要作用部位,也是整合记忆和学习等认知功能的结构,海马萎缩意味着神经发育过程的整体损伤(Drevets et al.,2008)。研究表明,海马是MT作用的主要靶点,MT可保护该结构免受氧化应激或缺血引起的损伤,还可防止松果体切除大鼠海马区神经元的减少。在啮齿动物中,MT刺激神经可塑性的所有阶段,特别是刺激松果体切除大鼠齿状回的神经发生,并增加小鼠的神经元存活率(Ramirez-Rodriguez et al.,2009)。MT刺激海马中的树突和突触发生,这些过程受到慢性社会心理压力和抑郁症的干扰,并可被抗抑郁药逆转(Kendler et al.,1999)。
海马神经发生在运动和抗抑郁药的抗抑郁作用中起着关键作用(Yau et al.,2011)。在皮质酮诱导的应激动物模型中,运动诱导的BDNF水平升高、海马神经发生和树突状结构重构说明了运动能够改善抑郁(Zhao et al.,2008)。运动在海马的分子水平上促进大脑健康,可增加海马神经发生和突触可塑性,并以类似于慢性抗抑郁药物治疗的方式影响行为,对治疗抑郁症具有潜在意义。运动和MT都可以改善神经发生和加强神经元连接的可能性,进而改善由抑郁导致的海马—前额叶皮层神经通路突触可塑性减少。推测MT在运动过程中,通过影响神经可塑性和海马神经发生从而起到抗抑郁作用。
5.2 MT通过同步生物钟基因表达介导运动抗抑郁作用
外源性MT治疗可预防神经元损伤,MT对神经发生和神经元分化的刺激不仅对MDD患者有益,还可稳定神经可塑性的昼夜节律(Bouchard-Cannon et al.,2013)。昼夜节律系统由位于SCN中的中央生物钟和位于全身的外围时钟组成,其通常与SCN中心时钟同步(Dibner et al.,2010)。主时钟受核心生物钟基因的调节,如Clock,Bmal,Per,Arntl,Nr1d1和Cry等,它们彼此相互作用以影响昼夜节律靶基因的转录(Guissoni et al.,2018),因此这些基因的任何功能发生异常都可能在抑郁症中发挥作用(Bunney et al.,2008)。MT能增加时钟基因Per 1和Per 2的表达,后者在重置生物钟中起着关键作用(Kandalepas et al.,2016)。MT可通过与MT1和MT2相连的信号途径集中参与到调节睡眠—觉醒周期和昼夜节律的过程中(Liu et al.,2017)。研究发现,在短光周期(8 h光照/16 h黑暗)下光偏移前2 h对抑郁小鼠进行MT治疗不仅显著改变了SCN生物钟基因(Per1、Per2、Bmal1和Clock)的mRNA水平,且能改善SCN内生物钟基因在短光周期内的节律紊乱,还可以减少强迫游泳实验中的不动时间,表明MT、生物钟基因和抑郁行为之间存在着密切的联系(Nagy et al.,2015)。
运动是除光之外的可调节生物钟的另一相移信号,运动对昼夜节律紊乱是有益的。在恒定黑暗条件下进行跑轮运动的啮齿动物的节律发生相移,Per1和Per2表达的改变与运动开始的时间相关(Maywood et al.,1999)。研究发现,Clock突变小鼠的骨骼肌表现出线粒体含量和运动耐受性降低,8周的耐力运动可提高骨骼肌线粒体水平和运动耐受性且能恢复紊乱的昼夜节律(Maywood et al.,2013)。血管肠多肽(VIP)缺陷小鼠表现出活动、心率和体温节律的相位提前,以及SCN中Per2节律表达的振幅降低;跑轮运动可改善VIP缺乏小鼠的节律紊乱(Sasaki et al.,2014)。通过运动可将生物钟基因表达保持在适当的相位和幅度,对改善抑郁行为有积极作用,提示运动可能通过MT的节律恢复使生物钟基因表达与昼夜节律同步。
5.3 MT通过BDNF介导运动抗抑郁作用
作为脑中最丰富的神经营养因子,BDNF是一种在神经发生、神经保护、神经再生和突触可塑性中具有重要作用的蛋白质,在抑郁症的发病机制中具有关键作用(Jiang et al.,2017),且被认为是可发挥运动抗抑郁作用的最佳候选分子之一(Duman et al.,2008)。中枢神经系统和血液中的神经营养因子和MT水平受应激、抑郁和抗抑郁治疗的影响(Fernandez et al.,2015)。MDD患者降低的MT和神经营养因子(BDNF、NT-3、NGF等)会降低脑内抗氧化保护机制,诱发炎症反应(Oglodek et al.,2016)。血清神经营养因子浓度和夜间唾液MT浓度的高低可能反映了抑郁症的严重程度。BDNF的分泌遵循生物节律,并且受到光线的影响,因此BDNF可能是与时间疗法相关的生物标志物。抑郁症患者MT分泌节律紊乱可能会影响BDNF的节律,而BDNF紊乱影响突触可塑性,可能导致中枢神经系统神经退行性病变的恶化(Eyre et al.,2012b)。
运动对大脑最有力的影响表现在神经营养因子BDNF水平的极高增长上。研究发现,运动可以提高腰脊髓、小脑和海马神经元中BDNF水平(Toups et al.,2011)。其他研究强调,有氧运动可能是抑郁症治疗的关键手段,可增强BDNF水平和海马体积。支持这一观点的两项研究显示,抑郁症(Laske et al.,2010)和恐慌症患者(Strohle et al.,2010)的长时间体力活动能够增加血清中BDNF的浓度。MT和BDNF均具有神经保护作用,可以增加海马神经发生;通过增加BDNF和MT来增强神经可塑性的干预措施已经被证明可以逆转抑郁症的病理效应,两者被认为可能介导与运动相关的神经可塑性(Pae et al.,2008)。运动可能通过MT的节律恢复或分泌增加,使BDNF节律恢复或表达水平增加,暗示MT可能通过调节BDNF水平介导运动抗抑郁作用。
5.4 MT通过改善炎症及氧化应激介导运动抗抑郁作用
一项关于82项研究的元分析显示,与健康对照组相比,MDD患者外周血细胞因子及趋化因子(包括IL-6、TNF-α、IL-10、CCL-2等)水平显著升高(Kohler et al.,2017)。中枢神经系统(central nervous system,CNS)炎症在MDD的发病机制中发挥了重要作用,CNS损伤后的病理生理改变都可以通过运动来调节,所涉及的机制可能包括升高神经营养因子水平(Kobilo et al.,2011),以及抗炎和抗细胞凋亡(Mota et al.,2012)。MT具有抗炎和抗氧化作用,可通过在不同的病理生理条件下调节促炎细胞因子和抗炎细胞因子来发挥其抗炎作用(Dong et al.,2016)。抑郁状态下MT昼夜节律紊乱与炎症过程的恶化有关,氧化应激诱发了抑郁症的促炎机制,这会影响到大脑防御机制且使MT分泌减少。
有氧运动降低血清IL-1β水平与降低抑郁症严重程度呈正相关,较高的TNF-α基线水平与抑郁症状可能得到较大改善相关(Rethorst et al.,2013)。运动对抑郁相关的神经免疫机制有积极影响,包括减少促炎介质(如TNF-α、IL-6、IL-1β、TLR-4和CRP)、升高IL-10、降低ROS(活性氧)、增加CXCL 1、CXCL 12和MKP-1等(Eyre et al.,2012a)。运动通过神经免疫变化减少MDD中的炎症和氧化应激的可能机制包括增加CNS中巨噬细胞、小胶质细胞数目,上调可负调控促炎巨噬细胞MAPK活化的MKP-1水平以及调节海马T细胞(Chen et al.,2010)。而MT在改善身体表现和运动诱导的氧化应激和炎症反应中发挥了重要作用(Beck et al.,2016)。剧烈运动后可能出现的严重氧化应激可能引发慢性炎症、细胞凋亡和组织坏死等问题,在急性运动中口服外源性MT,可以预防炎症、氧化应激和肌肉损伤(Maldonado et al.,2012)。长期运动能重置MT的分泌节律,急性运动能使MT分泌瞬时增加,提示运动可能通过MT改善炎症和氧化应激发挥其抗抑郁作用。基于上述证据推测,运动、外源性MT与内源性MT需要在时相性上进行精准配伍才能发挥最佳的抗抑郁作用(图3)。
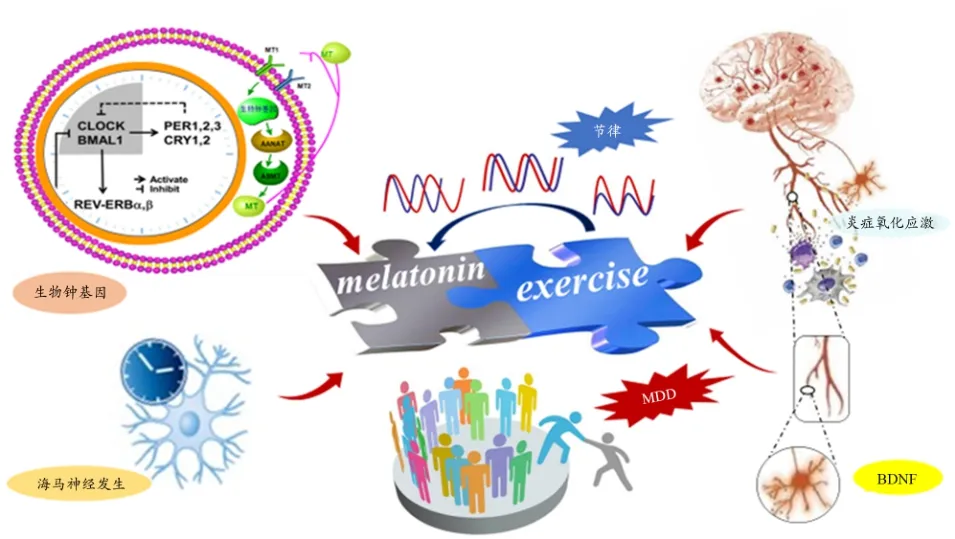
图3 MT在运动调控生物节律和改善抑郁中的作用Figure 3. The Role of MT in the Regulation of Biorhythm and the Improvement of Depression
6 “运动+MT”联合抗抑郁的策略与建议
研究发现,近80%的抑郁症患者睡眠觉醒周期严重紊乱(Armitage et al.,2001),摄入生理剂量的MT可降低睡眠潜伏期,提高睡眠效率并改善总睡眠时间(Wilson et al.,2010)。通过调节MT的分泌以恢复正常的昼夜节律和睡眠—觉醒周期的时间疗法可能是治疗抑郁症的一个潜在疗法。白天摄入MT可能会导致烦躁不安和疲劳,晚睡以及嗜睡(Carman et al.,1976)。且内源性MT的分泌依赖于光/暗周期,内源性MT在正常的光/暗条件下不能成为主要的昼夜节律调节因素(董毅,2019),所以服用MT时需排除光照影响。单独服用MT可能会产生一些抗抑郁作用,但MT本身不是一种抗抑郁药。目前第一种MT抗抑郁药阿戈美拉汀被证明有抗抑郁活性。研究表明,阿戈美拉汀在25 mg/天的标准剂量范围内对MDD有效,改善不足的患者可将剂量提高到50 mg/天(Kennedy et al.,2014)。
运动可以引起昼夜节律相移并重塑睡眠—觉醒周期。在排除光/暗周期的影响下,适当的定时运动可调整生物节律,如MT的分泌时间(Kim et al.,2013)。由于运动引起皮质醇增加,晚上的高强度运动会减少MT的分泌,增加睡眠潜伏期且降低睡眠效率(Monteleone et al.,1992)。当在黑暗或非常暗的光线下运动时,夜间运动会使MT节律相位延迟(Barger et al.,2004)。最近有一项研究,是对101名参与者在8个不同时间点运动后的生物节律进行的长达5天半的检查,研究发现,上午7点或下午1—4点的运动使生物节律相位提前,并且在7—10点的运动使生物节律相位延迟。然而在凌晨1—4点以及上午10点的锻炼对生物钟没有什么影响,并且运动的相移效应在年龄和性别上没有差异(Youngstedt et al.,2019)。
由于抑郁症患者的夜间MT释放通常会减少,这种下降可能与睡眠障碍有关。而白天摄入MT会导致体温下降,反应速度减慢,影响认知功能,所以患者可在睡前补充外源性MT,以恢复紊乱的昼夜节律,其中还需排除光照影响。MT能使生物节律(内源性MT、核心温度、睡眠)发生明显相移,所以应该根据相位反应曲线的提前或延迟,选择生理剂量(0.1~0.3 mg,能在24 h内被循环清除)和药理学剂量的MT(5 mg,不能在24 h内被循环清除)。相比之下,仅用MT治疗似乎不能起到一个很好的抗抑郁效果,因为MT主要是靶向紊乱的昼夜节律。可使用MT作为抗抑郁药物的附加物,通过协同作用来缓解抑郁症,或直接使用褪黑素受体激动剂阿戈美拉汀。目前阿戈美拉汀治疗MDD的推荐剂量为25 mg/天,如果治疗2周后症状没有改善,可增加剂量至50 mg/天,均为睡前口服(洪武等,2018)。研究发现,晚上运动或长时间的剧烈运动会增加光线暴露,诱发睡眠障碍及抑制MT的分泌(Rosa et al.,2016),建议MDD患者可选择白天中等强度的有氧运动。总之,运动能改变生物钟,这种效果的方向和强度取决于运动在白天或夜晚的时间。基于抑郁症的昼夜节律紊乱有5种不同类型,我们提议:面对相位延迟或提前的MDD患者要重点考虑运动和口服MT的时间,面对振幅提高或降低的MDD患者要充分考虑运动强度和恢复,并需要MDD患者根据自己的昼夜节律和睡眠时间选择合适的运动时间和强度。
7 结论与展望
恢复昼夜节律同步是抗抑郁治疗的重要策略之一。其中,MT的分泌以及生物节律发挥关键作用。运动不仅对MT的分泌水平有即刻或延时性影响,也对MT昼夜节律有相移效应,但是运动对MT振幅和相移的作用效果却是不确定的,取决于光照条件、运动时间、强度、年龄等多种因素。抑郁症患者的昼夜节律紊乱表现为MT振幅增加或降低、相位提前或延迟或完全紊乱等5种类型,这就要求运动应在不同抑郁类型的准确时间点切入,促使MT向振幅正常、相位正常的方向偏移。运动的抗抑郁效果是否应遵从MT的生物节律,是值得进一步研究的课题。此外,在分子机理层面,运动的抗抑郁作用涉及MT对海马神经发生、生物钟基因表达、BDNF水平及炎症和氧化应激的调节作用。运动的抗抑郁作用,一方面通过MT的分泌调节恢复MT乃至整个机体昼夜节律,还能通过MT及其受体的基因表达调节促使海马神经发生,使生物钟基因表达与昼夜节律同步,另一方面通过影响MT节律来恢复BDNF节律和提高BDNF水平及改善氧化应激。
