小檗碱对高糖诱导心肌细胞AMPK-AS160-GLUT4通路的调节及保护作用
2020-04-05王瑞瑶霍梦露李超关锡梅倪伟建唐丽琴
王瑞瑶,霍梦露,李超,关锡梅,倪伟建,唐丽琴
[1.安徽中医药大学药学院,合肥 230031;2.中国科学技术大学附属第一医院(安徽省立医院)药剂科]
糖尿病是一类以胰岛素分泌的绝对或相对不足而引起的持续性高糖为特征,并伴有脂肪,蛋白质代谢紊乱的内分泌性疾病[1]。糖尿病心肌病(DCM)是由糖尿病引起的、与血管疾病同时伴行或单独发生的特殊性心肌病,是糖尿病最为严重的并发症之一[2]。糖尿病心肌病状态下由于心脏代谢紊乱,微血管病变引发心脏广泛灶性坏死,出现亚临床心功能异常,最终发展为心律失常、心力衰竭以及心源性休克[3]。目前糖尿病心肌病发病原因尚不清楚,研究显示,慢性高血糖会通过电子链使活性氧(ROS)大量生成,进而诱发心肌细胞凋亡。2型糖尿病患者通常伴随高胰岛素血症,在高胰岛素和胰岛素抵抗情况下心脏对于葡萄糖利用明显减弱,从而使心脏更多依赖于脂肪酸氧化进行能量代谢,相应的葡萄糖转运蛋白GLUT1及GLUT4表达减少,导致心脏能量代谢效率大幅降低[4],其中GLUT4主要在胰岛素敏感的骨骼肌、心肌和脂肪细胞中表达,因此刺激GLUT4质膜转运将会是改善心脏葡萄糖代谢障碍重要的一环[5-8]。小檗碱(BBR)是黄连根茎中的主要成分,有降血糖、降血脂之功效,为黄连治疗消渴的物质基础。有研究报道,小檗碱可通过激活AMPK抑制脂肪合成,改善胰岛素抵抗[9]。AMPK为生物能量代谢关键分子,其所调控的AS160蛋白即为GLUT4关键激动蛋白。因此本实验将通过高糖诱导心肌细胞模拟糖尿病机体心脏高血糖环境,探讨BBR对高糖诱导心肌细胞糖代谢功能以及心肌细胞损伤是否有改善作用,为BBR治疗DCM提供理论依据。
1 材料与方法
1.1 细胞及培养 H9c2(2-1)大鼠心肌细胞购自中国科学院上海细胞库,使用Low Glucose DMEM培养基+10%胎牛血清+1%双抗培养,培养环境温度37 ℃,5%CO2浓度。
1.2 药品与试剂 小檗碱由中国科学技术大学附属第一医院药剂科提取纯化(小檗碱纯度98%);兔抗腺苷酸活化蛋白激酶(AMPK)单克隆抗体,兔抗磷酸化腺苷酸活化蛋白激酶(P-AMPK)单克隆抗体,兔抗丙酮酸脱氢酶(PDH)单克隆抗体,兔抗磷酸化糖代谢调节蛋白(P-AS160),兔抗甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体购自CST公司;兔抗葡萄糖转运蛋白4(GLUT4),兔抗糖代谢调节蛋白(AS160),购自Abcam公司;辣根酶标记的山羊抗兔IgG购自CST。Immobilon Western ECL化学发光试剂盒,PVDF膜购自Millpore;磷酸酶抑制剂,蛋白酶抑制剂购自Med Chem Express;Quickblock一抗稀释液,Quickblock二抗稀释液,SDS-PAGE凝胶快速配置试剂盒,PMSF,RIPA裂解液(强),BCA蛋白定量试剂盒,SDS-PAGE蛋白上样缓冲液(5×),曲拉通X-100,DAPI染色液,青霉素-链霉素双抗,胰酶细胞消化液购自碧云天;甘氨酸,Tris购自北京索莱宝;H9C2(2-1)大鼠心肌细胞购自中国科学院上海细胞库;DMEM低糖培养基购自Hyclone;胎牛血清购自Gibco;CCK-8试剂盒,膜蛋白和胞浆蛋白提取试剂盒购自上海贝博;Annexin V-FITC凋亡检测试剂盒购自南京维诺赞公司;鬼笔环肽购自Sigma;4%多聚甲醛购自Biosharp。
1.3 主要仪器 超净工作台,苏州净化技术有限公司;细胞培养箱,上海力申科学仪器有限公司;压力蒸汽灭菌器,上海申安仪器厂;金属浴,杭州博日有限公司;超声波清洗器,宁波新芝生物科技有限公司;电子分析天平,Mettler Toledo公司;纯水机,力康仪器有限公司;超低温冰箱,中科美菱有限公司;高速冷冻离心机,安徽中科中佳科学仪器有限公司;酶标仪,美国Molecular Devices公司;摇床,海门市其林贝尔仪器制造有限公司;电泳装置及转膜装置,上海天能科技有限公司;制冷剂,常熟市雪科电器有限公司;化学发光成像仪,上海培清科技有限公司。流式细胞仪,美国Beckman Coulter公司。荧光显微镜,德国Leica公司。
1.4 方法
1.4.1 细胞计数 台盼蓝染色液经0.22 μm滤膜过滤备用。将细胞消化,细胞悬液转移至EP管中吹打混匀,取10 μL细胞悬液与台盼蓝染液等体积混匀,吸取10 μL至细胞计数板。将计数板插入细胞自动计数仪,于显示屏上可见活细胞呈中间通透圆点状,死细胞为实心深色圆点状,待机器自动计算板中活细胞及死细胞数量,记录数据。
1.4.2 细胞活力检测 根据细胞计数结果,将细胞加入培养基稀释密度至1×105/mL。横向加入96孔板各孔100 μL细胞悬液,边缘36孔加入PBS。待细胞长至70%~80%,弃去原培养基,分别加入高糖(葡萄糖浓度50 mmol/L)及BBR(浓度分别为25、50、100 μmol/L)组,模型组(葡萄糖浓度50 mmol/L)和健康对照组干预24 h。各孔加入培养基体积十分之一体积即10 μL CCK-8试剂。4 h内任意时间点读板,选取吸光度(OD)值在1.0附近时分析。
1.4.3 细胞凋亡检测 使用Annexin V-FITC/PI双染法检测心肌细胞凋亡,分组为健康对照组,高糖诱导模型组及高糖条件下BBR(浓度分别为25、50、100 μmol/L)加药组,心肌细胞培养24 h后收集各实验组细胞,控制1×106个细胞与500 μL工作液中,加入10 μL FITC染液,混匀避光室温孵育10 min,再在每组加入5 μL PI染液同样混匀避光室温孵育10 min,上流式细胞仪检测细胞凋亡百分率。
1.4.4 心肌细胞骨架观察 将心肌细胞接种在24孔板中,分组同1.4.3分别加入高糖及小檗碱刺激24 h,弃去培养基,用37 ℃水浴中预热的PBS洗2次,向各孔中加入150 μL 4%多聚甲醛固定细胞,室温孵育10 min。吸出多聚甲醛,用PBS冲洗2次,加入200 μL 0.1%曲拉通,室温孵育5 min后用PBS冲洗2次。向每孔中刚加入100 μL现配0.1%鬼笔环肽,室温避光孵育30 min,于摇床上使用PBS洗3次,每次5 min,再加入100 μL DAPI染液,室温避光孵育10 min,用PBS清洗2次,每孔加入200 μL PBS于荧光显微镜下观察。
1.4.5 Western blot检测相关蛋白表达 取处于对数生长期细胞,分组为高糖条件下BBR(25、50、100 μmol/L)浓度组,模型组,对照组,以1×108个/孔接种六孔板,加药处理24 h后使用细胞刮收集细胞,加入RIPA裂解液及膜蛋白或胞浆蛋白提取试剂盒分别提取细胞总蛋白或膜蛋白,BCA定量测定蛋白浓度。总蛋白与膜蛋白分别加入1/4体积的SDS-PAGE蛋白上样缓冲液(5×),总蛋白放入沸水煮沸5 min后备用,膜蛋白-80 ℃保存备用。待SDS-PAGE凝胶电泳结束,切胶转PVDF膜,放入5%脱脂牛奶室温封闭2 h,TPBS洗涤3次,置于配置好的辣根过氧化酶标记的二抗室温孵育2 h,ECL显色,利用Image J软件分析灰度值,以GAPDH为内参考察各蛋白变化。

2 结果
2.1 BBR对高糖诱导心肌细胞存活率影响 图1的CCK-8结果显示,高糖刺激24 h后,与健康对照组相比,高糖组细胞存活率明显下降;BBR(25、50、100 μmol/L)与高糖组相比可以逐步提高心肌细胞存活率,且呈浓度相关性。

注:与健康对照组比较,aP<0.01;与高糖组比较,bP<0.05
图1BBR对高糖诱导心肌细胞存活率的影响(n=3)
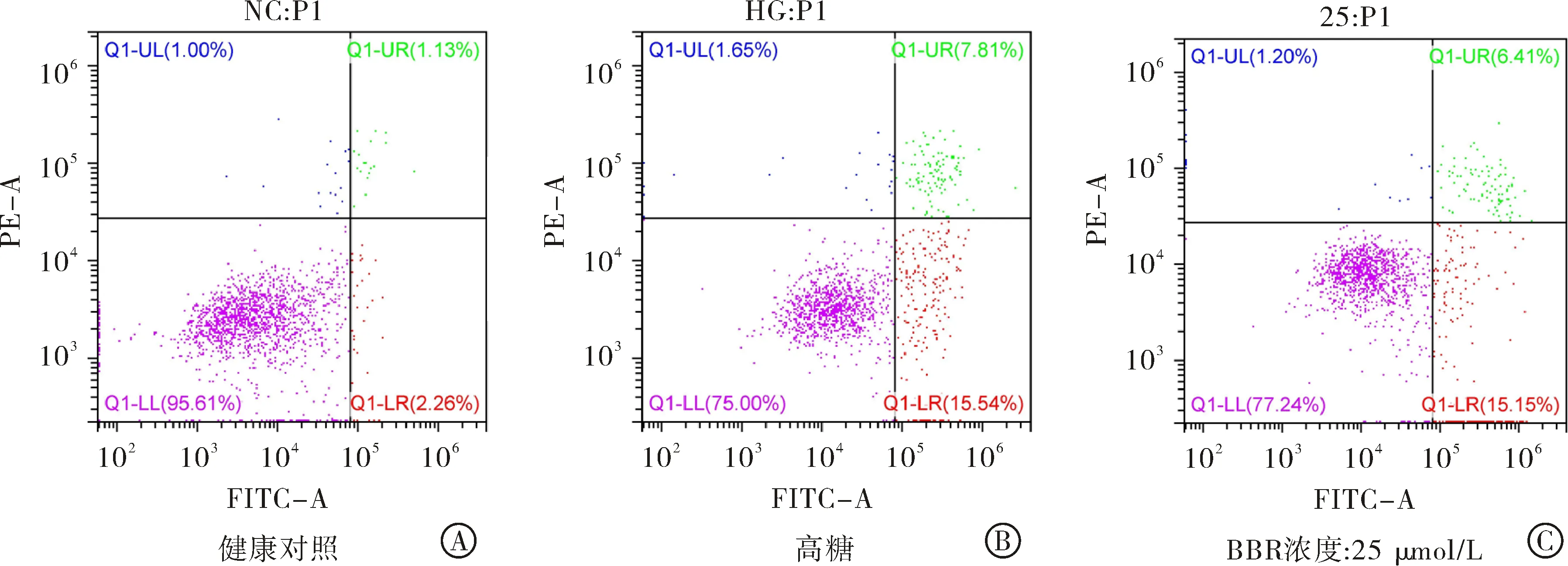
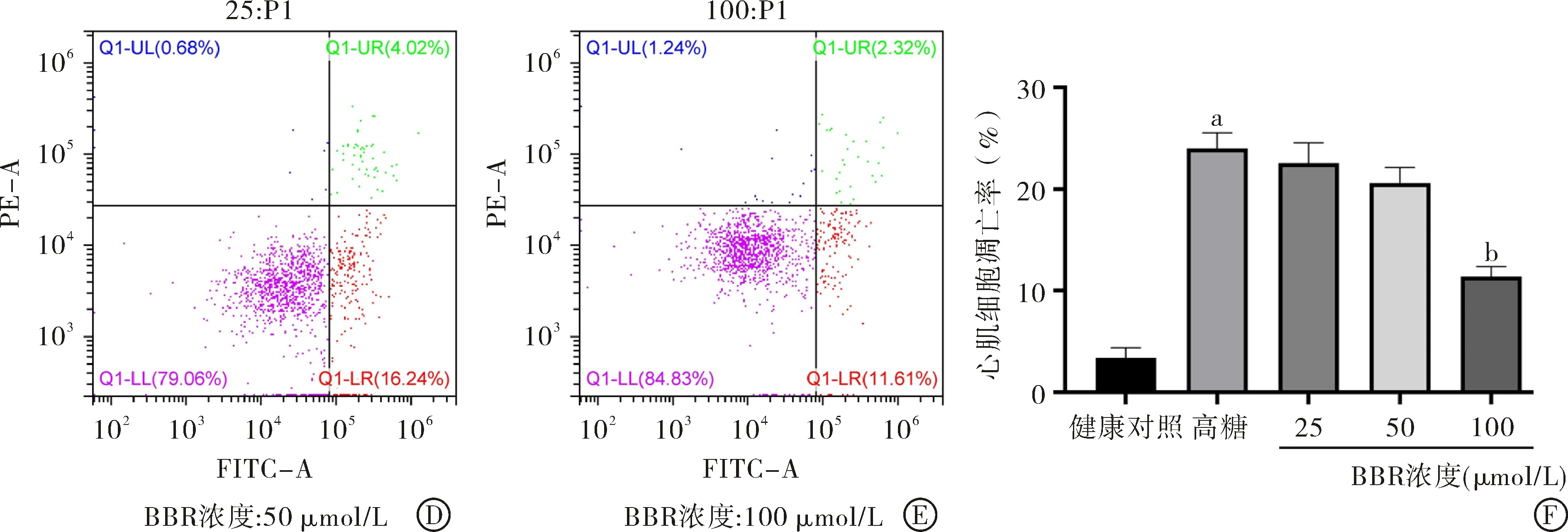
2.2 BBR对高糖诱导心肌细胞凋亡的影响 采用Annexin V-FITC/PI双染法检测心肌细胞凋亡率。图2流式细胞仪检测结果显示,模型组与对照组相比,高糖能明显诱导心肌细胞凋亡;高糖条件下BBR(25、50、100 μmol/L)加药组与模型组比较,加药组可以明显降低心肌细胞凋亡率,对心肌细胞起到一定的保护作用。
2.3 BBR对高糖诱导心肌细胞形态影响 鬼笔环肽染色结果显示,高糖诱导心肌细胞与正常组细胞相比,细胞呈肥大表现,BBR干预组(25、50、100 μmol/L)则可不同程度上改善心肌细胞肥大,使细胞形态趋于正常。见图3。
2.4 BBR对高糖诱导心肌细胞AMPK、P-AMPK、AS160、P-AS160、PDH、GLUT4蛋白表达影响 AMPK蛋白是生物能量代谢关键分子,其调控AS160从而激活GLUT4向膜外转运,维持细胞正常葡萄糖摄取功能。PDH为丙戊酸脱氢酶,是催化丙酮酸不可逆的氧化脱羧为乙酰辅酶A的限速酶。
注:与健康对照组比较,aP<0.01;与高糖组比较,bP<0.05
图2BBR对高糖诱导心肌细胞凋亡的影响(n=3): A-E:Annexin V-FITC/PI双重染色法检测BBR对心肌细胞凋亡的影响;F:不同组大鼠心肌细胞凋亡率比例的定量分析
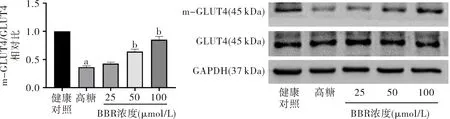
Western blot结果显示,与正常组比较,高糖组P-AMPK、P-AS160、PDH、胞膜GLUT4含量明显降低;与高糖组相比,BBR(25、50、100 μmol/L)可以不同程度提高心肌细胞内P-AMPK、P-AS160、PDH、胞膜GLUT4的表达水平。见图4。
3 讨论
DCM作为糖尿病最为严重并发症之一,病理特征表现为心肌细胞肥大、间质纤维化和PAS阳性的物质浸润,冠状小动脉基底膜增厚,心肌内可见微血管病变[10]。糖尿病心血管病变中,DCM发病率最高,目前已成为老年糖尿病患者死亡的主要原因。由于发病机制尚不清楚,目前DCM的治疗主要是通过控制血糖及血压实现的,并没有较为理想的药物。因此进一步探索DCM发病机制,以便制定更加有效合理的治疗方案显得尤为重要。
有研究显示,慢性高血糖可引起心肌细胞损伤,高脂血症会使脂肪酸大量进入心肌细胞,进而致使细胞脂肪酸氧化过载产生脂毒性[11]。因此心肌细胞的能量代谢障碍或许是DCM发病的重要原因。正常心肌细胞中,脂肪酸氧化与葡萄糖、乳酸代谢共同供能于心脏,保证其正常收缩功能[12-13]。而在高血糖环境中,葡萄糖转运蛋白活性下降,影响细胞对葡萄糖跨膜运输速率,导致葡萄糖代谢提供ATP不足,进而导致心脏供能不足。本实验则从改善心肌细胞葡萄糖代谢入手,观察小檗碱是否可以通过AMPK-AS160通路刺激GLUT4的向膜转运,从而逆转糖尿病状态下的心脏糖代谢障碍。
本实验中,通过考察心肌细胞活力值,凋亡率,细胞形态观察以及相关通路蛋白的表达分析小檗碱对HG诱导心肌细胞的保护作用。从实验结果可得知小檗碱可一定程度提高HG条件下心肌细胞活力值,降低心肌细胞凋亡率,改善心肌细胞肥大[14]。通路蛋白中,小檗碱激活AMPK的磷酸化,从而刺激下游通路AS160,促进GLUT4的质膜转运过程。
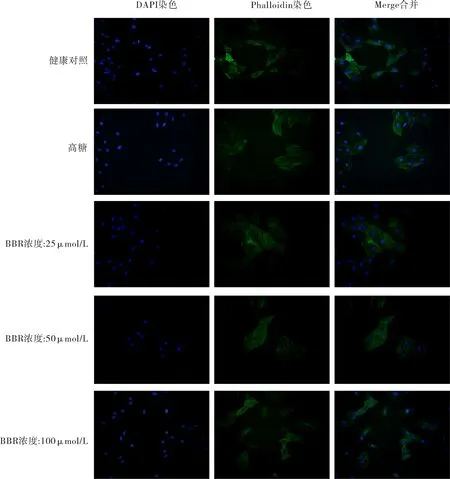
图3 BBR对高糖诱导H9c2(2-1)大鼠心肌细胞形态影响(×200)



注:与健康对照组比较,aP<0.01;与高糖组比较,bP<0.01,cP<0.05
图4BBR对AMPK、AS160、PDH和GLUT4蛋白表达的影响(n=3)
这提示到小檗碱可通过激活AMPK通路改善HG诱导心肌细胞葡萄糖代谢障碍情况。但其通过何种方式进入细胞影响AMPK还有待进一步考证。
综上所述,本实验阐明了小檗碱可保护心肌细胞,降低HG诱导下细胞凋亡率,并激活AMPK磷酸化,促进GLUT4质膜转运,从而起到治疗DCM状态下心肌细胞能量代谢障碍的作用,为治疗DCM提供新思路。
