13例年轻局部晚期宫颈鳞状细胞癌手术方式探讨
2020-04-03康海利赵群吴玉梅
康海利 赵群 吴玉梅
[摘要] 目的 探讨年轻局部晚期宫颈癌患者手术分期同时保留生殖内分泌功能的治疗方式。 方法 选取2016年5月~2018年3月首都医科大学附属北京妇产医院收治的<40岁的局部晚期宫颈癌患者13例,放射治疗前均进行腹腔镜手术分期及卵巢冻存,回顾病例资料,评估CT/MRI判断淋巴结转移准确性及生殖内分泌功能保留的可行性。 结果 局部晚期宫颈癌患者应用CT/MRI评估淋巴转移灵敏度为66.7%,特异度为70.0%。13例患者进行卵巢冻存,2例患者治疗后行卵巢移植术,激素水平稳定,更年期症状完全缓解。 结论 CT/MRI评估淋巴结转移情况灵敏度及特异性欠佳,局部晚期宫颈癌行腹腔镜盆腔、腹主动脉旁淋巴结切除术是评估淋巴结转移情况的重要手段,卵巢冻存可成为解决年轻宫颈癌患者保存和恢复生殖内分泌功能的新选择。
[关键词] 年轻局部晚期宫颈癌;手术分期;卵巢冻存
[中图分类号] R713.6 [文献标识码] A [文章编号] 1673-7210(2020)02(c)-0099-04
[Abstract] Objective To explore the surgical stage of young patients with locally advanced cervical cancer while preserving reproductive endocrine function. Methods From May 2016 to March 2018, 13 cases of locally advanced cervical cancer patients < 40 years old admitted to Beijing Obstetrics and Gynecology Hospital, Capital Medical University were selected. Laparoscopic surgical staging and ovarian cryopreservation were performed before radiotherapy. Case data were reviewed to evaluate the accuracy of CT/MRI in judging lymph node metastasis and the feasibility of preserving reproductive endocrine function. Results The sensitivity of lymph metastasis in patients with locally advanced cervical cancer was 66.7% by CT/MRI and Specificity was 70.0%. Thirteen patients underwent ovarian cryopreservation, and two underwent ovarian transplantation after treatment, with stable hormone levels and complete remission of menopausal symptoms. Conclusion CT/MRI is not sensitive and specific enough to evaluate lymph node metastasis. Laparoscopic pelvic and para-aortic lymph node resection for locally advanced cervical cancer is an important means to evaluate lymph node metastasis. Ovarian cryopreservation can be a new option to save and restore reproductive endocrine function in young cervical cancer patients.
[Key words] Young locally advanced cervical cancer; Surgical staging; Ovarian cryopreservation
宮颈癌是女性最常见的生殖系统恶性肿瘤之一,约78%的宫颈癌发生于发展中国家,其中我国约占世界新发病例的1/3[1]。在20~39岁年轻女性中,其发病率为9.9/100 000每年,死亡率为2.5/100 000每年,占所有致死恶性肿瘤的14.3%[2-3]。由于缺乏相关的知识及筛查的不足,很多女性发现患病的时候已经属于局部晚期。
国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)定义广义的局部晚期宫颈癌指ⅠB2~ⅣA期的宫颈癌,狭义的局部晚期宫颈癌指肿瘤直径>4 cm的早期宫颈癌,即ⅠB2、ⅡA2期宫颈癌。ⅠB1期宫颈癌5年生存率为80%~95%,ⅡA1期为79.7%,而ⅠB2和ⅡA2仅为50%~60%[4],它们明显的预后差别可能与淋巴结转移相关[5]。淋巴转移是宫颈癌的一种重要的转移方式,2019年FIGO已把淋巴结转移情况列入新的宫颈癌分期[6],目前影像学检查并不能完全反映出宫颈癌淋巴结转移的情况。
宫颈癌的发病年龄趋向于年轻化,局部晚期患者的治疗主要为放射治疗,低剂量的放射线就会使卵巢永久衰竭,有效保留生殖内分泌功能非常重要,最常用的卵巢移位成功率有限,同时存在一些并发症,因此我们希望患者接受放射治疗前先行腹腔镜手术评估淋巴结情况,并行卵巢冻存,为保留生殖内分泌功能提供一个新的选择。
本研究希望通过回顾性分析CT/MRI对淋巴结转移的评估情况及局部晚期宫颈癌手术分期同时卵巢冻存的可行性。
1 资料与方法
1.1 一般资料
选择2016年5月~2018年3月首都医科大学附属北京妇产医院接受放射治疗宫颈鳞状细胞癌患者13例。纳入标准:①年龄<40岁;②所有患者治疗前均由2名副主任及以上职称的医师检查盆腔,结合血液检查,影像检查包括B超、胸片、盆腔增强MRI/盆腹腔增强CT等确定临床分期;③经妇产医院病理科确诊为宫颈鳞状细胞癌;④按照FIGO 2009宫颈癌分期标准[7],ⅠB2~ⅢB期患者;⑤有强烈保留生殖内分泌功能意愿;⑥同时进行腹腔镜手术分期及卵巢冻存术;⑦放射治疗为盆腔外照射+后装腔内治疗+顺铂增敏化疗。排除标准:病例资料不完整。患者共13例,其中ⅠB2期4例,ⅡA1期1例,ⅡA2期2例,ⅡB期6例。
1.2 方法
13例患者均为年龄<40岁的年轻女性,手术方式均包括腹腔镜下盆腔淋巴结清扫+腹主动脉旁淋巴结切除+双侧输卵管切除术+双侧卵巢部分切除术+卵巢冻存术,腹主动脉旁淋巴结切除至肠系膜下动脉水平,盆腔淋巴结切除范围包括髂总、髂内、髂外、闭孔淋巴结。
术后1~2周开始行放射治疗,剂量为全盆外照射肿瘤剂量(dose of tumor,DT)30 Gy,后四小野外照射DT 20 Gy,腔内后装照射3~5 Gy/5~6 f,如存在盆腔淋巴结转移酌情增加5~10 Gy,髂总及腹主动脉胖淋巴结转移照射延伸野45 Gy。同时行顺铂增敏化疗30 mg/m2,每周1次。
2 结果
患者年龄23~37岁,平均(32.0±4.8)岁。内生型1例,外生型12例。中分化11例,低分化2例。腹腔镜手术分期手术时间90~190 min,平均(130.2±37.4)min;术中出血200~400 mL,平均(230.7±76.3)mL;住院时间6~15 d,平均(8.1±3.5)d,术后开始放疗时间7~14 d,平均(9.1±2.1)d。
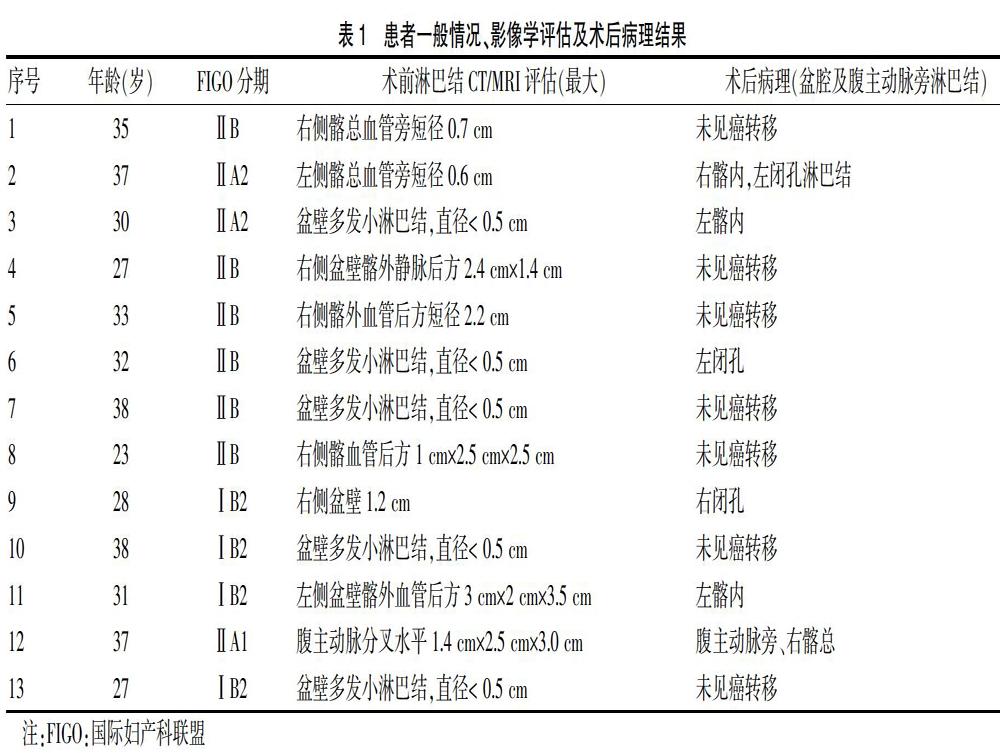
术后病理结果示,6例出现淋巴结转移,其中5例为盆腔淋巴结转移,1例为盆腔及腹主动脉旁淋巴结转移。根据术前CT/MRI结果显示,淋巴结>1 cm者均考虑可疑转移,CT/MRI评估淋巴结转移的灵敏度为66.7%(6/9),特异度为70.0%(7/10)。术前评估淋巴结短径>1 cm者6例,3例术后确认为淋巴结转移(50.0%,3/6);术前评估淋巴结短径<1 cm者7例,3例淋巴结转移(42.9%,3/7);术前评估淋巴结短径<0.5 cm共5例,2例淋巴结转移(40.0%,2/5)。见表1。
2例患者放射治疗结束后1年因更年期症状严重行卵巢移植术,将部分冻存卵巢移植至骶韧带与输尿管间腹膜后软组织处。术后卵泡刺激素(FSH)和黄体生成素(LH)缓慢下降,5~6个月后分别下降至FSH 8.31 U/L,LH 2.52 U/L及FSH 7.28 U/L,LH 3.12 U/L并保持平稳,分别随访36个月及40个月,更年期症状完全缓解。
3 讨论
美国国立综合癌症网络宫颈癌指南(2018.v1)对于ⅡB~ⅣA及部分ⅠB2和ⅡA2期的治疗建议包括手术分期或影像学评估(CT、MRI、PET),旨在通过不同的方法评估淋巴结转移情况后决定治疗方式。影像学评估方法主要为CT、MRI和PET/CT。CT对淋巴结转移的评估仅仅通过淋巴结的大小及位置,当以短径>1.0 cm为标准时,其敏感度为62.0%,特异度为93.5%,当以短径>1.5 cm为标准时,敏感度为33.8%,特异度为99.0%,并且CT扫描不能准确判断淋巴的内部结构特征,在反映增生性淋巴结与转移性淋巴结上存在一定的误差[8]。
核磁共振弥散加权成像诊断淋巴结转移的敏感度为70%~85%,特异度为70%~90%[9],主要通过淋巴结大小及强化方式,以淋巴结短径>1.0 cm或环形强化伴不规则中心坏死为诊断标准,但30%~50%的转移淋巴结大小在正常范圍内。即使短径>1.0 cm也可能由于炎性反应性增生所致,对于无典型影像学表现也无法准确判断。同时MRI也存在一定的局限性,如患者有宫内节育器、人工瓣膜、心脏起搏器等均禁止行MRI检查,因检查时间较长,对幽闭恐惧症或一般情况较差的患者慎用。
PET/CT从分子代谢的角度评估淋巴结转移情况,相对于CT、MRI具有更高的灵敏度与特异度。但由于受部分容积效应的影响,对于<0.5 cm的淋巴结检出灵敏度较低,对于无明显F-FDG摄取的微小浸润淋巴结存在假阴性,在炎性、生理性代谢活跃等情况出现假阳性。PET/CT虽评估效果较前两种更好,但昂贵的价格及医院本身设施的局限使其并不能作为常规评估方法。
研究结果显示,CT/MRI评估淋巴结转移的灵敏度为66.7%,特异度为70.0%,术前评估淋巴结短径>1 cm的患者6例,3例术后确认为淋巴结转移(50.0%,3/6),假阳性比例偏高。术前评估淋巴结<1 cm者7例(42.9%,3/7),<0.5 cm 5例(40.0%,2/5),假阴性比例偏高,不管是灵敏度还是特异度,结果都差强人意。Dabi等[10]、Chargari等[11]也进行过相同的回顾性研究,98例患者中,淋巴结转移中约60%为微浸润,与手术结果比较,术前CT扫描漏诊约20%的淋巴结转移,局部晚期宫颈癌患者的手术分期可以提供比CT扫描更准确的信息,使43%的患者改变了放射治疗野,从手术分期获得的信息允许更好的个体化治疗,可以改善整体临床结果。如不进行手术评估淋巴结情况,很可能漏掉一部分存在转移的患者。Gold等[12]研究发现,用手术及影像学方法分别评估腹主动脉旁淋巴结转移情况并进行相应治疗,对于Ⅲ期及Ⅳ的宫颈癌患者,手术组较影像学组4年无进展生存(48.9%比36.3%),总生存(54.3%比40.0%),手术评估转移情况明确影响患者预后。
腹腔镜手术创伤小,术后恢复快,本研究手术患者无明显并发症,术后开始放射治疗平均时间为(9.1±2.1)d,不会影响肿瘤患者的预后。在一项回顾性研究中,Uzan等[13]发现,是否进行手术分期对放射治疗开始时间的影响差异无统计学意义(15 d,范围3~49 d 比18 d,范围3~42 d,P > 0.05),Kohler等[14]在一项前瞻性研究中,255例患者随机分配到手术分期和同步放化疗及同步放化疗组中,手术分期组无患者死亡,仅2例出血>500 mL,同步放化疗在术后7~21 d间开始,放射治疗并不会因手术而延迟。
对于局部晚期宫颈癌,治疗方法主要为放射治疗及手术治疗,手术治疗的患者术后绝大部分也需要补充放射治疗。卵巢接受1次400 cGy照射或者分次照射1500 cGy将会导致卵巢功能衰竭[15]。年轻女性失去卵巢功能,不仅会因性激素分泌下降出现围绝经期症状,也会影响全身脂肪、钙磷代谢,导致心血管系统、神经系统、泌尿系统等异常[16]。
目前的保留生殖内分泌功能应用最多的是卵巢移位和卵巢冻存。卵巢结肠旁沟移位对卵巢血管损伤较小,方便易行,是目前采用最多的方式,但卵巢移位后离盆腔放射野距离近,仍有可能受到放射治疗影响。Buekers等[17]研究了80例宫颈癌同时行卵巢移位的患者,术后放疗患者仅42%保留了卵巢功能。腔内后装治疗对卵巢功能影响较小,体外放疗后卵巢功能保持率仅65%。移位存在一些潜在的风险和并发症,主要包括为慢性疼痛、卵巢囊肿、蒂扭转等。Gubbala等[18]对892例卵巢移位手术患者进行meta分析发现,15%的患者出现卵巢囊肿。Gomez-Hidalgo等[19]报道了2例移位卵巢出现蒂扭转的个案。
卵巢组织冻存及移植是近些年的新兴技术。在放疗前行手术将部分卵巢组织取出后冻存,待肿瘤治疗结束后选择适当的时机移植回体内,国外多个团队已报道了冻存卵巢组织自体移植后恢复和维持卵巢功能,获得成熟卵母细胞,成功生產新生儿的案列[20-21]。本研究中局部晚期宫颈癌患者目前2例接受移植手术,术后内分泌功能恢复正常,更年期症状完全缓解。
应用影像学评估局部晚期宫颈癌患者的淋巴结转移情况并不准确,腹腔镜手术创伤小,恢复快,是评估淋巴结情况的重要手段,随着冷冻保存技术、辅助生殖技术的发展,卵巢冻存已成为解决年轻宫颈癌患者保存和恢复生殖内分泌功能的新选择。
[参考文献]
[1] Verma J,Monk BJ,Wolfson AH. New Strategies for Multimodality Therapy in Treating Locally Advanced Cervix Cancer [J]. Semin Radiat Oncol,2016,26(4):344-348.
[2] Tsu V,Jeronimo J. Saving the World′s Women from Cervical Cancer [J]. N Engl J Med,2016,374(26):2509-2511.
[3] Fidler MM,Gupta S,Soerjomataram I,et al. Cancer incidence and mortality among young adults aged 20-39 years worldwide in 2012:a population-based study [J]. Lancet Oncol,2017,18(12):1579-1589.
[4] Larry JC,Chou YJ,Huang N,et al. Survival analysis of Stage ⅡA1 and ⅡA2 cervical cancer patients [J]. Taiwanese J Obste Gynecol,2013,52(1):33-38.
[5] Park SH,Cheon H,Chong GO,et al. Prognostic significance of residual lymph node status after definitive chemoradiotherapy in patients with node-positive cervical cancer [J]. Gynecol Oncol,2018,148(3):449-455.
[6] Bhatla N,Aoki D,Sharma DN,et al. Cancer of the cervix uteri [J]. Int J Gynaecol Obstet,2018,143 Suppl 2:22-36.
[7] Pecorelli S. Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium [J]. Int J Gynaecol Obstet,2009,105(2):103-104.
[8] 尚靳,郭启勇,孙洪赞,等.CT、MRI及与PET融合显像评价宫颈癌分期及淋巴结转移中的应用进展[J].中国医学影像技术,2016,32(5):795-798.
[9] 周传亚,孙秀丽.MRI对宫颈癌阴道受累及淋巴结转移的诊断价值[J].中国CT和MRI杂志,2018,16(4):113-116.
[10] Dabi Y,Simon V,Carcopino X,et al. Therapeutic value of surgical paraaortic staging in locally advanced cervical cancer:a multicenter cohort analysis from the FRANCOGYN study group [J]. J Transl Med,2018,16(1).
[11] Chargari C,Mazeron R,Dunant A,et al. Impact of primary para-aortic lymphadenectomy on distant failure in locally advanced cervical cancer patients treated in the era of image-guided adaptive brachytherapy [J]. Clin Exp Metastasis,2016,33(8):775-785.
[12] Gold MA,Tian C,Whitney CW,et al. Surgical versus radiographic determination of para-aortic lymph node metastases before chemoradiation for locally advanced cervical carcinoma:a Gynecologic Oncology Group Study [J]. Cancer,2008,112(9):1954-1963.
[13] Uzan C,Souadka A,Gouy S,et al. Analysis of morbidity and clinical implications of laparoscopic para-aortic lymphadenectomy in a continuous series of 98 patients with advanced-stage cervical cancer and negative PET-CT imaging in the para-aortic area [J]. Oncologist,2011, 16(7):1021-1027.
[14] Kohler C,Mustea A,Marnitz S,et al. Perioperative morbidity and rate of upstaging after laparoscopic staging for patients with locally advanced cervical cancer:results of a prospective randomized trial [J]. Am J Obstet Gynecol,2015,213(4):501-503.
[15] Zulpaite R,Bumbuliene Z. Reproductive health of female childhood cancer survivors [J]. Ginekol Pol,2018,89(5):280-286.
[16] Neumannova H,Mullerova M. Premature ovarian failure [J]. Cas Lek Cesk,2018,157(7):350-353.
[17] Buekers TE,Anderson B,Sorosky JI,et al. Ovarian function after surgical treatment for cervical cancer [J]. Gynecol Oncol,2001,80(1):85-88.
[18] Gubbala K,Laios A,Gallos I,et al. Outcomes of ovarian transposition in gynaecological cancers:a systematic review and meta-analysis [J]. J Ovarian Res,2014,7:69.
[19] Gomez-Hidalgo NR,Darin MC,Dalton H,et al. Ovarian torsion after laparoscopic ovarian transposition in patients with gynecologic cancer:a report of two cases [J]. J Minim Invasive Gynecol,2015,22(4):687-690.
[20] Dittrich R,Hackl J,Lotz L,et al. Pregnancies and live births after 20 transplantations of cryopreserved ovarian tissue in a single center [J]. Fertil Steril,2015,103(2):462-468.
[21] Revelli A,Marchino G,Dolfin E,et al. Live birth after orthotopic grafting of autologous cryopreseerved ovarian tissue and spontaIleous conception in Italy [J]. Fenil Steril, 2013,99(1):227-230.
(收稿日期:2019-10-27 本文編辑:封 华)
